根际促生菌对棉苗盐碱胁迫的缓解效应
2017-03-23庞学兵王朝阳王爱英易小龙郭建强
庞学兵,王朝阳,王爱英,易小龙,郭建强,裴 娟,王 军
(1.石河子大学 生命科学学院,农业生物技术重点实验室,新疆石河子 832000 2.新疆农垦科学院,新疆石河子 832000)
根际促生菌对棉苗盐碱胁迫的缓解效应
庞学兵1,王朝阳1,王爱英1,易小龙1,郭建强1,裴 娟1,王 军2
(1.石河子大学 生命科学学院,农业生物技术重点实验室,新疆石河子 832000 2.新疆农垦科学院,新疆石河子 832000)
为探究根际促生菌(PGPR)对棉苗盐碱胁迫下的缓解效应,采用1株具ACC脱氨酶活性的PGPR菌株P2处理棉花,测定不同质量浓度盐碱胁迫下棉花的相关生理指标。结果表明,在盐碱胁迫下,PGPR能缓解棉苗所受的毒害,且随着盐碱质量浓度的增大缓解作用越明显。在10 g/L的混合盐碱胁迫下,P2菌株处理后棉花种子的萌发率提高185%;可溶性糖质量分数升高69.55%,可溶性蛋白质量分数升高43.67%,提高棉花的渗透调节能力;丙二醛摩尔浓度下降35.33%,过氧化物酶活性升高64.9%,降低胁迫对棉花的伤害;同时,叶片的光合能力、根系活力及根系发育情况也明显优于无菌处理。表明具有ACC脱氨酶活性的菌株P2能有效缓解盐碱胁迫对棉苗的抑制,提高棉苗的抗盐碱性。
棉花;盐碱胁迫;根际促生菌(PGPR);生理响应
土壤盐碱化是导致盐碱地区作物产量降低的最主要因素之一。中国约有盐渍化土壤1.7×107hm2,1/3耕地存在不同程度的盐渍化问题[1]。新疆的盐渍化问题尤为严重,新疆盐渍化耕地共计1.47×106hm2,占全疆耕地总面积的32%[2]。并且,近年新疆对膜下滴灌技术的应用逐渐成熟,膜下滴灌种植已经成为新疆农业可持续发展中重要的科学技术,但由于滴灌条件下淋溶作用微弱,难以利用灌溉水有效地淋洗盐分,盐分仅在土层中转移而无法消除,从而造成农田的次生盐碱化,加重新疆耕地的盐碱危害[3-4]。
棉花是新疆最重要的经济作物,尽管棉花的耐盐碱性较强,在低盐碱条件下有利于棉花出苗、生长,提高产量和品质;而在高盐碱条件下棉花出苗困难,生长迟缓,严重影响棉花的产量和品质[5]。棉花耐盐生理的研究大多以NaCl胁迫为主,少有碳酸盐胁迫的研究,忽略盐碱共存的实际情况。因此,在对棉花耐盐生理的研究中,单以NaCl胁迫并不准确,应当突出混合盐碱胁迫对棉花的影响。
盐碱胁迫会提高植物中内源乙烯的产量,而过量的乙烯会导致植物发育受阻,甚至死亡,任何减少盐分的机制都可以降低盐诱导所产生的乙烯,从而减少乙烯对植物生长造成的消极影响[6]。而具有ACC脱氨酶活性的根际促生菌(PGPR)可以分解乙烯的前体物质ACC,降低植物体内的乙烯水平,从而缓解植物在逆境的不良反应,提高植物对逆境的抗性[7-8]。
因此,本文研究在不同质量浓度的单盐(NaCl)、单碱(NaHCO3)及混合盐碱(NaCl+NaHCO3)胁迫下,产ACC脱氨酶的促生菌P2对棉苗萌发及生长的影响,探究促生菌对棉花盐碱胁迫下的生理响应,以期为盐碱地的棉花种植、促生菌的产业化应用提供理论依据。
1 材料与方法
1.1 材 料
供试菌株为石河子大学农业生物技术重点实验室分离的 PGPR菌株P2,该菌株具有ACC脱氨酶活性。供试棉花为‘新陆早33号’,由石河子大学农业生物技术重点实验室提供。
1.2 材料处理
1.2.1 菌悬液的制备 将纯化后的P2菌株接种至牛肉膏蛋白胨液体培养基。在振荡培养箱中于37 ℃、200 r/min条件下恒温振荡培养48 h。取出后按每200 mL液体培养基接种1 mL菌悬液的比例接种至新的培养基中,振荡培养24 h,制备成108mL-1的菌悬液。
1.2.2 种子消毒 挑选饱满、大小一致的棉种,φ=75% 的酒精消毒0.5 min,无菌水清洗3次,然后用φ=0.1% 的升汞浸泡5 min,无菌水清洗3次。
1.2.3 试验处理 根据新疆盐碱土壤的盐分组成及棉花的盐碱耐受性设计盐碱梯度,将NaCl和NaHCO3按不同比例混合,根据盐碱质量浓度分为A、B、C、D、E、F 6个胁迫处理[9-10],具体配比见表1。
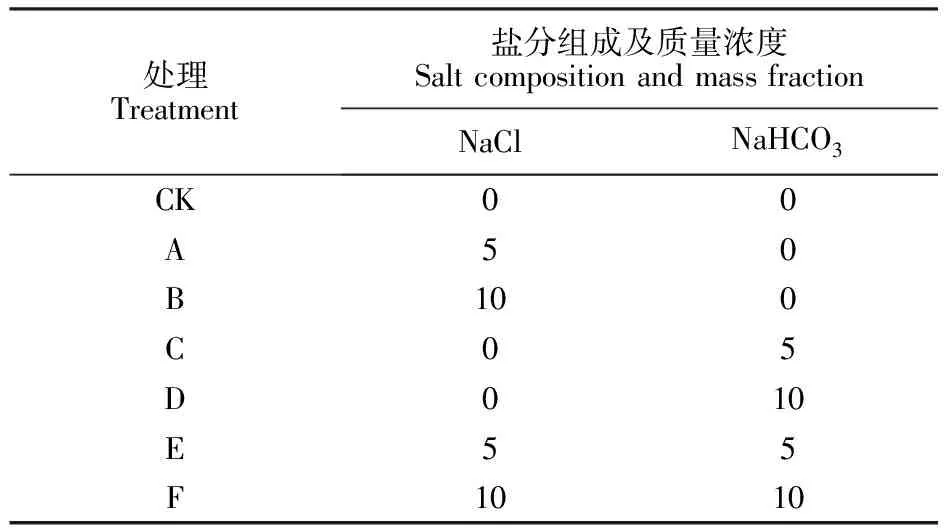
表1 盐碱胁迫处理Table 1 Salt-alkaline stress treatments g/L
将用无菌水和菌悬液浸泡4 h的棉花种子分别种植于口径20 cm的花盆中,每盆20株,以上述不同质量浓度溶液的相同体积浇灌,每个盐碱梯度种植3盆。于人工智能气候箱中培养(光强:300 μmol/(m2·s2),光照:14 h/d;昼夜温度:30 ℃/25 ℃,相对湿度:40%) 。30 d后测定各项生理生化指标[11]。
将菌体悬液和无菌水浸泡过的棉花种子分别放入铺有滤纸的培养皿内,每皿放置20粒,同时加入上述不同质量浓度的盐碱溶液5 mL,每个胁迫处理重复3皿,每2 d补加2 mL盐碱溶液[12]。
1.2.4 生理指标的测量 处理7 d后统计棉花种子萌发率,计算相对盐害率。相对盐害率=(对照发芽率-盐处理发芽率)/对照发芽率×100%。LI-6400光合仪测定棉花功能叶的光合响应值,程序选用PSC-1501,光源选用6400-02B Red Blue #SI-1607,Flow样品室内气流速率为499.4 μmol/s[13]。棉苗叶片的丙二醛(MDA)、可溶性糖、可溶性蛋白、过氧化物酶(POD)、根系活力的测定参照文献[14]。立体扫描仪(For Root Morphology and Architecture Measurement) 扫描棉花根部,根据扫描数据获得根长、根表面积[15-16]等数据,分析根系的生长状况,数据用“平均数±标准差”表示。
2 结果与分析
2.1 盐碱胁迫下P2菌株对棉花萌发率的影响
如表2所示,3种胁迫处理均能使棉花的萌发率下降,且随着盐碱质量浓度增大,抑制作用逐渐增强,相对盐害率逐渐上升。在Na+质量浓度相同的条件下, NaCl处理后棉花的萌发率均低于NaHCO3处理,说明NaCl对发芽率的胁迫高于NaHCO3。对比单盐、单碱、混合盐碱胁迫对发芽率的影响发现,混合盐碱胁迫对发芽率的影响大于单盐和单碱胁迫。P2菌株处理后能促进棉花种子发芽,发芽率较CK提高19.51%。盐碱胁迫时,在同一盐碱质量浓度下,菌株处理的种子发芽率高于同组无菌水处理,相对盐害率低于同组无菌水处理。在F组中,P2处理后棉花的萌发率较同组无菌水处理提高185%,相对盐害率降低35.01%,进行单因素方差分析后发现差异显著。
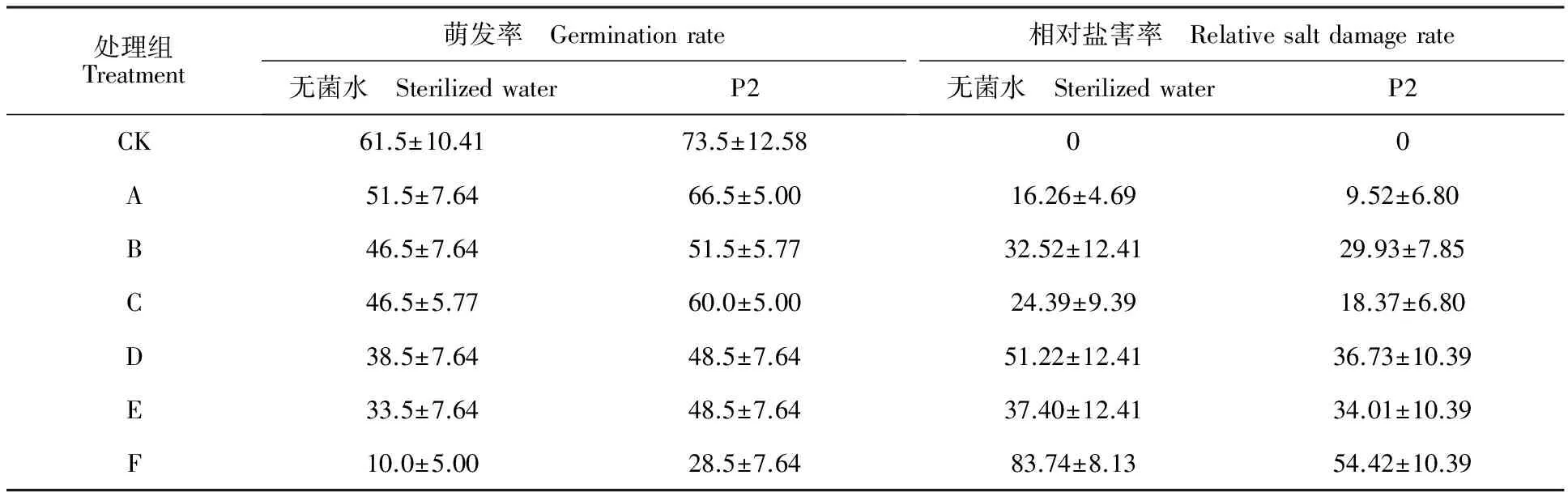
表2 盐碱胁迫下P2菌株处理后棉花的萌发率和相对盐害率Table 2 Effects of the stain P2 on germination rate of cotton under salinity-alkalinity stress %
2.2 盐碱胁迫下P2菌株对棉花苗期MDA质量摩尔浓度的影响
如图1所示,3种胁迫处理均能使棉花的MDA质量摩尔浓度上升。NaHCO3处理后,MDA质量摩尔浓度与CK差异不显著;NaCl和混合盐碱胁迫处理后MDA质量摩尔浓度上升幅度较大,与CK差异显著。在Na+质量浓度相同的条件下,NaCl处理棉花后MDA的质量摩尔浓度高于NaHCO3处理。5 g/L的混合盐碱胁迫处理后MDA质量摩尔浓度高于5 g/L的NaHCO3处理,而低于5 g/L的NaCl处理。比较不同盐碱质量浓度下P2菌株处理和无菌处理后棉花的MDA质量摩尔浓度发现,P2菌株处理后的MDA质量摩尔浓度低于同组无菌水处理,且随盐碱质量浓度增大MDA质量摩尔浓度降低幅度越大。E组和F组处理时,P2菌株处理后MDA质量摩尔浓度分别降低37.63%和35.33%,较同组无菌水处理相比差异显著,有效地缓解盐碱胁迫对棉花的毒害。
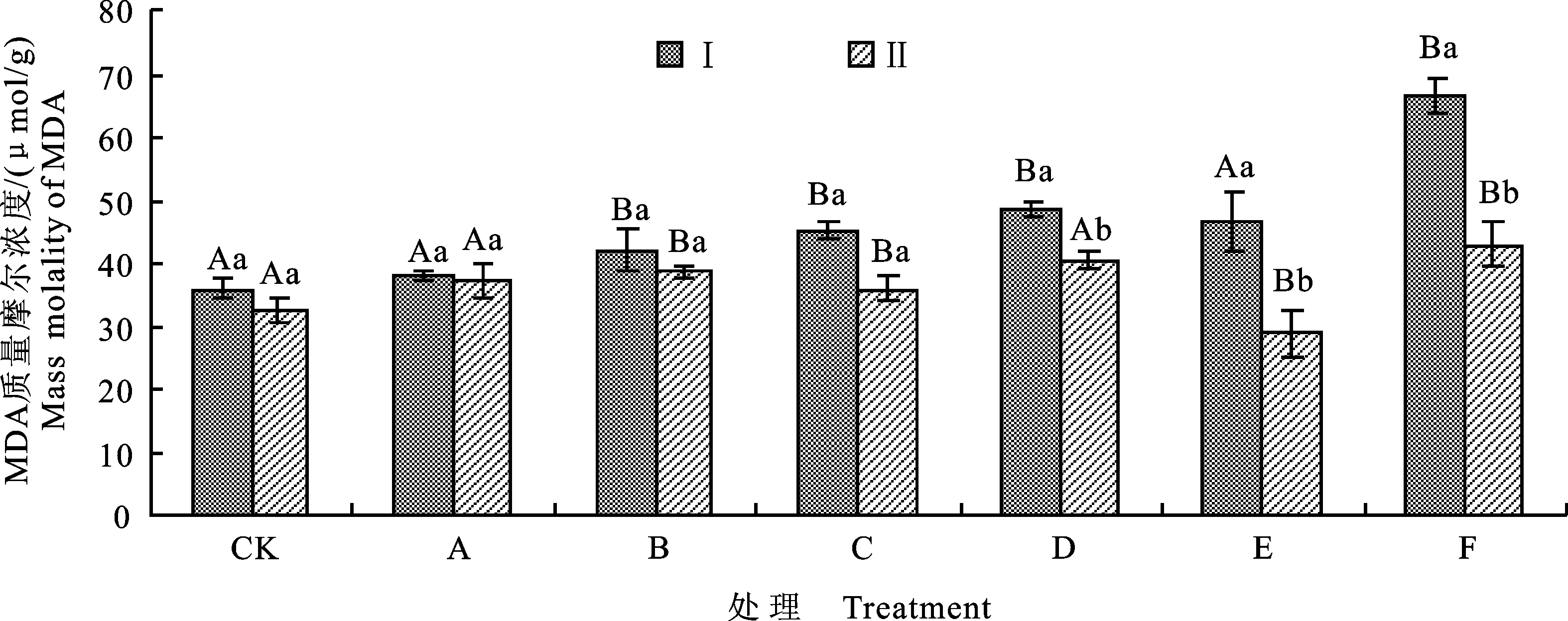
Ⅰ.种子采用无菌水浸泡 Seeds were soaked in sterile water;Ⅱ.种子采用菌悬液浸泡 Seeds were soaked with bacteria suspension.下同 The same as below
不同大写字母表示同一处理下不同盐碱质量浓度间差异显著(P<0.05) Different capital letters meant significant difference between different saline concentrations under the same treatment atP<0.05;不同小写字母表示同一盐碱质量浓度下不同处理差异显著(P<0.05) Different lower-case letters meant significant difference between different treatment under the same saline concentrations atP<0.05;下同 The same as below
图1 盐碱胁迫下P2菌株处理棉花后MDA的质量摩尔浓度
Fig.1 MDA content of cotton treated by P2 strain under salinity-alkalinity stress
2.3 盐碱胁迫下P2菌株对棉苗叶片可溶性蛋白质量分数的影响
如图2所示,NaCl和NaHCO3处理棉花后,可溶性蛋白质量分数降低幅度较小,与CK差异不显著;而混合盐碱胁迫时可溶性蛋白质量分数大幅下降,F组可溶性蛋白质量分数下降41.36%,较CK差异显著,说明混合盐碱胁迫对蛋白质合成抑制更明显。对比不同盐碱质量浓度下P2菌株处理和无菌处理后棉花可溶性蛋白的质量分数发现,在每个盐碱梯度下P2菌株处理后的可溶性蛋白质量分数都高于同一梯度下无菌处理。B组和C组中P2菌株处理棉花后,棉花的可溶性蛋白质量分数甚至高于CK,较同组无菌水处理分别提高38.08%和35.82%,较同组无菌水处理差异显著;F组P2菌株处理后可溶性蛋白质量分数提升幅度最大,提高43.67%,较同组无菌水处理差异显著。
2.4 盐碱胁迫下P2菌株对棉苗叶片中可溶性糖质量分数的影响
如图3所示,当棉苗受到NaCl和NaHCO3胁迫时,可溶性糖质量分数先升高后下降,较CK相比差异显著(除C组外)。在Na+质量浓度相同时,NaCl胁迫后可溶性糖质量分数与NaHCO3胁迫无显著差异。而在混合盐碱胁迫下可溶性糖质量分数急剧下降,混合盐碱胁迫后棉苗的可溶性糖质量分数明显低于单盐、单碱胁迫,较CK差异显著。混合盐碱胁迫对棉苗渗透能力伤害较大。对比不同盐碱质量浓度下P2菌株处理和无菌处理后棉花的可溶性糖质量分数发现:P2菌株处理明显可以提高受盐碱胁迫的棉花的可溶性糖质量分数,且胁迫质量浓度越大提升幅度越大,F组P2菌株处理后的棉花可溶性糖质量分数提高69.55%,与同组无菌水处理差异极显著,提高棉苗对盐碱胁迫的渗透能力。

图2 盐碱胁迫下P2菌株处理棉花后可溶性蛋白的质量分数Fig.2 Soluble protein content of cotton treated by P2 strain under salinity-alkalinity stress
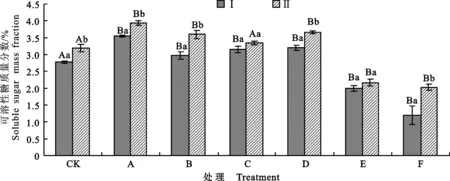
图3 盐碱胁迫下P2菌株处理棉花后棉花可溶性糖的质量浓度Fig.3 Soluble sugar mass fraction of cotton treated by P2 strain under salinity-alkalinity stress
2.5 盐碱胁迫下P2菌株对棉苗叶片中POD活性的影响
如图4所示,当棉花受到NaCl和NaHCO3胁迫时POD活性逐渐升高,NaCl处理后POD活性上升幅度较大,与CK差异显著;而NaHCO3处理后POD活性上升幅度较小,与CK差异不显著。当Na+质量浓度相同时,NaCl处理后棉花的POD活性高于NaHCO3处理。在混合盐碱胁迫下POD活性先升高后降低,高质量浓度混合盐碱胁迫处理后棉花的POD活性低于单独采用NaCl或NaHCO3处理。对比不同盐碱质量浓度下有菌处理和无菌处理后棉花的POD活性发现:在无胁迫处理条件下,P2菌株处理能提高POD活性,与同组无菌水处理差异不显著;随着盐碱胁迫质量浓度升高,P2菌株处理诱导棉苗的POD活性提高越明显,F组P2菌株处理的POD活性较同组无菌水处理提高64.9%,其POD活性甚至高于CK,与同组无菌水处理差异显著。
2.6 盐碱胁迫下P2菌株对对棉苗光合速率的影响
如图5所示,3种胁迫处理都能使棉花光合速率下降,且随盐质量浓度增大下降幅度越明显。NaHCO3处理棉花后,光合速率下降幅度较小,与CK差异不显著;而NaCl和混合胁迫后棉花的光合速率下降幅度较大,与CK差异显著。在相同Na+质量浓度条件下,NaCl处理后棉花的光合速率低于NaHCO3处理,说明单盐胁迫的危害要大于单碱胁迫。在无盐碱胁迫时,P2菌株处理棉花后,棉花的光合速率提高13.06%,较同组无菌水处理差异显著。对比相同盐碱梯度的处理下,P2菌株处理的棉花其光合速率要明显高于同组无菌水处理,随胁迫的盐质量浓度增大,光合速率提升幅度越大。F组P2菌株处理后,棉苗光合速率提高43.80%,较同组无菌水处理差异显著。
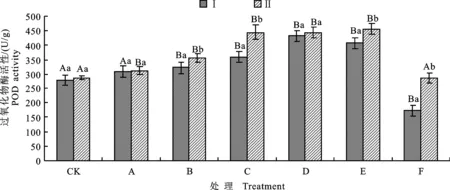
图4 盐碱胁迫下P2菌株处理棉苗后的POD的活性Fig.4 POD content of cotton treated by P2 strain under salinity-alkalinity stress
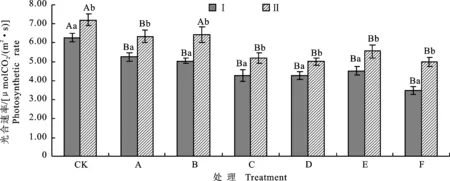
图5 盐碱胁迫下P2菌株处理后棉花的光合速率Fig.5 Photosynthetic rate of cotton treated by P2 strain under salinity-alkalinity stress
2.7 盐碱胁迫下P2菌株对棉苗根系发育的影响
如表3所示,3种胁迫处理都能降低棉花根系总长、根系总表面积、根系总体积,且随着盐碱质量浓度增大,棉花根系总长、总表面积、总体积降低幅度越大。在相同Na+质量浓度下,NaCl处理对根系总长、总表面积、总体积的抑制大于混合盐碱胁迫和NaHCO3胁迫。在无盐碱胁迫条件下,P2菌株处理对根系发育的促进并不明显,而对比盐碱胁迫下无菌和P2菌株处理根系发育的情况发现,随着盐碱质量浓度增大,P2菌株处理棉花后,棉花根系总长、总表面积、总体积都有明显的提升,且随盐碱质量浓度增大,促进效果越明显。
2.8 盐碱胁迫下P2菌株对对棉花根系活力的影响
如图6所示,在NaHCO3胁迫下随着盐质量浓度增大,根系活力逐渐上升,A组棉花根系活力提高21.24%,较CK差异显著;而在NaCl和混合盐碱胁迫下随着盐质量浓度上升根系活力逐渐降低,较CK差异显著。整体而言,混合盐碱胁迫对根系活力的损伤最大。在无盐碱胁迫下,P2菌株处理棉花后,棉花的根系活力低于同组无菌水处理;而在盐碱胁迫下,P2菌株处理后能提高棉花根系的活力,但提升幅度不大,除A、D组较同组无菌水处理有显著提升外,其余各组与同组对照差异均不显著。其中D组提升幅度最大,根系活力较同组无菌水处理提高42.47%。
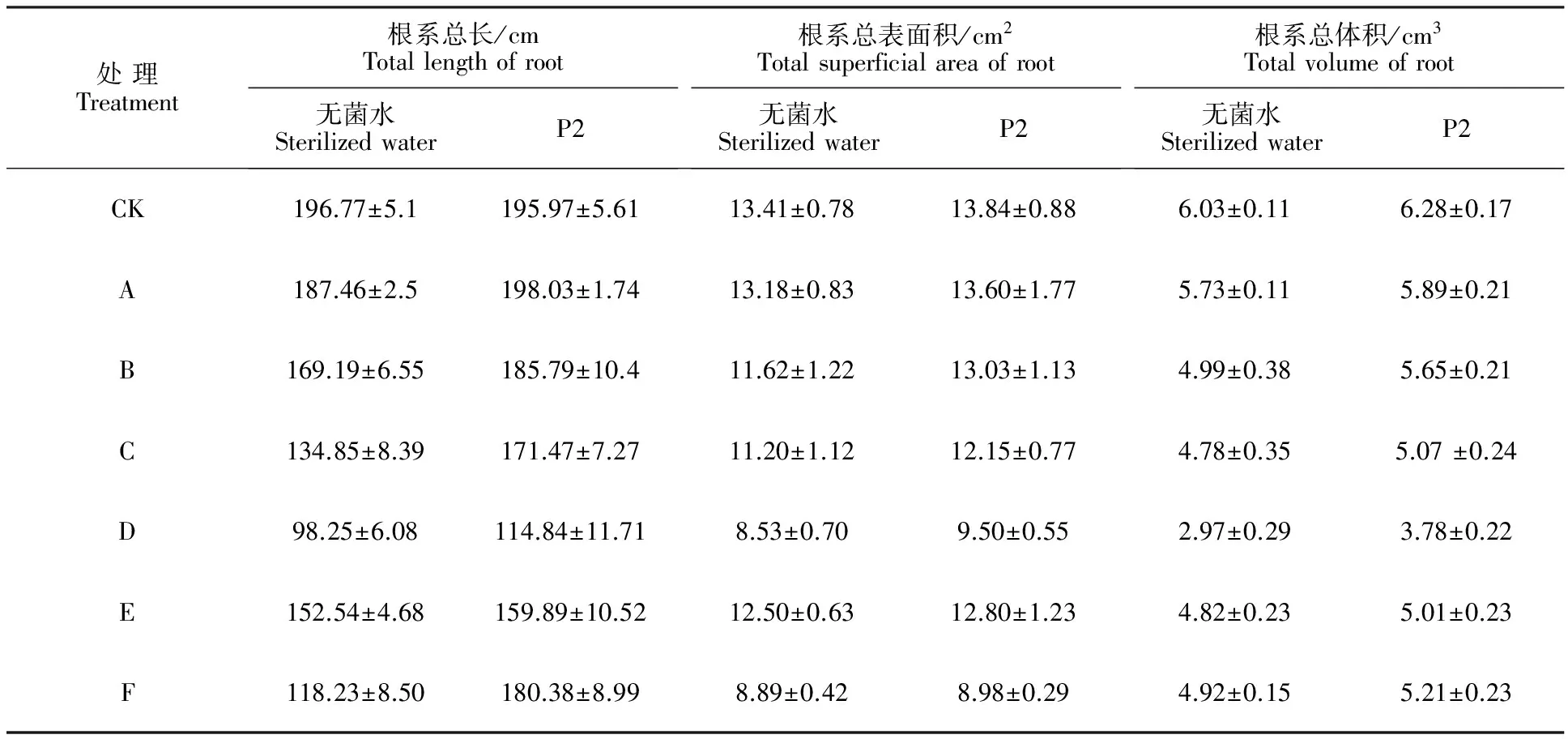
表3 盐碱胁迫下P2菌株处理棉花后的根系发育Table 3 Root Development of cotton treated by P2 strain under salinity-alkalinity stress
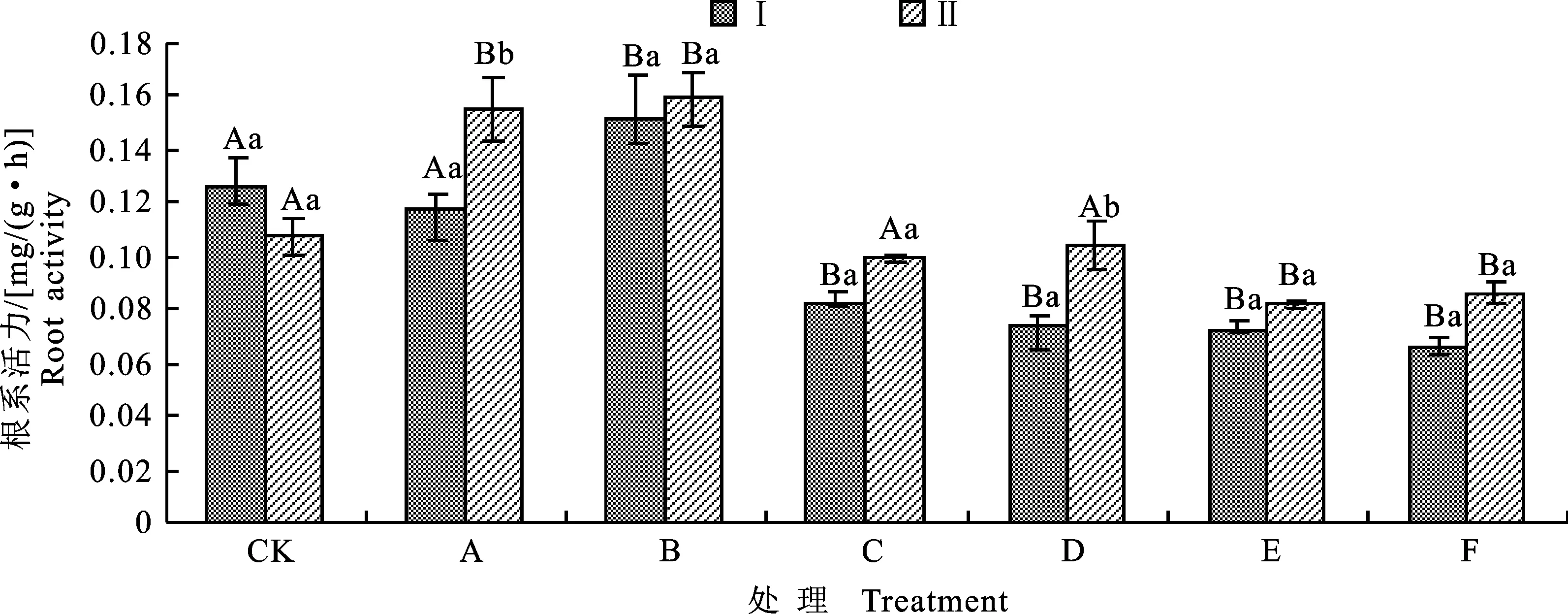
图6 盐碱胁迫下P2菌株处理棉花后的根系活力Fig.6 Root activity of cotton treated by P2 strain under salinity-alkalinity stress
3 讨论与结论
棉花是耐盐碱性较强的植物,但在较高的盐碱质量浓度下,其生长发育仍然会受到影响。关于棉花在盐胁迫毒害的研究已有大量报道,但多为研究单盐毒害,关于盐碱混合胁迫下棉花生理响应的研究则鲜见报道。本试验结果表明,单盐胁迫时NaCl胁迫对棉苗的盐害程度大于NaHCO3胁迫,这与前人[17-18]的研究结果不同,通常认为碱性盐对植物的毒害大于中性盐。这可能是由于在碱胁迫时棉花分泌的有机酸增加,减轻碱胁迫对棉花的伤害。相比单盐胁迫,混合盐碱胁迫对棉花的盐害更加剧烈。盐胁迫主要通过降低土壤水势和离子毒害来抑制作物生长,而混合盐碱胁迫又增加额外的高pH胁迫。随着盐质量浓度增加,混合盐碱胁迫对棉花的伤害越大,说明高pH与盐质量浓度交互作用加剧渗透胁迫与离子毒害对棉花幼苗生长的影响[19]。
植物在逆境胁迫下会大量产生乙烯,过量的乙烯会阻碍植物的发育甚至导致死亡。研究[20]表明,产ACC脱氨酶的细菌可以吸收并分解乙烯的前体ACC,并利用其分解产物作为碳源和氮源,使植物根际的ACC含量降低,从而使根系不断向外分泌ACC,进而降低根系中ACC和乙烯的水平,减轻盐碱胁迫下乙烯对植物的毒害,促进植物生长发育[21]。Mayak等[7]和Saravanakumar等[22]的研究表明具有ACC脱氨酶的细菌可以通过降低乙烯的含量来增强番茄和花生对盐碱的抗性,从而增加其产量。
接种PGPR可以增强植物对盐碱胁迫的抗性,这种抗性的增强涉及到植物体内某些生理特性的响应。P2菌株处理棉花后在无盐碱胁迫条件下较CK相比萌发率提高19.51%,在10 g/L的混合盐碱胁迫下,PGPR处理棉花种子后萌发率较同组无菌水处理提高185%,这与赵骥民等[23]的研究结果一致。棉花生长发育各阶段以发芽出苗时期耐盐碱能力最弱,促生菌P2能提高盐碱胁迫下棉花的萌发率,拓宽棉花在盐碱胁迫下生长发育的生态幅,为盐碱环境中种植棉花提供可能性。植物体内MDA是膜脂过氧化作用的最终产物,其水平能反映植株在逆境条件下膜损伤的程度[24]。在盐碱胁迫下P2菌株能明显提高各处理的POD活性,且随盐碱质量浓度增大提高越明显。这表明PGPR菌可以提高植物体内活性氧清除系统的活性,从而降低植物体内MDA的含量,达到减轻植物细胞盐碱毒害的目的。盐碱胁迫条件下,植物的叶绿素合成受阻,导致植物的光合能力下降[25]。P2菌株处理棉花后可以减轻盐碱胁迫下对棉花叶片中叶绿素合成的抑制,缓解盐碱胁迫对光合速率的影响,从而提高植物的光合效率,达到增强棉花抗盐碱胁迫的能力,光合速率的测定结果证实这一结论。盐碱胁迫下可溶性蛋白和可溶性糖的含量降低,这是可能是由于降解的速率高于合成的速率,导致一些有害氨基酸的产生从而引起植株毒害[26]。该菌株通过提高胞内可溶性糖和可溶性蛋白的含量来维持胞内的渗透压,从而减轻盐碱毒害。植物生长的无机离子主要靠根部来吸收,因此根部的生长状况对植物整体的生长都会造成影响,根长及根表面积的增大可以增强植物吸收无机离子的能力,根系总体积的增大也能提高植物的生长能力[27-28]。该根际促生菌能显著促进棉花根部的生长,通过增加总根长、根表面积、根总体积、提高根系活力,为棉花地上部位的生长发育起到很大的辅助作用。
由此可见,3 种盐碱胁迫处理对棉花细胞的伤害依次是混合盐碱>NaCl>NaHCO3。P2菌株处理棉花种子后能减轻盐碱对棉花的胁迫,提高棉花的耐盐碱能力,为次生盐碱化土壤微生态的棉花种植、促生菌的产业化应用提供理论依据。但本试验仅在盆栽条件下研究P2菌株对棉花盐碱胁迫的缓解效应,而PGPR有效性的发挥还依赖于其在植物根际的有效定殖,因此PGPR菌剂的制备及在田间的试验效果有待于进一步研究。
Reference:
[1] 王遵亲,祝寿泉,俞仁培,等.中国盐渍土[M].北京:科学出版社,1994:250-251.
WANG Z Q,ZHU SH Q,YU R P,etal.China Saline Soil[M].Beijing:Science Press,1994:250-251(in Chinese).
[2] 陈春秀,田长彦.新疆盐渍土渗透势与盐分的关系[J].干旱区研究,2013,30(6):998-1003.
CHEN CH X,TIAN CH Y.Relationship between osmotic potential and total salt content in saline or alkaline soil in Xinjiang[J].AridZoneResearch,2013,30(6):998-1003(in Chinese with English abstract).
[3] 刘洪亮,褚贵新,赵风梅,等.北疆棉区长期膜下滴灌棉田土壤盐分时空变化与次生盐渍化趋势分析[J].中国土壤与肥料,2010(4):12-17.
LIU H L,CHU G X,ZHAO F M,etal.Study on the variation and trend analysis of soil secondary salinization of cotton field under long-term drip irrigation condition northern xinjiang [J].SoilandFertilizerSciencesinChina,2010(4):12-17(in Chinese with English abstract).
[4] 杨红梅,徐海量,牛俊勇.干旱区滴灌条件下防护林次生盐渍化土壤水盐运移规律研究[J].土壤学报,2010,47(5):1023-1027.
YANG H M,XU H L,NIU J Y.Soil water and salt transport in secondary salinized soil under shelterbelt using drip irrigation in arid zone[J].ActaPdologicaSinica,2010,47(5):1023-1027(in Chinese).
[5] 李应升,何 海,叶智丽,等.盐碱地植棉技术[J].新疆农业科技,2006(4):16-16.
LI Y SH,HE H,YE ZH L,etal.Saline-alkali land planting technology[J].XinjiangAgriculturalScienceandTechnology,2006(4):16-17(in Chinese).
[6] EDUARDO B.Sodium transport and salt tolerance in plants[J].CurrentOpinionCellBiology,2000,12(4):431-434.
[7] MAYAK S,TIROSH T,GLICK B R.Plant growth promoting bacteria confer resistance in tomato plants to salt stress[J].PlantPhysiologandBiochemisty,2004,42(6):565-572.
[8] CZARNY J C,GRICHKO V P,GLICK B R.Genetic modulation of ethylene biosynthesis and signaling in plants[J].BiotechnologyAdvances,2006,24(4):410-419.
[9] 戴海芳,武 辉,阿曼古丽·买买提阿力,等.不同基因型棉花苗期耐盐性分析及其鉴定指标筛选[J].中国农业科学,2014,47(7):1290-1300.
DAI H F,WU H,AMANGULI·MAIMAITIALI,etal.Analysis of salt-tolerance and determination of salt-tolerant evaluation indicators in cotton seedlings of different genotypes[J].ScientiaAgriculturaSinica,2014,47(7):1290-1300(in Chinese with English abstract).
[10] 曹东慧.抗碱盐生植物虎尾草和甜土植物棉花应对各种盐碱胁迫时DNA甲基化调节的研究[D].长春:东北师范大学,2012.
CAO D H.The studies of DNA methylation occuured in alkali-resisitant halophophyte chloris virgata and glycophyte cotton under kinds of and alkali stresses[D].Changchun:Northeast Normal University,2012(in Chinese with English abstract).
[11] 赵乃妮,侯培强,任 珺.模拟盐碱胁迫对小麦种子萌发的影响[J].环境科学与管理,2008,33(11):42-46.
ZHAO N N,HOU P Q,REN J.Effect of simulated saline-alkali stress on germination of wheat[J].EnvironmentalScienceandManagement,2008,33(11):42-46(in Chinese with English abstract).
[12] 沈禹颖,闫顺国,余 玲.盐份浓度对碱茅草种子萌发的影响[J].草业科学,1991,8(3):68-71.
SHEN Y Y,YAN SH G,YU L.Effect of concentrations on the seed germination of korean alkaligrass[J].PrataculturalScience,1991,8(3):68-71(in Chinese with English abstract).
[13] 陈托兄,陈水红,卢欣石.NaCl胁迫下秋眠型紫花苜蓿光合作用特性的研究[J].东北农业大学学报,2010,41(11):96-102.
CHEN T X,CHEN SH H,LU X SH.Research on photosynthetic characteristics of fall dormant alfalfa under salt stress[J].JournalofNortheastAgriculturalUniversity,2010,41(11):96-102(in Chinese with English abstract).
[14] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2006:100-227.
ZHANG ZH L,QU W J,LI X F.Plant Physiology Experiments Instruction[M].Beijing:Higher Education Press,2006:100-227(in Chinese).
[15] ZAMORA D S ,JOSE S,NAIR P K R.Morphological plasticity of cotton roots in response to inter specific competition with pecan in an alley cropping system in the southern United States[J].AgroforestSyst,2007,69 (2):107-116.
[16] 何雨江,靳孟贵,王在敏,等.膜下滴灌棉花根系发育特征及其与土壤水盐分布的关系[J].高校地质学报,2010,16(1):39-44.
HE Y J,JIN M G,WANG Z M,etal.Characteristics of cotton root development under mulch drip irrigation and their relationship with soil water and salt distribution[J].GeologicalJournalofChinaUniversities,2010,16(1):39-44 (in Chinese with English abstract).
[17] 申忠宝,潘多锋,王建丽,等.混合盐碱胁迫对5种禾草种子萌发及幼苗生长的影响[J].草地学报,2012,20(5):914-920.
SHEN ZH B,PAN D F,WANG J L,etal.Effects of saline-alkaloid stress on seed germination and seedling growth of grasses[J].ActaAgrestiaSinica,2012,20(5):914-920(in Chinese with English abstract).
[18] GULNAR YASIN,YANG R R,ZHEN Y L.Effects of salt-alkali mixed stresses on seed germination of the halophyteChenopodiumglaucumL.[J].ChineseJournalEcology,2014,33(1):76-82.
[19] 孟 鹏,李玉灵,张柏习.盐碱胁迫下沙地彰武松和樟子松苗木生理特性[J].应用生态学报,2013,24(2):359-365.
MENG P,LI Y L,ZHANG B X.Physiological characteristics ofPinusdensifloravar.zhangwuensisandPinussylvestrisvar.mongolicaseedlings on sandy lands under salt-alkali stresses[J].ChineseJournalofAppliedEcology,2013,24(2):359-365(in Chinese with English abstract).
[20] 刘 莹,李艳菊,石在强,等.含ACC脱氨酶菌株Rs-5对棉苗生长及其耐盐性的影响[J].干旱地区农业研究,2009,27(6):173-178.
LIU Y,LI Y J,SHI Z Q,etal.Effect of strain Rs-5 containing ACC deaminase on growth and salt-tolerance of cotton seedling under salt stress[J].AgriculturalResearchintheAridAreas,2009,27(6):173-178(in Chinese with English abstract).
[21] GLICK B R,CHENG Z Y,CZARNY J,etal.Promotion of plant growth by ACC deaminase-producing soil bacteria[J].EuropeanJournalofPlantPathology,2007,119(3):329-339.
[22] SARAVANAKUMAR D,SAMIYAPPAN R.ACC deaminase from Pseudomonas fluorescens mediated saline resistance in groundnut(Arachishypogea)plants[J].JournalofAppliedMicrobiolog,2007,102(5):1283-1292.
[23] 赵骥民,辛树权,何正飚,等.碱胁迫下PGPR菌株对水稻萌发及水稻幼苗生长的促生作用—具ACC脱氨酶活性的PGPR在盐碱逆境下的应用初探[J].安徽农业科学,2007,35(34):11060-11062.
ZHAO J M,XIN SH Q,HE ZH B,etal.Promoting effect of two PGPR strains on the rice germination and seedling growth under the alkali stress[J].JournalofAnhuiAgriculturalSciences,2007,35(34):11060-11062(in Chinese with English abstract).
[24] 谭永安,柏立新,肖留斌,等.绿盲蝽危害对棉花防御性酶活性及丙二醛含量的诱导[J].棉花学报,2010,22(5):479-485.
TAN Y A,BAI L X,XIAO L B,etal.Herbivore stress byLyguslucoruminducing protective enzyme activity and MDA content on different cotton varieties[J].CottonScience,2010,22(5):479-485(in Chinese with English abstract).
[25] 丁丽娜,金 华,殷鸣放,等.盐胁迫对杨树幼苗叶片光合色素及气体交换特征的影响[J].西北植物学报,2006,26(12):2523-2527.
DING L N,JIN H,YIN M F,etal.Effects of salt stress on photosynthetic pigment and gas exchange characteristics of the leaves ofPopulusseedlings[J].ActaBotanicaBoreali-OccidentaliaSinica,2006,26(12):2523-2527(in Chinese with English abstract).
[26] 李晓雅,赵翠珠,程小军,等.盐胁迫对亚麻荠幼苗生理生化指标的影响[J].西北农业学报,2015,24(4):76-83.
LI X Y,ZHAO C ZH,CHENG X J,etal.Effects of stress on physiological biochemical indexes ofCamelinasativaseedlings[J].ActaAgriculturaeBoreali-occidentalisSinica,2015,24(4):76-83(in Chinese with English abstract).
[27] 潘晓华,王永锐,傅家瑞.水稻根系生长生理的研究进展[J].植物学通报,1996,13(2):13-20.
PAN X H,WANG Y R,FU J R.Dvancein the study on the grow th-physiology in rice of root system(Oryzasativa) [J].ChineseBulletinofBotany,1996,13(2):13-20(in Chinese with English abstract).
[28] YAO J,SHI W M.Effect of salt stress on structure and growth of tomato seedling roots[J].Soil,2008,40(2):279-282.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Mitigative Effect of PGPR on Cotton Seedings Subjected to Salt-alkaline Stress
PANG Xuebing1,WANG Chaoyang1,WANG Aiying1,YI Xiaolong1, GUO Jianqiang1,PEI Juan1and WANG Jun2
(1.Key Laboratory of Agricultural Biotechnology,College of Life Science, Shihezi University,Shihezi Xinjiang 832000,China; 2.Xinjiang Academy of Agricultural and Reclamation Science,Shihezi Xinjiang 832000,China)
To explore mitigation effect of plant growth-promoting rhizobacteria (PGPR) on cotton seedlings under salt-alkaline stress,a PGPR strain P2 with ACC deaminase activity was adopted to treat cotton seedlings,and determined related physiological indexes of cotton seedlings under different concentration of salt-alkaline stress.The results showed that under salt-alkaline stress,PGPR alleviated the toxicity of salt-alkaline to cotton seedlings,and with the increase of salinity concentration,its relief effect was more obvious.Under the mixed salt and alkaline stress of 10 g/L concentration,the germination rate of cotton seeds treated with P2 strain increased by 185%; soluble sugar content increased by 69.55%,soluble protein content increased by 43.67%,which improved the osmotic regulation ability of cotton; MDA content decreased by 35.33%,POD activity increased by 64.9%,which reduced the stress damage to cotton.Meanwhile,the leaf photosynthetic capacity,root activity and development was also significantly better than those of the control group.These results showed that the strain P2 with the ACC deaminase activity effectively alleviated the suppression of salt-alkaline stress on cotton seedlings,and improved salt tolerance of cotton seedlings.
Cotton; Salt-alkaline stress; PGPR; Physiological response
PANG Xuebing,male,master student.Research area: development and utilization of microbial resources.E-mail:648979405@qq.com
WANG Aiying,female,associate research fellow.Research area: environmental biotechnology.E-mail:way-sh@126.com
2015-11-25
2016-01-23
校企合作(0257-5001601);师市科技型中小企业技术创新基金(2015QY10)。
庞学兵,男,硕士研究生,研究方向为微生物资源开发与利用。E-mail:648979405@qq.com
王爱英,女,副研究员,研究方向为环境生物技术。E-mail:way-sh@126.com
日期:2016-12-20
S182
A
1004-1389(2017)01-0101-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161220.1645.026.html
Received 2015-11-25 Returned 2016-01-23
Foundation item School-Enterprise Cooperation Project(No.0257-5001601);Division and City SME Technology Innovation Fund (No.2015QY10).
