云南万寿菊叶斑病病菌生物学特性及其抑菌药剂研究
2017-03-21鲁海菊徐聪梅李河
鲁海菊+徐聪梅+李河
摘要:以万寿菊叶斑病病菌WY1为供试菌株,采用菌丝生长速率法测定不同培养基、碳源、氮源、温度、酸碱度、光照和湿度对菌丝生长的影响,并在室内筛选有效抑菌药剂。结果表明:该病原菌最佳培养条件为玉米琼脂培养基,以葡萄糖为碳源,甘氨酸为氮源,最适温度为25 ℃,最佳pH值为10,全光照,最适湿度范围为50%~60%。58%甲霜·锰锌可湿性粉剂和50%异菌脲可湿性粉剂抑菌效果较好,抑制率达100%。此结论可为云南万寿菊叶斑病的防治提供一定的科学理论依据。
关键词:万寿菊;叶斑病;生物学特性;药剂筛选;生长速率法
中图分类号: S436.8+1 文献标志码: A
文章编号:1002-1302(2016)11-0157-03
万寿菊(Tagetes erecta)是一种适应性广的草本花卉,花中的天然色素可广泛应用于食品、饲料、医药等领域[1]。万寿菊原产于墨西哥[1],现已广泛种植于世界各地。在我国的北京、吉林、甘肃、湖北、云南等地均已有大面积栽种,但各产区都受到万寿菊叶斑病的严重危害。据报道,万寿菊叶斑病病原菌共有6种:百日菊细极链格孢(Alternaria zinniae)[2]、万寿菊链格孢(A. tagetica)[3-6]、芸臺链格孢(A. brassicae)[7]、链格孢(A. alternata)[8]、石竹链格孢(A. gypsophilae)[9]、细极链格孢(A. tenuissima)[10]。笔者研究发现,云南省万寿菊叶斑病是由芸薹生链格孢(A. brassicicola)引起[11],其病原菌与其他地区的报道均不一致,有必要对其生物学特性及杀菌剂进行系统研究,进而为有效防治此病害提供科学依据。
1 材料与方法
1.1 供试菌株
从云南省蒙自市鸣鹫镇万寿菊种植基地采集症状典型的万寿菊叶斑病病叶,采用常规组织分离和单孢分离法进行分离纯化[12],获得的菌株(WY1)于斜面培养基上低温(4 ℃)保存。
1.2 供试培养基
马铃薯葡萄糖(PDA)培养基:马铃薯200 g、葡萄糖16 g、琼脂粉20 g、蒸馏水1 000 mL;马铃薯蔗糖(PSA)培养基:马铃薯200 g、蔗糖16 g、琼脂粉 20 g、蒸馏水1 000 mL;玉米琼脂(MA)培养基:玉米30 g、琼脂粉17 g、蒸馏水1 000 mL;小麦琼脂(WA)培养基:小麦30 g、琼脂粉20 g、蒸馏水 1 000 mL;胡萝卜琼脂(CA)培养基:胡萝卜200 g、琼脂粉 20 g、蒸馏水1 000 mL;察氏(CM)培养基:硝酸钠2 g、磷酸二氢钾1 g、氯化钾0.5 g、硫酸鎂0.5 g、硫酸铁0.01 g、蔗糖 30 g、琼脂粉20 g、蒸馏水1 000 mL。上述培养基配制好后均于121 ℃高压灭菌25 min。
1.3 试剂
碳源(可溶性淀粉、α-乳糖、麦芽糖、葡萄糖、鼠李糖、木糖醇、D-甘露醇)、氮源(硫酸铵、硝酸铵、磷酸二氢铵、酵母膏、牛肉膏、蛋白胨、甘氨酸、尿素),0.1% HCl、0.1% NaOH溶液。试剂均为分析纯。
1.4 供试杀菌剂
58%甲霜·锰锌可湿性粉剂、50%多菌灵可湿性粉剂、70%甲基硫菌灵可湿性粉剂、75%百菌清可湿性粉剂、50%异菌脲可湿性粉剂、6%春雷霉素可湿性粉剂,上述材料均购自农贸市场及试剂公司。
1.5 不同培养基对菌丝生长的影响
将其病菌在PDA平板培养基中,25 ℃扩大培养7 d,在培养基同一半径周围用打孔器取直径为5 mm的菌块,同时接种于PDA、CM、MA、WA、CA 5种培养基平板中央,设3次重复,在25 ℃下恒温培养7 d,十字交叉法测定菌落直径[10]。
1.6 不同碳源、氮源对菌丝生长的影响
以察氏(Czapek-Dox Medium)培养基为基础培养基,分别用相等质量分数的碳(可溶性淀粉、α-乳糖、麦芽糖、葡萄糖、鼠李糖、木糖醇、D-甘露醇)和氮(硫酸铵、硝酸铵、磷酸二氢铵、酵母膏、牛肉膏、蛋白胨、甘氨酸、尿素)替换蔗糖和硝酸钠,设不加碳、氮为对照[10],接种及测量方法同“1.5”节。
1.7 不同温度对菌丝生长的影响
以PDA为供试培养基,接种后分别在10、15、20、25、30、35、40 ℃下恒温培养[10],接种及测量方法同“1.5”节。
1.8 不同pH值对菌丝生长的影响
以PDA为供试培养基,分别用0.1%盐酸及0.1%氢氧化钠溶液将pH值调至3、4、5、6、7、8、9、10[10],接种及测量方法同“1.5”节。
1.9 光照对菌丝生长的影响
以PDA为供试培养基,接种后分别在光暗交替(12 h-12 h)、全黑暗和全光照3种光处理下培养[10],接种及测量方法同“1.5”节。
1.10 不同湿度对菌丝生长的影响
用步骤“1.5”的方法将其病菌接种于PDA培养基平板中央,分别在湿度为50%、60%、70%、80%、90%、100%的培养箱中培养7 d[10],测量方法同“1.5”节。
1.11 药敏性测定
将58%甲霜·锰锌、50%多菌灵、70%甲基硫菌灵、75%百菌清、50%异菌脲、6%春雷霉素6种可湿性粉剂杀菌剂按照使用说明上的浓度配成PDA含药营养液后,倒平板,将叶斑病菌菌块接种于平板中央,设不加药液的PDA平板为对照,培养7 d后,测量菌落直径,并计算6种药剂对菌落生长的抑制率[13],接种及测量方法同“1.5”节。
抑制率=[(dCK-dB)/dCK]×100%。
式中:dCK、dB分别表示对照、处理病原菌菌落直径(mm)。
1.12 数据分析
所有试验数据均采用SPSS 19.0统计软件分析,处理间的差异显著性采用Duncans多重比较法。
2 结果与分析
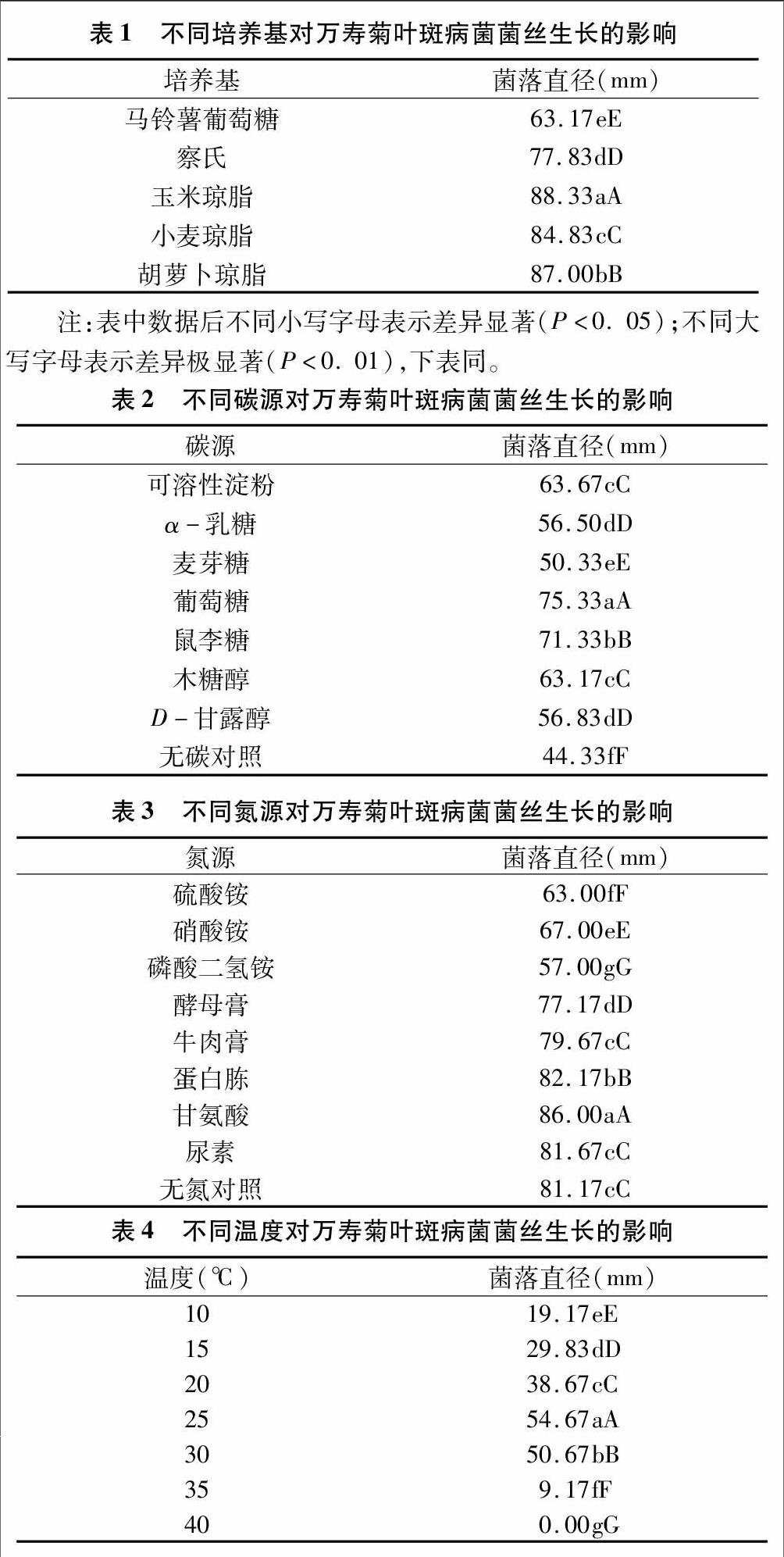
2.1 不同培养基对菌丝生长的影响
由表1可知,供试菌株WY1在5种培养基上均能生长,且具有较强的营养适应性,说明供试菌株对营养条件的要求并不是很严格,但对5种培养基的利用效果有所差异。经Duncans多重比较,供试菌株在5种培养基上的菌落直径差异极显著,其中,在玉米琼脂培养基上生长最快,在PDA培养基上生长最慢;在其余3种培养基上的生长由强到弱顺序为:胡萝卜琼脂培养基>小麦琼脂培养基>察氏培养基。
2.2 不同碳源对菌丝生长的影响
由表2可知,供试菌株WY1在7种不同碳源培养基上均能生长,菌落直径均大于无碳对照。经Duncans多重比较,可溶性淀粉和木糖醇2个处理间的菌落直径差异不显著,D-甘露醇和α-乳糖2个处理间的菌落直径差异也不显著,说明在可溶性淀粉和木糖醇2种碳源中菌丝生长一致,在 D-甘露醇和α-乳糖2种碳源中菌丝生长也一致。其余各碳源处理之间菌落直径差异极显著。其中,葡萄糖最佳,麦芽糖最差;在其余碳源培养基上的菌落生长由强到弱顺序为:鼠李糖>可溶性淀粉=木糖醇>D-甘露醇=α-乳糖。
2.3 不同氮源对菌丝生长的影响
由表3可知,供试菌株WY1在3种无机氮源和5种有机氮源培养基上均能生长,但对8种氮源的利用效果不同。经Duncans多重比较, 在甘氨酸和蛋白胨培养基上的菌落直径均极显著高于无氮对照,对供试菌株具有促生长的作用,而且促进作用前者高于后者。尿素、牛肉膏及无氮对照三者间的菌落直径差异不显著,说明尿素和牛肉膏的加入对菌落生长无显著影响。其余4种氮源与无氮对照差异极显著,且四者对菌落的生长均有抑制作用,抑制顺序由强到弱为:磷酸二氢铵>硫酸铵>硝酸铵>酵母膏。
2.4 不同温度对菌丝生长的影响
由表4可知,供试菌株WY1在10~35 ℃范围内均能生长。经Duncans多重比较,各温度处理间的菌落直径差异极显著。在10~25 ℃范围内,温度越高菌落直径越大,25 ℃ 时菌落直径达到最大值,30、35 ℃菌落直径小于25 ℃,40 ℃时菌落直径为0.00 mm,说明25 ℃为供试菌株生长最佳温度。
2.5 不同pH值对菌丝生长的影响
由表5可知,供试菌株WY1在pH值3~10范围内均能生长。pH值为10时与其余处理间菌落直径差异极显著,且菌落直径最大,说明pH值=10为最佳酸碱度值。pH值=6、8、9等3个处理间菌落直径差异均不显著,其余处理间菌落直径差异极显著,说明偏碱环境有利于供试菌株生长。
2.6 不同光照对菌丝生长的影响
由表6可知,供试菌株WY1在3種光照条件下均能生长。经Duncans多重比较,全光照与其余2种处理间菌落直径差异极显著,且菌落直径最大,说明全光照有利于其生长。光暗交替与全黑暗处理差异不显著,二者菌落直径较一致。
2.7 不同湿度对菌丝生长的影响
由表7可知,供试菌株WY1在湿度50%~100%范围内均能生长。经Duncans多重比较,在湿度50%、60%的2个处理间菌落直径差异不显著,但与其余处理差异极显著,且菌落直径最大。说明供试菌株最适合的湿度范围在50%~60%,超出此范围,病原菌的生长受到抑制。
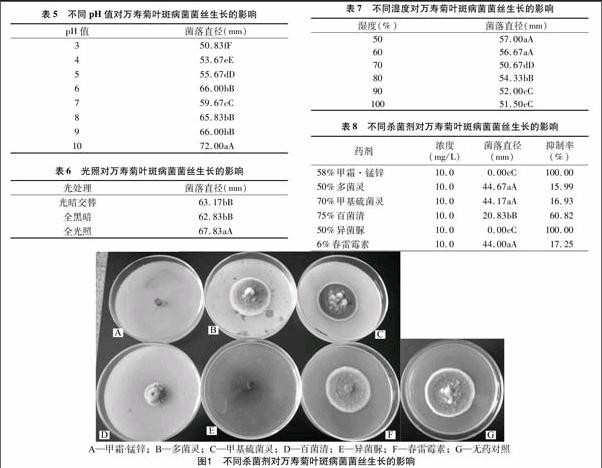
2.8 万寿菊叶斑病菌的药敏性
由表8、图1可知,6种药剂对供试菌株WY1的抑制作用不同。在58%甲霜·锰锌可湿性粉剂和50%异菌脲可湿性粉剂的培养基中菌落直径差异不显著,但与其余处理间差异极显著,病原菌均不能生长,抑制率达到100%。50%多菌灵可湿性粉剂、70%甲基硫菌灵可湿性粉剂和6%春雷霉素3种药剂之间菌落直径差异不显著,但与其余处理间差异显著,抑制率在16%左右。75%百菌清可湿性粉剂中菌落直径与其余5种药剂差异极显著,抑制率为60.82%。说明抑菌效果较好的药剂为58%甲霜·锰锌和50%异菌脲可湿性粉剂。
3 讨论
该病原菌WY1菌株生物学特性研究表明,最适培养基为玉米粉,最佳碳源为葡萄糖,最佳氮源为甘氨酸,最适温度为 25 ℃,最佳pH值为10,全光照,最适湿度范围为50%~60%。这与吴新颖等研究报道有一致的地方,也有不一致之处[9,13,10]。导致生物学特性差异的最主要原因是病原菌所属的种不同。供试菌株WY1为芸薹生链格孢(A. brassicicola)[11],吴新颖报道的为石竹链格孢(A. gypsophilae)[9],王婷等报道的为细极链格孢(A. tenuissima)[10]。3个种生物学特性一致之处是25 ℃为最适生长温度,25 ℃~30 ℃范围内适宜菌丝生长。吴新颖报道麦芽糖为最佳碳源[9],而我们的结论是麦芽糖利用最差。王婷等对碳源和氮源没有进行研究[10]。吴新颖报道pH值6.27~7.00最适宜生长及产孢[9],王婷等报道pH值4.96~7.00最适宜生长,pH值6.04~8.01最适宜产孢[10]。本试验研究的WY1菌株菌丝生长最适合pH值为10,很难在培养第7天产孢。该菌株最适合的产孢条件有待进一步研究。
另外,在室内药剂筛选方面,50%异菌脲可湿性粉剂对WY1菌株抑制效果最好,抑制率达100%,75%百菌清可湿性粉剂效果较好,抑制率为60.82%,这与吴新颖等的研究结果[9,13]一致。58%甲霜·锰锌可湿性粉剂对WY1菌株抑制效果也最好,抑制率达100%,这与王龙的研究结果[13]不一致。出现差异的最主要原因是病原菌所属的种不同,其次是各地区病原菌的抗药性不同。说明链格孢属不同种引起的万寿菊叶斑病,选用的防治药剂应有所不同。6—7月是万寿菊鲜花成熟期,也刚好是云南高温高湿期,因此,提前做好预防措施是很有必要的,尽量少施或不施含甘氨酸的化肥,可施其他对该病原菌有抑制作用的化肥(如磷酸二氢铵类化肥),发病高峰期施用58%甲霜·锰锌和50%异菌脲可湿性粉剂,为了避免抗药性的产生,可选用75%百菌清可湿性粉剂混配使用。本研究仅做了室内药剂筛选试验,今后还应结合田间试验示范来制定相应的防治措施。
参考文献:
[1]宫 力. 万寿菊的经济用途[J]. 中国花卉园艺,2001(23):31.
[2]Edward J C. Leaf and infloreseenees blight of Tagetes erectal(Marigold)caused by Alternaria zinnia[J]. Sicence and Culturation,1957,22:683-684.
[3]Shome S K,Mustafce T P. Alternaria tagetica sp. nov. causing blight of Marigold(Tagetes sp.)[J]. Current Science,1966,35(14):370-371.
[4]Tomioka K,Toyozo S,Koganezawa H. Marigold leaf spot caused by Alternaria tagetica new to Japan[J]. Journal of General Plant Pathology,2000,66(4):294-298.
[5]Singh P J,Singh P,Dhindsa G S,et al. Efficacy of systemic and non-systemic fungicides against leaf spot(Alternaria tagetica)of Marigold[J]. Indian Phytopathology,2006,59(1):118-119.
[6]高 山,王孟飛,胡 平,等. 基于ITS序列对万寿菊叶斑病病原菌的分子鉴定[J]. 湖北农业科学,2013,52(9):2074-2076.
[7]Mukadam D S,Deshpande K B. Role of light and temperature on growth sporulation and subsequent spore germinatility of Alternaria brassicae(Berk)Sacc[J]. Science and Culture,1979,45:244-246.
[8]Li Y,Shen J,Pan B H,et al. First report of leaf spot caused by Alternaria alternata on marigold(Tagetes erecta)in Beijing,China[J]. Plant Disease,2014,98(8):1153.
[9]吴新颖. 万寿菊链格孢叶斑病研究[D]. 长春:吉林农业大学,2002.
[10]王 婷,王 龙,王生荣. 万寿菊叶斑病病原鉴定及其生物学特性研究[J]. 甘肃农业大学学报,2010,45(3):66-68.
[11]鲁海菊,潘柳君,李 河,等. 云南万寿菊叶斑病病原菌的鉴定与ITS序列分析[J]. 西北农业学报,2015,24(6):116-119.
[12]方中达. 植病研究法[M]. 3版. 北京:中国农业出版社,1998:57-125.
[13]王 龙. 万寿菊叶斑病病原鉴定及药剂防治研究[D]. 兰州:甘肃农业大学,2007.
