替莫唑胺在MGMT高表达的非小细胞肺癌脑转移治疗中的应用观察*
2017-03-20李小芳贾友超
李小芳, 王 悦,陈 雪,苏 雷,史 茜,贾友超,霍 燃∆
1.河北大学附属医院肿瘤内科 (保定 071000),2.河北省保定市第一医院老年病科 (保定 071000),3.河北省保定市第二医院心内科 (保定 071000),4.河北大学附属医院放疗科 (保定 071000),
·药物与临床·
替莫唑胺在MGMT高表达的非小细胞肺癌脑转移治疗中的应用观察*
李小芳1, 王 悦2,陈 雪3,苏 雷4,史 茜5,贾友超1,霍 燃1∆
1.河北大学附属医院肿瘤内科 (保定 071000),2.河北省保定市第一医院老年病科 (保定 071000),3.河北省保定市第二医院心内科 (保定 071000),4.河北大学附属医院放疗科 (保定 071000),
5.河北大学附属医院儿科 (保定 071000)
目的:探讨替莫唑胺 (TMZ)在O6甲基鸟嘌呤DNA甲基转移酶 (MGMT)高表达的非小细胞肺癌脑转移中的临床效果和不良反应。方法:收集非小细胞肺癌脑转移患者90例,根据治疗方式分为全脑化疗联合替莫唑胺组和单纯化疗组,对所有患者进行为期2年的随访,记录两组的有效率、生存周期以及不良反应。结果:放疗结束后1个月后对两组患者的治疗效果进行评价,联合组患者有效率为61.6%,单纯放疗组患者有效率为37.3%,差异有统计学意义(P<0.022);联合组中位生存时间为18个月,放疗组中位生存时间为16个月,两组比较差异无统计学意义(P>0.05);联合组在中性粒细胞减少以及肝功能损伤方面发生率高于单纯放疗组,差异有统计学意义(P<0.05)。 结论:应用替莫唑胺联合放疗可以有效增加MGMT高表达的非小细胞肺癌脑转移患者的有效率而不增加患者的不良反应,患者可耐受。
据统计III期和IV期非小细胞肺癌 (Noncell lung cancer, NSCLC)脑转移患者的发病率约占NSCLC患者的30%~50%[1]。化疗是晚期NSCLC主要治疗手段,然而化疗在杀灭肿瘤细胞的同时,对机体有一定程度的损伤,如骨髓免疫功能抑制等[2],影响患者治疗依从性。脑转移后患者预后差,临床研究显示脑转移病人中位生存期仅为1个月。随着同步放化疗(CRT)的出现以及普及,局部控制率和生存率都在提高,但是对于脑转移的控制效果不佳,原因是由于大多数的化疗药物不能透过血脑屏障[3]。O6甲基鸟嘌呤DNA甲基转移酶 (O6 methylguanine DNA methyltransferase, MGMT)是一种重要的DNA修复酶,MGMT高表达与恶性程度相关[4]。替莫唑胺 (TMZ) 是一种口服的烷化剂类抗肿瘤药,在脑胶质瘤中效果明显,对转移癌也有一定的疗效[5]。但是TMZ在MGMT高表达的NSCLC脑转移中的效果尚不可知。本研究通过研究TMZ治疗TGMT高表达的NSCLC脑转移中的治疗效果,为临床应用TMZ提供依据。
资料与方法
1 一般资料 收集我院2008年1月至2013年1月因非小细胞肺癌而发生脑转移的住院患者90例,纳入标准:①经术中冰冻病理切片确定位非小细胞肺癌脑转移患者;②脑转移经颅脑核磁或CT确定合并脑转移;③所有患者MGMT表达,诊断MGMT表达方法:应用链霉菌抗生物素蛋白-过氧化酶免疫组化法(S-P法)检测MGMT表达,定义MGMT高表达标准为5个高倍视野计数500个癌细胞,阳性率>30%为MGMT高表达。排除标准:①失访患者;②治疗前后数据不全患者。两组患者一般资料比较,差异无统计学意义(P>0.05),见表1。
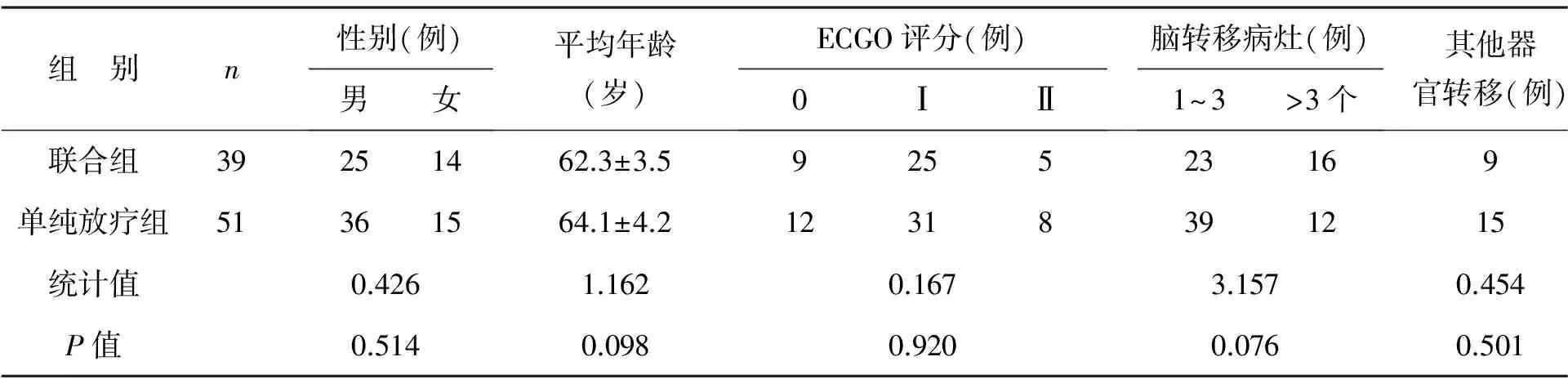
表1 两组患者一般资料比较
2 治疗方法 所有患者均行放射治疗,头部放疗采用常规的全脑放射治疗,放射剂量为2 Gy,放射周期为5 d/周,共治疗4周,总剂量约为40 Gy。联合组在放射治疗期间应用替莫唑胺,剂量为75 mg/(m2·d),每日服用,直至放疗结束。放疗结束后1个月开始维持治疗,维持剂量为:第1周期150 mg/(m2·d),第2~6周期200 mg(m2·d),连续服用5d,28 d为1周期。治疗期间根据患者反映酌情给予脱水剂或止吐药以减轻患者的不良反应。
3 观察指标 开始化疗的前1周对患者进行基线资料的采集,辅以脑MRI以及脑CT检查。放疗期间每周随访1次,包括上述的检查。放射治疗后的1个月复查脑MRI。在每周期替莫唑胺服用完成后完成血常规的检查,2周期结束完成脑MRI检查。6周期之后的随访每月进行1次,对所有患者进行为期2年的随访。
4 疗效评价及不良反应 患者的疗效依据世界卫生组织 (World Health Organization, WHO)关于癌症的评价标准进行评价,不良反应依据国际癌症机构统一的副作用评价标准进行。有效率=(CR+PR)/总例数×100%。
5 统计学方法 SPSS 20.0统计学软件,两组间疗效以及不良反应以率表示,采用χ2检验;生存分析采用Graphapad Prism 5.0 进行统计分析,采用Kpalan-Meier方法,两组间比较采用Log-rank test进行,P<0.05为差异有统计学意义。
结 果
1 两组有效率比较结果 放疗结束后1个月后对两组患者的治疗效果进行评价,联合组有效率61.6%,单纯放疗组有效率37.3%,两组比较差异有统计学意义(χ2=5.223,P=0.022),见表2。
2 两组生存期比较 两组患者生存期见图1,Log-rank检验后,联合组中位生存时间为18个月,放疗组中位生存时间为16个月,两组比较差异无统计学意义(χ2=0.206,P=0.650)。
3 两组并发症比较 联合组在中性粒细胞减少以及肝功能损伤方面发生率高于单纯放疗组,差异有统计学意义(P<0.05)。在恶心、呕吐、血红蛋白减少以及血小板减少等方面发生率比较,差异无统计学意义(P>0.05),见表3。
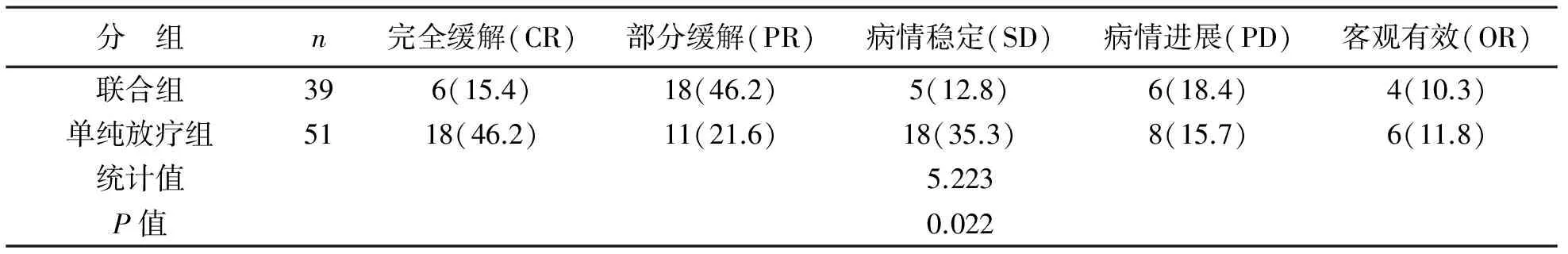
表2 两组患者有效率比较[例(%)]
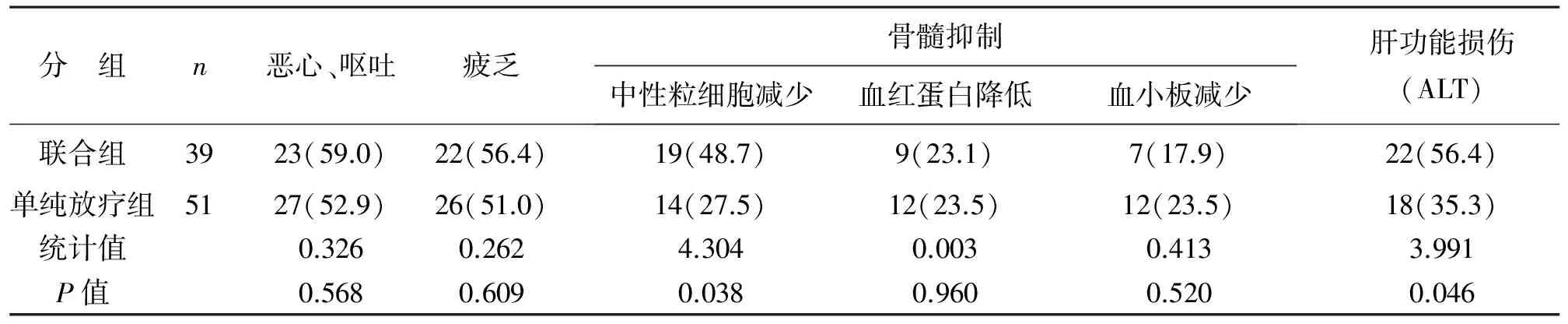
表3 两组患者并发症比较[例(%)]
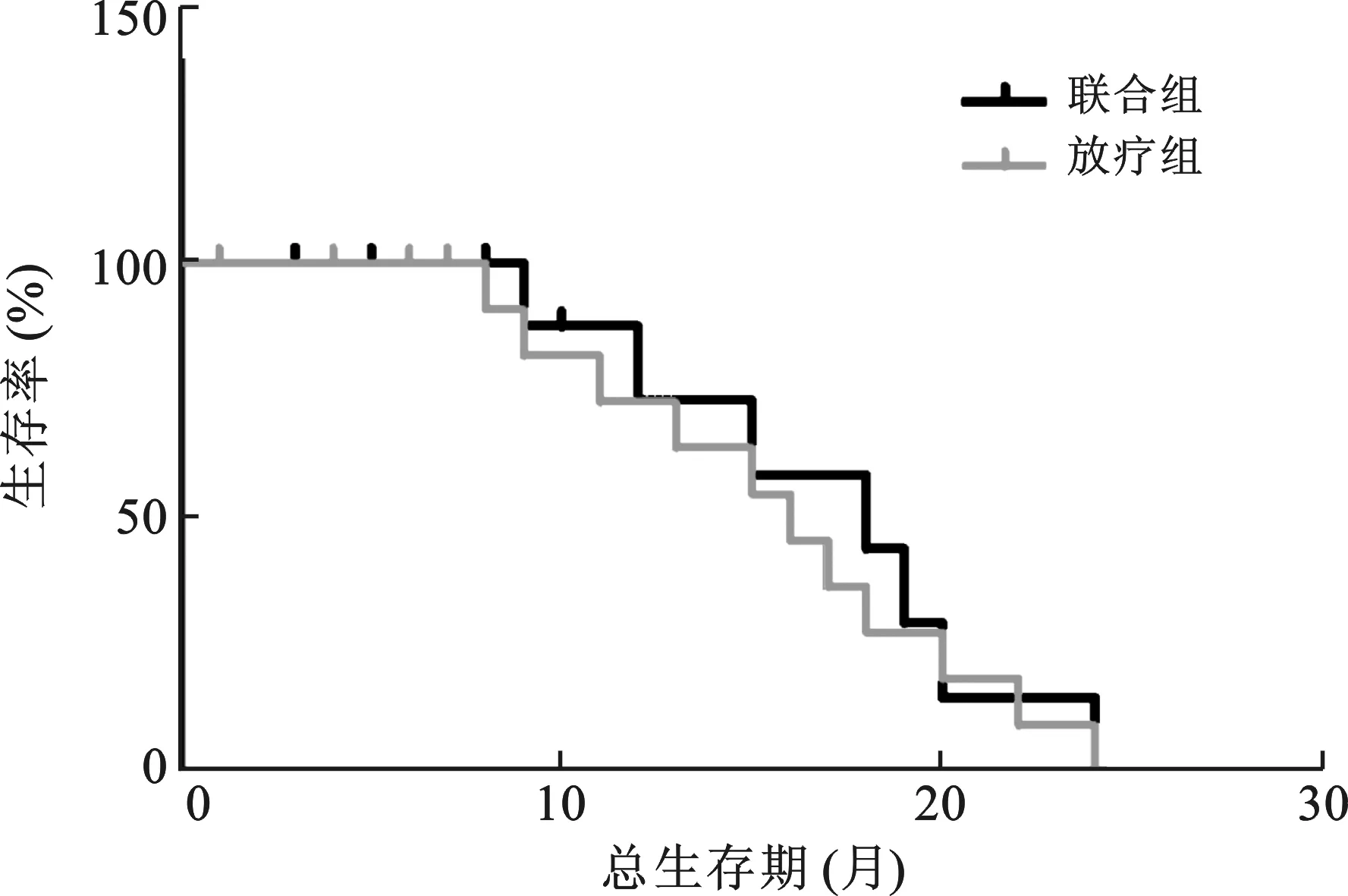
图1 两组患者生存期比较
4 替莫唑胺联合放疗组6周期常见不良反应统计 在替莫唑胺治疗6周期过程中,仅有2例患者出现Ⅳ度骨髓抑制现象,其他如贫血、中性粒细胞减少是替莫唑胺治疗过程中常见的不良反应,Ⅱ度中性粒细胞减少以及贫血发生率分别为25.6%和30.8%。Ⅲ度中性粒细胞减少以及贫血发生率分别为20.5%和25.6%,见表4。

表4 替莫唑胺联合放疗组6周期常见不良反应统计[例(%)]
讨 论
非小细胞肺癌一旦出现脑转移则表示患者的后期生活质量受到严重影响,并且经常伴随着不良结局。随着临床药物以及各种技术手段的发展,病人的生存周期得到提高。但是这些治疗方法均存在着不同程度的并发症。有研究报道全脑放疗会对脑细胞造成损伤,引起脑细胞的凋亡以及痴呆等并发症的发生。而化疗药物应用的效果一直未得到肯定结果,主要是血脑屏障的作用使得有效药物不能进入靶器官发挥作用,反而由于化疗药物的使用增加了不良反应的发生。有研究指出MGMT这种DNA修复酶,主要通过保护机体DNA免受烷化剂的损伤进而延缓肿瘤的发生发展[6]。金文波等[7]报道MGMT与肺癌的发生、发展相关,监测MGMT的变化有助于对肺癌的发展做出正确诊断。但是在MGMT高表达的非小细胞肺癌患者中应用替莫唑胺的疗效如何尚不可知。
本研究首次报道在MGMT高表达的非小细胞肺癌脑转移患者中应用替莫唑胺的疗效以及并发症分析。研究发现替莫唑胺联合全脑放疗在随访周期内的有效率高于单纯放疗组,差异有统计学意义。替莫唑胺可以有效的通过血脑屏障,从而缓解肿瘤患者的生存时间,提高生活质量。曾宪起等[8]将替莫唑胺与司莫司丁作为对照,研究结果显示替莫唑胺的缓解率较司莫司丁高,患者术后临床功能改善明显。替莫唑胺可以抑制肿瘤细胞在各个分裂时期的分裂和增殖,而且对肿瘤细胞的肽亲和区有明显作用。另一方面替莫唑胺可以在脑脊液中达到有效的浓度,进而发挥抗肿瘤的效果[9]。有研究指出替莫唑胺还有化疗增敏的作用[10]。
但是在中位生存期两组患者之间差异无统计学意义。由于本研究纳入患者的数量有限,在中位生存期上替莫唑胺联合化疗是否优于单纯化疗需要进一步的研究和临床证实。Addeo等[11]报道应用替莫唑胺使小细胞肺癌脑转移患者的中位生存期延长至8个月,但是本研究针对MGMT高表达的患者,中位生存期为18个月。可见在MGMT高表达的脑转移患者疗效较好。另一方面反应MGMT高表达与预后的关系。
对两组患者并发症进行对比分析,表明替莫唑胺联合化疗不良反应的耐受性可,临床大可接受。在6周期后,仅有2例患者出现Ⅳ度不可耐受不良反应,表现为中性粒细胞减少。我们应用生白剂患者中性粒细胞可以一定程度上升高。在其他肿瘤包括胶质瘤、白血病等恶性肿瘤其不良反应均可耐受。
总之,应用替莫唑胺联合放疗可以有效增加MGMT高表达的非小细胞肺癌脑转移患者的有效率而不增加患者的不良反应,患者可耐受,值得进一步深入研究。
[1] Cai Z. Relationship between serum carcinoembryonic antigen level and epidermal growth factor receptor mutations with the influence on the prognosis of non-small-cell lung cancer patients[J]. OncoTargets and Therapy,2016,9:3873-3878.
[2] 丁春杰,杨 磊.参芪扶正注射液联合化疗治疗晚期非小细胞肺癌35例[J].陕西中医,2012,33(1):30-32.
[3] Ju L, Han M. Isolated brain metastasis as a late recurrence of completely resected non-small cell lung cancer[J].Oncology letters,2016,12:731-733.
[4] Gu C, Lu J, Cui T,etal. Association between MGMT promoter methylation and non-small cell lung cancer: a meta-analysis[J].PloSone,2013,8:e72633.
[5] Ramirez RA, Beyer DT, Chauhan A,etal.The role of Capecitabine/temozolomide in metastatic neuroendocrine tumors[J]. The oncologist,2016,21:671-675.
[6] Hashimoto K, Narita Y, Matsushita Y, Miyakita Y, Ono M, Kayama T,etal. Methylation status of O6-methylguanine-DNA-methyl transferase promoter region in non-small-cell lung cancer patients with brain metastasis[J]. Clinical & translational oncology : official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico,2012,14:31-35.
[7] 金文波, 郑梦利, 祁彦君,等. 非小细胞肺癌患者 O6-甲基鸟嘌呤-DNA 甲基转移酶的表达及意义[J]. 中国医药导刊,2012,14:657-658.
[8] 曾宪起, 申长虹, 浦佩玉, 等. 应用替莫唑胺对照司莫司丁治疗恶性脑胶质瘤的疗效观察[J]. 中华神经外科杂志,2006,22:204-207.
[9] Boggs DH, Robins HI, Langer CJ,etal. Strategies to prevent brain metastasis in high-risk non-small-cell lung cancer: lessons learned from a randomized study of maintenance temozolomide versus observation[J]. Clinical Lung Cancer,2014,15:433-440.
[10] van Rijn J, Heimans JJ, van den Berg J,etal. Survival of human glioma cells treated with ation of temozolomide and X-rays[J]. International Journal of Radiation Oncology, Biology, Physics,2000,47:779-784.
[11] Addeo R, De Rosa C, Faiola V,etal. Phase 2 trial of temozolomide using protracted low-dose and whole-brain radiotherapy for nonsmall cell lung cancer and breast cancer patients with brain metastases[J]. Cancer,2008,113:2524-2531.
(收稿:2016-07-15)
The efficacy and safety of temozolomide in patients with the high expression of O6 methylguanine DNA methyltransferase of non-small-cell lung cancer patients with brain metastasis
Li Xiaofang,Wang Yue,Chen Xue,et al.
Department of Medical Oncology,Affiliated Hospital of Hebei University(Baoding 071000)
Objective:To evaluate the efficacy and safety of temozolomide in patients with the high expression of O6 methylguanine DNA methyltransferase of non-small-cell lung cancer patients with brain metastasis.Methods: 90 patients were with non-small cell lung cancer with brain metastasis, according to the treatment was divided into whole brain combination chemotherapy with temozolomide group and only chemotherapy group. All patients were follow-up for 2 years, efficacy rates and adverse reaction were recorded. Results:After radiotherapy for 1 month, all patients were evaluated the therapeutic effect, effective rate in the combined group was 61.6% and 37.3% in simple radiotherapy group, the difference was statistically significant (P<0.05). Median survival period was 18 months and 16 months respectively. However, there was no statistically significant between the two groups (P>0.05). The occurrence of neutropenia and liver function injury was higher than that in combined group, the difference was statistically significant (P<0.05). Conclusion: Application of combined radiotherapy with temozolomide can effectively increase the survival rates in the high expression of MGMT of patients with brain metastases from non-small cell lung cancer without increasing the adverse reaction. It is worth further research and generalize in clinical administration.
Lung neoplasms/druy @ Temozolomide Neoplasm Metastasis O(6)Methylguanine-DNA methyltransferase/analysis Alkylating agents
*河北省政府资助临床医学优秀人才项目(361007)
肺肿瘤/药物疗法 @替莫唑胺 肿瘤转移 06-甲基鸟嘌呤DNA甲基转移酶/分析 烷化剂
R734.2
A
10.3969/j.issn.1000-7377.2017.03.043
∆通讯作者
