复合催化剂Co@Co3O4催化硼氢化钠水解制氢性能研究*
2017-03-15孙丹丹谢广文
张 月,颜 双,孙丹丹,谢广文
(青岛科技大学 材料科学与工程学院,山东 青岛 266042)
经济的高速发展使得社会对能源的需求量增加,能源过度使用、环境污染等问题越来越引起人们的重视[1-2]。为改善现有生存环境、节约化石能源、实现可持续发展,寻求一种绿色可再生能源显得尤为重要。氢气由于其能量密度大,燃烧产物绿色无污染,可循环使用等优点被认为是未来最有可能替代化石能源应用于生活生产的能源之一。氢气不是一次能源,质子交换膜燃料电池可以高效地将氢能转化为电能,由于其高效清洁的特点有望成为替代石油天然气等化石能源的供能体[3]。然而一般情况下,氢气都是以气体的形式存在,其易爆易燃等特点成为阻碍实际应用的主要因素,一般的储存方法就是高温高压条件下液化但成本较高[4-6]。与这种方法相比硼氢化钠、硼氢化钾、氨基硼烷等化学氢化物被认为是最有研究前景的储氢材料[7-8]。在这些材料中,1 mol的硼氢化钠可与水反应生成4 mol氢气[9],其理论储氢量高达10.8%,反应副产物偏硼酸钠可以循环使用,环境友好。
贵金属例如Pt[10-11]、Pd[12]、Ru[13-14]等,在催化碱性硼氢化钠方面均有优异的性能,但受其价格昂贵、储量有限的影响很难实际应用。许多研究者们将研究的重点转向非贵金属,Co-Ni-P[15-17],Co-P-B[18],Ni-Co-B[19],Ni-B[20]等催化剂均已被发现有良好的催化性能。金属纳米颗粒的催化性能可通过改变其组成,形貌和金属-氧化物界面结构进行调控[21]。过渡金属氧化物有着独特的电子结构和磁学性能[22-23],在这些金属氧化物中,尖晶石型四氧化三钴拥有较大的晶胞间距、较多的活性位点[24-25]。因此作者通过不同的方法制备了纳米级的钴微粉,采用不同的氧化方法制备了Co@Co3O4复合催化剂。重点研究了液相化学还原法制备的催化剂,探讨其催化碱性硼氢化钠产氢性能,并对其结构和催化性能进行了一系列的研究。实验表明当钴微粉在350 ℃条件下退火制备的Co@Co3O4复合催化剂有较好的性能。
1 实验部分
1.1 试剂与仪器
乙酸钴、十二烷基苯磺酸钠、次亚磷酸钠、聚乙二醇20000:分析纯,天津市巴斯夫化工有限公司;氢氧化钠、正丁醇:分析纯,双氧水:质量分数30%,莱阳经济技术开发区精细化工厂;氯化钴:分析纯,淄博永新化工有限公司;乙二胺:分析纯,天津博迪化工股份有限公司;乙二醇:分析纯,上海埃彼化学试剂有限公司;水合肼:质量分数80%,天津市广成化学试剂有限公司;硼氢化钠:分析纯,国药集团化学试剂有限公司。
场发射扫描电子显微镜:JSM-6700F,日本电子公司;X射线衍射仪:D/max-500,日本理学公司;能量色散X射线谱仪:INCA,英国Oxford仪器公司。
1.2 钴微粉的制备
1.2.1 水热法制备钴微粉
称取0.48 g CoCl2和1.2 g NaOH,量取50 mL去离子水,搅拌充分溶解;分别加入1 mL的乙二胺和水合肼,搅拌15 min;将溶液转移到100 mL反应釜中,200 ℃下反应4 h;反应结束后自然冷却到室温,离心,去离子水和乙醇交替洗3次;50 ℃下真空干燥3 h,得到钴微粉。
1.2.2 化学还原法制备钴微粉
A液:称取0.442 0 g Co(CH3COO)2溶于40 mL乙二醇溶液中,加入0.023 9 g十二烷基苯磺酸钠,充分溶解。
B液:称取1.8 g NaOH加少量水溶解,加入40 mL的乙二醇,超声震荡,使其混合均匀;加入0.44 g NaBH4,超声震荡,使其充分溶解。
用滴管将B液逐滴加入到A液中,并伴随着超声震荡,滴加速度为10~15滴/min;将得到的黑色胶体放入离心机离心,水洗,醇洗各3次;50 ℃真空干燥3 h,得到钴微粉。
1.3 Co@Co3O4复合催化剂的制备
1.3.1 退火氧化法
将制备的钴微粉在不同温度下退火1 h,升温速度为4 ℃/min。在高温状态下,颗粒外表面与空气充分接触发生氧化反应生成高价态的四氧化三钴,而颗粒内部反应不完全存在少量未被氧化的钴微粉,经自然冷却至室温,得到样品。
1.3.2 双氧水直接氧化法
取0.5 g钴微粉、10 mL的双氧水分别放入到烧杯中,用一次性滴管将3~4滴双氧水逐滴加入到钴微粉中,不断震荡,直至不再有明显气体冒出。取吸铁石将粉末收集,倒出反应后的液体,继续重复上述工作,直到双氧水耗尽。将处理好的粉末放入到烘箱中,干燥3 h,获得样品。
1.3.3 双氧水水热氧化法
取0.015 mol的钴微粉放入烧杯A中并加入10 mL的去离子水,不断搅拌。称量0.78 g的聚乙二醇20000溶于37 mL的去离子水,将溶解好的聚乙二醇20000溶液倒入烧杯A中,搅拌10 min,之后加入8 mL的双氧水和15 mL的正丁醇,搅拌30 min,放入聚四氟乙烯为内衬的水热反应釜中,160 ℃水热10 h,自然冷却至室温,离心,50 ℃干燥3 h,得到样品。
1.4 Co@Co3O4复合催化剂催化产氢性能测试
硼氢化钠水解制氢实验装置见图1。
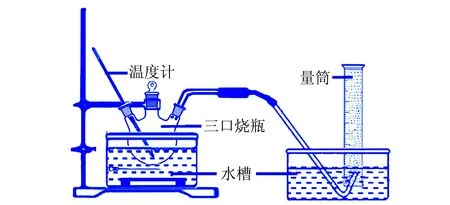
图1 硼氢化钠水解制氢实验装置图
称取0.8 g的硼氢化钠溶解在20 mLw(氢氧化钠)=10%的溶液中,将充分溶解的溶液转移至三口烧瓶中,水浴加热到40 ℃。准确称量(0.010±0.001)g Co@Co3O4复合催化剂加入到三口烧瓶中,所制备的氢气用排水法收集,用秒表计时。对时间和氢气产生量作图,以此表征Co@Co3O4催化剂的催化效率。
2 结果与讨论
2.1 不同制备方法制备Co@Co3O4复合催化剂性能对比
2.1.1 钴微粉的制备方法对Co@Co3O4催化剂催化产氢的影响
在w(NaBH4)=4%、w(NaOH)=10%、m(催化剂)=0.01 g、反应温度为40 ℃条件下,不同方法合成的钴微粉经高温退火制备的Co@Co3O4催化剂的催化性能见图2。
从图2可以看出,由水热法制备的钴微粉氧化后得到的复合催化剂在催化体系中响应时间较长,化学还原法制备催化剂反应迅速,响应时间较短。从热力学上分析,化学还原法制备的催化剂属于非晶结构处于亚稳态[26],能量较高更容易催化硼氢化钠水解释放氢气。采用双氧水直接氧化、双氧水水热氧化两种方法制备的Co@Co3O4复合催化剂同样证明化学还原法制备的钴微粉性能较好,因此选用化学还原法制备的钴微粉进一步研究。
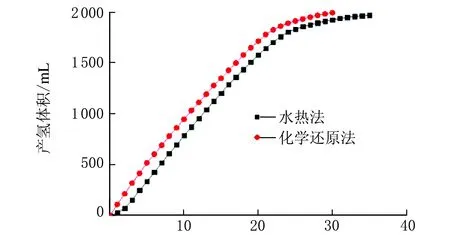
t/min图2 钴微粉的制备方法对Co@Co3O4 催化剂催化产氢的影响
2.1.2 氧化方法对Co@Co3O4复合催化剂的催化产氢的影响
在w(NaBH4)=4%、w(NaOH)=10%、m(催化剂)=0.01 g、反应温度为40 ℃条件下,不同的氧化方法制备Co@Co3O4复合催化剂的催化性能对比见图3。

t/min图3 氧化方法对Co@Co3O4复合催化剂催化产氢的影响
从图3可以看出,经双氧水氧化后的样品产氢性能低于钴微粉。350 ℃退火制备的Co@Co3O4复合催化剂性能优于钴单质以及其它的氧化方法制备的Co@Co3O4复合催化剂。说明采用退火方式制备的Co@Co3O4催化剂具有较好的性能,进一步探究不同退火温度对Co@Co3O4复合催化剂性能的影响。
2.1.3 退火温度对Co@Co3O4复合催化剂催化产氢的影响
在w(NaBH4)=4%、w(NaOH)=10%、m(催化剂)=0.01 g、反应温度为40 ℃条件下,不同退火温度制备的Co@Co3O4复合催化剂催化碱性硼氢化钠产氢性能见图4。

t/min图4 退火温度对Co@Co3O4复合催化剂催化产氢的影响
由图4可知,退火温度对催化性能有较大的影响。退火温度为350 ℃时,催化剂活性显著提高。当t=15 min时,产氢体积约为1 650 mL,其催化硼氢化钠溶液的平均产氢速率可达11.0 L/(g·min)。这明显高于Eom K S等[27]通过化学镀法制备的Co-P催化剂和李等[16]通过化学镀法制备的Co-Ni-P/γ-Al2O3催化剂。这主要是由于以下两方面的原因。第一,该催化剂独特的非晶结构。随退火温度的升高,催化剂逐渐晶化,催化活性降低,因而催化速率下降。李等证明非晶态结构的催化剂催化效率明显要比晶态结构的要高[27]。第二,合理的催化剂成分组成。不同温度退火后,催化剂复合结构中Co3O4和Co的含量会出现明显差异,这会对催化剂的催化性能产生显著影响。
2.2 Co@Co3O4催化剂的微观形貌、元素分析与晶体结构
2.2.1 Co@Co3O4催化剂的微观形貌
钴微粉与不同退火温度制备的Co@Co3O4复合催化剂SEM照片见图5。
图5a为采用化学还原法制备的钴微粉,图5b~5d为钴微粉(图5a)经不同温度退火1h得到的Co@Co3O4复合催化剂。由图5a可知,化学还原法制备的钴微粉粒径均一,直径小于150 nm。如图5b所示,当退火温度为350 ℃时,制备的催化剂粒径较小(约200 nm)。由图5b~5d可得,随着退火温度的增加,催化剂颗粒粒径不断增加,小颗粒团聚逐渐长成形状不规则的大颗粒,形貌迥异。一定程度上解释了在高温区随退火温度的增加催化剂活性下降这一现象。

a 钴微粉

b 350 ℃退火制备Co@Co3O4催化剂

c 400 ℃退火制备Co@Co3O4催化剂

d 450 ℃退火制备Co@Co3O4催化剂图5 钴微粉与不同氧化方法制备的Co@Co3O4 复合催化剂SEM照片
由图5可知,通过化学还原法制备的钴微粉粒径较小接近纳米级别。350 ℃退火处理使得部分催化剂在晶化的同时氧化成Co3O4,使其催化性能增强,而且该催化剂粒径变化不明显,结晶化程度不高,保留了非晶态催化剂独特的短程有序、长程无序的特点,赋予它更高的表面活性中心密度。
2.2.2 Co@Co3O4催化剂的元素分析
化学还原法制备的钴微粉经350 ℃退火合成的Co@Co3O4复合催化剂EDS谱图见图6。

E/keV图6 Co@Co3O4复合催化剂的EDS谱图
从谱图上可以清晰的找到钴、氧、碳各元素的特征峰,表明成功制备了Co@Co3O4复合催化剂。其中碳的峰较高,这主要是测试时所使用的导电胶和反应过程中加入的表面活性剂十二烷基苯磺酸钠共同作用的结果。
Co@Co3O4复合催化剂在电子束激发情况下所产生的特征X射线中的K线系谱线的EDS分析结果见表1。

表1 Co@Co3O4复合催化剂的EDS分析结果
2.2.3 Co@Co3O4催化剂的晶体结构
钴微粉和Co@Co3O4复合催化剂的XRD谱图见图7。

2θ/(°)图7 不同样品的XRD谱图
从图7a可以看出,化学还原法制备的钴微粉的X射线衍射在2θ≈20°、45°附近各有一个宽泛的特征弥散峰,这是非晶态结构比较典型的特征峰,说明合成的钴微粉的物相结构为非晶态。由图7b~7d可以看出,退火处理后出现了明显的衍射峰,并随退火温度的升高,衍射峰逐渐增强。根据分析可知,温度越高,氧化生成的Co3O4含量越高,说明在空气中退火处理,钴微粉颗粒外表面逐渐氧化变成高价态的Co3O4并逐渐向结晶态转化,形成由钴微粉和氧化生成的Co3O4并存的非晶与微晶复合结构[28]。这是由于非晶态合金在热力学上处于亚稳态,在一定温度下退火可以使催化剂结构从非晶态转变为晶态[29]。衍射峰的2θ值分别为31.271°、36.852°、59.357°、65.236°,对应标准卡片(JCPDS,No.42-1467)结晶态的立方相Co3O4(220)、(311)、(511)、(440)晶面。2θ为41.683°、44.762°处的衍射峰对应标准卡片(JCPDS,No.05-0727)六方结构钴的(100)、(002)晶面。
2.3 Co@Co3O4复合催化剂磁性能测试
取适量Co@Co3O4复合催化剂加少量水超声分散,将磁铁置于烧杯外壁,Co@Co3O4复合催化剂在磁铁作用下的现象见图8。

图8 Co@Co3O4复合催化剂在磁铁作用下的现象
由图8可见,分散在水中的颗粒迅速聚集在一起并可以根据磁铁的运动而运动。钴是铁磁性材料,有较强的磁性,受钴的影响,复合催化剂拥有较强的磁性,利于分离收集回用。
3 结 论
通过化学还原法,以硼氢化钠为还原剂在室温下制备纳米钴微粉,在350 ℃条件下退火氧化得到粒径较小的Co@Co3O4复合催化剂。研究了Co@Co3O4复合催化剂催化水解硼氢化钠的速率与钴微粉的制备方法,氧化方式的关系。探究了退火温度对Co@Co3O4复合催化剂催化硼氢化钠水解制氢性能的影响。结果表明,液相化学还原法制备的钴微粉经退火后所得Co@Co3O4复合催化剂拥有较高的催化活性,在40 ℃催化硼氢化钠水解产氢速率为11.0 L/(g·min),并且具有一定的磁性,便于反应后催化剂的分离和收集,这在一定程度上克服了粉末状样品难回收的缺点。
[1] LUND H,MATHIESEN B V.Energy system analysis of 100% renewable energy systems——the case of Denmark in years 2030 and 2050[J].Energy,2009,34(5):524-531.
[2] FERNANDES R,PATEL N,MIOTELLO A.Hydrogen generation by hydrolysis of alkaline NaBH4solution with Cr-promoted Co-B amorphous catalyst[J].Applied Catalysis B:Environmental,2009,92(1):68-74.
[3] JIANG G M,LI X W,LV X S,et al.Core/shell FePd/Pd catalyst with a superior activity to Pt in oxygen reduction reaction[J].Science Bulletin,2016,61(16):1248-1254.
[4] SANTOS D M F,SEQUEIRA C A C.Sodium borohydride as a fuel for the future[J].Renewable and Sustainable Energy Reviews,2011,15(8):3980-4001.
[5] AHLUWALIA R K,HUA T Q,PENG J K.Fuel cycle efficiencies of different automotive on-board hydrogen storage options[J].International Journal of Hydrogen Energy,2007,32(15):3592-3602.
[6] WANG W L,ZHAO Y C,CHEN D H,et al.Promoted Mo incorporated Co-Ru-B catalyst for fast hydrolysis of NaBH4in alkaline solutions[J].International Journal of Hydrogen Energy,2014,39(28):16202-16211.
[7] ZHAO Y C,NING Z,TIAN J N,et al.Hydrogen generation by hydrolysis of alkaline NaBH4solution on Co-Mo-Pd-B amorphous catalyst with efficient catalytic properties[J].Journal of Power Sources,2012,207:120-126.
[8] PENA ALONSO R,SICURELLI A,CALLONE E,et al.A picoscale catalyst for hydrogen generation from NaBH4for fuel cells[J].Journal of Power Sources,2007,165(1):315-323.
[9] JENA P.Materials for hydrogen storage:past,present,and future[J].The Journal of Physical Chemistry Letters,2011,2(3):206-211.
[10] XU D Y,ZHANG H M,YE W.Hydrogen generation from hydrolysis of alkaline sodium borohydride solution using Pt/C catalyst[J].Catalysis Communications,2007,8(11):1767-1771.
[11] BAI Y,WU C,WU F,et al.Carbon-supported platinum catalysts for on-site hydrogen generation from NaBH4solution[J].Materials Letters,2006,60(17):2236-2239.
[12] GUELLA G,ZANCHETTA C,PATTON B,et al.New insights on the mechanism of palladium-catalyzed hydrolysis of sodium borohydride from 11 B NMR measurements[J].The Journal of Physical Chemistry B,2006,110(34):17024-17033.
[13] HUANG Y H,SU C C,WANG S L,et al.Development of Al2O3carrier-Ru composite catalyst for hydrogen generation from alkaline NaBH4hydrolysis[J].Energy,2012,46(1):242-247.
[14] ZAHMAKIRAN M,OZKAR S.Zeolite-confined ruthenium(0)nanoclusters catalyst:record catalytic activity,reusability,and lifetime in hydrogen generation from the hydrolysis of sodium borohydride[J].Langmuir,2009,25(5):2667-2678.
[15] GUO Y P,FENG Q H,MA J T.The hydrogen generation from alkaline NaBH4solution by using electroplated amorphous Co-Ni-P film catalysts[J].Applied Surface Science,2013,273(15):253-256.
[16] LI Z,LI H L,WANG L N,et al.Hydrogen generation from catalytic hydrolysis of sodium borohydride solution using supported amorphous alloy catalysts (Ni-Co-P/γ-Al2O3)[J].International Journal of Hydrogen Energy,2014,39(27):14935-14941.
[17] KIM D R,CHO K W,CHOI Y,et al.Fabrication of porous Co-Ni-P catalysts by electrodeposition and their catalytic characteristics for the generation of hydrogen from analkaline NaBH4solution[J].International Journal of Hydrogen Energy,2009,34(6):2622-2630.
[18] PATEL N,FERNANDES R,BAZZANELLA N,et al.Co-P-B catalyst thin films prepared by electroless and pulsed laser deposition for hydrogen generation by hydrolysis of alkaline sodium borohydride:a comparison[J].Solid Films,2010,518(17):4779-4785.
[19] XU D Y,WANG H Z,GUO Q J,et al.Catalytic behavior of carbon supported Ni-B,Co-B and Co-Ni-B in hydrogen generation by hydrolysis of KBH4[J].Fuel Process Technology,2011,92(8):1606-1610.
[20] LEE J K,ANN H H,YI Y,et al.A stable Ni-B catalyst in hydrogen generation via NaBH4hydrolysis[J].Catalysis Communications,2011,16(1):120-123.
[21] WHITE R J,LUQUE R,BUDARIN V L,et al.Supported metal nanoparticles on porous materials.Methods and applications[J].Chemical Society Reviews,2009,38(2):481-494.

[23] CHAE J,PYAGAI R,DEMIDIOUK V,et al.Influence of cobalt precursors on the catalytic activity of the cobalt oxide/Al2O3catalysts[J].Reaction Kinetics and Catalysis Letters,2004,83(2):369-375.
[24] LARCHER D,SUDANT G,LERICHE J B,et al.The electrochemical reduction of Co3O4in a lithium cell[J].Journal of the Electrochemical Society,2002,149(3):A234-A241.
[25] HAN B,PARK J M,CHOI K H,et al.Atomic layer deposition of stoichiometric Co3O4films using bis (1,4-di-iso-propyl-1,4-diazabutadiene) cobalt[J].Thin Solid Films,2015,589(31):718-722.
[26] 王丽娜,李忠,刘腾宇,等.负载型非晶合金催化剂 Ni-Co-P/γ-Al2O3的制备及其结构和催化性能表征[J].青岛科技大学学报(自然科学版),2016,37(1):41-46.
[27] EOM K S,CHO K W,KWON H S.Effects of electroless deposition conditions on microstructures of cobalt-phosphorous catalysts and their hydrogen generation properties in alkaline sodium borohydride solution[J].Journal of Power Sources,2008,180(1):484-490.
[28] 钟明龙.Co3O4纳米片的简单热氧化法制备及其磁性能[J].稀有金属,2015,39(2):119-123.
[29] 李忠,赵兴蕾,王丽娜,等.负载型非晶合金催化剂Ni-Co-P/γ-Al2O3催化硼氢化钠水解制氢[J].青岛科技大学学报(自然科学版),2014,35(6):582-586.
