不同方法建立双足大鼠脊柱侧弯动物模型的特点比较
2017-03-09李鹏飞杨建博刘金录靳宪辉
李鹏飞,贾 楠,赵 鹏,杨建博,刘金录,靳宪辉
(哈励逊国际和平医院骨病科,河北 衡水 053000)
·论 著·
不同方法建立双足大鼠脊柱侧弯动物模型的特点比较
李鹏飞,贾 楠,赵 鹏,杨建博,刘金录,靳宪辉*
(哈励逊国际和平医院骨病科,河北 衡水 053000)
目的探讨不同方法建立双足大鼠脊柱侧弯动物模型的特点及意义。方法脱离哺乳期SD大鼠40只,随机分为4组各10只。通过手术完全切除大鼠的前肢及尾部。对照组10只,单纯制作双足大鼠动物模型。设立3个实验组,其中6-巯基嘌呤组腹腔内注射6-巯基嘌呤(30 mL/kg),低褪黑素组腹腔内注射 2-苯基-N-乙酰色胺(0.2 mg/kg),肉毒毒素组椎旁肌注射肉毒毒素。对4组实验动物手术前后的脊柱曲度指数(Cobb角)、椎体高度变化情况及脊柱侧弯特点进行比较评估。结果所有实验动物均存活至完成脊柱侧弯建模实验。对照组未发生脊柱侧弯,3个实验组双足鼠均发生了脊柱侧弯。4组大鼠Cobb角均呈增加趋势,6-巯基嘌呤组Cobb角的幅度最大;4组椎体高度均呈升高趋势,与对照组比较,6-巯基嘌呤组和肉毒毒素组椎体高度丢失,低褪黑素组高度增加,4组组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。结论腹腔注射6-巯基嘌呤、 2-苯基-N-乙酰色胺以及椎旁肌注射肉毒毒素均可成功建立SD双足大鼠脊柱侧弯动物模型。
脊柱侧凸;模型,动物;大鼠
动物模型在特发性脊柱侧弯的病因学研究中具有重要作用[1]。针对特发性脊柱侧弯的多种发病原因,一系列动物模型被制作出来[2]。文献已经对各种特发性脊柱侧弯的动物模型进行了报道,包括鼠类、山羊、狗、兔、鸡、猪等[3]。其中,对鼠类脊柱侧弯的病因学动物模型研究报道较多:包括切除前肢及尾部建立双足直立行走动物模型;6-巯基嘌呤产生神经源性损伤;低褪黑素造成神经内分泌调节功能异常;肉毒毒素使椎旁肌损伤功能异常[4]。但都未针对不同的特发性脊柱侧弯动物模型产生的机制及特点进行深入的比较研究。本研究针对神经源性损伤、神经内分泌调节功能异常、椎旁肌功能异常等发病原因分别进行了动物模型的建立,旨在探讨不同方法建立双足大鼠脊柱侧弯动物模型的机制特点及对临床工作的指导意义。报告如下。
1 材料与方法
1.1 实验材料 选择出生时间相同的40只脱离哺乳期SD大鼠(健康,等级为一级,普通实验动物),雌、雄各20只,体质量92.5~106.8 g,均由河北省实验动物中心提供,并在室温18~22 ℃、相对湿度40%~60%、光照12 h/d的条件下进行常规分笼饲养。本研究中动物实验过程及处置方法均严格遵守动物伦理学要求,并经过作者所在单位伦理委员会的批准。实验于2015年2—12月在河北医科大学第三医院动物实验中心、影像学中心及骨科研究所完成。
1.2 实验方法 将SD大鼠饲养观察1周。之后随机分为对照组、6-巯基嘌呤组、2-苯基-N-乙酰色胺组(低褪黑素组)、肉毒毒素组并编号,每组10只SD大鼠。手术均由同一实验人员完成切除前肢及尾部的操作。大鼠术前停止饲喂及饮水8 h术前准备。应用10%水合氯醛溶液腹腔注射麻醉(0.3 mg/g)。麻醉后对SD大鼠进行备皮、消毒,之后应用手术丝线双重结扎大鼠前腿近端及尾巴基底部,应用手术刀小心分离肩肱关节后完全离断SD大鼠双前肢,并在SD大鼠尾根部完全离断其长尾,完成SD大鼠双足直立动物模型的建立。术后处理:对照组术后不进行任何干预;6-巯基嘌呤组术后腹腔注入6-巯基嘌呤(6-mercaptopurine,Glaxo Smith Kline Company,US),注射剂量严格按照30 mL/kg计算;低褪黑素组术后腹腔注入 2-苯基-N-乙酰色胺(luzindole,Sigma Company,US),注射剂量严格按照0.2 mg/kg计算;肉毒毒素组术后椎旁肌内注射肉毒毒素(botulinum toxin A,Allergan Botox Cosmetic Company,US,100 U/tube),注射剂量严格按照50 U/kg计算,使用1 mL标准注射器给予双足大鼠椎旁肌多点注射肉毒毒素。
1.3 一般情况 双足大鼠完成切除前肢及尾部术后改为高围栏饲养笼。严密观察双足大鼠进食、饮水等生物学行为。并观察其直立行走情况。每日对双足大鼠生物学行为观察记录并测量体质量。
1.4 影像学观察 术后拍摄脊柱全长正位X线片。拍摄脊柱全长正位X线片观察之前采用10%水合氯醛进行腹腔注射麻醉。严格按照0.3 mg/g使用麻醉药物水合氯醛。将SD双足大鼠固定脊柱承重直立向上的体位后,保持直立位拍摄脊柱全长正位X线。需要指出的是:拍摄脊柱全长正位X线片频率为每月1次。
1.5 图像处理及测量 应用Photoshop CS4.0软件进行图像处理及测量。由同一实验人员仔细测量各组每一只实验动物术前及术后的脊柱曲度指数(Cobb角)。确定脊柱侧弯产生的标准为:Cobb角>10 °。同时,由同一实验人员测定各组每一只SD双足大鼠的胸、腰椎各个节段的椎体高度。具体方法为通过Photoshop CS 4.0软件作出上下终板中央的连线,测量连线之间的距离。将测量的胸、腰椎高度进行统计后,计算每一只双足大鼠胸、腰椎的椎体高度之和,应用统计软件进行分析。
1.6 统计学方法 应用SPSS 17.0统计学软件分析数据。计量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 双足大鼠生物学行为 所有大鼠均顺利度过围手术期。所有实验动物均无严重手术并发症及死亡。完成大鼠切除前肢及尾部的操作术后改为高围栏饲养笼。观察发现双足大鼠逐渐开始直立体位站立及并较快适应直立行走。同时,由同一实验人员持续观察双足大鼠进食、饮水等生物学行为。双足大鼠在整个研究过程中生物学行为均正常,未发现明显异常。双足大鼠术后适应性直立行走情况良好。在拍摄脊柱全长正位X线片的麻醉及拍摄过程中均无实验动物死亡。同时,在搬运实验动物及全部拍摄过程中,实验人员均未发现双足大鼠异常生物学行为。
2.2 脊柱侧弯形成情况 术后3个月时,测定4组每只双足大鼠的胸、腰各节段椎体高度,计算椎体高度之和。对照组双足大鼠Cobb角均<10 °,尚未产生脊柱侧弯;3个实验组双足大鼠Cobb角均大于10 °,符合脊柱侧弯标准。4组大鼠Cobb角均呈增加趋势,6-巯基嘌呤组Cobb角增加幅度最大,4组组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表1,图1。

表1 各组应用药物干预后脊柱曲度变化比较Table 1 Comparison of Cobb angle changes after drug intervention in each group

图1 双足大鼠脊柱侧弯产生情况
2.3 椎体高度变化情况 术后4组椎体高度均呈升高趋势,与对照组进行比较,6-巯基嘌呤组和肉毒毒素组椎体高度丢失,低褪黑素组高度增加,4组组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表2,图2。

表2 各组应用药物干预后椎体高度变化比较Table 2 Comparison of total height of vertebral body changes after drug intervention in each group
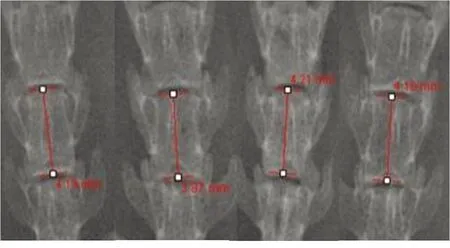
图2 显示双足大鼠椎体高度测量方法
3 讨 论
特发性脊柱侧弯对青少年成长发育影响重大[5]。病因学研究对其意义重大[6]。因此,建立特发性脊柱侧弯的动物模型是阐明其病因、发展、诊断、治疗的重要方法[7]。双足大鼠具有饲养和繁殖容易、产生脊柱侧弯时间短、存活率较高等特性[8]。同时,其脊柱解剖学结构与人类相似[9]。这些特点使其在建立特发性脊柱侧弯的动物模型研究中应用非常广泛[10]。有学者对于实验室诱发双足大鼠产生脊柱侧弯的方法进行了广泛研究,主要有药物致畸、低褪黑素致畸、椎旁肌生物力学失衡致畸三大类[11]。但是,对于不同方法制作脊柱侧弯鼠类动物模型的原理及效果尚存争议。
本研究选择6-巯基嘌呤进行双足大鼠腹腔注射,成功模拟神经源性损害诱发脊柱侧弯畸形的动物模型。首先,6-巯基嘌呤可以直接影响并抑制次黄嘌呤-鸟嘌呤磷酸核糖转移酶的生物活性。同时,6-巯基嘌呤可以明显抑制嘌呤核苷酸补救合成途径。本研究应用6-巯基嘌呤产生明显脊柱侧弯原理即是利用其对动物机体的不良反应,主要为脊髓神经功能紊乱。最终,脊髓所支配脊柱区域的血液、养分供应破坏,严重影响脊柱发育,并进一步阻碍神经元、神经纤维生长及抑制功能形成,使机体丧失对脊柱发育平衡性的支配和调控。在脊髓和脊柱均失去有效调节之后,进入发育异常的恶性循环,侧弯畸形进展加速。本研究发现6-巯基嘌呤抑制脊柱生长,使脊柱发育异常,椎体高度丢失。
国内外学者在褪黑素水平与脊柱侧弯关系方面进行了大量的研究[12]。低褪黑素水平与脊柱侧弯存在正相关,低褪黑素水平可以诱发脊柱侧弯[13]。进展期脊柱侧弯患者血液中褪黑素水平与健康人比较明显降低。但对于特发性脊柱侧弯患者血液中褪黑素水平是否均降低这一观点存在较大争议。关于低褪黑素与脊柱侧弯畸形诱发的相关性分析中,目前文献报道主要有两方面原因:首先,低褪黑素可以影响中枢神经系统的信号传导;其次,低褪黑素直接影响脊柱脊髓的调节功能。并且可以使成骨细胞的功能受损,最终诱发脊柱侧弯畸形。本研究应用肉毒毒素进行椎旁肌内注射,成功制作出了脊柱侧弯模型。笔者对实验动物椎旁肌肉内注射肉毒毒素后进行了持续观察及X线片精确测量,发现椎旁肌肉内注射肉毒毒素的双足大鼠的椎体高度无明显改变。说明椎旁肌的生物力学失衡对脊柱本身的生长发育影响不大。
神经源性损害产生的脊柱侧弯的原因主要为脊髓的神经功能紊乱。本研究发现双足大鼠脊髓神经源性损害所致的脊柱侧弯严重。因此,脊髓神经源性损害对研究人体所出现的严重特发性脊柱侧弯有重要意义。证明脊髓营养水平不足、支配功能下降、神经源性损害为脊柱侧弯发病原因之一。其次,机体的低褪黑素水平可以影响其中枢神经系统的信号传导,影响脊柱脊髓的调节功能,使成骨细胞的功能受损。低褪黑素水平与脊柱侧弯的关系一直是研究的热点。本研究证明褪黑素拮抗剂所造成的机体褪黑素水平降低可以诱发双足大鼠产生脊柱侧弯。证明机体长期处于低褪黑素水平可诱发脊柱侧弯,同时其与脊柱侧弯的进展相关。低褪黑素水平与神经源性损害产生的脊柱侧弯的原因有相似之处,即两者均可以产生脊髓的神经功能调节紊乱。但对两者进行椎体高度变化分析比较发现,神经源性损害产生的脊柱发育异常表现为椎体短小,而低褪黑素水平诱发的脊柱侧弯的特点为椎体高度增加。神经源性损害与低褪黑素水平两者在对脊柱生长发育过程中的影响存在明显差异,但均可诱发机体产生脊柱侧弯。表明特发性脊柱侧弯可由于不同原因诱导产生。提示在临床工作之中,要根据患者自身不同情况分析患者脊柱侧弯产生的原因,更深一步了解脊柱侧弯的特点、病因、类型,积极指导预防及治疗工作。同时,两者所产生脊柱侧弯的部位及程度均不可控,均不适合应用于固定及矫正脊柱侧弯畸形的相关实验研究。
对实验组脊柱侧弯特点进行比较,发现椎旁肌生物力学失衡所致脊柱侧弯原理简单,即椎旁肌肉收缩及自身调节能力丧失,最终造成实验动物两侧椎旁肌生物力学产生不可逆性变化,脊柱在椎旁肌挛缩和牵引作用下失去平衡,产生脊柱侧弯。椎旁肌生物力学失衡所致脊柱侧弯对脊柱骨性结构、脊髓神经功能和脊柱韧带结构产生的影响相对小。而低褪黑素水平与神经源性损害产生脊柱侧弯可以使椎体结构发育明显异常、脊髓神经功能明显受损、脊柱韧带结构失去平衡。值得指出的是,可以通过调整肉毒毒素的注射剂量,控制椎旁肌肉组织挛缩和牵引作用。
本研究中,6-巯基嘌呤组和肉毒毒素组小鼠椎体高度丢失,低褪黑素组高度增加。笔者认为6-巯基嘌呤其明显抑制了嘌呤核苷酸补救合成,致使双足鼠神经调控功能受到严重损害,破坏了脊柱区域血液、养分供应及自身调节能力,最终椎体生长发育被抑制,椎体高度明显丢失。与之不同,肉毒毒素对小鼠椎旁肌纤维组织严重破坏后,椎旁肌对脊柱的辅助支撑和共同维持稳定性的作用消失,双足小鼠站立后由于四足类动物缺乏横突间韧带等结构,脊柱椎体及椎间盘承重增加,稳定性下降,对椎体发育起到负面作用。更重要的是,肉毒毒素对椎旁肌破坏后,生物机体自身修复过程中产生的纤维化、瘢痕化对脊柱发育、椎体高度增长产生阻力。褪黑素水平可影响脊柱的纵向生长,笔者认为其机制主要为对椎体生长板软骨细胞的影响,高浓度褪黑素可以抑制椎体生长板软骨细胞的增殖和分化,然而低褪黑素水平可起到促进作用。本研究中应用低浓度褪黑素促进了双足小鼠椎体生长发育,椎体高度增加。但是随时间增加(小鼠周龄)椎体生长板软骨细胞的增殖能力逐渐下降。
本研究对3个实验组脊柱侧弯畸形特点进行比较研究,椎旁肌生物力学失衡所致脊柱侧弯畸形的原理最简单,即椎旁肌肉收缩及自身调节能力丧失,最终造成实验动物两侧椎旁肌的生物力学产生不可逆性变化,脊柱在椎旁肌挛缩和牵引作用下失去平衡,产生脊柱侧弯畸形。椎旁肌生物力学失衡所致脊柱侧弯畸形对脊柱骨性结构、脊髓神经功能和脊柱韧带结构产生的影响相对小。而低褪黑素水平与神经源性损害产生脊柱侧弯畸形可以使椎体结构发育明显异常、脊髓神经功能明显受损、脊柱韧带结构失去平衡。值得指出的是,椎旁肌生物力学失衡所致脊柱侧弯畸形最具特点:即可以通过调整肉毒毒素的注射剂量,控制椎旁肌肉组织挛缩和牵引作用。实验人员可以利用这一特点制作出不同侧弯程度和部位的侧弯动物模型。在进行固定及矫正脊柱侧弯畸形以及相关实验研究的过程中,所建立的动物模型侧弯畸形程度和部位一致将使实验更具有说服力。下一步实验人员将致力于特发性脊柱侧弯畸形的干预及治疗。
[1] Ungi T,King F,Kempston M,et al. Spinal curvature measurement by tracked ultrasound snapshots[J]. Ultrasound Med Biol,2014,40(2):447-454.
[2] Zhang H,Zhao S,Zhao Z,et al. The association of rs1149048 polymorphism in Matrilin-1(MATN1) gene with adolescent idiopathic scoliosis susceptibility:a meta-analysis[J]. Mol Biol Rep,2014,41(4):2543-2549.
[3] Schiess R,Boeni T,Rühli F,et al. Revisiting scoliosis in the KNM-WT 15000 Homo erectus skeleton[J]. J Hum Evol,2014,67:48-59.
[4] Pasha S,Aubin CE,Sangole AP,et al.Three-dimensional spinopelvic relative alignment in adolescent idiopathic scoliosis[J]. Spine(Phila Pa 1976),2014,39(7):564-570.
[5] Franzin FJ,Gotfryd AO,Neto NJ,et al. Radiographic and functional evaluation of the iliac bone graft in the treatment of adolescent idiopathic scoliosis[J]. J Pediatr Orthop B,2014,23(4):307-311.
[6] Forsberg D,Lundström C,Andersson M,et al. Fully automatic measurements of axial vertebral rotation for assessment of spinal deformity in idiopathic scoliosis[J]. Phys Med Biol,2013,58(6):1775-1787.
[7] Romano M,Minozzi S,Zaina F,et al. Exercises for adolescent idiopathic scoliosis:a Cochrane systematic review[J]. Spine(Phila Pa 1976),2013,38(14):E883-893.
[8] Ogura Y,Takahashi Y,Kou I,et al. A replication study for association of 53 single nucleotide polymorphisms in a scoliosis prognostic test with progression of adolescent idiopathic scoliosis in Japanese[J]. Spine(Phila Pa 1976),2013,38(16):1375-1379.
[9] Rushton PR,Grevitt MP. Comparison of untreated adolescent idiopathic scoliosis with normal controls:a review and statistical analysis of the literature[J]. Spine(Phila Pa 1976),2013,38(9):778-785.
[10] Meng XL,Zhao H,Su QJ,et al. Acute pulmonary embolism following adolescent idiopathic scoliosis correction surgery:case report and review of literature[J]. J Int Med Res,2013,41(5):1759-1767.
[11] Daubs MD,Hung M,Neese A,et al. Scoliosis research society-22 results in 3052 healthy adolescents aged 10 to 19 Years[J]. Spine(Phila Pa 1976),2014,39(10):826-832.
[12] Yang JH,Suh SW,Sung PS,et al. Asymmetrical gait in adolescents with idiopathic scoliosis[J]. Eur Spine J,2013,22(11):2407-2413.
[13] 卢颖.矫形器在青少年特发性脊柱侧弯治疗中的临床应用价值[J].河北医科大学学报,2012,33(5):566-568.
(本文编辑:赵丽洁)
The characteristics of different methods to create scoliosis model of bipedal rats
LI Peng-fei, JIA Nan, ZHAO Peng, YANG Jian-bo, LIU Jin-lu, JIN Xian-hui*
(DepartmentofOrthopaedics,HarrisonInternationalPeaceHospital,Hengshui053000,China)
Objective To explore the mechanism and the significance of different methods to establish scoliosis model of bipedal rats. Methods Forty SD rats were randomly divided into four groups. The front limb and tail of SD rats was completely removed. The control group only create model of bipedal rats. Ten bipedal rats in group A were given intraperitoneal injection of 6-mercaptopurine(30 mL/kg). Tenbipedal rats in group B received intraperitoneal injection of luzindole(0.2 mg/kg). 10 bipedal rats in group C received intramuscular injection of botulinum toxin A. The spinal curvature index, change of intervertebral height and the characteristics of scoliosis were compared between the four groups before and after operation. Results All the experimental animals survived to complete the modeling experiment of scoliosis. In control group, there was no scoliosis. All three experimental groups had scoliosis. Cobb's angle of rats were all increased in four groups and showed an raising trend. However, cobb's angle of the 6- mercaptopurine group increased the maximum. Vertebral height of rats in four groups were all increased and showed a rising trend. Compared with control group, the height of vertebral body was lost in 6-mercaptopurine group and botulinum toxin group. However, the vertebral height of low melatonin group height was increased. There were significant differences among groups, time points, interaction of group and point-in-time(P<0.05). Conclusion Application of intraperitoneal injection 6-mercaptopurine can establish a severe scoliosis model. Intraperitoneal injection of luzindole proved that low concentration of melatonin can induce scoliosis. The botulin can damage the fiber tissue of paraspinal muscle. It is proved that destruction of biomechanical balance of paraspinal muscle can creat scoliosis models.
scoliosis; models, animal; rats
2016-06-03;
2016-07-05
李鹏飞(1985-),男,河北肃宁人,哈励逊国际和平医院主治医师,医学博士研究生,从事脊柱外科疾病诊治研究。
*通讯作者。 E-mail:pengflyl@163.com
R682.3
A
1007-3205(2017)02-0154-05
10.3969/j.issn.1007-3205.2017.02.008
