海州香薷不同种群细胞壁转化酶蛋白结构与分子模拟对接
2017-03-09蔡深文徐仲瑞熊治廷
蔡深文++徐仲瑞++熊治廷

摘要:为研究铜胁迫下海州香薷(Elsholtzia haichowensis Sun)非矿区种群細胞壁转化酶(EhNcwINV)和矿区种群细胞壁转化酶(EhCcwINV)活性差异的机理,运用在线分析工具对细胞壁转化酶基因推导的氨基酸序列进行分析,利用SWISS-MODEL进行同源建模,并将细胞壁转化酶与蔗糖分子进行模拟对接。结果表明,海州香薷两个种群细胞壁转化酶蛋白质在443位点和538位点处存在氨基酸趋异位点,模拟的3D结构非常相似,仅在趋异位点Leu433/Pro433和Tyr538/His538处有差别。EhNcwINV、EhCcwINV和模拟突变体(EhNcwINV-L433P和EhNcwINV-Y538H)与蔗糖分子对接形成的催化活性中心构象基本一致,但在空间位置上存在细微差异,氨基酸趋异可能是造成两个种群细胞壁转化酶活性差异的原因之一。
关键词:海州香薷(Elsholtzia haichowensis Sun);细胞壁转化酶;同源建模;分子对接
中图分类号:Q51;Q942.7 文献标识码:A 文章编号:0439-8114(2017)01-0166-05
DOI:10.14088/j.cnki.issn0439-8114.2017.01.042
Protein Structure and Molecular Modeling Docking of Cell Wall Invertase from
Different Populations in Elsholtzia haichowensis Sun
CAI Shen-wen1,XU Zhong-rui2,XIONG Zhi-ting2
(1.School of Resource and Environment,Zunyi Normal College,Zunyi 563002,Guizhou,China;
2.School of Resource and Environmental Sciences,Wuhan University,Wuhan 430079,China)
Abstract: It was to study the mechanism of enzyme activity difference of cell wall invertase from different populations,one from non-mine population(EhNcwINV),the other from mine population(EhCcwINV) in Elsholtzia haichowensis Sun under copper stress. The amino acid sequences of cell wall invertase were analyzed by ExPASy(http://au.expasy.org/tools/). The three-dimensional structure was constructed by homologous modeling. The structures of cell wall invertase from two populations of E. haichowensis Sun and non-mine population with each single point mutation in complex with sucrose were simulated. The results showed that there were two divergent amino acids at position 443 and 538 between EhNcwINV and EhCcwINV. The three-dimensional structures were exactly similar between EhNcwINV and EhCcwINV. It showed difference at Leu433/Pro433 and Tyr538/His538,which were divergent sites. The structures of catalytic active center of EhNcwINV,EhCcwINV,and simulated mutants(EhNcwINV-L433P,EhNcwINV-Y538H) binding with sucrose showed no significant differences. However,there were differences on spatial position. It might be one of the reasons for the difference of cell wall invertase activity between two populations.
Key words: Elsholtzia haichowensis Sun;cell wall invertase;homologous modeling;molecular docking
在重金属污染的土壤中,植物生长受重金属的胁迫,为了维持重金属抗性机制,植物必须获得足够的由糖提供的碳源和能量。对于大多数高等植物,糖在源器官叶中合成,以蔗糖的形式转运至库器官根中,用于维持异养代谢和生长[1]。然而,蔗糖不能够被植物直接用于新陈代谢,必须通过蔗糖合酶或转化酶水解为己糖才能被利用。细胞壁转化酶(Cell wall invertase,cwINV)在水解蔗糖的过程中起着至关重要的作用,且在调节韧皮部糖代谢、控制储藏器官内糖的组成、参与植物应对逆境胁迫以及植物早期生长发育调控等方面均具有重要的作用[2]。细胞壁转化酶为酸性转化酶,其最适pH为4.5~5.5,也叫β-呋喃果糖苷酶[3],为不溶性转化酶,通过离子作用结合在细胞壁上,等电点为碱性。在靠近成熟蛋白质的N-末端含有一个β-呋喃果糖苷酶的特征序列(NDPNG/A),在其半胱氨酸催化域具有特征序列WECPD,这两个特征序列高度保守[3,4]。
海州香薷(Elsholtzia haichowensis Sun)是一年生草本植物,属唇形科,广泛分布于長江中下游铜矿区和铜污染的土壤中,是一种铜矿指示植物,俗称“铜草”[5,6]。海州香薷在非铜矿区也有发现[7]。铜矿区的海州香薷由于长期生活在高浓度铜污染的环境胁迫条件下可能已经发生了与Cu污染相适应的抗性进化,形成了与非矿区种群不同的抗性生态型[8]。通常来自矿区种群的海州香薷对Cu具有很高的吸收富积能力和耐受能力[9]。海州香薷作为一种研究铜抗性的模式植物,其基因信息公布的还较少,前期研究表明海州香薷两个种群的细胞壁转化酶活性在铜胁迫下存在差异[10],而酶活性通常与基因及其表达调控过程相关,因此获得海州香薷细胞壁转化酶基因编码的蛋白质信息,对于进一步深入研究铜胁迫下两个种群酶活性差异的分子机理具有重要的理论意义。
1 材料与方法
1.1 材料
海州香薷非矿区种群细胞壁转化酶基因(EhNcwINV)和矿区种群细胞壁转化酶基因(EhCcwINV)序列为本实验室前期克隆所得,GenBank登录号分别为JX500753和JX500754。
1.2 蛋白结构分析
使用在线ExPASy序列分析工具(http://au.expasy.org/tools/)对推导的氨基酸序列进行分析,采用ProtParam分析蛋白的氨基酸序列组成、相对分子质量、等电点等理化性质,采用ProtScale分析蛋白质的疏水性。将海州香薷两个种群细胞壁转化酶和液泡转化酶的氨基酸序列提交至在线分析工具SWISS-MODEL(http://swissmodel.expasy.org/)进行同源建模,选择拟南芥(Arabidopsis thaliana)细胞壁转化酶基因AtcwINV1的3D蛋白质结构(PDB:2AC1,www.pdb.org)为模板,预测海州香薷细胞壁转化酶蛋白质的三级结构。
1.3 分子对接
海州香薷细胞壁转化酶蛋白质与蔗糖分子的对接采用自动对接软件AutoDock4.0完成。蔗糖分子结构来自于MMsINC数据库(http://mms.dsfarm.unipd.it/MMsINC/)。选择细胞壁转化酶活性中心的GLU227设置为柔性残基。蛋白质分子和蔗糖分子在对接过程中同时被赋予Geister Huckel电荷,Grid大小设置为26×28×28(x,y,z),格点间隔为默认值0.375 ?魡,Grid中心坐标设置为74.158、112.502、-4.938(x,y,z)。Number of GA Runs设置为30,其他参数均使用系统默认参数。对接过程使用拉马克遗传算法(Lamarckian Genetic Algorithm,LGA)对结合位点进行搜索和能量评价,选择结合自由能最低的构象为最终的结合模式。同源模拟生成的PDB文件以及分子对接结果均使用PyMOL软件显示和分析。
2 结果与分析
2.1 海州香薷两个种群细胞壁转化酶蛋白质的基本特征
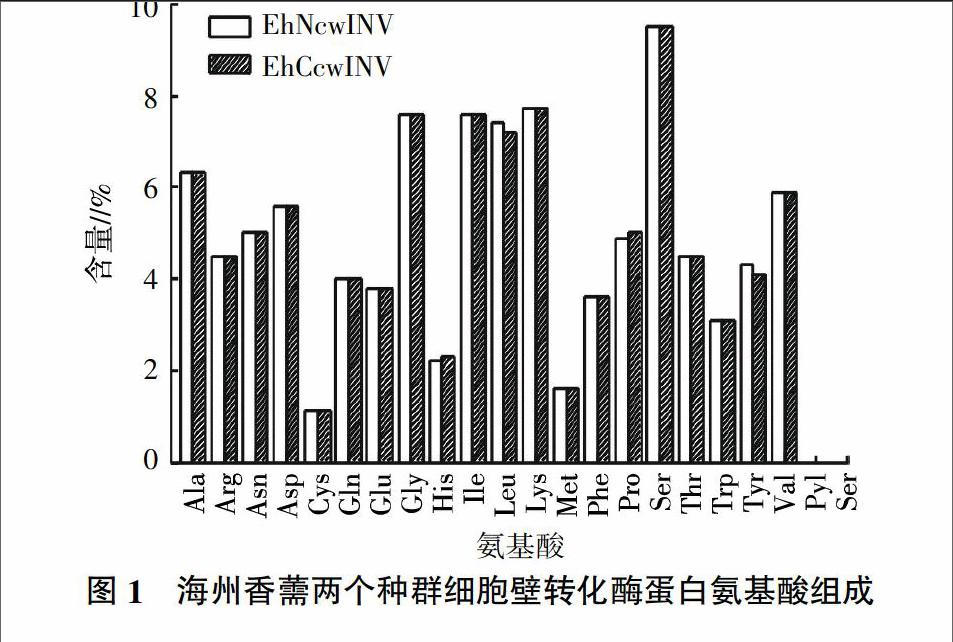
海州香薷细胞壁转化酶基因编码蛋白质的氨基酸序列为完整的开放阅读框,由556个氨基酸残基组成,两个种群海州香薷细胞壁转化酶蛋白质的氨基酸组成基本一致,丙氨酸(Ala)、甘氨酸(Gly)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)和丝氨酸(Ser)含量较高,均高于6%,无吡咯赖氨酸(Pyl)和含硒半胱氨酸(Sec)(图1)。两个种群间共有2个氨基酸趋异位点,其中非矿区细胞壁转化酶在443位和538位分别为亮氨酸和酪氨酸,而矿区细胞壁转化酶在这两个位点分别为脯氨酸和组氨酸。非矿区细胞壁转化酶蛋白质原子总数为8 781个,分子式为C2 823H4 365N765O813S15,分子质量为62 510.2 D,理论等电点为9.29。矿区细胞壁转化酶蛋白质原子总数为8 775个,分子式C2 819H4 359N767O812S15,分子质量为62 468.1 D,理论等电点为9.30。亲水/疏水性分析结果表明,两个种群细胞壁转化酶蛋白质的疏水性在趋异位点443和538处存在差异,非矿区种群的细胞壁转化酶蛋白质在该区域具有较强的疏水性(图2)。
2.2 海州香薷不同种群细胞壁转化酶蛋白质的3D结构
非矿区和矿区种群海州香薷细胞壁转化酶蛋白质的3D结构非常相似,仅在趋异位点Leu433/Pro433和Tyr538/His538处有细微的差别,如图3所示。二者均由N-末端类似螺旋桨形状的β-转角结构域和C-末端的β-折叠区组成,这两个结构域由两个较短的α螺旋连接。其中N-末端的结构域由5个β转角组成,主要负责与底物蔗糖结合,是酶的催化中心,C-末端的结构域由2组反向平行的β折叠组成。
2.3 海州香薷细胞壁转化酶蛋白模拟突变与分子对接
为了研究海州香薷不同种群细胞壁转化酶活性的差异,从细胞壁转化酶蛋白质与底物结合的角度进行计算机模拟分析,以非矿区种群的细胞壁转化酶为基础,在两个种群间的趋异位点处进行模拟定点突变,获得突变体酶蛋白质分子EhNcwINV-L433P和EhNcwINV-Y538H,并与蔗糖分子进行对接。首先使用拟南芥细胞壁转化酶蛋白质AtcwINV1(PDB ID:2AC1)[11]、突变体AtcwINV1-E203Q(PDB ID:2OXB)、AtcwINV1-E203A(PDB ID:2QQV)和AtcwINV1-D239A(PDB ID:2QQU)[12]的晶体结构模型检测海州香薷细胞壁转化酶蛋白质与蔗糖的对接程序,确保对接结果的可靠性。
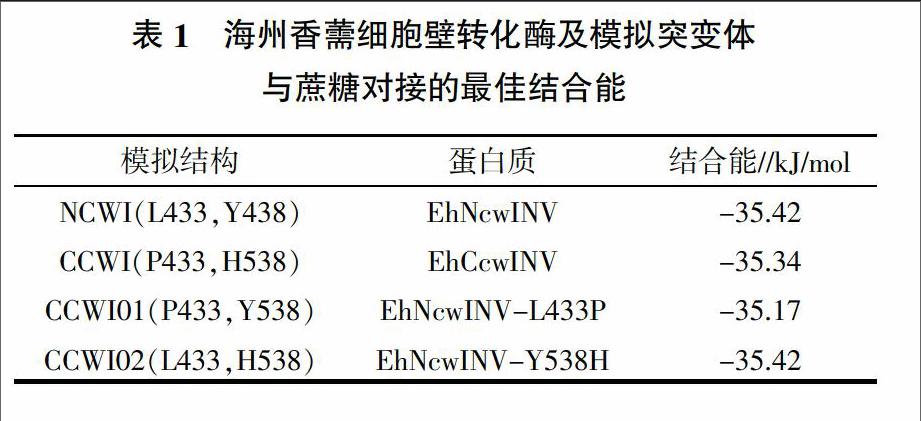
海州香薷细胞壁转化酶与蔗糖分子的对接模拟结果显示,蔗糖分子在EhNcwINV、EhCcwINV、EhNcwINV-L433P和EhNcwINV-Y538H催化活性中心的构象基本一致(图4),呋喃果糖环上的氧原子O6分别与N46上的氮原子ND2、Q63上的氧原子OE1和W71上的氮原子NE1,O4分别与S107上的N和D173上的OD1,O3分别与D173上的OD2、R172上的NE和E227上的OE2,O2与N46上的ND2,O1与D47上的OD1之间形成氢键相互作用。吡喃葡萄糖环上的O2与E227上的OE2,O3与N260上ND2之间也形成了氢键相互作用,使蔗糖分子稳定地结合在细胞壁转化酶的催化活性中心。尽管蔗糖分子与EhNcwINV、EhCcwINV、EhNcwINV-L433P和EhNcwINV-Y538H之间对接的构象基本一致,但在空间位置上存在细微差异,计算机模拟对接的结合能分别为-35.42、-35.34、 -35.17和-35.42 kJ/mol(表1)。
3 讨论
本研究在前期扩增获得的海州香薷两个种群细胞壁转化酶基因全长cDNA序列(EhNcwINV和EhCcwINV)的基础上,推测得到的氨基酸序列属于GH32糖苷水解酶家族,该家族成员的成熟蛋白质有40%~60%的同源性[13],具有多个植物细胞壁转化酶基因的保守序列,包括两个最为保守的特征基序β-呋喃果糖苷酶(NDPN)和催化区域的重要组成部分(WECP/VD)。推测的蛋白分子质量及等电点与其他物种已报道的细胞壁转化酶蛋白质都相似[3,14,15],且与其他物种的细胞壁转化酶氨基酸序列具有较高的同源相似性。几乎所有高等植物的细胞壁转化酶在催化区域的保守位点上都有一个脯氨酸(P)[16],海州香薷细胞壁转化酶也相同。植物细胞壁转化酶和果糖基转移酶的同源性较高,具有相同的保守区域,如蔗糖结合基序、RDP基序和EC基序[17],海州香薷细胞壁转化酶也具有这些特征序列。
海州香薷非矿区细胞壁转化酶(EhNcwINV)与矿区细胞壁转化酶(EhCcwINV)的氨基酸序列存在两个趋异位点,这可能是由于两个种群长期生活在不同的环境中,矿区种群在铜胁迫下发生适应性进化的结果,从而使矿区种群具有较高的转化酶活性,获得更多的能量来源,用以维持铜抗性机制。氨基酸序列的改变可能会导致蛋白质活性的改变,Fridman等[18]研究证实番茄细胞壁转化酶催化活性中心附近的一个氨基酸Glu突变为Asp后,其酶活性升高了3倍。NDPN基序和EC基序在转化酶中高度保守,如果将Asp23替换为Asn23,或者将Glu203替换为Ala203,转化酶将失去活性[19],拟南芥细胞壁转化酶晶体结构X射线衍射分析显示这两个氨基酸残基与RDP基序中的Asp149都位于转化酶的活性位点[11]。海州香薷细胞壁转化酶EhNcwINV和EhCcwINV对应的NDPN、RDP和EC基序中3个保守的同源氨基酸分别为Asp47、Asp173和Glu227。最近,通过对拟南芥突变体的研究表明,除高度保守的NDPN、RDP和EC基序外,其附近的氨基酸残基Trp82、Asp239和Lys242对于底物分子结合的稳定性也具有重要意义,这些位点的突变将改变转化酶水解蔗糖的活性参数,如Km和Kcat值[12,20,21]。Asp239突變为Asn239后与野生型AtcwINV1的活性无差别,但突变为Ala239后将使AtcwINV1失去转化酶活性,表现出果聚糖水解酶(1-FEH)活性[20]。AtcwINV1的Trp82、Asp239和Lys242同源氨基酸在海州香薷EhNcwINV和EhCcwINV中分别为Trp106、Asn260和Phe263。显然,海州香薷两个种群细胞壁转化酶的趋异氨基酸位点都不在上述活性位点及其附近。
EhNcwINV和EhCcwINV的2个趋异位点都位于C末端,尽管不在活性中心及其附近,但Leu433/Pro433紧邻酸性转化酶保守区域FGL(430~432),Tyr538/His538靠近保守区域FNNG(533~536)。这些氨基酸残基结构的差异可能会导致其临近区域的蛋白质构象发生细微改变,而这种细微改变可能会影响整个蛋白质的稳定性或活性。在玉米细胞壁转化酶INCW2中,C末端的一个胞嘧啶突变为胸腺嘧啶导致Pro变为Leu,尽管这个突变位点不在催化活性中心(WECPD),不在糖基化位点,也不在β-呋喃果糖基序(NDPNG)中,但突变使INCW2的蛋白质活性在Incw2转录正常的情况下仅为正常值的6%,这可能是由于该位点的Pro被替换后降低了整个蛋白质的稳定性[22]。虽然计算机模拟结果表明海州香薷不同种群细胞壁转化酶趋异位点处的疏水性存在差异,但3D结构模拟表明并未造成蛋白质构象的显著差异。分子对接结果表明EhNcwINV和EhCcwINV与蔗糖分子的结合构象基本一致,且EhNcwINV和EhCcwINV与蔗糖分子对接的结合能差异较小,可能是由于趋异的氨基酸位点在C末端,远离活性中心,对活性中心的构象没有产生影响。虽然海州香薷不同种群间的细胞壁转化酶与蔗糖分子结合的构象差异不显著,但蔗糖分子与细胞壁转化酶蛋白质催化活性中心氨基酸之间的空间距离具有细微差异。虽然模拟定点突变结果也显示突变位点差异对结合的整体构象不产生显著影响,但蔗糖分子与酶催化中心之间的空间距离发生细微变化,这种细微差别可能是由于趋异氨基酸的结构差异导致其附近的氨基酸残基的构象发生改变,尽管这种改变很小,但也可能会传递至活性中心的氨基酸,从而使活性中心底物结合的口袋构象产生差异。但是这种构象上的细微差异是否会导致不同种群间细胞壁转化酶的活性或蛋白质稳定性表现出显著差异还需进一步进行验证。
参考文献:
[1] ROLLAND F,BAENA-GONZALEZ E,SHEEN J.Sugar sensing and signaling in plants: Conserved and novel mechanisms[J].Annual Review of Plant Biology,2006,58:675-709.
[2] LI Z,PALMER W M,MARTIN A P,et al. High invertase activity in tomato reproductive organs correlates with enhanced sucrose import into, and heat tolerance of young fruit[J].Journal of Experimental Botany,2011,63(3):1155-1166.
[3] STURM A. Invertases: Primary structures,functions, and roles in plant development and sucrose partitioning[J].Plant Physiology,1999,121(1):1-8.
[4] RUAN Y L,JIN Y,YANG Y J,et al. Sugar input,metabolism,and signaling mediated by invertase: Roles in development,yield potential,and response to drought and heat[J].Molecular Plant,2010,3(6):942-955.
[5] 柯文山,席紅安, 杨 毅,等.大冶铜绿山矿区海州香薷(Elsholtzia haichowensis)植物地球化学特征分析[J].生态学报,2001,21(6):907-912.
[6] 谢学锦,徐邦梁.铜矿指示植物——海州香薷[J].地质学报,1952,32(4):360-368.
[7] LIU J,XIONG Z T.Differences in accumulation and physiological response to copper stress in three populations of Elsholtzia haichowensis S.[J].Water Air and Soil Pollution,2005,168(1):5-16.
[8] 熊治廷.植物抗污染进化及其遗传生态学代价[J].生态学杂志, 1997,16(1):53-57.
[9] YANG M J,YANG X E,R?魻MHELD V.Growth and nutrient composition of Elsholtzia splendens Nakai under copper toxicity [J].Journal of Plant Nutrition,2002,25(7):1359-1375.
[10] CAI S W,XIONG Z T,LI L,et al. Differential responses of root growth,acid invertase activity and transcript level to copper stress in two contrasting populations of Elsholtzia haichowensis[J].Ecotoxicology,2014,23(1):76-91.
[11] VERHAEST M,LAMMENS W,LE ROY K,et al.X-ray diffraction structure of a cell-wall invertase from Arabidopsis thaliana[J].Acta Crystallographica Section D Biological Crystallography,2006,62(12):1555-1563.
[12] LAMMENS W,LE ROY K,VAN LAERE A,et al. Crystal structures of Arabidopsis thaliana cell-wall invertase mutants in complex with sucrose[J].Journal of Molecular Biology,2008, 377(2):378-385.
[13] DAVIES G,HENRISSAT B.Structures and mechanisms of glycosyl hydrolases[J].Structure,1995,3(9):853-859.
[14] HUANG W X,CAO Y,HUANG L J,et al. Differential expression of acid invertase genes in roots of metallicolous and non-metallicolous populations of Rumex japonicus under copper stress[J].Chemosphere,2011,84(10):1432-1439.
[15] DRAIE R,P?魪RON T,POUVREAU J,et al. Invertases involved in the development of the parasitic plant Phelipanche ramosa:Characterization of the dominant soluble acid isoform,PrSAI1 [J].Molecular Plant Pathology,2011,12(7):638-652.
[16] TYMOWSKA-LALANNE Z, KREIS M. The plant invertases: Physiology, biochemistry and molecular biology[J]. Advances in Botanical Research,1998,28:71-117.
[17] RITSEMA T,SMEEKENS S C M.Engineering fructan metabolism in plants[J].Journal of Plant Physiology,2003,160(7):811-820.
[18] FRIDMAN E,CARRARI F,LIU Y,et al. Zooming in on a quantitative trait for tomato yield using interspecific introgressions[J].Science,2004,305(5691):1786-1789.
[19] GOETZ M,ROITSCH T. Identification of amino acids essential for enzymatic activity of plant invertases[J].Journal of Plant Physiology,2000,157(5):581-585.
[20] LE ROY K,LAMMENS W,VERHAEST M,et al.Unraveling the difference between invertases and fructan exohydrolases: A single mmino acid(Asp-239) substitution transforms Arabidopsis cell wall invertase1 into a fructan 1-exohydrolase[J].Plant Physiology,2007,145(3):616-625.
[21] M?魣TRAI J,LAMMENS W,JONCKHEER A,et al. An alternate sucrose binding mode in the E203Q Arabidopsis invertase mutant:An X-ray crystallography and docking study[J].Proteins:Structure,Function,and Bioinformatics,2008,71(2):552-564.
[22] CARLSON S J,SHANKER S,CHOUREY P S.A point mutation at the Miniature 1 seed locus reduces levels of the encoded protein,but not its mRNA,in maize[J].Molecular and General Genetics,2000,263(2):367-373.
