含锑复杂硫化矿臭氧协同氧化浸出机理
2017-03-02郭学益辛云涛田庆华
郭学益,辛云涛,王 浩,田庆华
含锑复杂硫化矿臭氧协同氧化浸出机理
郭学益1, 2,辛云涛1, 2,王 浩1, 2,田庆华1, 2
(1. 中南大学 冶金与环境学院,长沙 410083;2. 中国有色金属工业协会 中国有色金属清洁冶金工程研究中心,长沙 410083)
利用臭氧气体作为协同氧化剂,在盐酸体系中配合氧气浸出含锑复杂硫化矿,研究其在不同温度条件下的浸出行为,结合动力学并从间接氧化的角度研究浸出反应机理。结果表明:采用臭氧协同氧化浸出含锑复杂硫化矿,在一定条件下可以有效地浸出其中的锑,锑的浸出率随着温度的升高而升高。相比于氧气氧化浸出,臭氧可以有效地促进浸出反应的进行。动力学分析表明,臭氧可以直接促进化学反应的进行,使得氧化浸出反应过程呈现出不同的动力学控制步骤和参数。
臭氧;含锑复杂硫化矿;协同氧化;浸锑
锑在工业上主要用作阻燃剂、塑料行业的催化剂及陶瓷颜料[1−2],是一种重要的金属材料。中国锑资源丰富,是世界上最大的锑生产国[3]。在我国最重要的锑矿资源是辉锑矿(Sb2S3),一般锑的冶炼过程为火法冶炼,包括氧化焙烧和还原熔炼两个主要过程[4−6],虽然火法冶炼过程具有效率高、处理量大的优点,但是会产生大量二氧化硫烟气造成一系列的环境污染问题[7]。火法冶炼技术主要用于处理高品位锑硫化矿,而对于低品位复杂硫化矿则很难达到较好回收效果。湿法冶炼技术具有选择性强、适应性强的优点,且不会产生烟气,其在处理低品位含锑复杂硫化矿方面的优势引起了广泛的关注[8−9]。
研究者们充分开展了辉锑矿的碱性浸出的相关研究,同时辉锑矿的碱性浸出技术在中国、澳大利亚和美国已经得到工业化应用[10−12]。ANDERSON[13]采用硫化钠(Na2S)和氢氧化钠(NaOH)混合碱溶液处理辉锑矿,得到良好的效果。RASCHMAN等[10]采用含1.0% Na2S和1.0% NaOH (摩尔分数)的混合液处理辉锑矿,在19 ℃经过60 min的浸出过程,锑的浸出率可达90%。类似的,在20 g/L Na2S和NaOH溶液中,在80℃条件下浸出5 min,锑的回收率可以达到85%[9]。在锑的酸性浸出中,盐酸常常被用做浸出剂并配合氧化剂来处理辉锑矿[14],酸性氧化浸出的相关研究同样展现出其在处理含锑硫化矿方面的优势,FeCl3、氯气和SbCl5等氧化剂常被用于辉锑矿的浸出,在优化条件下锑的浸出率可达99%[15−19]。
臭氧作为强氧化剂具有清洁、无残留和高效的特点,广泛应用于废水处理领域,并且已经用于硫化矿的氧化浸出[20−23]。相比纯氧气/空气的氧化浸出,加入臭氧协同作用之后,其氧化能力得到极大提升,在常温常压下即可达到氧气在高温高压下才能到达的效果。UKASIK和HAVLIK探索了利用臭氧在盐酸体系中协同氧化浸出黝铜矿[24]。ELORZA-RODRÍGUEZ 等[25]利用臭氧处理金矿浮选尾渣中的黄铁矿。李青翠等[26]利用臭氧进行难处理金矿的氧化预处理,有效地打开了硫化物对金相的包裹。由此可见,臭氧在协同氧化处理硫化矿方面具有较好的效果及应用前景。
湖南湘西的低品位锑复杂硫化矿通常由黄铁矿、辉锑矿和脉石成分组成。目前已经有很多从高品位辉锑矿中提取锑的研究,而从低品位含锑复杂硫化矿回收锑的研究较少。随着优质资源的日益枯竭,从低品位矿物中回收有价金属具有长远的意义。本文作者以湘西某冶炼厂含锑复杂硫化物为对象,采用臭氧作为协同氧化剂在盐酸体系中进行氧化浸出实验,通过动力学分析间接氧化反应过程,揭示盐酸体系臭氧协同氧化浸出含锑复杂硫化矿的机理。
1 实验
1.1 材料与仪器
采用来自湘西某冶炼厂的含锑复杂硫化矿为实验原料。矿物中和浸出液中各元素含量采用电感耦合等离子体原子发射光谱(ICP-AES, PS−6, Baird, USA)测定,矿物的物相采用X射线衍射(XRF, S0902724, Rigaku, Japan)进行测定。图1所示为含锑复杂硫化矿的XRD谱。由图1可知,矿物中的主要物相为辉锑矿(Sb2S3),黄铁矿(FeS2),毒砂(FeAsS)和脉石。矿物的成分含量如下表1所示,从结果可以看出,矿物中主要元素为铁、硫、锑、砷和硅。结合XRD和ICP结果可知,该矿物为典型低品位含锑复杂硫化矿。
根据相关数据绘制Sb-S(Cl)-H2O系电位−pH 图[27],根据本研究中具体元素浓度((Sb)=0.05 mol/L,(Fe)=0.1 mol/L,(S)=0.1 mol/L,(Cl)=4.0 mol/L,(As)=0.01 mol/L)和实验操作条件,设定pH值范围为−1.5~3.0,结果见图2。由图2可知,浸出反应过程涉及到的反应方程式,如式(1)~(6)所示,其中硫元素或转化为单质硫或转化为硫酸根进入溶液。由−pH图可知,臭氧和氧气的标准氧化还原电位高于硫化物和离子之间转化的化学反应电位,因此浸出反应过程在理论上可行。同时从−pH图可以看出,反应体系中存在多种元素及价态,电子传输和反应过程较为复杂,其中Fe3+和Sb5+具有高于相应硫化物的电位,因此可知本反应过程主要涉及到O3和O2的直接氧化以及Fe3+和Sb5+间接氧化。

表1 粒径小于74 μm含锑复杂硫化矿成分
1) By X-ray fluorescence spectrometric analysis (XRF).

图2 Sb-S(Cl)-H2O系φ−pH图和Fe(As)-S-H2O系φ−pH图
Sb2S3+2iCl−+3H++12O3=3HSO4−+2SbCl3−i+12O2(1)
FeS2+H2O+7O3=Fe2++2HSO4−+7O2(2)
2FeAsS+3H2O+4H++5O3=
2Fe2++2H3AsO3+2H2SO4+2O2(3)
Sb2S3+2iCl−+6H++3O3=3S+2SbCl3−i+3H2O+3O2(4)
FeS2+2H++O3=Fe2++2S+O2+H2O (5)
2FeAsS+H2O+4H++3O3=2Fe2++2H3AsO3+2S+2O2(6)
1.2 实验步骤
浸出实验在800 mL的烧杯中进行,温度通过恒温水浴锅进行调节,使用机械搅拌器控制搅拌速度,反应中采用冷凝回流防止溶液的挥发损失。实验中采用臭氧发生器制备出稳定的臭氧气体(为O2和O3的混合气体),臭氧浓度约为120 mg/L,气体中氧气(O2)量多于臭氧(O3)量,气体的流量通过流量计控制。将400 mL 4.0 mol/L 的盐酸溶液和8.0 g矿物放入烧杯混合均匀,调节到预定温度,保持搅拌速度900 r/min,然后通入流量为2.0 L/min的臭氧气体开始反应,每隔一定时间取3.0 mL 溶液送检,同时添加3.0 mL盐酸溶液保持体系稳定。反应结束后,对浸出渣进行XRD分析,以明确反应过程机理。锑和铁的浸出率由以下公式计算:

式中:为浸出率;i为溶液中元素含量;为溶液体积;0为矿物质量;为矿物中元素质量分数。
2 结果与讨论
2.1 臭氧气体氧化浸出行为
图3所示为不同温度下臭氧气体氧化浸出过程中锑的浸出率与时间的关系。结果表明,随着体系温度的升高,锑的浸出率也随之升高,反应50 min时,锑的浸出率从15 ℃的19.9%升高到85 ℃的86.1%。通常认为,温度条件会影响反应体系内的传质过程和化学反应过程,因此较高的温度会增强气液固传质效率,促进锑的浸出。虽然臭氧在溶液中的溶解度随着温度的升高而下降,但是由于传质过程和化学反应速率较快,而反应消耗和溶解增加的臭氧达到动态平衡状态,溶液中实际溶解的臭氧保持稳定,溶解度的改变不会对反应过程产生影响。为了研究氧化反应机理,对反 应数据进行动力学拟合,从反应的控制步骤及活化能角度明确反应过程。

图3 不同温度下臭氧气体氧化锑的浸出率
在85 ℃浸出时浸出渣的XRD谱如图4所示。由图4可知,矿物中的硫在反应过程中并没有形成硫单质,而是进入溶液,反应过程并无固体产物生成,该反应过程符合收缩核模型[28−29]。经典动力学方程如下式(8)、(9)、(10)所示。由于无固体产物生产,故不考虑内扩散控制,而该反应过程为气−液−固三相反应,必须考虑外扩散控制,其中式(9)为外扩散控制时的方程式,式(8)为界面化学反应控制时的方程式,而式(10)为混合过程控制的方程式。




式中:x为浸出率;ki为速率常数;t为反应时间。
为了确定反应过程的控制步骤和动力学参数,采用相关方程式对实验数据进行拟合,结果表明扩散控制方程式和混合过程控制方程式具有较好的拟合度,结果见图5。并根据图5可得出速率常数(i)。阿仑尼乌斯公式如下所示:


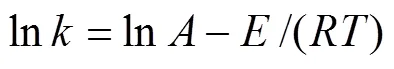
结果见图6。

图5 外扩散控制拟合曲线和混合过程控制拟合曲线
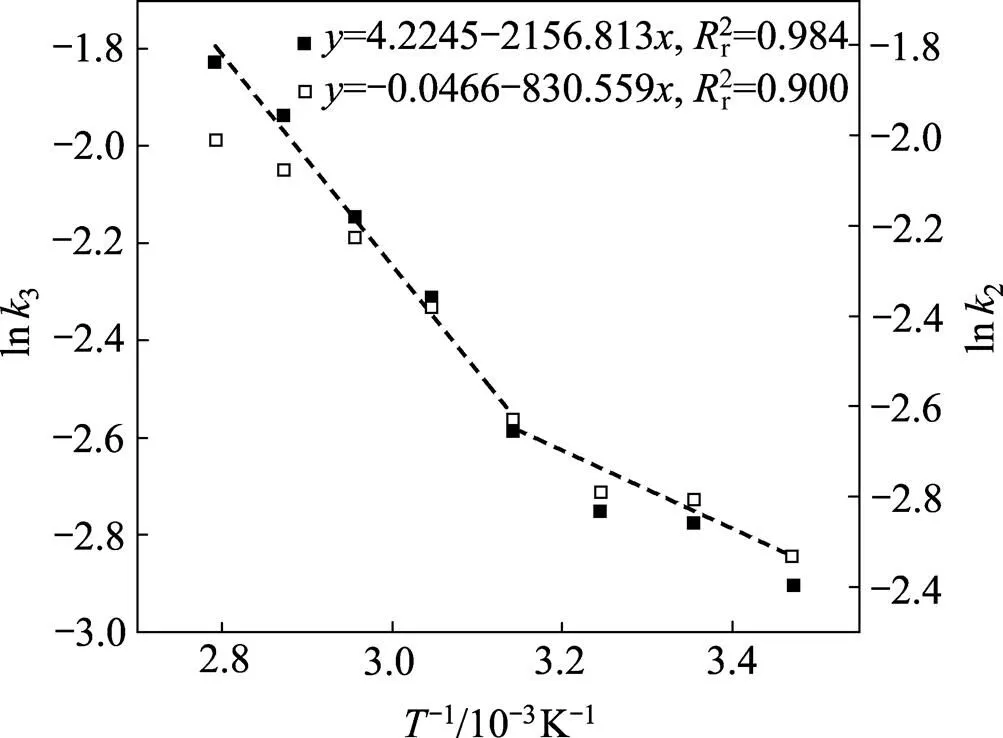
图6 臭氧气体氧化浸出过程阿仑尼乌斯拟合曲线
根据图5中曲斜率可得k值,并通过拟合可得图6曲线。从图6可以看出,在高温(45~85 ℃)和低温(15~45 ℃)时分别存在两条不同的直线,高温时的直线过程具有较大的斜率而低温时斜率较小,表明该反应过程在高温和低温时具有不同的反应动力学,因此在高温时采用混合控制拟合,低温时采用扩散控制拟合,如图6中直线所示。结合阿仑尼乌斯公式可知,在高温时反应表观活化能为17.93 kJ/mol,低温时表观活化能为6.91 kJ/mol。一般地,扩散控制过程的表观活化能小于10 kJ/mol,化学反应控制过程的表观活化能则大于40 kJ/mol,混合过程控制的表观活化能介于两者之间。综上,低温时传质过程相比反应过程速率较慢,故控制步骤为传质过程控制,随着温度的升高,传质速率提高,转变为化学反应和传质过程共同控制。
2.2 氧气氧化浸出行为
上述反应过程中所采用的氧化气体名义上为臭氧气体,实为臭氧和氧气组成的混合气体。为了明确反应中臭氧和氧气的作用和反应机理,采用同样流量的纯氧气气体做氧化剂进行对比实验,实验条件与臭氧气体氧化浸出实验相同,浸出率见图7。从图7可看出,随着浸出温度的升高,锑的浸出率随之增加。锑的浸出率从15 ℃的9.4%升高到85 ℃的26.7%。从浸出率来看,臭氧气体作为氧化剂时,锑浸出率远大于氧气氧化的锑浸出率,臭氧对本反应过程有较强的促进作用。同样的,对实验数据进行动力学拟合,从动力学方面明确臭氧氧化浸出过程机理。

图7 不同温度下氧气气体氧化锑的浸出率
将浸出率进行动力学拟合,结果见图8。并进行阿仑尼乌斯拟合,结果见图9。从图8和图9可以看出,混合过程控制拟合具有较好的拟合度,同时阿仑尼乌斯拟合表明,氧气氧化浸出过程不同于臭氧氧化过程分为两种不同的控制过程,表现为混合过程控制,即化学反应和传质过程共同控制反应速率。氧气氧化反应的表观活化能为16.05 kJ/mol。

图8 混合过程控制拟合曲线

图9 氧气氧化浸出过程阿仑尼乌斯拟合曲线
相比于臭氧气体氧化过程,氧气氧化在低温时为混合过程控制,这一对比说明在低温时,传质效率较低,有臭氧存在时化学反应速率较快,表现为控制步骤为扩散控制,而没有臭氧存在时,化学反应速度较慢,表现为混合过程控制。这一对比充分说明臭氧在低温时对反应过程的促进作用。
3 结论
1) 采用臭氧气体氧化浸出含锑复杂硫化矿,一定条件下可以浸出86.1%的锑,锑的浸出率随着温度的升高而升高。而氧气氧化浸出实验中,只能提取26.6%的锑,相比于氧气氧化浸出,臭氧的存在可以极大地促进浸出反应的进行。
2) 动力学分析表明,臭氧气体氧化浸出在较低温度(15~35 ℃)时为扩散过程控制,反应表观活化能为6.91 kJ/mol;在较高温度(35~85 ℃)时为混合控制,表观活化能为17.93 kJ/mol,说明随着温度的升高,体系内部传质过程增强,控制步骤转化为混合控制。
3) 氧气氧化过程为混合过程控制,表观活化能为16.05 kJ/mol,说明其化学反应速率较低,表现为化学反应和传质过程共同控制;而臭氧可以直接促进化学反应的进行,使得氧化浸出反应过程呈现出不同的动力学控制步骤和参数。
[1] OORTS K, SMOLDERS E. Ecological threshold concentrations for antimony in water and soil[J]. Environmental Chemistry, 2009, 6: 116−121.
[2] TIAN Qing-hua, XIN Yun-tao, YANG Li, WANG Xue-hai, GUO Xue-yi. Theoretical simulation and experimental study of hydrolysis separation of SbCl3in complexation– precipitation system[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(10): 2746−2753.
[3] 杨薛玲. 2013年锑市场分析报告[J]. 中国铅锌锡锑, 2014(1): 45−54. YANG Xue-Ling. Antimony market analysis report in 2013 [J]. Lead-zinc-tin and Antimony in China, 2014(1): 45−54.
[4] 谢兆凤, 杨天足, 刘伟锋, 黄臻高. 脆硫铅锑矿无污染冶炼工艺研究[J]. 矿冶工程, 2009, 29(4): 80−84. XIE Zhao-feng, YANG Tian-zu, LIU Wei-feng, HUANG Zhen-gao. Study on smelting of jamesonite without pollution[J]. Mining and Metallurgical Engineering, 2009, 29(4): 80−84.
[5] 卢红波. 锡阳极泥硫化焙烧分离锑[J]. 中国有色金属学报, 2015, 25(11): 3202−3208. LU Hong-bo. Separation of antimony from tin anode slime by sulfidation roasting[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(11): 3202−3208.
[6] 戴 曦, 周康洁, 李良斌, 徐兴亮. 辉锑矿富氧挥发熔池熔炼工艺研究[J]. 矿冶, 2015, 24(4): 27−31.DAI Xi, ZHOU Kang-jie, LI Liang-bin XU Xing-liang. Study on oxygen enriched volatilebath smelting of stibmite conventrate[J]. Mining and Metallurgy, 2015, 24(4): 27−31.
[7] 王吉坤, 雷 霆. 熔池熔炼−连续烟化法处理低品位锑矿研究[J]. 有色金属, 2000, 52(2): 44−48.WANG Ji-Kun, LEI Ting. Treating low grade antimony ore by bath smelting-continuous fuming process[J]. Nonferrous Met, 2000, 52(2): 44−48.
[8] 刘付朋, 刘志宏, 李玉虎, 刘智勇, 李启厚, 文达敏. 锌粉置换镓锗渣硫酸浸出过程[J]. 中国有色金属学报, 2016, 26(4): 908−918. LIU Fu-peng, LIU ZHI-hong, LI Yu-hu, LIU Zhi-yong, LI Qi-hou, WEN Da-min. Sulfuric leaching process of zinc powder replacement residue containing gallium and germanium[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(4): 908−918.
[9] LIU Zhi-xiong, XIANG Yan-hong, YIN Zhou-lan, WU Xian-wen, JIANG Jian-bo, CHEN Yi-guang, XIONG Li-zhi. Oxidative leaching behavior of metalliferous black shale in acidic solution using persulfate as oxidant[J]. Transactions of Nonferrous of Metals Society of China, 2016 (2): 565−574.
[10] RASCHMAN P, SMINČÁKOVÁ E. Kinetics of leaching of stibnite by mixed Na2S and NaOH solutions[J]. Hydrometallurgy, 2012, 113: 60−66.
[11] UBALDINI S, VEGLIO` F, FORNARI P, ABBRUZZESE C. Process flow-sheet for gold and antimony recovery from stibnite[J]. Hydrometallurgy, 2000, 57: 187−199.
[12] ANDERSON C G. The industrial alkaline sulfide hydrometallurgical treatment of mercury bearing antimony ores and concentrates[C]// Proceedings of TMS Annual Meeting, San Diego, CA, 2003: 227−237.
[13] ANDERSON C G. The metallurgy of antimony[J]. Chemie der Erde–Geochemistry, 2012, 72(s4): 3−8.
[14] 杜新玲, 汤长青. 高纯锑白生产工艺述评[J]. 辽宁化工, 2007, 36(12): 853−856. DU Xin-ling, TANG Chang-qing. Production technology of high-purity antimony white[J]. Liaoning Chemical Industry, 2007, 36(12): 853−856.
[15] 刘斌莲, 魏洪洁, 王宝文. 铅电解阳极泥中锑铋的浸出试验[J]. 矿产综合利用, 2013(2): 48−50. LIU Bin-lian, WEI Hong-jie, WANG Bao-wen. Experiment of leaching of stibium and bismuth in the lead anode slime[J]. Multipurpose Utilization of Mineral Resources, 2013(2): 48−50.
[16] TIAN Qing-hua, WANG Heng-li, XIN Yun-tao, LI Dong, GUO Xue-yi. Ozonation leaching of a complex sulfidic antimony ore in hydrochloric acid solution[J]. Hydrometallurgy, 2016, 159: 126−131.
[17] 陈进中, 曹华珍, 郑国渠, 支 波, 杨天足. 高锑低银类铅阳极泥制备五氯化锑新工艺[J]. 中国有色金属学报, 2008, 18(11): 2094−2099. CHEN Jin-zhong, CAO Hua-zhen, ZHENG Guo-qu, ZHI Bo, YANG Tian-zu. Novel technology for preparation of SbCl5from lead anode slime with high antimony and low silver[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(11): 2094−2099.
[18] YANG Jian-guang, WU Yong-tian. A hydrometallurgical process for the separation and recovery of antimony[J]. Hydrometallurgy, 2014, 143: 68−74.
[19] 陈进中, 杨天足. 高锑低银铅阳极泥控电氯化浸出[J]. 中南大学学报(自然科学版), 2010, 41(1): 44−49. CHEN Jin-zhon, YANG Tian-zu. Chlorination,-leaching of lead anode slime with high antimony and low silver contents at controlled potential[J]. Journal of Central South University (Science and Technology), 2010, 41(1): 44−49.
[20] VIÑALS J, JUAN E, ROCA A, CRUELLS M, CASADO J. Leaching of metallic silver with aqueous ozone[J]. Hydrometallurgy, 2005, 76(3/4): 225−232.
[21] RODRÍGUEZ-RODRÍGUEZ C, NAVA-ALONSO F, URIBE- SALAS A. Silver leaching from pyrargyrite oxidation by ozone in acid media[J]. Hydrometallurgy, 2014, 149: 168−176.
[22] CARRILLO-PEDROZA F R, NAVA-ALONSO F, URIBE- SALAS A. Cyanide oxidation by ozone in cyanidation tailings: Reaction kinetics[J]. Minerals Engineering, 2000, 13(5): 541−548.
[23] 田庆华, 辛云涛, 姚 标, 郭学益. 锌湿法冶金过程中臭氧氧化沉淀除去微量钴[J]. 中国有色金属学报, 2013, 23(4): 1140−1144. TIAN Qinghua, XIN Yuntao, YAO Biao, GUO Xueyi. Efficient purification of trace cobalt in zinc hydrometallurgical process by ozone oxidation[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(4): 1140−1144.
[24] UKASIK M, HAVLIK T. Effect of selected parameters on tetrahedrite leaching by ozone[J]. Hydrometallurgy, 2005, 77(1/2): 139−145.
[25] ELORZA-RODRÍGUEZ E, NAVA-ALONSO F, JARA J, LARA-VALENZUELAC C. Treatment of pyritic matrix gold-silver refractory ores by ozonization-cyanidation[J]. Minerals Engineering, 2006, 19(1): 56−61.
[26] LI Qing-cui, LI Deng-xin, QIAN Fang-jun. Pre-oxidation of high-sulfur and high-arsenic refractory gold concentrate by ozone and ferric ions in acidic media[J]. Hydrometallurgy, 2009, 97(1/2): 61−66.
[27] POURBAIX M. Atlas d'equilibres electrochimiques a 25 °C[M]. Paris: Travaux Réalisés Avec L'appui, 1963: 287−291. (in French)
[28] FENG Xing-liang, LONG Zhi-qi, CUI Da-li, WANG Liang-shi, HUANG Xiao-wei, ZHANG Guo-cheng. Kinetics of rare earth leaching from roasted ore of bastnaesite with sulfuric acid[J]. Transactions of Nonferrous Metals Society of China, 2013, 23: 849−854.
[29] ZHENG Ya-jie, CHEN Kun-kun. Leaching kinetics of selenium from selenium-tellurium-rich materials in sodium sulfite solutions[J]. Transactions of Nonferrous Metals Society of China, 2014, 24: 536−543.
Mechanism of synergistic oxidation leaching of antimony-bearing complex sulfides ore by ozone
GUO Xue-yi1, 2, XIN Yun-tao1, 2, WANG Hao1, 2, TIAN Qing-hua1, 2
(1. School of Metallurgy and Environment, Central South University, Changsha 410083, China; 2. Cleaner Metallurgical Engineering Research Center, Nonferrous Metal Industry of China, Changsha 410083, China)
Antimony-bearing complex sulfides ore was processed by oxidation leaching in hydrochloric acid with ozone gas as synergistic oxidant. Leaching behavior at different temperatures was studied, leaching mechanism was analyzed by leaching kinetics combined with indirect oxidation. The results show that antimony in complex sulfides ore could be effective extracted by synergistic oxidation under certain conditions, and the leaching rate of antimony increases with the increase of temperature. Compared with the leaching process with oxygen gas as oxidant, leaching process is efficiently improved by synergistic ozone. Kinetic analysis shows that ozone directly influences the process and promotes chemical reactions, where the leaching process shows different control step and parameters of kinetics model.
ozone; antimony-bearing complex sulfides ore; synergistic oxidation; antimony leaching
(编辑 龙怀中)
Project(51474257) supported by the National Natural Science Foundation of China; Project (2015zzts037) supported by the Postgraduate Research and Innovation Projects of Hunan Province, China
2016-08-15;
2017-04-05
TIAN Qing-hua; Tel: +86-731-88877863; E-mail: qinghua@csu.edu.cn
国家自然科学基金资助项目(51474257);湖南省研究生科研创新项目(2015zzts037)
2016-08-15;
2017-04-05
田庆华,副教授,博士;电话:0731-88877863;E-mail: qinghua@csu.edu.cn
10.19476/j.ysxb.1004.0609.2017.12.22
1004-0609(2017)-12-2583-07
TF818
A
