2015年湖北省小麦条锈菌群体结构及多样性分析
2017-03-01马金娟杨立军王保通
王 峭,马金娟,杨立军,李 强,王保通
(1.西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.湖北省农科院植保土肥研究所,湖北武汉 430064)
2015年湖北省小麦条锈菌群体结构及多样性分析
王 峭1,马金娟1,杨立军2,李 强1,王保通1
(1.西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.湖北省农科院植保土肥研究所,湖北武汉 430064)
为了明确湖北省小麦条锈菌生理小种的构成以及变化动态,利用中国鉴别寄主对2015年采自湖北省6个地(市)的102份条锈病标样进行了群体结构分析,鉴定到已知条锈菌小种(类型)19个,其中CYR33和CYR32是湖北省的优势小种,出现频率分别居第一位(40.2%)和第二位(17.65%),其他小种(类型)以水源11类群、Hybrid 46类群以及贵农22类群为主,首次从湖北省标样中监测到贵农22菌系,其出现频率为17.64%。群体多样性研究结果表明,被测条锈病标样在物种水平上的Nei’s基因多样性指数(H)为 0.19,Shannon’s信息指数(I)为0.31,表明湖北省小麦条锈菌毒性多样性比较丰富。UPGMA聚类分析结果表明,湖北省小麦条锈菌群体毒性遗传相似系数范围为0.95~0.99,相似系数较高,遗传距离较小,群体之间交流广泛,并且毒性遗传结构与地理距离无相关性。
湖北省;小麦条锈菌;生理小种;群体结构;毒性多样性
小麦条锈病是由小麦条锈菌(Pucciniastriiformisf.sp.tritici)引起的一种气流传播性病害,在全球大多数小麦产区均有发生,具有分布范围广、流行频率高、暴发性强、为害严重等特点[1],是我国小麦危害最严重的病害之一和主要监控防治对象[2-3]。选育和种植抗病品种是控制该病害最经济、有效和对环境安全的措施。但由于小麦条锈菌生理小种具有高度变异性,新小种的产生并发展成为优势小种是品种抗锈性丧失的主要因素[4-5]。湖北省是我国小麦条锈病流行体系中重要的冬繁区,也是小麦条锈病菌由西北向黄淮海广大麦区传播的重要“桥梁”地区和“咽喉”地带[6],为包括豫南、华北小麦主产区提供春季菌源[7]。因此,明确湖北省小麦条锈菌生理小种的构成以及动态变化对指导我国黄淮海小麦主产区小麦品种布局和全国条锈病的防控具有重要意义。本研究利用我国小麦条锈菌鉴别寄主对采自湖北省6个地(市)的102份条锈病标样进行了鉴定和群体结构分析,以期为湖北小麦的抗病育种和抗病品种合理布局提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 小麦条锈菌标样
2015年4月份在湖北省荆州、宜城、荆门、襄阳、枝江、十堰等6个地(市)的7个县(区)采集小麦条锈菌标样160份,繁殖成活102份。标样均采自田间成株期自然发病的叶片,选择无杂菌污染、病斑呈条状、夏孢子新鲜饱满的病叶。
1.1.2 小麦条锈菌鉴别寄主
小麦条锈菌鉴别寄主采用全国通用的19个鉴别品种,分别是Fulhard、保春128、Trigo Eurdka、抗引655、维尔、丰产3号、南大2419、阿勃、丹麦1号、尤皮2号、洛夫林13、早洋、中四、洛夫林10、Su 11、Hybrid 46、T.speltaalbum和贵农22,以小麦条锈病感病品种铭贤169作为对照。
1.2 试验方法
1.2.1 标样的分离、繁殖和保存
小麦条锈菌生理小种鉴定在西北农林科技大学农业部太白小麦条锈病菌重点野外科学观测试验站进行。在温室将感病品种铭贤169种植于7 cm×7 cm×7 cm小花盆中,待第一叶完全展开时,将叶片脱蜡,分别接种经处理活化后的条锈菌标样的夏孢子(每叶片接一个夏孢子堆),黑暗保湿(9±2 ℃)24 h后移至温室潜育(14±3 ℃)发病。到叶片可以看到夏孢子时,每盆只留一棵发病较好的苗,编号,隔离培养。发病充分后收集夏孢子并转接到新种的铭贤169上进行扩繁。剩余的夏孢子置于干燥器中4 ℃短期保存备用,封口袋中真空-80 ℃长期保存。
1.2.2 标样鉴定
按套种植鉴别寄主,每盆种植4个鉴别寄主(每个角种一个品种)并编号,5盆为一套,以感病品种铭贤169为对照。待第一叶完全展开时,把上述繁殖好的菌种采用撒粉法进行接种,经黑暗保湿24 h后,置于温度14±3 ℃、光照时间14 h、光照强度8 000~10 000 lx温室中培养16~18 d。待其发病充分后按小麦条锈病0~4级分级标准记录侵染型,其中0~2级为抗病(R),3~4级为感病(S)[8-9]。根据鉴别寄主对被鉴定小麦条锈菌的侵染型,确定其生理小种类型[10]。
1.3 数据统计分析
毒性分析采用二元归类法,即将无毒反应型(0~2级)数据转化为0,有毒反应型(3~4级)数据转化为1。基于简单匹配的相似矩阵,利用POPGENE version 1.32 软件计算下列统计数据:观察等位基因数、多态性条带数、多态性条带百分率、有效等位基因数、Nei’s基因多样性指数、Shannon’s信息指数。根据Nei’s遗传距离,用Ntsys软件对条锈菌群体进行聚类分析。
2 结果与分析
2.1 小麦条锈菌生理小种鉴定结果
102份小麦条锈病标样共监测到已知小种(类型)19个(表1、表2),分别为CYR21、CYR29、洛13-8,Hybrid46类群中的CYR31、CYR32、Hy-7、Hy-8,Su11类群中的CYR33、Su11-4、Su11-23、Su11-24、Su11-26、Su11-32、Su11-41,以及贵农22类群的Gui22-3、Gui22-6、Gui22-9、Gui22-13、Gui22-14,这些小种(类型)出现频率依次为0.98%、0.98%、0.98%、0.98%、17.65%、0.98%、1.96%、40.20%、2.94%、0.98%、0.98%、0.98%、0.98%、4.90%、0.98%、0.98%、6.86%、0.98%、7.84%。
Su11类群中,CYR33出现频率最高,为40.20%,其分布流行范围最广,是2015年湖北省小麦条锈菌优势小种;其次是Su11-41,频率为4.90%,有一定分布范围;Su11-4、Su11-23、Su11-24、Su11-26、Su11-32等类型的出现频率在0.98%~2.94%之间,频率较低。
Hybrid 46类群中,CYR32出现频率最高,为17.56%,在本年度监测到的所有条锈菌小种中仅次于CYR33,且分布范围较广,也是湖北省小麦条锈菌优势小种;其他小种(类型)CYR31、Hy-4、Hy-8出现频率在0.98%~1.96%之间。
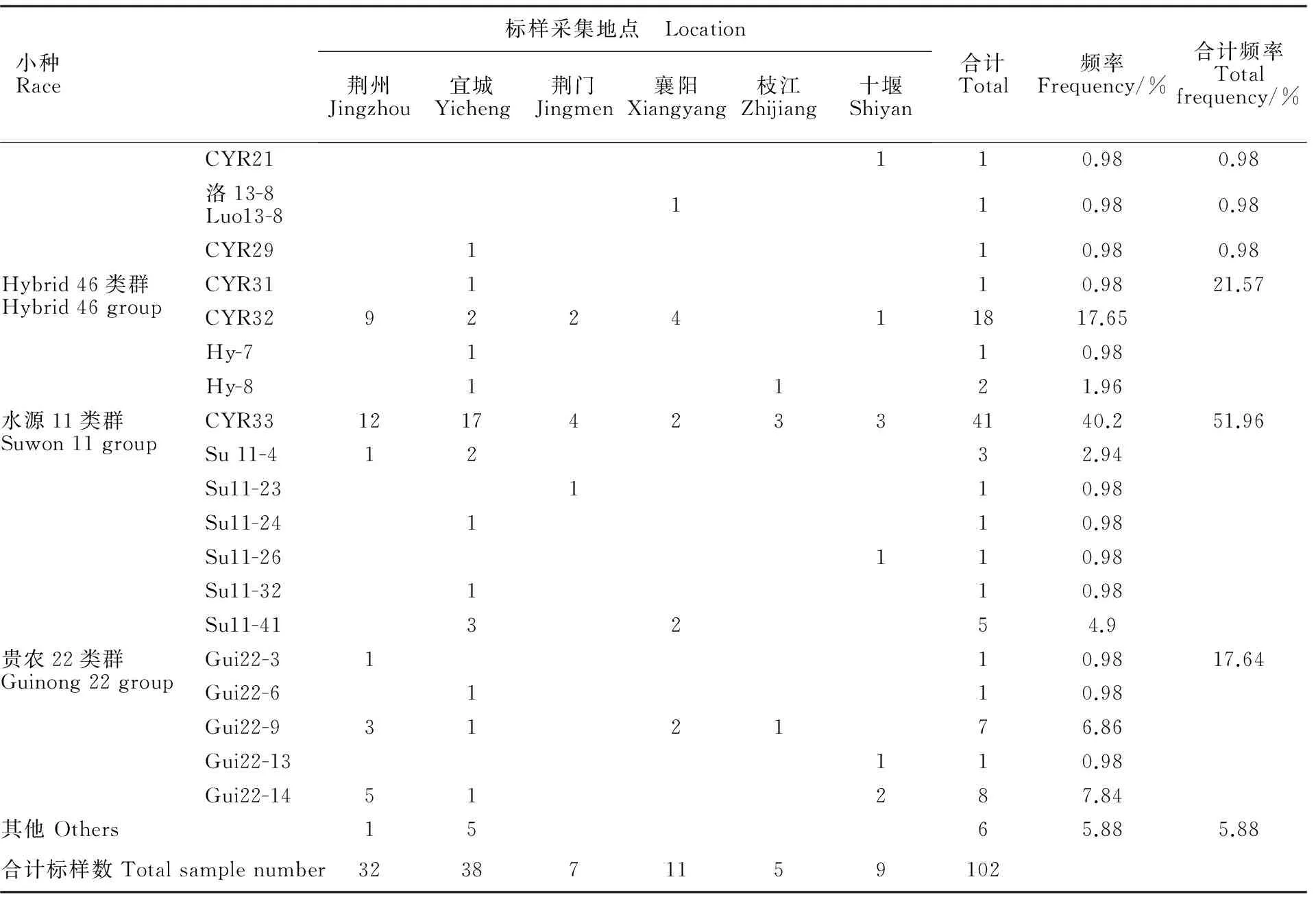
表1 2015年湖北省小麦条锈菌生理小种监测结果Table 1 Identification results of Puccnia striiforms f.sp triciti races in Hubei province in 2015
本年度首次从湖北省小麦条锈病标样中监测到感染鉴别寄主贵农22的贵农22类群,其中,以Gui22-9和Gui22-14为主要小种类型,具有与 CYR32和 CYR33类似的致病特点,毒性较强,其出现频率总和达到了17.64%;Gui22-3、Gui22-6、Gui22-13的出现频率均为0.98%。
2.2 小麦条锈菌群体毒性多态性分析
2.2.1 小麦条锈菌生理小种毒性多样性分析
群体毒性多样性分析结果显示(表3),在物种水平上,观察等位基因数为1.79,有效等位基因数目为1.28,Nei’s基因多样性指数为 0.19,Shannon’s信息指数为 0.31;在群体水平上,Nei’s基因多样性指数为0.054~0.270,平均为0.131 0;Shannon’s指数为0.082~0.408,平均为0.196;多态性位点数目为3~15,平均为6.83;多态性位点百分率为15.79%~78.95%,平均为35.96%。说明湖北省小麦条锈菌毒性多样性比较丰富,毒性多样性在不同区域间存在一定程度的差异,宜城的群体毒性多样性最高,枝江的群体毒性多样性最低。
2.2.2 小麦条锈菌不同种群间的毒性遗传距离和遗传一致度
由表4可知,6个群体的小麦条锈菌群体Nei’s 遗传一致度为0.950~0.989,Nei’s 遗传距离为0.011~0.051,可见湖北省不同地区小麦条锈菌群体间的毒性遗传距离较小,相似程度较高。枝江和襄阳间的毒性遗传结构相似性(0.989)最高,遗传距离(0.011)最小;襄阳和十堰群体间的相似性(0.950)最低,遗传距离(0.051)最远。
2.3 小麦条锈菌群体毒性聚类分析
聚类分析结果显示(图1),湖北省小麦条锈菌群体的毒性遗传相似系数值为0.97时,6个群体可聚为两个大的类群,十堰、宜城聚为第一个大类群,荆州、荆门、襄阳、枝江聚为第二个大类群。在毒性遗传相似系数值为0.98时,第二个大类群又可分为三个小类群,即荆州为一个类群,荆门为一个类群,襄阳和枝江为一个类群,其中,襄阳和枝江遗传相似系数值为0.99,可认为其毒性结构相同。
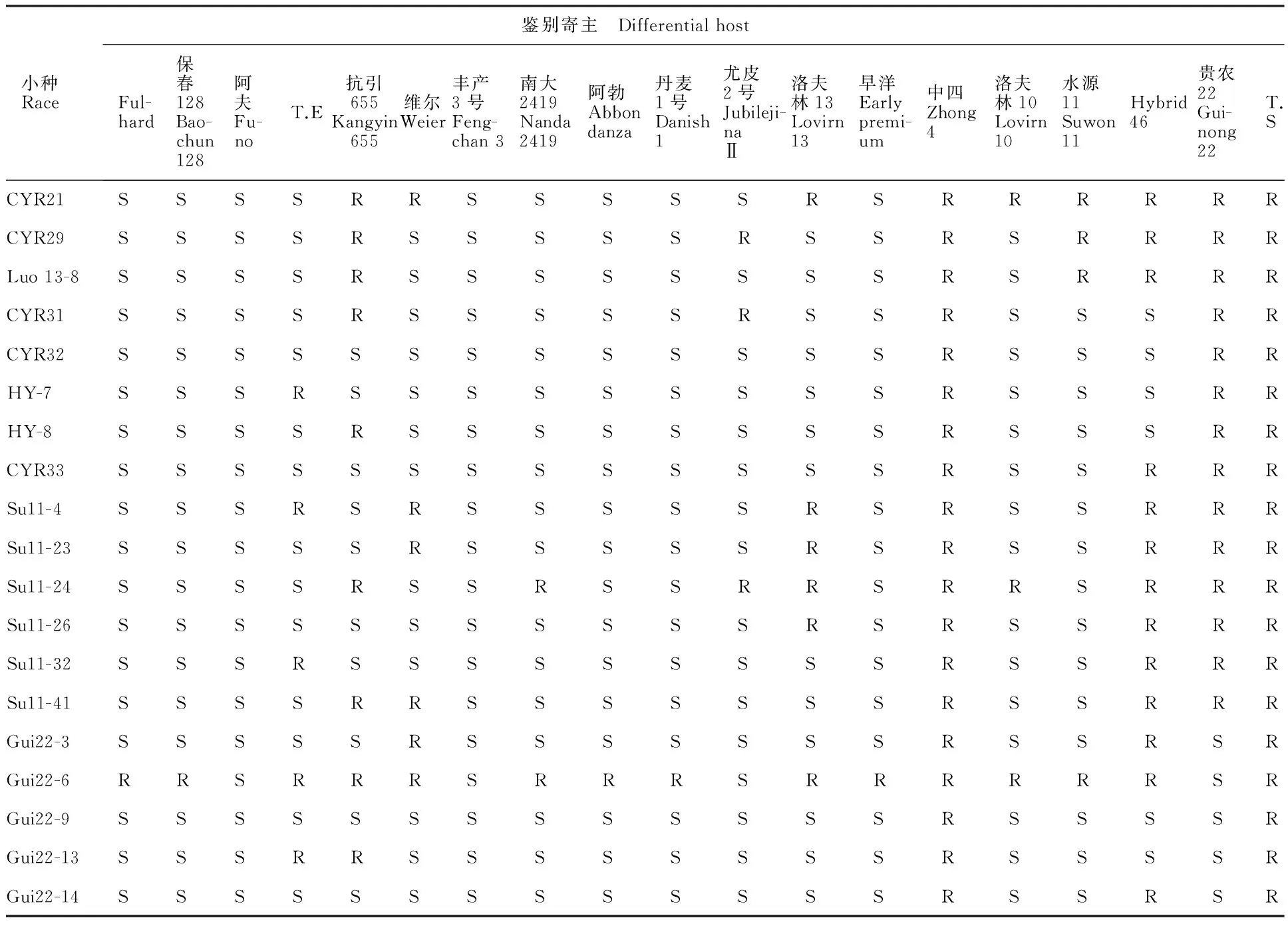
表2 2015年湖北省小麦条锈菌生理小种的类型及其在鉴别寄主上的反应Table 2 Races and their infection types on the differential hosts in Hubei province in 2015
Na:观察等位基因数;Ne:有效等位基因数;H:基因多样性指数;I:Shannon’s信息指数;NP:多态性位点数;PL:多态性位点百分率。
Na:Observed number of alleles;Ne:Effective number of alleles;H:Nei’s gene diversity;I:Shannon’s information index;NP:Number of polymorphic loci;PL:Percentage of polymorphic loci.
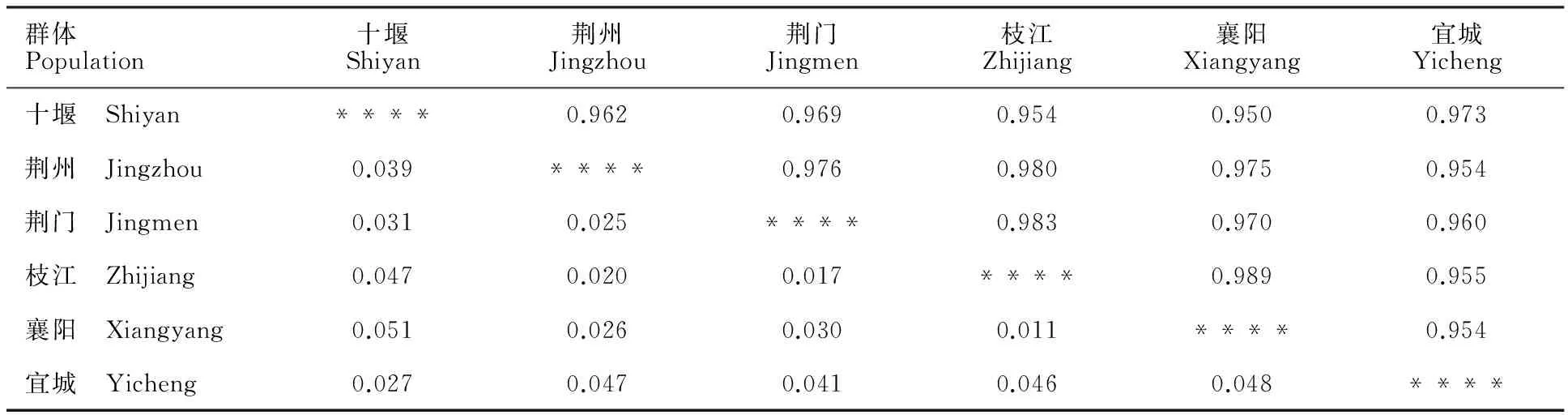
表4 Nei’s无偏遗传距离和遗传一致度Table 4 Nei’s unbiased genetic distance and genetic identity
对角线以上为遗传一致度,对角线以下为遗传距离。
Genetic identity is above the diagonal,and genetic distance is below the diagonal.
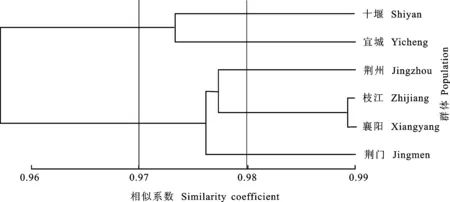
图1 2015年湖北6个小麦条锈菌群体毒性聚类分析树状图
3 讨 论
小麦条锈病是大区流行病害,湖北省冬麦区冬季气候条件有利于条锈病菌的繁殖,因此,该地区为小麦条锈菌的“冬繁区”。同时,该地区也是病菌自西北向黄淮海广大麦区传播的“桥梁”地区,在全国小麦条锈病大区流行中具有特殊作用[11]。因此,明确该地区小麦条锈菌的群体结构及动态变化,对于整个黄淮麦区小麦条锈病的预测和防治都有至关重要的作用。本研究结果表明,2015年湖北省小麦条锈菌优势小种与2013年相比[12]仍然是CYR33和CYR32,其分布范围广,出现频率高,致病性强,是湖北省当前小麦生产上的主要流行小种。值得关注的是,2014年之前湖北省尚未监测到能够感染鉴别寄主贵农22(含有小麦抗条锈病基因 Yr26/Yr24)的贵农22致病类型,2015年湖北省标样中,首次监测到贵农22致病类型,分别为Gui22-3、Gui22-6、Gui22-9、Gui22-13和Gui22-14,其出现频率总和达到17.64%,表明贵农22菌系已经从甘肃省、四川省传播到了湖北省小麦产区,对湖北省小麦主栽品种已经构成了潜在的威胁。在今后,应当注意减少或者淘汰含有 Yr26/Yr24抗病基因小麦品种的种植面积,控制贵农22菌系的出现频率,减轻其危害。
本研究通过对湖北省小麦条锈菌群体毒性多态性分析发现,湖北省小麦条锈菌群体毒性多样性比较丰富,且毒性多样性在不同区域间存在一定程度的差异,造成差异的原因可能有以下几个方面:环境条件的影响,不同地区种植品种的不同或品种布局复杂程度的影响,采样局限性的影响,不同地区接受不同菌源(甘肃陇南菌源和四川盆地菌源)的影响,也可能是上述2个或多个影响因子共同作用的结果。
Nei’s遗传一致度结果表明,群体间毒性遗传相似性系数较高,表明群体间存在广泛的遗传交流。其中,枝江和襄阳间的毒性遗传相似性系数为0.99,为群体间最高,襄阳和十堰群体间的相似性最低。依据遗传一致度绘制的毒性聚类图,枝江和襄阳划为一个类群,但两地区的地理距离很远;襄阳和十堰毒性遗传距离较远,分别处在不同的类群中,但两地区的地理区域相对较近。表明条锈菌群体的毒性遗传结构与地理距离的远近没有相关性,进一步说明地理距离并不是导致条锈菌群体毒性多样性的根本原因。这与樊 玉等[12]对鄂西北小麦条锈菌群体毒性结构分析的结果一致。
条锈菌不仅毒性多样性,而且条锈菌生理小种具有高度变异性,新小种的出现往往会使原有抗病基因丧失抗性,造成小麦严重减产,因此,监测条锈菌群体结构变异动态具有重要意义。但在我国目前通用的鉴别寄主中,绝大多数鉴别寄主对条锈菌主要小种均感病,已经不能满足及时监测小麦条锈菌小种变异的要求。因此,应根据目前小麦条锈菌群体结构和生产品种含有的基因类型及时调整我国小麦条锈菌鉴别寄主,或使用近等基因系或单基因系鉴别寄主[13]来更好的监测小麦条锈菌变异动态。
[1] 贺建勋.系统建模与数学模型[M].福州:福建科学技术出版社,1995:148.
HE J X.System Modeling and Mathematical Model[M].Fuzhou:Fujian Science and Technology Press,1995:148.
[2] 王建锋,陆宁海,陈长卿,等.陕西省小麦条锈菌群体遗传结构分析[J].植物病理学报,2013,43(3):294.
WANG J F,LU H N,CHEN C Q,etal.Analysis of population genetic structure ofPucciniastriiformisf.sp.triticiin Shaanxi province,China [J].ActaPhytopathologicaSinica,2013,43(3):294.
[3] 胡小平,王保通,康振生.中国小麦条锈菌毒性变异研究进展[J].麦类作物学报,2014,34(5):709.
HU X P,WANG B T,KANG Z S,etal.Research progress on virulence variation ofPucciniastriiformisf.sp.triticiin China [J].JournalofTriticeaeCrops,2014,34(5):709.
[4] 李明菊,邬 琰,吕建平,等.云南省小麦条锈菌生理小种组成与分布研究[J].西南农业学报,2005,18(1):55.
LI M J,WU Y,LU J P,etal.Study on the component and distribution of physiological races ofPucciniastriiformisf.sp.triticiin Yunnan [J].SouthwestChinaJournalofAgriculturalSciences,2005,18(1):55.
[5] CHEN X M,MOORE M K,MILUS E A,etal.Wheat stripe rust epidemics and races ofPucciniastriiormisf.sp.triticiin the United States in 2000 [J].PlantDisease,2002,86(5):39.
[6] 杨立军,唐道廷,向礼波,等.近10年来湖北省审(认)定小麦品种对条锈病的抗性表现[J].麦类作物学报,2012,32(5):982.
YANG L J,TANG D Y,XIANG L B,etal.Evaluation of resistance to strip rust of wheat cultivars released in the past decade in Hubei province [J].JournalofTriticeaeCrops,2012,32(5):982.
[7] 黄朝炎,杨秋生,龚国安,等.鄂西北地区小麦条锈病发生规律研究[J].湖北植保,2003(3):5.
HUANG Z Y,YANG Q S,GONG G A,etal.Sdudies on the occurrence ofPucciniaglumarumin the northwest area of Hubei [J].HubeiPlantProtection,2003(3):5.
[8] 万安民,吴立人,贾秋珍,等.1997-2001年我国小麦条锈菌生理小种变化动态[J].植物病理学报,2003,33(3):262.
WAN A M,WU L R,JIA Q J,etal.Pathogenic changes of stripe rust fungus of wheat in China during 1997-2001 [J].ActaPhytopathologicaSinica,2003,33(3):262.
[9] 李佼佼,兰永红,夏 滔,等.2011年西藏地区小麦条锈菌生理小种群体结构分析[J].麦类作物学报,2012,32(5):974.
LI J J,LAN Y H,XIA T,etal.Population structure and analysis ofPaceiniastriiformisf. sp.triticirace in Tibet in 2011[J].JournalofTriticeaeCrops,2012,32(5):974.
[10] 中华人民共和国农业部.SY/T1443.1-2007小麦抗条锈病评价技术规范[S].北京:中华人民共和国农业部,2007:7.
Ministry of Agriculture of the PRC.SY/T1443.1-2007 Rule for Resistance Evaluation of Wheat to Yellow Rust [S].Beijing:Ministry of Agriculture of the PRC,2007:7.
[11] 万安民,张忠军,金社林,等.湖北省西北部山区小麦条锈菌越夏研究简报[J].植物病理学报,2004,34(1):90.
WAN A M,ZHANG Z J,JIN S L,etal.Investigation on the over-summering ofPucciniastriiformisf.sp.triticiin the northwestern mountain area of Hubei province of China [J].ActaPhytopathologicaSinica,2004,34(1):90.
[12] 樊 玉,薛 楠.2013年鄂西北小麦条锈菌群体毒性结构分析[J].麦类作物学报,2015,35(12):1744.
FAN Y,XUAN N.Investigation of population virulence structure ofPucciniastriiformisf.sp.triticifrom northwestern Hubei province of China in 2013[J].JournalofTriticeaeCrops,2015,35(12):1744.
[13] WAN A M,CHEN X M.Virulence characterization ofPucciniastriiformisf.sp.triticiusing a new set ofYrsingle-gene line differentials in the United States in 2010 [J].PlantDisease,2014,98(11):1534.
Population Structure and Diversity Analysis ofPucciniastriiformisf.sp.triticiin Hubei Province in 2015
WANG Qiao1,MA Jinjuan1,YANG Lijun2,LI Qiang1,WANG Baotong1
(1.College of Plant Protection,Northwest A&F University/State Key Laboratory for Crop Stress Biology in Arid Areas,Yangling,Shaanxi 712100,China; 2.Hubei Academy of Agricultural Sciences,Research Institute of Plant Protection Soil and Fertilizer,Wuhan,Hubei 430064,China)
In order to clarify races composition and dynamics ofPucciniastriiformisf.sp.tritici(Pst) in Hubei province,102 wheat stripe rust samples collected from six cities in Hubei province in 2015 were identified on Chinese differential hosts.Nineteen Pst races were detected.Among these races,CYR33 and CYR32 were the most prevalent races in Hubei province,ranking the first(40.2%) and second(17.65%),respectively.The other Pst races mainly belonged to Suwon 11 group,Hybrid 46 group and Guinong 22 group.In addition,Guinong 22 group was firstly detected in Hubei province,and its occurrence frequency was up to 17.64%.The group diversity study showed that Nei’s genetic diversity index(H) and Shannon’s information index(I) were 0.19 and 0.31 at the species level,respectively,indicating that the toxicity diversity of Pst races in Hubei province is high.UPGMA cluster analysis indicated that the similarity coefficient of genetic toxicity of Pst population ranges from 0.95 to 0.99,which suggested high similarity coefficient,short genetic distance and extensive communication among different groups,and there is no correlation between the toxicity genetic structure of tripe rust population and the geographical distance.
Hubei province;Pucciniastriiformisf.sp.tritici; Races;Population structure; Virulence diversity
时间:2017-01-16
2016-06-25
2016-07-26
国家“973”计划项目(2013CB127700);国家“十二五”科技支撑计划项目(2012BAD19B04-12);国家小麦产业技术体系项目(CARS-3-1);高等学校学科创新引智计划项目(B07049)
E-mail:qiaozi@nwsuaf.edu.cn
李 强(E-mail:qiangli@nwsuaf.edu.cn);王保通(E-mail:wangbt@nwsuaf.edu.cn)
S512.1;S332
A
1009-1041(2017)02-0275-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170116.1835.034.html
