高谷物日粮促进山羊瘤胃上皮单羧酸转运蛋白1及钠钾ATP酶mRNA的表达
2017-02-28刘军花朱伟云毛胜勇
刘军花,朱伟云,毛胜勇
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物研究室, 江苏 南京210095)
高谷物日粮促进山羊瘤胃上皮单羧酸转运蛋白1及钠钾ATP酶mRNA的表达
刘军花,朱伟云,毛胜勇*
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物研究室, 江苏 南京210095)
本试验旨在研究高谷物日粮对山羊瘤胃上皮形态结构及单羧酸转运蛋白(monocarboxylate transporter, MCT)和钠钾ATP酶mRNA表达的影响。将10头装有永久性瘤胃瘘管的健康阉割公山羊随机分为饲喂全粗料日粮的对照组(Hay,0%谷物,n=5)和饲喂高谷物日粮的处理组(HG,65%谷物,n=5),试验期为7周。试验开始后,于每周晨饲后的0、2、3、4、6、8和12 h连续采集瘤胃液监测瘤胃pH值的变化,收集其中第0、3、6和12 h的瘤胃液待测挥发性脂肪酸(volatile fatty acid, VFA)浓度。试验的第50天,屠宰采集瘤胃上皮用于形态学及基因定量分析。研究结果显示:与全粗料组山羊相比,高谷物组山羊瘤胃pH值、乙酸浓度及乙丙比都显著下降(P<0.001),而瘤胃丙酸浓度、丁酸浓度及其他VFA浓度都显著升高(P<0.001);高谷物日粮组的瘤胃乳头长度显著高于对照组(P=0.001),瘤胃乳头宽度显著低于对照组(P<0.001),但是两组间的瘤胃乳头表面积并无显著差异;透射电镜结果显示,长期饲喂高谷物日粮导致瘤胃上皮细胞线粒体发生降解;实时定量PCR结果表明,与对照组相比,高谷物日粮显著升高了MCT1(P<0.001)和钠钾ATP酶(P=0.001)的mRNA表达量,显著降低了MCT4的mRNA表达量(P=0.041),但对MCT2的表达没有显著影响(P=0.305);进一步分析这些基因的mRNA表达量与pH值和VFA浓度之间的相关性,结果显示,MCT1和钠钾ATP酶的mRNA表达量与瘤胃pH值和乙酸浓度呈显著负相关,与总VFA、丙酸、丁酸的含量呈显著正相关,而MCT4的mRNA表达量与pH值呈显著正相关,与总VFA、丙酸、丁酸的含量呈显著负相关。以上结果提示:高精料引起的瘤胃pH值下降和VFA的变化可能与瘤胃上皮MCT和钠钾ATP酶表达量的变化相关。研究结果对深入认识高谷物饲喂引发的瘤胃功能紊乱具有重要意义。
高谷物日粮;瘤胃上皮;单羧酸转运蛋白;钠钾ATP酶;山羊
在现代集约化养殖系统中,常常给高产反刍动物饲喂大量的精料以满足其快速生长或是高产奶量的能量需要[1-4]。然而,大量的易发酵碳水化合物使得瘤胃的发酵速度超过瘤胃上皮对挥发性脂肪酸(volatile fatty acid, VFA)的吸收速度,导致VFA浓度上升,pH值下降[3,5],而瘤胃内环境的改变对瘤胃上皮代谢及细胞内pH稳态都将是巨大挑战。
瘤胃是反刍动物最大的消化吸收器官,瘤胃上皮对VFA的吸收除了能够为机体提供能量需要外,还可以调节瘤胃内环境和瘤胃pH。瘤胃内产生的VFA约有65%至85%通过瘤胃上皮被吸收,同时瘤胃上皮也是Na+和Mg2+的主要吸收部位[6]。日粮中精料或代谢能水平的升高会增加瘤胃上皮对这些底物的转运能力[7-8]。更高的转运速率主要是依赖于瘤胃上皮形态学的改变,即高精料导致瘤胃上皮乳头表面积增加,最终增加瘤胃上皮的吸收表面积[6-7]。大量研究结果显示,高精料日粮可促进瘤胃上皮的生长发育,增加其吸收面积,最终促进VFA的吸收转运[7,9]。但是,对于山羊瘤胃上皮上的VFA转运相关蛋白如何快速适应高精料日粮并不是很清楚。因此,本研究的主要目的将研究饲喂高谷物日粮对山羊瘤胃吸收表面积及VFA转运相关基因[包括:单羧酸转运蛋白(monocarboxylate transporter, MCT)和钠钾ATP酶(Na+/K+-ATPase)] mRNA表达的影响,预期结果将对深入认识高谷物饲喂引发的瘤胃功能紊乱具有重要意义。
1 材料与方法
1.1 实验设计与动物饲养
试验于2012年1-4月在南京农业大学动物实验基地进行。为了让动物适应低能量日粮,试验开始前5周,所有动物自由采食全粗料日粮。试验开始,将10头装有瘤胃瘘管的2到3岁去势公山羊(波尔山羊×淮南羊杂交山羊)随机分为饲喂全粗料的对照组(Hay, 0%谷物,n=5)和饲喂高谷物日粮的处理组(HG, 65%谷物,n=5),自由饮水,单栏饲喂。试验开始前,两组山羊的体重没有显著差异(29.8±0.86 vs. 30.0±1.05 kg,P=0.886)。依据山羊营养需要标准(NY/Y816-2004, 中国农业部, 2004)设计饲粮配方,对照组的代谢能略高于30 kg山羊的维持需要, 处理组的代谢能满足30 kg山羊每天200 g 的生长需要。 对照组和处理组的日粮组成见表1。日粮平均分成两份,于每天早晨八点半和下午四点半分别饲喂,饲喂量为每日750 g干物质每头山羊,连续饲喂7周。
1.2 样品采集
试验开始后,于每周晨饲后的0、2、3、4、6、8和12 h连续采集瘤胃腹囊部瘤胃液监测瘤胃pH的变化,收集其中第0、3、6和12 h的瘤胃液-20 ℃保存待测VFA浓度。试验的第50天,在晨饲后的4~5 h对山羊进行屠宰。屠宰后5 min之内,采集一块腹囊部的瘤胃壁并用钝物将浆膜层和肌肉层分离,得到的瘤胃上皮在冰的磷酸缓冲溶液里清洗3次,并将组织剪成0.5 cm×0.5 cm的小碎块置于液氮保存,用于RNA的提取。清洗后的瘤胃乳头4%多聚甲醛(Sigma,美国)和2.5%戊二醛(国药)中固定保存,用于石蜡切片和透射电镜观察。
1.3 瘤胃生理参数测定
用便携式pH计 (HI 9024C; HANNA Instruments, 美国) 测定瘤胃pH值。气相色谱测定(GC-14B, 岛津, 日本; 毛细管柱: 30 m×0.32 mm×0.25 mm 膜厚度) VFA浓度,参照秦为琳[10]的方法(柱温=110 ℃, 汽化室温度=180 ℃, 检测器=180 ℃)。
1.4 组织形态学分析
每头山羊取10根多聚甲醛固定的瘤胃乳头做石蜡切片,苏木精伊红染色,切片厚度为6 μm,具体方法参见Odongo等[11]。我们在进行组织形态学分析时采用盲检的方法, 在2倍镜下对瘤胃乳头的长度和宽度进行测量,每根乳头选取5张片子,每头动物每个-未检测。-Not determined.指标共有50个重复。戊二醛固定的瘤胃乳头参照Graham等[12]的方法进行处理。 瘤胃乳头在2.5%的戊二醛溶液中固定至少24 h,固定好的样品在酒精溶液中梯度脱水。脱水样品在1∶1的树脂和丙酮混合液中置换30 min,之后再在100%的树脂中置换10 h。含有树脂的样品放入模具中,在40 ℃ 或 60 ℃温度下聚合48 h。用玻璃刀切成半薄片(0.25~0.50 μm),再用1%甲苯胺蓝和1%硼酸钠染色,用钻石刀切出超微薄片(70~90 nm),然后再用甲醇醋酸铀和柠檬酸铅染色,最后透射电镜进行观察 (Hitachi H-7650, 日立, 日本)。
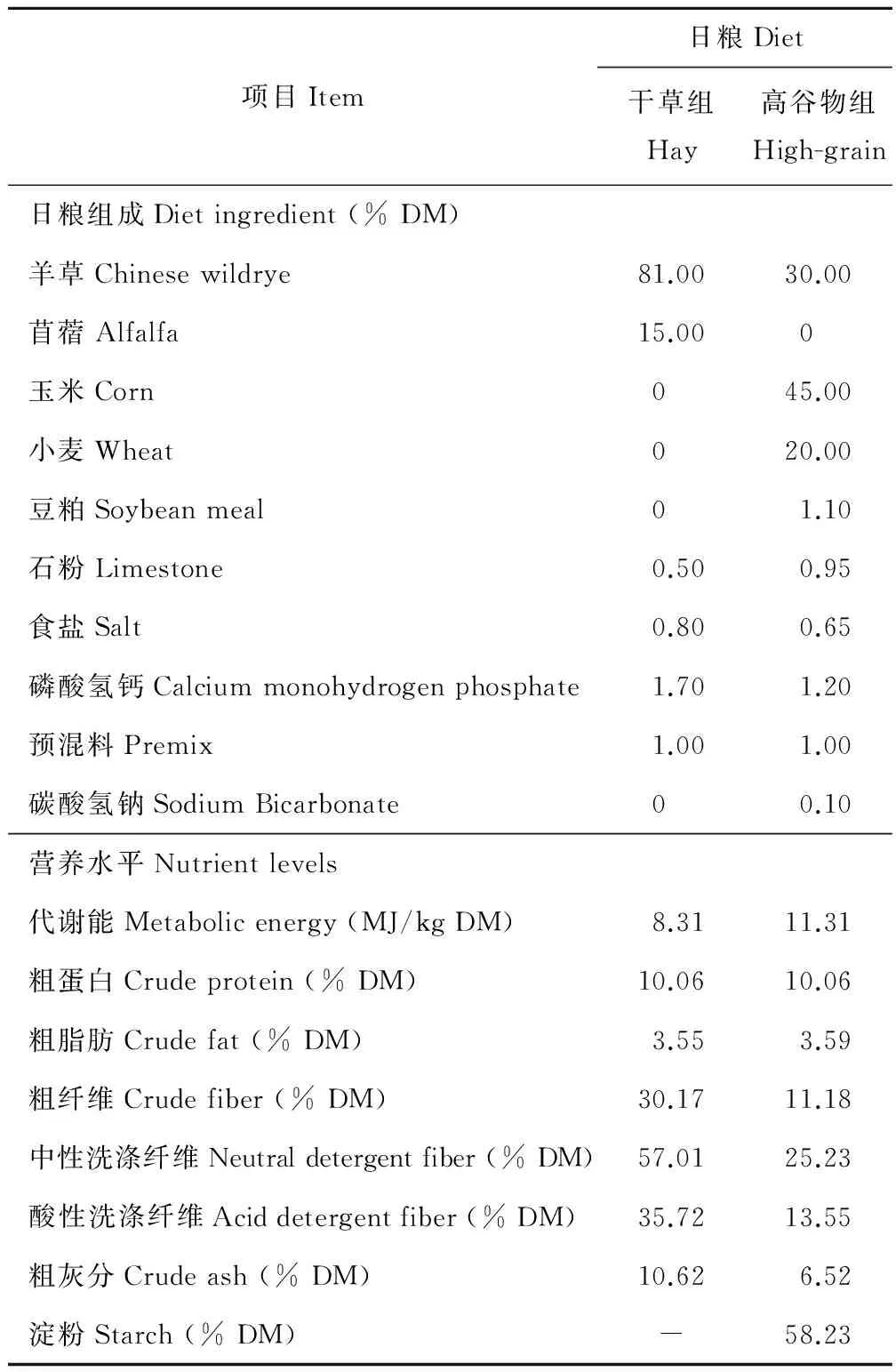
表1 试验日粮组成及营养水平Table 1 Ingredient and nutrient levels of the experimental diets
1.5 RNA的提取和cDNA的合成
瘤胃上皮总RNA的提取参照Chomczynski等[13]的方法。使用微量核酸蛋白测定仪测定RNA的浓度和纯度。所有样品的吸收比例(260/280 nm)都在1.8~2.0之间,证明RNA纯度较高。用1.4%的琼脂糖胶检测RNA的完整性。将所有的RNA浓度调整到1 μg/μL,置于-80 ℃冰箱保存备用。利用含基因组RNA酶的反转录试剂盒(Takara 生物, 日本)进行cDNA的合成。
1.6 引物的合成和实时定量PCR
MCT1, MCT2和MCT4的引物序列参照Naeem等[14],Na+/K+-ATPase的引物序列参照Kuzinski等[6],内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的引物序列参照Wang等[15]。利用ABI 7300 定量PCR仪对目的基因及内参基因GAPDH进行定量。反应条件为:95 ℃ 30 s预变性,95 ℃ 5 s,57.5 ℃ (GAPDH) 或是 60 ℃ (目的基因) 31 s, 重复40个循环。反应体积20 μL,含有2×SYBRGreen PCR Master Mix,1~10 ng cDNA和200 nmol/L的上游和下游引物。所有样品设3个重复。目的基因的相对表达量以管家基因GAPDH作为内参进行校正,数据分析采用2-△△CT的方法。
1.7 数据处理
结果以平均值±标准误(means±SE)进行表示。采用SPSS 18.0中的混合模型(mixed model)对表2中的瘤胃生理参数进行统计,其中日粮(diet)及饲喂周数(week)作为固定效应(fixed effect),山羊作为随机效应(random effect),每天的采样时间点(time)作为重复测量(repeated measurement)。其他数据采用独立样本t检验进行显著性分析。采用GraphPad Prism 5.00 (www.graphpad.com) 软件分析目的基因的mRNA表达量与pH值和VFA浓度之间的相关性。P<0.05表示差异显著。
2 结果与分析
2.1 长期饲喂高谷物日粮对瘤胃内环境的影响
如表2所示,与全粗料组山羊相比,高谷物饲喂组山羊瘤胃pH值(P<0.001)、总VFA浓度(P<0.001)、乙酸浓度(P<0.001)及乙丙比(P<0.001)显著下降;与全粗料组山羊相比,高谷物饲喂组山羊瘤胃丙酸浓度(P<0.001)、丁酸浓度(P<0.001)及其他VFA浓度(P<0.001)都显著升高。随着饲喂周数的变化,瘤胃pH值(P<0.001)、总VFA浓度(P<0.001)、乙酸浓度(P<0.001)、丙酸浓度(P=0.001)、丁酸浓度(P<0.001)、其他VFA浓度(P<0.001)及乙丙比(P<0.001)变化差异都显著。饲喂周与日粮对瘤胃pH值(P<0.001)、总VFA浓度(P=0.004)、乙酸浓度(P=0.001)、丙酸浓度(P=0.002)及乙丙比(P<0.001)的影响存在显著的交互作用。饲喂周与日粮对丁酸浓度(P=0.263)和其他VFA浓度(P=0.944)的影响不存在显著的交互作用。

表2 连续7周高谷物饲喂对山羊瘤胃发酵参数的影响Table 2 Effects of high-grain (HG) diet on rumen fermentation during 7 weeks feeding
2.2 高谷物日粮对瘤胃乳头形态结构的影响
如表3所示,高谷物日粮组的瘤胃乳头长度显著高于对照组(P=0.001),瘤胃乳头宽度显著低于对照组(P<0.001),但是两组间的瘤胃乳头表面积并无显著差异;透射电镜结果显示(图1),高谷物日粮导致瘤胃上皮细胞的线粒体发生肿胀和降解。
2.3 高谷物日粮对瘤胃上皮MCT和Na+/K+-ATPase mRNA表达的影响
如图2所示,与对照组相比,高谷物日粮显著升高了 MCT1(P<0.001)和Na+/K+-ATPase(P=0.001)量(P=0.041),但对MCT2的表达没有显著影响(P=0.305)。

表3 饲粮营养水平对瘤胃乳头数目和表面积的影响Table 3 Effects of nutrition level on number and surface of rumen papillae in goats
注:数据以平均值±标准误形式表示,n=5。

图1 高谷物日粮对瘤胃上皮细胞线粒体结构的影响Fig. 1 Effects of HG diet on ruminal epithelial cell mitochondrial structure N:细胞核;M:线粒体。N: Nuclei; M: Mitochondria.
Note: Value are means±SEM,n=5.的mRNA表达量,显著降低了MCT4的mRNA表达
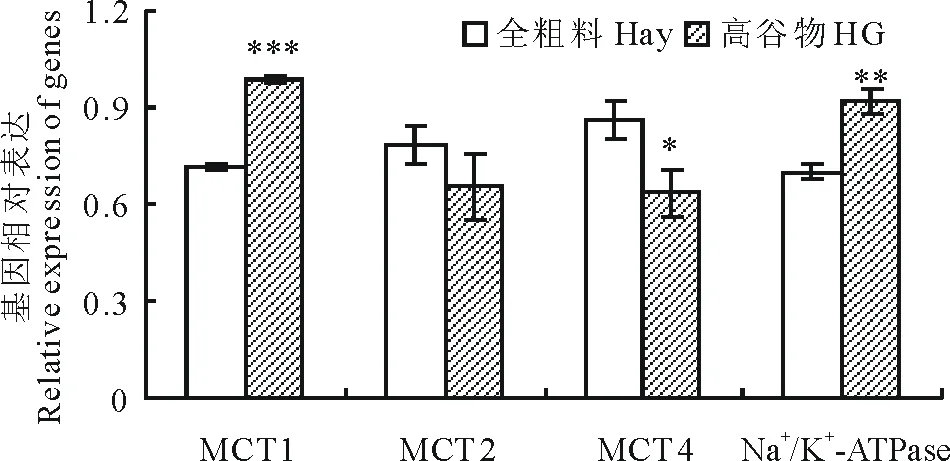
图2 高谷物日粮对瘤胃上皮单羧酸转运蛋白和Na+/K+-ATPase mRNA 的相对表达量的影响Fig.2 The effect of HG diet on relative mRNA expression of ruminal epithelial MCT and Na+/K+-ATPase*,**,*** indicate significat difference.
2.4 瘤胃上皮营养转运蛋白mRNA表达水平与瘤胃内pH值和VFA浓度的关系
进一步分析这些基因的mRNA表达量与pH值和VFA浓度之间的关系(表4),结果显示,MCT1和Na+/K+-ATPase的mRNA表达量与瘤胃pH值和乙酸浓度呈显著负相关,与总VFA、丙酸、丁酸的含量呈显著正相关,而MCT4的mRNA表达量与pH值呈显著正相关,与总VFA、丙酸、丁酸的含量呈显著负相关。

表4 目的基因的mRNA表达量与瘤胃生理指标之间的相关性Table 4 Relationship between target gene mRNA expression and ruminal physiological parameters
3 讨论
瘤胃上皮发育受日粮等因素的影响。早期研究表明,增加日粮能量水平使瘤胃乳头表面积在6~8周后增加到最大[16]。Bannink等[17]报道,给奶牛饲喂含高比例易发酵碳水化合物的日粮,其瘤胃上皮增殖速率迅速增加。Shen等[7]研究发现,高精料饲喂促进山羊瘤胃乳头的增殖,使瘤胃乳头吸收面积增加。许多学者对此结果的解释为:动物对于瘤胃内高浓度的VFA可做出适应性反应,即通过增加瘤胃上皮的吸收面积来促进上皮对VFA的吸收,从而短时间缓解由高精料引起的瘤胃环境恶化[1,16]。本研究发现,长期饲喂高谷物日粮导致瘤胃乳头长度增加,但并未对瘤胃乳头的吸收面积产生显著影响,推测其原因可能是短时间饲喂高谷物可促进瘤胃乳头的生长,但长期饲喂导致瘤胃乳头损伤,宽度变窄,虽然长度变长,但在宽度变窄的情况下,瘤胃乳头的总吸收面积未发生改变,该推测也能在一定程度上解释瘤胃内VFA的变化规律。在短期饲喂高谷物日粮时,瘤胃有一个适应过程(增加瘤胃乳头的吸收面积),此时瘤胃上皮对VFA的吸收能力增强,因而瘤胃内VFA的浓度有一个阶段性下降的过程。但随后在长期酸性及毒性物质的作用下,瘤胃乳头形态受损,宽度变窄,吸收面积逐渐和对照组接近,这也使动物通过瘤胃上皮吸收来减少瘤胃内VFA累积的能力减弱,因而山羊瘤胃内VFA的浓度在短暂下降后又出现一个反弹的上升过程。
单羧酸转运蛋白家族是反刍动物瘤胃上皮细胞膜上一类重要的跨膜转运蛋白,负责乳酸、VFA等单羧酸类化合物的跨膜转运。近年来有研究发现,高精料日粮或是亚急性瘤胃酸中毒会改变与瘤胃上皮单羧酸(VFA、乳酸和酮体等)转运密切相关的MCT的表达[1]。Metzler-Zebeli等[9]研究发现,高谷物饲喂显著上调山羊瘤胃上皮MCT1的表达,但是显著下调MCT4的表达。本文的研究结果与上述研究结果相吻合。早期研究表明,MCT1主要位于瘤胃上皮细胞的底端(棘状和基底层细胞),介导VFA从上皮细胞转运到血液,其基因表达具有底物依赖性[18]。这就能很好地解释为什么高谷物饲喂可导致MCT1表达上升,并且其与瘤胃内VFA浓度显著相关。MCT4主要位于瘤胃上皮的顶端(颗粒层细胞),介导VFA从瘤胃腔转运到上皮细胞[19]。这两种单羧酸转运蛋白位置及功能的差异决定了其表达变化的差异。我们前期研究表明,高谷物饲喂导致瘤胃上皮颗粒层细胞厚度显著降低[20],这可能与MCT4表达的下降密切相关。另一方面,研究表明,MCT4对VFA的转运能力相对较弱[21],那么高谷物饲喂引发的MCT4表达的下降可能是瘤胃上皮通过被动运输和VFA-/HCO3-交换过度摄取VFA的一种平衡反应。上述结果也暗示,MCT1和MCT4在介导VFA吸收方面发挥着不一样的作用。
Na+/K+-ATPase位于瘤胃上皮的棘装层和基底层,对于建立其他营养物质转运所必需的细胞间电化学梯度具有重要的作用。由Na+/K+-ATPase建立的Na+转运动力对Na+的吸收及非直接的通过Na+/H+交换的VFA的吸收都是必需的[22]。已有研究证明,高精料日粮显著增加绵羊瘤胃上皮急性转运蛋白Na+/K+-ATPase的活性[6]。高谷物饲喂可导致瘤胃内的渗透压升高[1],瘤胃上皮Na+/K+-ATPase表达的上升可适应高强度的钠离子转运。同时透射电镜的结果也进一步证实,高谷物饲喂导致瘤胃上皮细胞线粒体结构破坏,能量供应不足,从而导致Na+/K+-ATPase的表达适应性增强。因此,Na+/K+-ATPase表达上升更多可看作是山羊瘤胃上皮适应高能量日粮的一种调节机制。
4 结论
长期饲喂高谷物日粮并未改变瘤胃乳头的吸收表面积,但导致瘤胃上皮细胞线粒体发生降解;同时,高谷物日粮显著升高了 MCT1和Na+/K+-ATPase的mRNA表达量,显著降低了MCT4的mRNA表达量。相关性分析结果表明,高精料引起的瘤胃pH值下降和VFA含量的变化与瘤胃上皮MCT和Na+/K+-ATPase表达量的变化相关。研究结果将对深入认识高谷物日粮引起的瘤胃功能紊乱具有重要意义。
References:
[1] Penner G B, Steele M A, Aschenbach J R,etal. Ruminant nutrition symposium: Molecular adaptation of ruminal epithelia to highly fermentable diets. Journal of Animal Science, 2011, 89(4): 1108-1119.
[2] Penner G B, Oba M, Gabel G,etal. A single mild episode of subacute ruminal acidosis does not affect ruminal barrier function in the short term. Journal of Dairy Science, 2010, 93(10): 4838-4845.
[3] Hu H L. Study on the Nutritional and Physiological Mechanism of Subacute Ruminal Acidosis in Dairy Goats[D]. Huhhot: Inner Mongolia Agricultural University, 2008. 胡红莲. 奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D]. 呼和浩特: 内蒙古农业大学, 2008.
[4] Liu L, Wang J Q, Liu S J,etal. Subacute ruminal acidosis in dairy herds. China Animal Husbandry & Veterinary Medicine, 2008, 35(5): 72-75. 刘亮, 王加启, 刘仕军, 等. 奶牛亚急性瘤胃酸中毒研究进展. 中国畜牧兽医, 2008, 35(5): 72-75.
[5] Penner G B, Aschenbach J R, Gabel G,etal. Epithelial capacity for apical uptake of short chain fatty acids is a key determinant for intraruminal ph and the susceptibility to subacute ruminal acidosis in sheep. Journal of Nutrition, 2009, 139(9): 1714-1720.
[6] Kuzinski J, Zitnan R, Viergutz T,etal. Altered Na+/K+-ATPase expression plays a role in rumen epithelium adaptation in sheep fed hay ad libitum or a mixed hay/concentrate diet. Veterinarni Medicina, 2011, 56(1): 35-47.
[7] Shen Z, Seyfert H M, Lohrke B,etal. An energy-rich diet causes rumen papillae proliferation associated with more IGF type 1 receptors and increased plasma IGF-1 concentrations in young goats. Journal of Nutrition, 2004, 134(1): 11-17.
[8] Lu J Y. Effect of Dietary Energy Intake on Growth of Rumen Epithelium and Its Underlying Mechanism in Goats[D]. Nanjing: Nanjing Agricultural University, 2012. 卢劲晔. 日粮能量水平对山羊瘤胃上皮生长的影响及机理研究[D]. 南京: 南京农业大学, 2012.
[9] Metzler-Zebeli B U, Hollmann M, Sabitzer S,etal. Epithelial response to high grain diets involves alteration in nutrient transporter and Na+/K+-ATPase mRNA expression in rumen and colon of goats. Journal of Animal Science, 2013, 91(9): 4256-4266.
[10] Qin W L. Determination of rumen volatile fatty acids by means of gas chromatography. Journal of Nanjing Agricultural College, 1982, 4: 110-116. 秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进. 南京农业大学学报, 1982, 4: 110-116.
[11] Odongo N E, AlZahal O, Lindinger M I,etal. Effects of mild heat stress and grain challenge on acid-base balance and rumen tissue histology in lambs. Journal of Animal Science, 2006, 84(2): 447-455.
[12] Graham C, Simmons N L. Functional organization of the bovine rumen epithelium. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 2005, 288(1): 173-181.
[13] Chomczynski P, Sacchi N. Single-step method of rna isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry, 1987, 162(1): 156-159.
[14] Naeem A, Drackley J K, Stamey J,etal. Role of metabolic and cellular proliferation genes in ruminal development in response to enhanced plane of nutrition in neonatal holstein calves. Journal of Dairy Science, 2012, 95(4): 1807-1820.
[15] Wang A, Gu Z, Heid B,etal. Identification and characterization of the bovine g protein-coupled receptor GPR41 and GPR43 genes. Journal of Dairy Science, 2009, 92(6): 2696-2705.
[16] Dirksen G, Liebich H, Mayer E. Adaptive changes of the ruminal mucosa and their functional and clinical significance. Bovine Practitioner, 1985, 20: 116-120.
[17] Bannink A, France J, Lopez S,etal. Modelling the implications of feeding strategy on rumen fermentation and functioning of the rumen wall. Animal Feed Science and Technology, 2008, 143(1): 3-26.
[18] Kirat D, Masuoka J, Hayashi H,etal. Monocarboxylate transporter 1 (MCT1) plays a direct role in short-chain fatty acids absorption in caprine rumen. Journal of Physiology, 2006, 576(2): 635-647.
[19] Kirat D, Matsuda Y, Yamashiki N,etal. Expression, cellular localization, and functional role of monocarboxylate transporter 4 (MCT4) in the gastrointestinal tract of ruminants. Gene, 2007, 391(1-2): 140-149.
[20] Liu J H, Xu T T, Liu Y J,etal. A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 2013, 305(3): 232-241.
[21] Aschenbach J R, Penner G B, Stumpff F,etal. Ruminant nutrition symposium: Role of fermentation acid absorption in the regulation of ruminal pH. Journal of Animal Science, 2011, 89(4): 1092-1107.
[22] Albrecht E, Kolisek M, Viergutz T,etal. Molecular identification, immunolocalization, and functional activity of a vacuolar-type H(+)-ATPase in bovine rumen epithelium. Journal of Comparative Physiology B, 2008, 178(3): 285-295.
A high-grain diet promotes expression of MCT1 and Na+/K+-ATPase mRNAs in the ruminal epithelium of goats
LIU Jun-Hua, ZHU Wei-Yun, MAO Sheng-Yong*
JiangsuKeyLaboratoryofGastrointestinalNutritionandAnimalHealth,LaboratoryofGastrointestinalMicrobiology,NanjingAgriculturalUniversity,Nanjing210095,China
The objective of this study was to investigate the effect of a high-grain (HG) diet on the ruminal epithelial structure and the transcript levels of genes encoding monocarboxylate transporters (MCTs) and a Na+/K+-ATPase in goats. Ten ruminally fistulated, castrated male goats were randomly assigned to either a hay diet (Hay,0% grain,n=5) or a HG diet (HG,65% grain,n=5) with continuous feeding for 7 weeks. Each week, at 0, 2, 3, 4, 6, 8 and 12 h after morning feeding, rumen fluid was collected to monitor the changes in ruminal pH. The rumen fluid collected at 0, 3, 6, and 12 h after morning feeding was used to determine the volatile fatty acid (VFA) concentration. The results showed that, compared with the control, the HG diet significantly reduced rumen pH, acetate concentration, and the acetate-propionate ratio (P<0.001), and significantly increased the concentrations of ruminal propionate, butyrate, and other VFAs (P<0.001). The HG diet significantly increased the length but decreased the width of rumen papillae. The surface of the rumen papillae did not differ significantly between the two groups. The HG diet caused substantial damage to ruminal epithelial cell mitochondria. Compared with the hay-fed group, the HG-fed group showed increased transcript levels of genes encoding MCT1 (P<0.001) and the Na+/K+-ATPase (P=0.001), but decreased transcript levels of the gene encoding MCT4 (P=0.041). There was no significant difference in the transcript levels of MCT2 between the hay-fed and HG-fed groups (P=0.305). Correlation analyses revealed that the transcript levels of the genes encoding MCT1 and Na+/K+-ATPase were negatively correlated with ruminal pH and acetate concentration, but positively correlated with total VFA, propionate, and butyrate concentrations. The MCT4 mRNA level was positively correlated with pH, but negatively correlated with total VFA, propionate, and butyrate concentrations. These results suggested that the changes in ruminal pH and VFA concentrations were associated with the changes in the expression levels of MCTs and Na+/K+-ATPase. These findings provide important information for understanding HG diet-induced ruminal epithelial function disorder in ruminants.Key words: high-grain diet; rumen epithelium; monocarboxylate transporter; Na+/K+-ATPase; goats
10.11686/cyxb2016121
http://cyxb.lzu.edu.cn
2016-03-23;改回日期:2016-05-11
国家自然科学基金(31172228)资助。
刘军花(1984-),女,江西新干人,博士,讲师。E-mail:liujunhua0011@163.com
*通信作者Corresponding author. E-mail:maoshengyong@163.com
刘军花, 朱伟云, 毛胜勇. 高谷物日粮促进山羊瘤胃上皮单羧酸转运蛋白1及钠钾ATP酶mRNA的表达. 草业学报, 2017, 26(2): 95-101.
LIU Jun-Hua, ZHU Wei-Yun, MAO Sheng-Yong. A high-grain diet promotes expression of MCT1 and Na+/K+-ATPase mRNAs in the ruminal epithelium of goats. Acta Prataculturae Sinica, 2017, 26(2): 95-101.
