热应激对肉牛核转录因子SNORA66基因表达的影响
2017-02-26彭术军
彭术军,王 玲,陈 宏
(1.西北农林科技大学动物科技学院, 陕西 杨凌 712100;2.西南大学动物科技学院 ,重庆 402460 )
热应激(Heat stress)是机体对外界或内部的热刺激所产生的非特异性应答反应的总和。研究表明,热应激能引起外周血液淋巴细胞凋亡,机体免疫下降,内环境失衡,从而严重影响肉牛生产性能,对肉牛的经济价值带来巨大损失。因此,从分子遗传角度来看,研究热应激对相关基因的表达及作用机制具有重要意义。SNORA66是一类位于非编码区的基因间区的核仁小RNA分子,属于核转录因子,是snoRNA家族之一,广泛分布于真核生物和原核生物中,最初起源于HeLa Cell[1],具有类似核仁提取物的性质(抗盐性),其主要指导其它RNA,特别是指导snRNA,tRNA和mRNA的转录后的修饰,进而调控mRNA翻译成蛋白质[2,3],因而SNORA66基因将极有希望成为研究肉牛应对热应激的候选基因。研究表明,强热应激下,转基因植物通过机体内SNORA66基因的调控作用产生热休克蛋白Hsp70抵御外界刺激[4]。姜同泉等[5]发现,哺乳动物细胞受热应激后会终止大部分蛋白质的合成。另外,研究显示,人体血液中也检测出SNORA66基因,并且发现与外周血淋巴细胞凋亡、蛋白激酶级联反应、阻止癌细胞增殖、免疫调节高度相关[6]。Chen等研究发现振荡刺激与静置两种状态下,人体血清样品中SNORA66基因的Cq值,前者明显高于后者[7]。有关SNORA66基因作为抗应激候选基因的研究在植物、人类等有所报道,而SNORA66基因作为肉牛抗应激基因的相关研究报道不多,热应激对肉牛SNORA66基因表达的差异性的研究国内外尚未见报道。本研究运用Real-time PCR方法检测 SNORA66基因的组织表达谱,同时分析SNORA66基因在不同应激下、不同品种的差异表达情况,探讨SNORA66基因的表达量与热应激、非热应激、品种的关系,为进一步研究SNORA66基因的功能和肉牛抗热应激选育提供一定的理论依据。
1 材料与方法
1.1 试验动物及样品采集
在重庆良种肉牛场选择26月龄左右的红安格斯和抗旱王空怀母牛各5头,在热应激和非热应激条件下利用真空采血管从颈静脉采集血液,并迅速将样品置于液氮内冷冻保存,然后在实验室分离白细胞。
1.2 温湿度的测定
试验期内,在牛舍中部及四个角距地面1.5 m高处各悬挂干湿球温度计,于每天上午8:00和14:00测定牛舍的干球温度(Td)和湿球温度(Tw),利用公式计算温湿指数(THI),THI=0.72(Td+Tw)+40.6。以THI作为热应激程度的评定标准,当THI≤72为无热应激;72
1.3 主要仪器与试剂
荧光定量PCR仪、电泳仪、CFX connectTM Real-Time System、台式高速冷冻离心机、反转录试剂盒等;2×Taq PCR MasterMix、DL2000 DNA Marker、10×Loading Buffer、6×DNA loading buffer;GoldViewⅠ型核酸染色剂、RNA抽提试剂Trizol、DEPC、琼脂糖(AGAROSE G-10)、Tris base、EDTA、硼酸。
1.4 总RNA提取与处理
本试验采用Trizol全血RNA提取法,其操作流程如下:
用2 mL EP管中收集1.5 mL新鲜的血液,加入红细胞裂解液按1:3的比例分离白细胞,在3500 r/min离心6 min,若效果不好,再重新裂解一次。分离得到的白细胞,立刻用质量好的TRIZOL裂解白细胞,或置于-20℃或-80℃保存,过后抽提。
1.5 引物设计与合成
根据GenBank数据库中搜索肉牛SNORA66基因的DNA或者mRNA为模板来设计引物,利用Primer Premier 5.0[1](在www.bio-soft.net下载)进行引物设计。综合考虑引物设计的各项原则,设计SNORA66基因的上、下游引物,以β-actin作为内参基因。引物由上海英俊公司合成,序列及信息见表1:
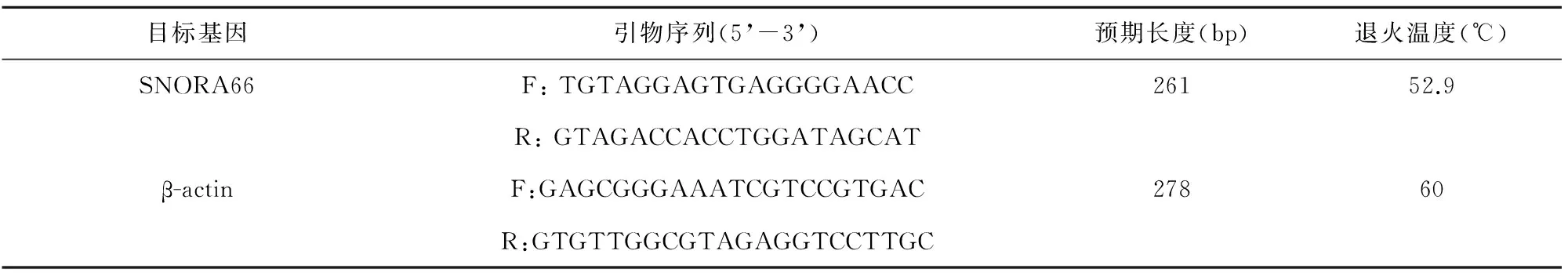
表1 引物详细信息
1.6 cDNA的合成
根据TaKaRa的反转录试剂盒说明进行反转录,反转录体系组成如:5×PrimeScript Buffer 4 μL,PrimeScript RT Enzyme MixⅠ1 μL,Oligo dT Primer(50 μmol/L)1 μL,Random 6 mers(100 μmol/L)1 μL,Total RNA(1 μg/μL) 2 μL,灭菌双蒸水补足20 μL。按37℃反应15 min,再85℃反应5s,获取cDNA,-20℃保存备用。
1.7 荧光定量引物普通PCR电泳检测
根据SsoAdvancedTM Universal SYBRR Green SuPermix配置荧光PCR反应体系10 μL,反应体系如下:SsoAdvancedTM Universal SYBRR Green SuPermix 5 μL,上下引物各0.4 μL,cDNA 模板1 μL,补灭菌双蒸水至10 μL。PCR反应程序:95℃预变性3 min;95℃变性10s,52.9℃退火30 s,39个循环,4℃保存,最后,用1%琼脂糖凝胶成像系统检测。
1.8 荧光定量引物扩增效率检测
以RT-PCR扩增产物为模板,进行倍比稀释,将PCR产物用EASY Dilution依次梯度稀释成(1×100~1×106)7个梯度,按上述1.6的方法对样品进行处理:红安格斯正常情况(HC)、红安格斯热应激情况(HH)和抗旱王正常情况(KC)、抗旱王热应激情况(KH)进行测定,每一品种选择3个样本,每个样本(重复3次),选取表达量最低的样品作为计算相对表达量的标准品,设置一个阴性对照(NTC)。取各梯度的标准品1 μL加入反应体系中,在同样的反应条件下,进行荧光定量PCR反应,检测扩增效率。根据Q-PCR仪绘制的PCR动力学曲线,分别绘制SNORA66、β-actin的标准曲线。
1.9 统计分析
本实验根据荧光曲线的Ct值,采用比较阈值法(2-ΔΔCT法)进行相对定量分析结果。针对基因的相对表达量,采用Bio-Rad CFX Manager 3.1软件对其进行统计分析,结果用平均值±标准差来表示,并进行显著性检验。
2 结果与分析
2.1 血液总RNA质量检验
采用Trizol法对肉牛外周血进行总RNA抽提,琼脂糖凝胶电泳检测图谱见图1。由图1可见3条明显的条带,按迁移率由小到大依次是28SrRNA、18SrRNA和5SrRNA。28S条带较明亮,28S条带与18S条带之比约为2,没有杂带和拖尾现象的样品为合格样品。
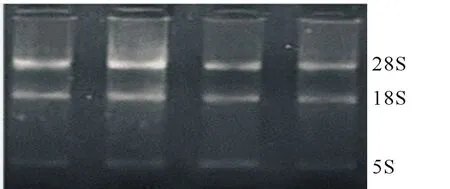
图1 RNA电泳结果
2.2 琼脂糖凝胶电泳检测
图2显示,SNORA66产物在琼脂糖凝胶电泳中只出现唯一符合预期长度的明亮条带,表明不存在明显的引物二聚体或非特异PCR产物,可供后续实验。
2.3 标准曲线

图2 β-actin、SNORA66基因扩增结果

图3 肉牛SNORA66基因Real-time PCR标准曲线

图4 β-actin基因Real-time PCR标准曲线

基因扩增效率(%)回归公式回归系数(R2)β-actin94.9Y=-3.451X+30.6920.999SNORA6698.7Y=-3.353X+32.2780.995
图3、图4得到的标准曲线公式和回归系数分别如表2所示,这说明在标准质粒稀释质量浓度范围内具有良好的线性关系。曲线的扩增效率为E=94.9%、98.7%符合要求;熔解曲线表现为单一的峰值,产物的Tm值均一。
2.4 SNORA66基因的相对表达量
经Bio-Rad CFX Manager 3.1软件进行分析预处理后得到每一样品的SNORA66基因相对表达量的统计数据,结果见表3、表4。从表3可知,红安格斯牛及抗旱王牛热应激条件下SNORA66基因表达量均显著高于非热应激条件(P<0.05)。
从表4可知,热应激及非热应激状态下红安格斯牛SNORA66基因表达量均显著低于抗旱王牛SNORA66基因表达量 (P<0.05)。

表3 不同状态下红安格斯及抗旱王SNORA66基因的表达量
注:数据中肩标相同或无字母表示差异不显著(P>0.05),附不同小写字母表示差异显著(P<0.05),附不同大写字母表示差异极显著(P<0.01)。下表同

表4 非热应激及热应激状态下红安格斯和抗旱王SNORA66基因表达量
3 讨论
3.1 不同状态下同一肉牛品种SNORA66基因的相对表达
热应激下,组织器官处于异常状态,体内SNORA66基因的表达水平发生改变。目前,在动物上研究热应激对SNORA66的影响的报道较少,而主要集中在植物和人类的研究中。在植物上,已有许多研究发现热应激较大程度影响植物中的基因表达。Jonathan等[4]研究转基因植物在热应激下的表达水平发现,SNORA66在热应激下表达发生改变,且大部分表达呈现上升趋势。另外,Chen等[7]研究发现振荡刺激与静置两种状态下,人体血清样品中SNORA66基因的Cq值,前者明显高于后者。另外,医学研究发现,人类基因组中15号染色体上缺少SNORA66基因会导致Prader-willi综合征,说明该基因与疾病的调控高度相关[8]。本研究表明,两种状态下安格斯及抗旱王牛外周血液中的SNORA66基因均有表达,且热应激下显著高于非热应激,与前人研究基本一致。通过以上研究结果表明,热应激下动植物体内部分SNORA66基因存在上调表达,调节着不同的生理过程来防御热应激。因此,本研究推测,短时间热应激将导致肉牛的免疫功能受到抑制,机体通过提升SNORA66基因表达量,调控产生热休克蛋白防御热应激破坏机体的内环境,而非热应激下则不会出现。同时,我们拟通过鉴定热应激下差异表达的SNORA66,初步探究动植物对热应激与非热应激的应答机制。
3.2 热应激条件下不同肉牛品种SNORA66基因的相对表达
热应激下,不同品种肉牛体温均迅速上升,机体内环境遭到破坏,严重影响牛血清生化指标(SOD抗氧化指标、免疫指标、酶活性指标)。近几年,Fuquay[9]等研究发现,肉牛热应激是当肉牛受到超过本身体温调节能力的过高温度刺激时,作用于垂体-肾上腺皮质系统引起机体的非特异性防御反应和特异性障碍的全身性适应症。研究表明,肉牛的耐热性状是一数量性状,不同的品种和个体的肉牛对热应激的反应存在一定的差异,抗旱王牛群耐热性状的遗传力为0.15~0.30[10]。本研究表明,热应激期的安格斯牛和抗旱王牛的SNORA66基因表达量差异较大。可能与种属特异性和品种的形成过程有关,由于品种的形成与自然环境密切相关,不同的自然环境使不同牛的品种在外貌特征,生理和基因组成上产生较大的差别,因而两品种肉牛对热应激的抵抗力也有显著的差异。黄薇等[11]曾报道,在不同的人群中,基因组的连锁不平衡的程度是不同的,即使在同一个群体中,基因组的不同区域的连锁不平衡程度也是不同的。同样,SNORA66基因在这2个肉牛品种中的连锁不平衡(Linkgae Disqeuiilbrium, LD)程度也不是完全一样的。李芳等[2,12]研究发现,热应激转录因子是最早被发现的热休克转录因子,它转录调控热休克蛋白基因的表达,直接或间接参与动物热休克反应。研究发现SNORA66基因是一种分布于真核生物细胞核仁的小分子非编码RNA,与热应激蛋白质合成有关,该基因高度保守遗传[2,13],不同物种间同源性高,研究证实所有SNORA66基因都包含三个及其相似结构:DNA 结合结构域、三聚化结构域、转录活化域。一旦机体受到热应激时,SNORA66基因接受刺激后,启动三聚化结构域结合形成有活性的三聚体,然后由DNA结合结构结合到转录调控的基因上,最后发挥转录活化区域的功能激活相应基因表达,因此,不同品种肉牛细胞可能通过提高SNORA66表达量的方式来应对热应激所带来的不良反应。另外,通过尹小平[14,15]等的研究分析,品种差异造成,抗旱王耐热性能较好,对热的敏感度较低,机体内含有瘤牛血液,体质强壮[16],合成热应激蛋白能力较强,热应激下抗旱王牛SNORA66基因表达量的上调明显。
本研究通过对SNORA66基因表达量的研究,统计分析不同品种与热应激的相关性,从分子水平上揭示SNORA66基因与肉牛耐热性状之间关系,探索不同品种肉牛发生热应激的遗传机理。结果表明,热应激状态下红安格斯牛外周血中SNORA66基因表达显著低于抗旱王牛,与前人研究有类似结论。因此,笔者推测,热应激是通过破坏内环境平衡,导致血液生化信号通路受阻、细胞凋亡、免疫功能下降,从而激活SNORA66基因调控功能,上调血液中基因表达量,以碱基配对的方式分别指导着核糖体RNA的甲基化和假尿嘧啶化修饰,与特定的热休克蛋白质结合形成核糖核蛋白体(snoRNP),并以此形式存在和行使功能,防御热应激;从分子遗传角度看,不同品种的肉牛在热应激存在差异性的基因表达机制,具体表达机制有待进一步研究。
4 结论
本研究结果表明,热应激状态下,红安格斯牛及抗旱王牛外周血中的SNORA66基因表达量均显著高于非热应激状态(P<0.05);热应激和非热应激状态下,SNORA66基因的表达量具有品种差异,红安格斯牛外周血中SNORA66基因表达量均显著低于抗旱王牛(P<0.05)。
[1] Ganot, Philippe,Caizergues-Ferrer, et al. The family of box ACA small nucleolar RNAs is defined by an evolutionarily conserved secondary structure and ubiquitous sequence elements essential for RNA accumulation[J]. Genes & Development,1997,11(7): 941-956.
[2] 张筱晨.snoRNA的结构与功能[J]. 生命科学,2008, 2(4):172-177.
[3] Kishore S, StammS.The snoRNA HBII-52 regulates alternative splicing of the serotonin receptor 2C[J]. Science,2006,311(5758): 230.
[4] Jonathan R, Allison K. Off-target Effects of Plant Transgenic RNAi:Three MechanismsLeadto Distinct Toxicologicaland Environmental Hazards[J]. GMO-Free Region,2015,(5):11-12.
[5] 姜同泉,任登良,姜忠玲等.热应激处理鼠囊胚Hsp70基因表达的RT- PCR检测[J]. 繁殖与生理,2007,(11): 8-9.
[6] Zaravinos A, Lambrou GI, Mourmouras N, et al. New miRNA Profiles Accurately Distinguish Renal Cell Carcinomas and Upper Tract Urothelial Carcinomas from the Normal Kidney[J]. PLoS ONE,2014,(9): e91646.
[7] Chen X, Liang H, Guan D, et al. A Combination of Let-7d, Let-7g and Let-7i Serves as a Stable Reference for Normalization of Serum microRNAs[J]. PLoS ONE,2013,8(11): e79652.
[8] Skryabin BV, Gubar LV, Seeger Betal. Deletion of the MBII-85 snoRNA gene cluster in mice results in postnatal growth retardation[J]. PLoS Genet.,2007,3(12):e235.
[9] Fuquay J W. Heat stress as it affects animal production[J].J Anim Sci,1981(52):164-174.
[10] Kinnula VL, Crapo JD, Raivio KO. Generation and disposal of reactive oxygen metabolites in lung[J]. Lab Invest, 1995, 73(1): 3-19
[11] Huang W, He Y, Wang H, et al. Linkage disequilibrium sharing and haPlotyPe-ragged SNP Portability between Populations[J]. Proc Natl Acad Sei USA,2006, 103(5): 1418-1421.
[12] LI Fang. Association of HSF1 Polymorphisms and its relationship with thermal tolerance in Holstein cows[J]. J Anim Sci,2009(6): 30-35.
[13] 翟丽丽,邹小婷,等.两个保守的snoRNA基因SNORA50和SNORA71在灵长类和啮齿类的转录活性及组织表达谱[J].中国细胞生物学学报,2014(8): 1-2.
[14] 尹小平,袁慧,张明.奶牛热应激及对免疫影响的研究进展[C]. 2003年全国家畜内科学学术研讨会论文专辑, 2003(10): 144-145.
[15] 胡艳欣,佘锐萍,张洪玉,等. 热应激后猪血清中 IL-2,IFN-γ及TNF-α水平的动态变化[J].畜牧兽医学报,2006, 37(5): 496-499.
[16] 孙晓燕,黄德均,等.抗旱王牛的血液理化指标测定[J]. 四川畜牧兽医,2014,(9): 26-28.

中国牛业科学2017,43(5):38-43ChinaCattleScience文献综述
