生物质降解酶生产菌株的育种和应用
2017-02-24王方忠张睿钦金建玲夏蕊蕊肖林易勇张继祥侯少莉方诩
王方忠,张睿钦,金建玲,夏蕊蕊,肖林,易勇,张继祥,侯少莉,方诩,5
1.山东大学微生物技术国家重点实验室,济南 250100
2.天津大学生物安全与战略研究中心,天津 300000
3.山东龙力生物科技股份有限公司,山东省秸秆生物炼制重点实验室,禹城 251200
4.山东圣琪生物有限公司,济宁 273517
5.国家糖工程技术研究中心,济南 250100
生物质降解酶生产菌株的育种和应用
王方忠1,2,张睿钦1,金建玲1,夏蕊蕊3,肖林3,易勇4,张继祥4,侯少莉1,方诩1,5
1.山东大学微生物技术国家重点实验室,济南 250100
2.天津大学生物安全与战略研究中心,天津 300000
3.山东龙力生物科技股份有限公司,山东省秸秆生物炼制重点实验室,禹城 251200
4.山东圣琪生物有限公司,济宁 273517
5.国家糖工程技术研究中心,济南 250100

方诩,博士,教授,博士生导师。先后入选“985工程”资源生物技术科技创新平台学术骨干,教育部新世纪优秀人才,山东省引进海外创新创业人才“万人计划”第一层次人选,泰山学者海外特聘专家。先后获得国家发明技术二等奖、山东省五四青年奖章、生物工程学报优秀论文奖、山东省留学人员回国创业奖、中国轻工业联合会科技进步三等奖。现担任中国可再生能源学会生物质能专业委员会第九届常委,中国生物发酵产业协会微生物育种分会理事,《Frontiers in Microbiology》和《Scientific Reports》编委等职。
主要研究领域有微生物生理生化、代谢工程、生物催化等。主持参加国家“973”、“863”、“科技支撑计划”等多项课题,发表相关领域的SCI论文30篇以上,获得中国发明专利授权13项,美国、欧洲发明专利授权各1项,日本发明专利授权2项,国际发明专利1项。被特邀参与编著了2部中文著作以及国际著名SPRINGER出版社出版的1部英文著作,多次被特邀在国际会议上做大会报告。E-mail:fangxu@sdu.edu.cn
虽然中国已经成为世界第二大经济体,但是依然面临着能源、资源和环境的挑战。石油资源面临枯竭,而且生物乙醇是可再生且碳中性的生物液体燃料,所以从生物质提取乙醇一直是中国政府支持的重点。在该工艺中,酶水解获得可发酵性糖是关键技术,而高产纤维素酶的微生物育种是核心,并且直接影响了整个工艺的生产成本。介绍了产纤维素酶的工业菌种,工业菌株的物理诱变、化学诱变以及基因工程改造,并且介绍了用生物质降解酶进行生物精炼的两个成功案例。
生物乙醇;纤维素酶;微生物育种;酶水解
目前,我国在能源、资源、环境等方面面临着越来越严峻的挑战。一方面,中国的石油对外依存度已经突破60%,严重依赖进口,直接威胁国家的能源安全和经济安全;同时,我国温室气体的排放主要是来源于大量矿石燃料的使用。作为世界上最大的碳排放国家之一,2009年11月26日,中国政府承诺“到2020年,中国单位国内生产总值CO2排放,比2005年下降40%~45%”。2014年11月26日,中国再次重申减排目标。我国调整能源结构,提高非化石能源的比重是势在必行的。 由于乙醇、丁醇等生物液体燃料来自于丰富的可再生资源,其利用过程中产生的CO2又会被植物吸收,形成碳封闭循环,被国际公认为“碳中性燃料”。更有大量的研究表明,燃料乙醇不仅有效地提升发动机燃料效率,还可以很大程度地改善汽车尾气的清洁程度。所以,生物液体燃料被公认是传统化石燃料的理想替代物。
同时,我国作为农业大国,在收获季节产生大量的玉米秸秆、麦秆、稻秆等高纤维素含量的生物质,但并未得到有效利用,常常就地焚烧,造成严重的环境污染,成为一大社会公害。
因此,采用环境友好的生物法(酶法)将秸秆等生物质降解成可发酵性糖,再通过发酵制备乙醇、丁醇等生物液体燃料[1-2],既减少了秸秆焚烧带来的空气污染,又减少了汽油造成的尾气污染,起到了“双清洁作用”。
1 纤维素酶的主要成分及来源
能降解秸秆的酶通常被称为“纤维素酶”。早在一百多年前,人类就从蜗牛体内发现了纤维素酶。随后,科学家们发现纤维素酶在细菌、放线菌、真菌、昆虫、某些无脊椎动物等自然界生物体中广泛存在。但是用于纤维素酶制剂工业化生产的微生物均属于丝状真菌(霉菌)。比较典型的有木霉属(Trichoderma sp.)、青霉属(Penicillium sp.)、曲霉属(Aspergillus sp.)、根霉属(Rhizopus sp.)及漆斑霉属(Myrothecium sp.)等。来源于丝状真菌制备的纤维素酶具有产生的胞外酶易分离和提取,比活性高且产酶效率好以及产生纤维素酶酶系结构合理等诸多优点。丝状真菌合成的纤维素酶不仅包含了内切-β-1,4-葡聚糖酶,外切-β-1,4-葡聚糖酶,β-葡萄糖苷酶等纤维素酶主要成分,还包含了木聚糖酶、甘露聚糖酶、木糖苷酶、甘露糖苷酶、阿拉伯呋喃糖酶、阿魏酸酯酶等半纤维素酶系以及具有辅助活性的AA9等相关的酶。在自然界中木质纤维素降解过程,常见的酶解机制是:纤维素的非结晶区被内切-β-1,4-葡聚糖酶作用,纤维素长链的糖苷链被随机切断,成为不同聚合度的纤维素短链,使得纤维素分子的聚合度降低,增加了外切-β-1,4-葡聚糖酶作用的纤维素链末端数;外切-β-1,4-葡聚糖酶水解纤维素结晶区,CBH(cellobiohydrolase)Ⅰ或CBHⅡ从纤维素链的还原端或非还原端开始持续水解,生成纤维二糖;纤维二糖和可溶性纤维寡糖被β-葡萄糖苷酶水解,最终将纤维素转化为可利用的单糖——葡萄糖[3]。同时,由于半纤维素、木质素和果胶等物质阻遏了内切-β-1,4-葡聚糖酶和外切-β-1,4-葡聚糖酶的移动,因此,降解半纤维素、木质素和果胶等物质的酶组分也是必要的。
2 高产纤维素酶菌种选育的传统育种方法
高产纤维素酶工业菌株的育种对于纤维素酶的生产成本至关重要,不同的菌株之间的产酶能力往往相差百倍。丝状真菌中,木霉、青霉属产生的纤维素酶酶组分最全且活力较高。其中, 里氏木霉(Trichoderma reesei)从最初的研究至今已经有65年,据统计,全世界纤维素乙醇的生产有80%是以里氏木霉为宿主生产的纤维素酶制备而成的,有报道里氏木霉的最高胞外蛋白产量可达100g/L以上[4]。里氏木霉已经成为了世界上研究和应用最广泛的生产纤维素酶的模式微生物,国内外的科学家和技术人员采用物理化学诱变法和基因遗传改造等手段进行了菌种改良,开发出多种工业高产菌株,被用于各种用途的纤维素酶商业酶制剂生产,其中T1菌株是山东大学方诩课题组经过多次诱变获得的高产菌株,TX是采用基因过程改造提高β-葡萄糖苷酶活力的突变高产菌株(图1)。1979年,山东大学曲音波等从山东济宁市土壤中筛选出来的野生型菌株114-2,最初被鉴定为斜卧青霉,2013年重新鉴定为草酸青霉(Penicillium oxalicum)[5]。该菌株在国内被广泛研究和应用了30年以上,并经过多次传统的物理诱变(紫外)、烷化剂化学诱变(甲基磺酸乙酯)和亚铵废液的驯化以及基因的重排等手段,选育出多个高产工业菌株(图2)。
在菌种的选育过程中,常用的物理诱变方法有紫外线诱变、X射线诱变、γ-射线诱变、快中子诱变、激光诱变、微波诱变、离子束诱变等。近年来,清华大学邢新会教授团队开发的ARTP常温诱变育种系统,由于其使用的便捷性,也已被广泛应用[6]。化学诱变中常用的试剂有烷化剂、天然碱基类似物、氯化锂、亚硝基化合物、叠氮化物、碱基类似物、抗生素、溴化乙锭(EB)等。甲基磺酸乙酯(EMS)和亚硝基胍(NTG)被证明是最有效的化学诱变剂。物理和化学诱变组合的方法可以大大提高菌种的活性[7]。

图1 世界各国的里氏木霉菌株的选育情况举例
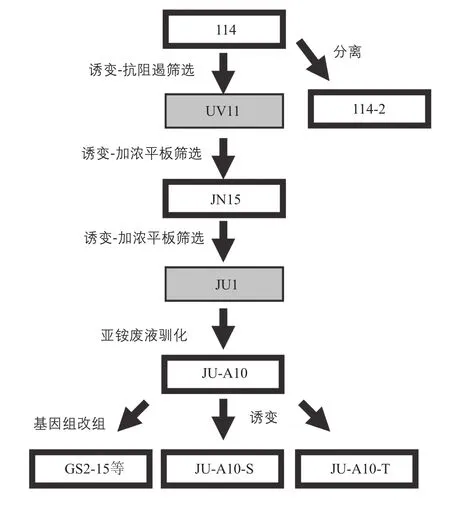
图2 草酸青霉菌株的选育
在诱变获得大量变异菌株的同时,筛选技术是获得高活力菌株的关键。从以往成功的经验可以找到一些规律,在平板上生长菌落直径小的突变株,往往活力高;在显微镜下观察,菌丝的分叉越多,往往该菌株的纤维素酶酶活强。在纤维素酶突变株筛选过程中,抗降解物阻遏突变株筛选技术往往被采用。纤维素酶的生产中,纤维素降解后生成的葡萄糖等易代谢利用的降解产物会引起降解物阻遏效应(carbon catabolite repression,CCR),抑制纤维素酶等水解酶的生物合成,是限制纤维素酶产量进一步提高的主要因素之一。在纤维素筛选平板中加入易代谢碳源(葡萄糖或甘油等),在此平板上生长的微生物的纤维素酶生产能力被抑制,原本在纤维素筛选平板上能产生透明圈的菌株就丧失了产圈的能力。利用这种平板筛选诱变后的微生物,很容易筛选到能在葡萄糖存在情况下抗CCR阻遏且纤维素酶高产的突变株。例如,里氏木霉NG14突变株就是利用磷酸膨胀纤维素-甘油平板获得的抗阻遏突变株。山东大学曲音波等改进了该筛选方法,用葡萄糖和脱木素的木粉代替甘油和磷酸膨胀纤维素,制成综纤维素(holocellulose)双层平板,直接根据突变株产生透明圈直径的大小,在经过紫外和NTG复合诱变后的变异株中,筛选出了两株具有明显抗阻遏特性的纤维素酶高产菌株,草酸青霉JN15和JU1[8]。
然而,传统的物理化学诱变提高纤维素酶酶活的水平是有限的,基因遗传改造工程被应用到纤维素酶菌种改良领域中。纤维素酶系是多种酶的复合物,所以优化各种酶系组成比例,解除中间产物的反馈抑制作用,是提高纤维素酶酶活的有效措施。最初发现里氏木霉纤维素酶系缺少β-葡萄糖苷酶,其作用是将纤维二糖水解为葡萄糖,从而解除二糖对内切酶和外切酶的反馈抑制作用,提高纤维素酶酶活。马良等[9]采用里氏木霉cbh1基因的启动子异源表达来源于草酸青霉的bgl1基因,转化子的滤纸酶活与出发株相比增加了6~8倍,利用预处理的玉米秸秆进行糖化实验,发现葡萄糖得率提高80%。王方忠等[10]发现采用木聚糖酶的启动子,能更有效地表达外源β-葡萄糖苷酶基因,并且不影响胞外蛋白的表达量。同时研究发现,木聚糖和甘露聚糖的降解产物木聚寡糖和甘露寡糖对cbh1酶活有很强的抑制作用[11]。作用机制可能是结合到cbh1的活性位点,从而抑制纤维素酶活力。然而里氏木霉中半纤维素酶的数量和活力都相对较低(例如缺少α-木糖苷酶和内切阿拉伯糖酶),所以提高半纤维素酶酶活也是很重要的遗传改造靶点。除了优化酶系组成比例外,很多与纤维素酶具有协同作用的辅助蛋白同样能提高纤维素酶酶活,例如CIP、SWO1和Expansin等[4]。具有里程碑式的研究结果就是多糖单加氧酶AA9家族(以前称为GH61)的发现和功能的解析,与传统的纤维素酶水解纤维素不同,AA9通过蛋白活性中心二价金属离子氧化断裂纤维素链。AA9与纤维素酶的协同作用只对I型纤维素有作用,并且需要有其他物质如CDH提供还原力。但是对于酸处理的玉米秸秆,不用添加任何还原物质,AA9与纤维素酶就能发挥很好的协同作用[12]。山东大学方诩课题组在里氏木霉中表达不同微生物来源的AA9,以脱木素木糖渣(delignif ed corncob residue,DCCR)和微晶纤维素为底物进行糖化实验,发现氨基酸序列不同的AA9和里氏木霉纤维素酶酶系协同效应有所差异,糖化效率的差别很大,有的AA9不仅可以提高葡萄糖得率20%~30%以上,而且和β-葡萄糖苷酶也有很好的协同作用(未发表数据)。
3 纤维素酶转录调控网络的遗传改造
提高丝状真菌生产纤维素酶的另一个途径就是纤维素酶转录调控网络的遗传改造。大量的实验证明Xyr1是里氏木霉中促进纤维素酶表达的主要激活因子。缺失Xyr1碳末端140个氨基酸就会使得菌体完全丧失生产纤维素酶能力[13],而在Xyr1中引入一个点突变,会极大提高纤维素酶和半纤维素酶酶活,并且不受诱导物限制[14]。Clr2是在粗糙脉孢菌中发现的纤维素酶主要转录激活因子。在不含有诱导物存在的条件下,过表达Clr2的菌体分泌纤维素酶量达到野生型在诱导条件下的水平[15]。同时,国内外的研究报道在有葡萄糖存在的条件下,Cre1就会介导碳代谢阻遏抑制纤维素酶基因的表达,所以敲除Cre1或者用截短的Cre1替代原有蛋白是提高纤维素酶表达的重要措施。但是这会大大抑制菌体生长,使得发酵过程菌体生物量减少,不利于后续发酵放大及最终纤维素酶酶活。山东大学方诩课题组采用构建人工激活元件的方法来解除Cre1介导的碳代谢阻遏,人工激活元件的组成如下:两个转录抑制因子(Cre1和Ace1)的结合结构域与各种转录激活因子的效应区(Xyr1、Ace2、Ace3、Clr2)[17]。利用高浓度乳糖进行培养,人工激活元件就会阻断Cre1介导的碳代谢阻遏,提高纤维素酶酶活并且菌体生长没有减弱(数据尚未发表)。
除此之外,还有很多遗传改造靶点可以挖掘。例如G蛋白、cAMP和MAPK等信号传导路径和感知传递诱导物信号的糖转运蛋白等[16]。这些尚处于较为基础的研究阶段,如何整合这些信息对整个调控网络进行重组是下一步遗传改造的重点。
在我国,纤维素酶被应用到玉米芯的生物精炼工艺中。玉米穗脱粒后剩余的玉米芯含有半纤维素和纤维素各约40%,是总糖含量最高的非木材木质纤维素材料原料之一。其中半纤维素主要组分是木糖,可用于生产木糖、木糖醇、低聚木糖、糠醛、糠醇等高附加值产品,加工过程产生的纤维素残渣中纤维素含量高达60%左右,而且这些纤维素残渣往往已经在上一道加工工序中经过了酸和高温处理等,相当于经过了纤维素乙醇的预处理工序,容易被纤维素酶水解成葡萄糖,进而发酵生产燃料乙醇[18](图3)。刘凯等[19]采用批次补料的工艺路线,利用纤维素酶水解玉米芯发酵生产乙醇。通过优化批次补料的底物浓度、补料时机和次数,纤维素酶的用量从15U/g底物降低到9.3U/g底物,并且发酵液中乙醇浓度提高2倍多。
纤维素酶不仅可以处理木质纤维素原料,而且还可以应用到纤维素含量较高的薯类工业废弃物处理。王方忠等[10]研究发现甘薯渣的主要成分为纤维素和果胶,在高浓度甘薯渣降解过程中,纤维素的吸水膨胀是造成其难被水解的主要原因。纤维素酶在降黏和葡萄糖产生的过程中发挥重要作用,果胶酶对降黏发挥着较小的作用,只是在较低纤维素酶浓度条件下,作为辅助蛋白协助纤维素酶释放葡萄糖。通过酶的复配及各个工艺条件的优化,发酵液中可以产生高达79g/L浓度的乙醇,同时每千克甘薯渣(干重)可产约200g乙醇。该工艺(图4)环境友好,生产效率高,同时易于产业化。

图3 玉米芯的生物精炼工艺

图4 甘薯的生物精炼工艺
生物质的开发利用是解决我国能源、资源、环境等难题的一把钥匙,纤维素酶作为生物催化剂,是技术中的核心和关键。纤维素酶不仅能降解秸秆等木质纤维素,还可以被应用到含有纤维素的生物质降解中,所以把它称之为“生物质降解酶”更为贴切。可以预见,生物质降解酶的产业化应用会越来越广泛。
[1] QU Y B,ZHU M T,LIU K,et al. Studies on cellulosic ethanol production for sustainable supply of liquid fuel in China[J]. Biotechnology Journal,2006,1(11):1235-1240.
[2] FANG X,SHEN Y,ZHAO J,et al. Status and prospect of lignocellulosic bioethanol production in China[J]. Bioresource Technology,2010,101(13):4814-4819.
[3] WANG M,LI Z,FANG X,et al. Cellulolytic enzyme production and enzymatic hydrolysis for second-generation bioethanol production[J]. Advances in Biochemical Engineering/Biotechnology,2012,128(1):1-24.
[4] BISCHOF R H,RAMONI J,SEIBOTH B. Cellulases and beyond:the first 70 years of the enzyme producer Trichoderma reesei[J]. Microbial Cell Factories,2016,15(1):106.
[5] LIU G,ZHANG L,QIN Y,et al. Long-term strain improvements accumulate mutations in regulatory elements responsible for hyper-production of cellulolytic enzymes[J]. Scientif c Reports,2013,3(7442):1569.
[6] 自振滔,石文昊,李钰茜,等. 利用等离子诱变技术改造纤维素酶生产丝状真菌工业菌株[J]. 中国酿造,2013,32(S1):5-8.
[7] FANG X,YANO S,INOUE H,et al. Strain improvement of Acremonium cellulolyticus for cellulase production by mutation[J].Journal of Bioscience and Bioengineering,2009,107(3):256-261.
[8] 曲音波,高培基,王祖农,等.青霉的纤维素酶抗降解物阻遏突变株的选育[J]. 真菌学报,1984,5(4):238-243.
[9] MA L,ZHANG J,ZOU G,et al. Improvement of cellulase activity in Trichoderma reesei by heterologous expression of a beta-glucosidase gene from Penicillium decumbens[J]. Enzyme and Microbial Technology,2011,49(4):366-371.
[10] WANG F,JIANG Y,GUO W,et al. An environmentally friendly and productive process for bioethanol production from potato waste[J]. Biotechnology for Biofuels,2016,9:50.
[11] XIN D,GE X,SUN Z,et al. Competitive inhibition of cellobiohydrolase I by manno-oligosaccharides[J]. Enzyme and Microbial Technology,2015,68:62-68.
[12] LANGSTON J A,SHAGHASI T,ABBATE E,et al. Oxidoreductive cellulose depolymerization by the enzymes cellobiose dehydrogenase and glycoside hydrolase 61[J]. Applied and Environmental Microbiology,2011,77(19):7007-7015.
[13] LICHIUS A,BIDARD F,BUCHHOLZ F,et al. Genome sequencing of the Trichoderma reesei QM9136 mutant identif es a truncation of the transcriptional regulator XYR1 as the cause for its cellulase-negative phenotype[J]. BMC Genomics,2015,16:326.
[14] DERNTL C,GUDYNAITE-SAVITCH L,CALIXTE S,et al. Mutation of the Xylanase regulator 1 causes a glucose blind hydrolase expressing phenotype in industrially used Trichoderma strains[J]. Biotechnology for Biofuels,2013,6(1):62.
[15] CORADETTI S T,XIONG Y,GLASS N L. Analysis of a conserved cellulase transcriptional regulator reveals inducer-independent production of cellulolytic enzymes in Neurospora crassa[J]. Microbiologyopen,2013,2(4):595-609.
[16] GUPTA V K,STEINDORFF A S,DE PAULA R G,et al. The post-genomic era of Trichoderma reesei:What’s next? [J]. Trends in Biotechnology,2016,S0167-7799:30085-3.
[17] 方诩,王方忠,梁亚,等. 纤维素酶和半纤维素酶激活因子及其表达基因与应用:201310384284.4[P].2014-09-17.
[18] 覃树林,王新明,孙保剑,等. 玉米芯综合利用研究进展[J].氨基酸和生物资源,2014,36(2):23-27.
[19] LIU K,LIN X,YUE J,et al. High concentration ethanol production from corncob residues by fed-batch strategy[J]. Bioresource Technology,2010,101(13):4952-4958.
Screening of cellulase hyper-producing strains and their application
WANG Fangzhong1,2,ZHANG Ruiqin1,JIN Jianling1,XIA Ruirui3,XIAO Lin3,YI Yong4,ZHANG Jixiang4,HOU Shaoli1,FANG Xu1,5
1. State Key Laboratory of Microbial Technology, Shandong University, Jinan 250100, China
2. Center for Biosafety Research and Strategy, Tianjin University, Tianjin 300000, China
3. Longlive Bio-Technology Co., Ltd., Shandong Key Labotory of Straw and Stover Bioref nement Technologies, Yucheng 251200, China
4. Shandong Bio Sunkeen Co., Ltd., Jining 273517, China
5. National Glycoengineering Research Center, Shangdong University, Jinan 250100, China
Although China becomes the world’s second largest economy by nominal GDP, there are many problems, such as energy crisis, resource exhaustion and environmental pollution. Because the depletion of fossil fuels in the future and bioethanol is a renewable and carbon neutral alternative liquid fuel, bioethanol production from biomass was being supported by the Chinese government.Enzymatic hydrolysis for obtaining the fermentable sugar is a key method in bioethanol production process from biomass. Furthermore, screening strains with cellulase hypersecreting ability is a core technology that has a signif cant effect on production cost of biomass bioref nery. In this paper, we introduce the industrial microorganisms producing the cellulolytic enzyme, the physical and chemical mutagens, and genetic reconstruction of the industrial strains. Two successful cases of biomass bioref nery with cellulolytic enzyme are also stated.
bioethanol; cellulase; microbial screening; enzymatic hydrolysis
10.3969/j.issn.1674-0319.2017.01.012
山东省自主创新及专项成果转化项目(2014CGZH1312),国家高技术研究发展计划“863计划”(2014AA021903),国家自然科学基金(31570040),山东大学基本科研业务费资助项目-自然科学专项(交叉学科培育项目)(2016JC031),中国博士后面上基金(2016M592178)
