晚期胰腺癌介入治疗临床操作指南(试行)
2017-02-22中国癌症研究基金会介入医学委员会
中国癌症研究基金会介入医学委员会
晚期胰腺癌介入治疗临床操作指南(试行)
中国癌症研究基金会介入医学委员会
胰腺肿瘤; 介入治疗; 诊疗准则
1 晚期胰腺癌的定义
本指南所指晚期胰腺癌(advanced pancreatic carcinoma,APC)为胰腺导管细胞癌,已发生局部和(或)远处转移,无法进行外科手术切除[1],TNM分期在T3N0M0以上,具体分期见表1。

表1 TNM及病理分析系统(AJCC第七版)[2]
胰腺癌是常见消化系统恶性肿瘤之一,全国肿瘤登记中心在《CA:A Cancer Journal for Clinicians》杂志上发表了2015年中国癌症统计数据,估计中国2015年新增430万癌症病例,癌症死亡病例超过280万[3]。肺癌、胃癌、胰腺癌等10种肿瘤是我国主要的恶性肿瘤,约占全部新发病例的75%,是目前国内主要的肿瘤死因,约占全部肿瘤死亡病例的80%。其中,胰腺癌的发病率在2000年-2011年是上升的,男性胰腺癌病死率居第7位。
胰腺癌分期不同,治疗方案选择也各不相同[4]。早期胰腺癌首选手术切除。Whipple手术仍为目前主要手术方式,但手术难度大,术后易发生胰瘘等并发症。中晚期胰腺癌,传统治疗方法主要是静脉化疗和放疗[5-9]。近年来,中晚期胰腺癌介入治疗应用范围日趋广泛,手术切除有困难、伴随病变较多不宜手术、不愿意接受手术或术后复发的患者,以及出现梗阻性黄疸、肝转移、剧烈腰背部疼痛能耐受全身化疗患者,均可采取敏感药物经导管直接灌注、放射性粒子植入、介入性生物治疗,也可以通过经皮肝穿刺胆道置管引流、胆管内支架置入等解除黄疸等并发症。
2 APC介入治疗的几个基本概念
2.1 经皮胰腺穿刺活组织检查术 经皮胰腺穿刺活组织检查术是经皮穿刺获取所需部位胰腺活组织,经过检验,明确胰腺病变的细菌学、细胞学和组织病理学诊断,甚至基因诊断与测序,从而提高胰腺病变诊断的精确率,以指导进一步临床治疗。
2.2 动脉内灌注化疗术(transarterial infusion chemotherapy,TAI)
2.2.1 定义 TAI是指经动脉内将导管或微导管插入到胰腺癌病灶主要供血动脉(如胃十二指肠动脉等)[10],根据临床资料确定相应化疗药物及其方案,将药物在一定时间内(一般30~45 min)经导管灌注到肿瘤组织内。
2.2.2 原理 通过导管经动脉进入肿瘤的供血动脉内再进行化疗药物的灌注,药物分布不受全身无关的血流影响,肿瘤区域是全身药物分布量最多且浓度最高的地方,即使以少于静脉给药量的剂量进行灌注,肿瘤区域的药物浓度仍远高于全身的药物浓度,其随血液循环流至全身其他地方的药物同样对靶器官外可能存在的其他转移性病灶起作用,是一种微创、相对高效,同时也兼顾局部和全身的治疗方式。
2.2.3 分类 依据注射方式可分为:(1)持续性动脉内灌注化疗术(continuous transarterial infusion chemotherapy,cTAI),一般要求留置动脉导管,灌注时间依据肿瘤生物性特性以及所选择药物的时间浓度曲线决定;(2)冲击性动脉内灌注化疗术(bolus transarterial infusion chemotherapy,bTAI),亦称团注灌注化疗,灌注时间一般在30~45 min,多在肿瘤血供丰富时进行。依据注射部位和药物是否加热,还可分为区域性灌注化疗和加热灌注化疗。
2.3 经皮125I粒子植入术
2.3.1 定义 经皮125I粒子植入术是指在局麻下,采用CT扫描等影像定位技术[11],依据模拟的放射治疗系统(treatment planning system,TPS)确定靶区和粒子植入的数目,采用直接穿刺的方法将125I粒子植入到胰腺癌和转移病灶组织中,使肿瘤组织细胞发生坏死。
2.3.2 原理 胰腺癌属于低氧性肿瘤,对常规放疗不敏感。而125I粒子半衰期为60.14 d,能持续释放γ射线。γ射线是原子核受激辐射的,比X射线光子能量高,波长更短,穿透能力更强,可持续破坏肿瘤细胞的DNA合成,从而阻止肿瘤细胞增殖;同时125I粒子所释放的γ射线为低能量射线,有效照射距离在1.0~2.0 cm,不容易对周围正常组织造成损伤。
2.4 经皮射频/微波治疗术
2.4.1 定义 经皮射频/微波消融治疗术是指在局麻下,采用CT扫描等影像定位技术将不同数量热消融针直接穿刺到胰腺癌和转移病灶组织中,在一定功率和时间内,使肿瘤组织细胞发生凝固坏死。
2.4.2 原理 射频和微波消融都是通过高热使肿瘤组织发生凝固性坏死,以达到彻底治愈的目的,其区别主要在于产热的原理不同。射频消融是通过高频交流电振荡产热,而微波消融是通过微波带动身体极性分子运动产热。
人体是由许多有机物和无机物构成的复杂结构,体液中含有大量的电介质,如离子、水、胶体微粒等,人体主要依靠离子移动传导电流,而射频消融治疗是一种频率达到15万次/s的高频振动。在高频交流电的作用下,离子相互磨擦并与其它微粒相碰撞而产生生物热作用,因为肿瘤散热差,使肿瘤组织温度高于其邻近正常组织,加上癌细胞对高热敏感,而对正常细胞没有副作用发生。
在CT扫描等影像定位技术引导下,把微波热凝电极植入肿瘤瘤体,组织内的极性分子在微波场的作用下高速运动产生热量,当温度升到50~90 ℃时,肿瘤细胞的蛋白质变性凝固,导致其不可逆坏死。灭活的肿瘤组织可生产热休克蛋白,刺激机体的免疫系统,提高机体的免疫功能,达到抑制肿瘤细胞扩散的作用。
3 APC的经皮胰腺穿刺活组织检查术
3.1 适应证与禁忌证 适应证包括:胰腺穿刺活组织检查术适用于胰腺实性肿块、胰腺囊实性肿块、怀疑有弥漫性疾病等,以确定胰腺肿块性质,鉴别胰腺原发癌与转移癌等[12-15]。禁忌证包括:严重出血倾向者,急性胰腺炎、腹膜炎、皮肤感染、心肺功能差、大量腹水等。
3.2 准备
3.2.1 患者准备 穿刺前检测凝血时间、血小板计数、PT,其他常规检查。怀疑胰腺炎时测血、尿胰淀粉酶。咳嗽剧烈者,服用可待因片、阿桔片等镇咳剂;精神过于紧张者,服用艾司唑仑等镇静药;术前禁食24 h,并给予生长抑素(0.3 mg静脉维持24 h,或0.1 mg每8 h皮下注射)等持续静脉滴注或皮下注射抑制胰液分泌。
3.2.2 器械准备 穿刺活组织检查包,包括消毒手术洞巾、穿刺针(也可根据实际情况选用不同长度的16~18 g左右切割活组织检查针)、注射器、11号手术刀片、无菌试管、标本瓶、组织标本固定液、局麻药、止血药等。
3.3 方法
(1)根据CT扫描等影像定位技术显示的病变位置,穿刺路径选择皮肤至胰腺病变中央区最短距离,避开胰腺周围大血管及扩张的胆囊、胆总管。胰头、胰体病变多采用垂直方向进针,胰尾病变多采用水平或斜向进针。条件许可单位还可以在ROBIO等穿刺机器人协助下选择特殊进针路径,以最大程度减少周边正常脏器损伤,降低并发症发生率。
(2)细针负压针吸活组织检查时,经CT扫描等影像定位技术确认穿刺针尖的准确位置后,进行多点多向负压抽吸活组织检查,并在有经验的病理医师协助下,快速将穿刺抽吸物固定在福尔马林溶液内,做细胞离心,涂片染色等检查。也可使用同轴套管针反复穿刺抽吸数次。也可用切割穿刺针获取标本,置入福尔马林液送常规病理检查、免疫组织化学检查;新鲜组织可置入液氮罐或深低温冰箱送基因检测。
(3)术后穿刺局部压迫10 min后包扎。患者平卧1~2 h,观察脉搏、血压及有无剧烈腹痛等症状。细针负压针吸活组织检查术后一般观察2 h,如患者无特殊不适可回家休息。切割针穿刺活组织检查术后,继续禁食,使用生长抑素(0.3 mg静脉维持24 h,或0.1 mg每8 h皮下注射);患者无明显不适次日复查血尿淀粉酶,正常后方可进食。
3.4 注意事项 主要防止术中、术后消化道或腹腔出血,急性胰腺炎,胆汁性腹膜炎,胃肠道穿孔继发腹腔感染,肿瘤针道种植及胰瘘等并发症的发生。
4 APC的cTAI治疗
对于不能手术切除的APC,经动脉灌注化疗的局部药物浓度较静脉用药显著升高,在改善疾病相关症状、延长生存期、减少胰腺癌继发肝转移及已经出现肝转移的治疗均取得更好的治疗效果[1,16]。
4.1 适应证和禁忌证 适应证包括:(1)不能手术切除的APC[17-24];(2)已采用其他非手术方法治疗无效的胰腺癌;(3)胰腺癌伴肝脏转移;(4)胰腺癌术后复发。禁忌证包括:(1)对比剂过敏;(2)大量腹水、全身多处转移;(3)全身情况衰竭者,明显恶液质,ECOG评分>2分,伴多脏器功能衰竭;(4)有出血或凝血功能障碍性疾病不能纠正,有明显出血倾向者;(5)肝、肾功能差,超过正常参考值1.5倍的患者;(6)WBC<3.5×109/L,PLT<50×109/L。以上(1)~(3)为绝对禁忌证,(4)~(6)为相对禁忌证。
4.2 术前准备
(1)患者准备:穿刺部位备皮,术前禁食、禁水4 h。
(2)实验室检查:常规检查肿瘤标志物(CA19-9、CEA、CA72-4等)、血常规、肝肾功能、凝血功能、电解质等。以了解患者全身及主要脏器状况,判断有无治疗禁忌证,并用作疗效评价指标。
(3)影像学检查:完善心电图、胸部正侧位片检查。初次治疗且无病理诊断者,需胰腺超声和PET/CT等两种以上影像学检查,提示具有胰腺癌影像学特点,扫描范围应包括胰腺全部。
(4)术前签署知情同意书,告知风险及可能并发症。
(5)术前用药:灌注化疗前半小时给予非那根肌注镇静,5-HT3等止吐药静推止吐。
(6)器械准备:包括穿刺针、超滑导丝、导管鞘、导管、化疗药盒(皮下化疗药盒置入术使用)。常用导管包括:4~6 FRH,Cobra导管等以及微导管。
(7)用药方法:①以肿瘤药敏为指导;②无病理时,结合CT、MRI等影像学表现,参考UICC治疗胰腺癌经典方案,如吉西他滨、氟尿嘧啶等。吉西他滨等非时间依赖性药物灌注2 h左右,如氟尿嘧啶可采用500~700 mg/m2连续2 d持续性灌注化疗。
4.3 操作方法
(1)患者体位:患者取仰卧位。
(2)操作步骤:常规腹股沟区消毒铺巾,腹股沟局部麻醉,Seldinger’s法穿刺股动脉,放置动脉鞘,选择性动脉插管。选择性动脉插管方法[25]:将导管分别选择性置于腹腔动脉、肠系膜上动脉造影(造影持续至静脉期,观察静脉受侵情况),若可见肿瘤供血血管,则超选至供血动脉灌注化疗。改良区域灌注技术:超选至肠系膜上动脉的胰腺供血动脉,用微弹簧圈进行栓塞,使胰腺由腹腔动脉和其分支进行供血,该方法理论依据为经灌注药物的再分配,可减轻化疗药物对肠道的影响,提高疗效。若未见肿瘤供血动脉,则根据肿瘤部位、侵犯范围及供血情况确定靶血管,建议:胰头、胰颈部肿瘤经胃十二指肠动脉灌注化疗;胰体尾部肿瘤视肿瘤侵犯范围、血管造影情况,经腹腔动脉、肠系膜上动脉或脾动脉灌注化疗;伴肝转移者同时经肝固有动脉灌注化疗,若造影下见肝内转移瘤的血供较丰富,可给予栓塞治疗,栓塞剂可选用超液化碘油或颗粒栓塞剂,栓塞时应在透视下监视,以免误栓非靶器官。有学者[26]认为:动脉供血不丰富,可以栓塞非主要动脉后,再保留主要动脉进行动脉内灌注化疗。
(3)药物选择:可选用吉西他滨、氟尿嘧啶、四氢叶酸、伊立替康等,原则上不超过3联用药[27-29]。
(4)给药方式:可以术中一次冲击性灌注化疗,亦可持续性灌注化疗或采用热灌注化疗[30]。①一次冲击性灌注化疗可于术中完成,建议为吉西他滨800~1000 mg/m2,氟尿嘧啶500~700 mg/m2,四氢叶酸100 mg,单药或联合应用。可2~3 周重复,或疼痛治疗缓解后再发时重复。②持续性灌注化疗包括留置导管持续性灌注化疗和皮下灌注药盒系统置入术。持续性灌注化疗可选择细胞周期特异性药物和(或)非特异性药物,在用药方法、灌注时间等可计划性和可控性方面均优于单次冲击灌注化疗,灌注时间根据药物的特性决定,如氟尿嘧啶可采用500~700 mg/m2连续2 d持续性灌注化疗,重复周期同一次冲击性灌注化疗。③热灌注化疗是指将相应的依据肿瘤生理学特征以及药物敏感性试验所选择的化疗药物,在进行动脉内灌注化疗前将生理盐水加热到一定温度(如60 ℃)后,由动脉导管直接灌注,以增加肿瘤细胞对化疗药物的敏感性,有选择的杀伤肿瘤细胞而不伤及正常胰腺组织,延长患者生存期。
4.4 术后处理
(1)充分补液、保肝、对症治疗(止吐、退热等)3~5 d。
(2)必要时抗生素治疗。
(3)术后1周内复查肝肾功能、血常规、肿瘤标志物、血清淀粉酶等。
4.5 常见并发症
(1)与血管内操作相关的并发症包括:血肿、动脉夹层形成、动脉痉挛、闭塞等。
(2)与化疗药物相关的并发症包括:胰腺炎、恶心、呕吐、疼痛、发热、骨髓抑制、肝损伤、肾损伤等。
(3)与机体抵抗力下降和(或)药物相关并发症包括:消化道出血/应激性溃疡等。
4.6 疗效评价与随访要求[31-38]
(1)建议每个月随访1次。
(2)生活质量评价(QOL,推荐使用ECOG评分系统)和血常规、肝肾功能、肿瘤标志物及影像学检查。
4.7 护理
4.7.1 术前准备
(1)患者准备:解释手术目的,以取得合作。
(2)术前4 h不进固体或难以消化的食物。
(3)术前按医嘱用镇静剂及镇静镇吐药。
4.7.2 术后护理
(1)动脉留置导管的护理:插管成功后将导管鞘和导管固定在穿刺部位,只暴露出三通接头部分,连接电脑输液泵控制药物剂量持续给药,每日更换输液皮条一副,注意严格无菌操作,观察有无出血倾向。为避免导管移位,防弯曲,连接输液皮条处要固定妥当,并加强巡视。指导并协助患者家属定时为其按摩该侧下肢,穿刺点敷料隔日更换,严密观察有无渗液、出血及炎症反应,发现异常及时与医生联系。
(2)观察患者给药后的副反应:若有发热、消化道不适的症状,可按医嘱对症处理。
(3)术侧肢体的观察:严密观察术侧足背动脉搏动、肢体温度、色泽,询问患者是否有疼痛、麻木感觉。如果发现足背动脉搏动消失、皮肤苍白、远端肢体发冷等,立即采取相关措施。术侧制动期间指导患者进行踝关节和趾关节的活动。
(4)拔管后的护理:动脉灌注结束后拔管,术侧下肢严格制动,重点观察穿刺点周围有无出血、血肿,检查皮肤是否变硬、有无包块、足背动脉搏动及肢体末梢血液循环情况。穿刺处拔管后加压包扎,沙袋加压穿刺部位6、12 h松绷带,24 h后可下床活动。
5 APC的经皮125I粒子植入治疗
5.1 适应证与禁忌证 适应证包括:(1)APC介入治疗术后;(2)不能手术切除的,预计生存期>3个月的胰腺癌;(3)不愿意接受胰腺癌切除手术患者;(4)预计生存期<3个月,为缓解持续性上腹部疼痛;(5)原发胰腺肿瘤最大直径>5.0 cm者应慎重选择肿瘤减荷。禁忌证包括:(1)临床有明确证据证明胰腺肿瘤已广泛转移;(2)多器官功能衰竭者,不能接受放射粒子植入治疗;(3)胰腺恶性肿瘤合并胰腺炎症者,炎症急性期不能接受放射粒子植入治疗;(4)合并凝血功能障碍,经药物治疗,不能改善者;(5)合并严重糖尿病,经过降糖治疗,血糖不能控制在16.7 mmol/L以下者;(6)合并菌血症、脓毒血症者,不能接受放射粒子植入治疗。
5.2 放射治疗处方剂量以及TPS
5.2.1 放射治疗处方剂量及125I粒子活度、数量 推荐放射治疗处方剂量为110~160 mGy;125I粒子活度0.38~0.4 mCi/粒。粒子数量计算:Cevc`s公式:计算总粒子数=(长+宽+厚)/3×5÷每个粒子活度。
5.2.2 治疗计划系统(TPS) 设计依据:(1)CT及超声等影像,了解胰腺病灶大小、形态及与周边组织器官(如胰管、十二指肠、胃、门静脉等)的关系;(2)PET-CT了解胰腺肿瘤病灶功能范围。设计原则:(1)TPS设计穿刺途径避开重要血管、神经、淋巴引流区;(2)辐射覆盖胰腺肿瘤病灶功能范围,尽量辐射均匀,粒子分布均匀。
5.3 围手术期治疗
5.3.1 术前准备(一般情况)
(1)胰腺恶性肿瘤合并梗阻性黄疸者,建议先行经皮肝穿胆道引流术(percutaneous transhepatic cholangial drainage,PTCD)、经内镜逆行胰胆管造影(ERCP)(下行鼻胆引流或胆道支架置入术)等手术,解除胆道梗阻。同时予以保肝药物治疗,短时间内恢复肝功能至可以承受麻醉、手术水平。术前注意补充维生素K3。
(2)术前常规应用生长抑素2~3 d,3 mg肌肉注射,1次/d。
(3)其余术前准备与普通外科手术术前常规准备相同。
(4)125I粒子准备,术后辐射防护准备。
5.3.2 手术操作[39-40]
(1)体表放置标记网格后CT平扫,按照术前TPS设计穿刺途径,体表标记穿刺点。
(2)消毒、铺巾。
(3)按照计划穿刺后,CT扫面复查穿刺针位置,并适当调整。
(4)按照计划植入125I粒子,拔针。
(5)CT再次复扫,明确125I粒子数量及分布。
(6)行PET-CT扫描,了解125I粒子辐射分布是否符合TPS设计。如病灶仍有辐射冷区,可两周后,无并发症情况下行Ⅱ期125I粒子植入术。
5.3.3 术后观察及处理
(1)术后禁食6 h。
(2)术后观察患者一般生命体征情况,有无腹痛、腹胀;大便颜色。24 h内复查血尿淀粉酶、血脂肪酶,便常规及便隐血。如有腹腔引流,注意观察引流液是否较术前增多,可查术后腹腔引流液淀粉酶。
(3)如穿刺途径经过肝、胃、十二指肠等,术后预防性用抗生素1~3 d。用胃肠动力药及胃肠道黏膜保护剂、抑制胃酸分泌药物1周。
(4)术后预防性应用生长抑素3 d,3 mg肌肉注射,1次/d。
5.4 常见并发症
(1)胰瘘:为穿刺损伤胰管所致。按照急性胰腺炎美国国立综合癌症网络治疗原则进行治疗。术中穿刺应避免损伤主胰管。常规处理原则有:禁食、胃肠减压、抑制胰酶分泌药物、营养支持等。一般可治愈。
(2)胃肠道症状:常见症状有腹胀、恶心、呕吐、食欲减退等,持续时间长,并因为125I粒子辐射区域距离胃、十二指肠较近从而引起放射性炎症。以预防为主,在制订TPS时应注意控制辐射范围及处方剂量。应用胃肠动力药、胃肠道黏膜保护剂及胃酸抑制剂治疗,症状可在短时间内缓解。
(3)术后腹水:常见病因有①营养状况差,低蛋白血症;②粒子造成肿瘤及周围组织放射性炎症产生腹水;③肿瘤组织放射性水肿压迫门静脉引起门静脉回流不畅,导致门静脉压力增高产生腹水。予以充分营养支持及生长抑素治疗,腹水可缓慢吸收。
(4)粒子移位:粒子可能迁移至肝、肺等部位,系在穿刺过程中,粒子误入门静脉、下腔静脉所致,无需特殊处理。
(5)感染、大量出血、乳糜瘘等并发症,临床少见,对症处理后一般可治愈。
5.5 护理
5.5.1 术前护理
(1)协助做好各种术前检查:血、尿、便常规;出凝血时间;血肝、肾功能、血糖等生化指标;心电图。准备好患者的影像资料,B超、胸片、CT等。
(2)做好患者的心理护理(介绍治疗目的、方法、手术进程、疗效等)。
(3)备好局麻药物。
(4)术前注射非那根。根据医嘱,术前30 min给予非那根25 mg肌肉注射,带好病历,护送患者到数字减影血管造影机房。
5.5.2 术后护理
(1)注意观察穿刺点出血情况,保持伤口敷料的清洁、干燥,若被渗血、渗液污染,敷料要及时更换。
(2)注意观察穿刺局部有无感染发生。
(3)注意异位栓塞症状及周围组织有无损害。
(4)观察生命体征。
(5)做好放射性防护:①环境管理:术后患者应住单间或用铅衣防护,缩小其活动范围,减少与其他患者接触,保持室内空气流动,室温应控制在22~25 ℃,减少热气与散在射线结合污染环境。②人员管理:对护理人员进行护理操作及放射防护知识培训,医护工作人员需近距离治疗护理时,戴铅制防护围裙、防护颈脖、防护眼镜,或采用自制铅防护小中单,遮盖住患者的粒子植入部位,在保证工作质量的前提下,固定护理人员,尽可能集中完成各类护理操作,以减少与射线接触的时间。限制患者家属的探视时间及人员。③家庭护理:粒子植入4个月内与患者接触采取一定的防护措施,儿童孕妇不能与患者同住一个房间。
6 APC的经皮射频与微波治疗
6.1 适应证与禁忌证 适应证包括:(1)APC介入治疗术后;(2)不能手术切除的,预计生存期>3个月的胰腺癌患者;(3)不愿意接受胰腺癌切除手术患者;(4)预计生存期<3个月,为缓解持续性上腹部疼痛可慎重选择;(5)原发胰腺肿瘤最大直径>7 cm者应慎重选择减瘤治疗。禁忌证包括:(1)临床有明确证据表明胰腺肿瘤已广泛转移;(2)恶病质者,不能接受射频与微波治疗;(3)胰腺恶性肿瘤合并胰腺炎症者,炎症急性期不能接受射频与微波治疗;(4)合并凝血功能障碍,经药物治疗,不能改善者;(5)合并严重糖尿病,经过降糖治疗,血糖不能控制在15.6 mmol/L以下者;(6)合并菌血症、脓毒血症者,不能接受射频与微波治疗。
6.2 射频与微波的选择
6.2.1 射频与微波的功率确定 根据肿瘤直径大小、位置和内部结构,可以选择T20~T40的不同电极。有关电极的种类、数量、间距等见表2。
6.2.2 针数及手术途径的选择
(1)胰腺癌的射频消融术推荐CT定位下治疗(穿刺前可服用2%碘水100 ml,以显示胃肠道情况与肿瘤关系)或开腹直视手术。由于胰腺嵌于十二指肠及胃形成的“C”凹陷内,周围较多空腔脏器,故B超定位欠佳,CT由于其较好的分辨率在经皮穿刺路径中成为首选。开腹手术对患者创伤较大,并存在麻醉风险,但其优点在于术中可同时活组织检查明确病理,对易出现转移的腹腔脏器如肝脏等行探查术,对合并有胆道及十二指肠梗阻的患者可行旁路手术,改善梗阻症状,并可及时处理术中血管损伤、胆道损伤等并发症。

表2 射频与微波治疗胰腺癌的参量及相关参数
(2)穿刺方案应尽可能避开重要脏器、血管及正常管腔组织,如胰管、胆管。
(3)根据肿瘤大小确定消融电极数量,一般选择1~3针、间隔2.0 cm成等腰三角形排列。
(4)微波消融因其消融形态可控性差,须慎重选择。原发灶及转移灶直径>5.0 cm以上,可优先选用肿瘤减瘤治疗,推荐参考微波功率剂量范围为:70~90 W,消融时间为:12~15 min,建议每消融5 min左右进行病灶的定位扫描,以观察被消融病灶的改变,确定再次消融的时间长短。
6.3 围手术期治疗
6.3.1 术前准备(一般情况)
(1)胰腺恶性肿瘤合并梗阻性黄疸者,建议先行PTCD、ERCP等手术,解除胆道梗阻。同时予以保肝药物治疗,短时间内恢复肝功能至可以承受麻醉、手术水平。术前注意补充维生素K3。
(2)术前常规应用生长抑素2~3 d,3 mg肌肉注射,1次/d。
(3)其余术前准备与普通外科手术术前常规准备相同。
6.3.2 手术操作
(1)体表放置标记网格后CT平扫,按照术前设计穿刺途径,体表标记穿刺点,有条件采用穿刺机器人。
(2)消毒、铺巾。
(3)按照计划穿刺后,CT扫描复查穿刺针位置,并适当调整。
(4)按照设定功率及时间进行消融。
(5)CT再次复扫,明确活性病灶及有无出血等并发症。
(6)有条件科室可行PET-CT扫描,了解消融病灶是否达到完全消融。由于胰腺癌在射频消融过程中,消融部位疼痛较明显,如患者条件允许的情况下应术中给予全身及静脉麻醉。如是经皮穿刺消融,需要患者呼吸配合,可于射频针穿刺到位后,消融病灶前给予麻醉。
6.3.3 术后观察及处理
(1)术后禁食6 h。
(2)术后观察患者一般生命体征情况,有无腹痛、腹胀;大便颜色。24 h内复查血尿淀粉酶、血脂肪酶,便常规及便隐血。如有腹腔引流,注意观察引流液量是否较术前增多,可查术后腹腔引流液淀粉酶。
(3)如穿刺途径经过肝、胃、十二指肠等,术后预防性用抗生素1~3 d。用胃肠动力药及胃肠道黏膜保护剂、抑制胃酸分泌药物1周。
(4)术后预防性应用生长抑素3 d,3 mg 肌肉注射,1次/d。
6.4 常见并发症
(1)胰瘘:为穿刺损伤胰管所致。按照急性胰腺炎美国国立综合癌症网络治疗原则进行治疗。术中穿刺应避免损伤主胰管。常规处理原则有:禁食、胃肠减压、抑制胰酶分泌药物、营养支持等。一般可治愈。
(2)胃肠道症状:常见症状有腹胀、恶心、呕吐、食欲减退等,持续时间长,应用胃肠动力药、胃肠道黏膜保护剂及胃酸抑制剂治疗,症状可在短时间内缓解。
(3)术后腹水:予以充分营养支持及生长抑素治疗,腹水可缓慢吸收。
(4)感染、大量出血、乳糜瘘等并发症,临床少见,对症处理后一般可治愈。
6.5 护理
6.5.1 术前护理
(1)协助做好各种术前检查:血、尿、便常规;出凝血时间;血肝、肾功能、血糖等生化指标;心电图。准备好患者的影像资料,B超、胸片、CT等。
(2)按肿瘤不同部位做好相应术中准备(由数字减影血管造影机房护士准备)。
(3)做好患者的心理护理(介绍治疗目的、方法、手术进程、疗效等)。经腹全麻的病人术前禁食12 h。
(4)根据医嘱打术前针,带好病历,护送患者进机房。
6.5.2 术后护理
(1)根据病情监测生命体征及伤口出血情况,根据医嘱给予吸氧,补液用止血剂、抗生素等。穿刺处伤口敷料要保持清洁、干燥,如被渗血、渗液污染要及时更换,防止伤口感染的发生。
(2)根据术中麻醉方式选择卧位及饮食,全麻患者按全麻术后护理常规。经腹穿刺时因穿刺针经过胃肠道,故术后需禁食24 h。
(3)测体温连续8次,注意有无感染的发生。
(4)观察局部有无疼痛,经腹穿刺者观察其腹部体征,如有异常及时向医生汇报处理。
(5)注意患者皮肤有无烫伤表现。
7 APC常见并发症的临床处置[41-42]
7.1 梗阻性黄疸 原因为:胰头部肿瘤,肝门部淋巴结转移。处置策略包括:(1)PTCD,一般情况下可行内外引流,若肝门部梗阻严重者,可先行外引流3~7 d,梗阻部位炎症水肿消失后,再行内外引流。其优点是技术要求较简单,路径短,操作简便,容易推广。缺点是有损伤。(2)ERCP,一般情况下可行内外引流,若肝门部梗阻严重者,可先行外引流3~7 d,等梗阻部位炎症水肿消失后,再行内外引流。其优点是无创。其缺点是技术要求高,路径长,操作相对困难。(3)胆道支架植入,根据梗阻原因的不同,选择不同规格的支架,在肝功能基本恢复正常后植入支架。(4)有关PTCD、ERCP及胆道支架的具体要求和技术标准,参见其他专业委员会相关指南。
7.2 淋巴结转移 是指腹腔内淋巴结转移,单个或融合淋巴结累计直径>1.0 cm以上。处置策略包括:同本指南中胰腺癌及肝内转移病灶处理方法。
7.3 胃肠道梗阻 原因为:(1)腹腔内淋巴结转移压迫胃肠道;(2)胰腺癌病灶压迫;(3)胰腺癌术后吻合口狭窄。处置策略包括:(1)胃肠减压,置入胃肠营养管至胃肠道梗阻段远端3~7 d,梗阻部位炎症水肿消失后,再行支架植入。(2) 胃肠道支架植入,根据梗阻原因、部位的不同,选择不同规格的支架。(3)有关胃肠道支架的具体要求和技术标准,参见其他专业委员会相关指南。
7.4 顽固性疼痛 原因为:(1)腹腔内淋巴结转移压迫;(2)胰腺癌病灶压迫;(3)腹腔神经节受侵犯。处置策略包括:(1)射频消融;(2)腹腔神经节阻滞术;(3)疼痛阶梯治疗原则;(4)有关射频消融的具体要求和技术标准,参见其他专业委员会相关指南。
8 APC介入治疗方法的优化选择
APC患者应尽早对原发灶及转移灶同时进行cTAI联合物理治疗的综合治疗方法。cTAI能有效的控制胰腺癌的原发灶及转移灶,化疗方案应依据肿瘤细胞对化疗药物的敏感性确定,物理治疗包括原发及转移病灶的粒子、射频和微波治疗,具体方法选择应依据肿瘤的部位、血供及内部结构确定[43-45]。胰头部肿瘤以影像学引导下,经皮125I粒子植入治疗为主,体尾部肿瘤以影像学引导下,经皮射频、微波为主;肿瘤血供不丰富者,以物理治疗为主。在提高患者临床免疫力的前提下,cTAI应作为首选方法,物理治疗是其有效补充,二者可以交互、重复应用[46-49]。
8.1 持续性动脉内灌注化疗(cTAI) 导管留置位置,依据肿瘤的发病部位不同而异,胰头肿瘤,留置于十二指肠上、下动脉;胰体部肿瘤,留置于胰背动脉、胰横动脉;胰尾部肿瘤,留置于胰大动脉、交界动脉。化疗方案遵照以下原则:首先以肿瘤药敏实验报告为依据;其次,缺乏或无法取得无病理学诊断时,结合CT、MRI等影像学表现,参考国际抗癌联盟治疗经典方案进行。药物持续灌注时间:非时间依赖性药物(如吉西他滨等)2 h左右;时间依赖性药物(如5-氟尿嘧啶等)20 h左右。
8.2125I粒子植入 首先,明确肿瘤大小、形态、部位、邻近脏器解剖关系,确定穿刺路径;其次,TPS确定具体粒子数目及125I植入部位。治疗遵循以下原则:距病灶中心最近、邻近器官损伤最小、操作简便。除常规介入术前准备外,术前1 d禁食,生长抑素24 h持续静滴抑制和降低术后继发胰腺炎的发生率。CT引导下,完成活组织检查和植入125I粒子,术后CT确认粒子分布是否合乎设计方案,有无缺失或移位,同时明确有无局部血肿及其他器官损害。术后继续禁食、生长抑素24 h持续静滴,予以静脉营养支持及止血治疗1~3 d;观察血压、腹痛、淀粉酶等变化。
8.3 射频/微波治疗 首先,明确肿瘤大小、形态、部位、邻近脏器解剖关系;其次,确定用针数量、穿刺路径;第三,依据影像学肿瘤大小和内部结构,确定射频/微波治疗的功率和时间。治疗遵循以下原则:距病灶中心最近、邻近器官损伤最小、操作简便。退针过程中,要适当灼烧封闭针道,以减少针道出血、防止肿瘤种植转移。其他围手术处理同粒子植入。
8.4 介入治疗策略 APC患者,cTAI是首选治疗手段,cTAI治疗后存在以下表现:(1)肿瘤病灶继续增大;(2)瘤体不能持续缩小;(3)患者体质不能耐受,应考虑运用125I粒子植入、射频或微波消融治疗。
8.5 粒子、射频和微波的选择原则
(1)为了避免损伤胰管、胆管及邻近十二指肠降段,胰头部肿瘤多选用125I粒子植入。
(2)体尾部肿瘤,可选用cTAI-125I粒子植入-cTAI模式,或cTAI-射频/微波消融-cTAI模式;也可选用cTAI-射频/微波消融后,部分残余病灶再加用125I粒子植入模式。
9 APC的介入治疗的随访与疗效监测方法
9.1 临床疗效
9.1.1 一般资料比较 本资料总结6家三级甲等医院(包括哈尔滨医科大学附属肿瘤医院、山东大学第二医院、兰州大学第一附属医院、贵州医科大学附属医院、丽水市中心医院和同济大学附属第十人民医院)2009年1月-2014年12月的相关资料,符合入组标准患者610例,其中失访19例,失访率为3.11%。在入组的患者中男370例、女240例,平均(67.24±12.46)岁(28~90岁),随机分为对照组(常规静脉化疗)、cTAI组(cTAI治疗)和cTAI联合组[cTAI联合物理治疗(包括原发灶及转移病灶的粒子、射频、微波治疗)]。患者治疗前一般资料见表3。治疗前组间在肿瘤体积、肾功能状态等方面均衡性良好,其中梗阻性黄疸和腹水存在差异,原因是对照组与cTAI组治疗动脉内持续性灌注化疗必须要求肝功能恢复正常或基本正常。
9.1.2 3组患者总体生存期分析 统计结果显示对照组、cTAI治疗组、cTAI联合组患者治疗后的总体生存时间分别为(6.13±5.40)个月、(10.52±8.17)个月和(13.80±8.86)个月,3组间存在明显的统计学差异(log-rank检验,P<0.001)(图1)。
9.1.3 改良实体瘤疗效评价标准分析 3组间临床缓解率比较分析,对照组临床缓解率为17.7%,cTAI组为41.9%,cTAI联合组为47.5%,进一步组间两两对照的分析显示,3组间总体临床缓解率表现出显著的优势(χ2检验,P<0.001)。其中,cTAI组及cTAI联合组缓解率明显高于对照组(表4)。

表3 3组患者治疗前一般资料比较
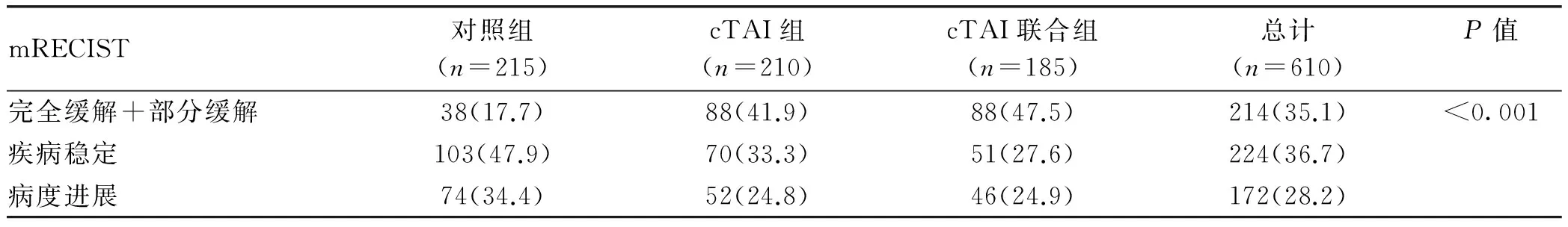
表4 3组间临床缓解率比较[例(%)]

表5 6、12、18个月3组间生存率比较[例(%)]

图1 生存曲线
9.1.4 3组生存率比较 3组间6、12、18个月的生存率比较显示,cTAI组、cTAI联合组比对照组表现出显著优势(χ2检验,P值均<0.001)(表5)。
9.2 与国内外同类研究的比较
9.2.1 cTAI与常规化疗比较 本研究对照组的总生存时间为(6.13±5.40)个月,其临床疗效与文献报导基本一致,无统计学差异(χ2检验,P>0.05)。本研究中的cTAI组的总生存时间为(10.52±8.17)个月,其临床疗效优于对照组,且具有统计学差异(χ2检验,P<0.05)。
9.2.2 cTAI联合物理治疗与单纯物理治疗的比较 美国东部合作肿瘤小组近期的一项回顾性临床试验研究[32]提示,APC单纯物理治疗的总生存时间为7.1个月,本研究cTAI联合组的总生存时间为(13.80±8.86)个月,其临床疗效明显优于文献报导的单纯物理治疗的临床疗效(χ2检验,P<0.05)。
9.2.3 cTAI联合物理治疗与常规化疗联合物理治疗的比较 本研究cTAI组总生存时间为(13.80±8.86)个月,美国东部合作肿瘤小组得出的常规化疗联合物理治疗总生存时间为9.2个月[32],cTAI联合组的临床疗效明显优于文献报导的常规化疗联合物理治疗的临床疗效(χ2检验,P< 0.05)。
10 小结
综上所述,对于不能手术切除的APC患者,cTAI、125I粒子植入、射频和微波消融等介入治疗是很好的选择。根据肿瘤大小、形态、部位、邻近脏器解剖关系等,选择一种或多种介入治疗方法,可有效提高APC患者的总体生存期和生存质量。随着纳米技术、基因技术、分子影像学技术及分子介入治疗学技术的不断发展,APC的疗效将进一步提高。
11 致谢
首先感谢中国癌症研究基金会介入医学委员会,对本次制订指南的大力支持与关怀;其次,感谢中国医学科学院肿瘤医院等27家国内三级甲等医院单位大力协助;最后,感谢45位国内从事胰腺癌介入治疗相关方向著名专家的共同撰写与反复修改,使本指南得到日臻完善;以期规范APC介入治疗的临床操作与标准,从整体上提高治疗水平,改善患者的生活质量、延长生存时间。
编写委员会单位及专家:中国医学科学院肿瘤医院(李肖、李槐);天津市肿瘤医院(郭志、于海鹏);浙江省肿瘤医院(邵国良);江苏省肿瘤医院(陈世唏);哈尔滨医科大学附属肿瘤医院(刘瑞宝);中山大学附属肿瘤医院(张福军);四川省肿瘤医院(许国辉);湖南省人民医院(向华);贵州医科大附属医院(周石);兰州大学第一医院(王文辉);东南大学附属中大医院(滕皋军、郭金和);中国医科大学附属第一医院(徐克、钟红珊、苏洪英);山东大学第二医院(李玉亮);珠海市人民医院(陆骊工);昆明医科大学第二附属医院(王家平);济宁医学院附属医院(乔元岗);浙江丽水市中心医院(纪建松);苏州大学附属第一医院(倪才方、朱晓黎);新疆医科大学第一附属医院(任伟新);中国人民解放军济南总医院(孙钢);第二军医大学附属长征医院(董伟华、肖湘生);复旦大学附属中山医院(王建华、颜志平、王小林);上海交通大学附属第六人民医院(程英升);上海交通大学医学院附属瑞金医院(王忠敏);上海交通大学附属同仁医院(茅爱武);第二军医大学附属长海医院(杨继金);同济大学附属第十人民医院(李茂全、曹传武、吕中伟、张家兴、刘占举、宋振顺、王实、曾莉);学术秘书:李雪、韩世龙。
[1] EDGE SB,FRITZ AG,BYRD DR,et al.Purpose and principles of cancer staging and staging forms.cancer staging manual (chapter 1)[M].7th ed.American Joint Committee on Cancer,2010.
[2] SOBIN LH,GOSPODAROWICZ MK,WITTEKIND C,et al.TNM classification of malignant tumours[M].7th ed.Chichester,West Sussex,UK; Hoboken,NJ:Wiley-Blackwell,2010.
[3] CHEN W,ZHENG R,BAADE PD,et al.Cancer Statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[4] FURUKAWA H,OKADA S,SAISHO H,et al.Clinicopathologic features of small pancreatic adenocarcinoma.A collective study[J].Cancer,1996,78(5):986-990.
[5] HIDAGOM M.Pancreatic cancer[J].N Engl J Med,2010,362(17):1605-1617.
[6] BRUGGE WR.Endoscopic ultrasonography:the current status[J].Gastroenterology,1998,115(6):1577-1583.
[7] Group of Pancreas Surgery,Chinese Society of Surgery,Chinese Medical Association.Guidelines for the management of pancreatic cancer(2014)[J].J Clin Hepatol,2014,30(12):1240-1245.(in Chinese) 中华医学会外科学分会胰腺外科学组.胰腺癌诊治指南(2014)[J].临床肝胆病杂志,2014,30(12):1240-1245.
[8] Group of Pancreas Surgery,Chinese Society of Surgery,Chinese Medical Association.Expert consensus on prevention and treatment of common surgical complications after pancreatic operation(2010)[J].Chin J Surg,2010,48(18):1365-1368.(in Chinese) 中华医学会外科学分会胰腺外科学组.胰腺术后外科常见并发症预防及治疗的专家共识(2010)[J].中华外科杂志,2010,48(18):1365-1368.
[9] NI QX,YU XR,LIU L.Discussion for the clinical definition of pancreatic cancer in China[J].China Oncol,2012,22(2):81-87.(in Chinese) 倪泉兴,虞先濬,刘亮.中国胰腺癌临床诊断标准的探讨[J].中国癌症杂志,2012,22(2):81-87.
[10] SHI HB,YANG MJ,WANG XL,et al.Feeding arteries of advanced pancreatic cancer:evaluation of 218 patients by digital subtract angiography[J].Clin Med J China,2014,21(1):61-62.(in Chinese) 施惠斌,杨敏捷,王小林,等.晚期胰腺癌患者的肿瘤血供来源:218例患者的DSA评价[J].中国临床医学,2014,21(1):61-62.
[11] SCHACHTER P,AVNI Y,GVIRZ G.The impact of laparoscopy and laparoscopic ultrasound on the management of pancreatic cystic lesions[J].Arch Surg,2000,135(3):260-264.
[12] HESS V,GLIMEUS B,GRAWE P,et al.CA 19-9 tumourmarker response to chemotherapy in patients with advanced pancreatic cancer enrolled in a randomised controlled trial[J].Lancet Oncol,2008,9(2):132-138.
[13] MAITHELS K,MALONEY S,WINSTON C,et al.Preoperative CA 19-9 and the yield of staging laparoscopy in patients with radiographically resectable pancreatic adenocarcinoma[J].Ann Surg Oncol,2008,15(12):3512-3520.
[14] TAKAHASHI H,OHIASHI H,ISHIKAWA O,et al.Serum CA19-9 alterations during preoperative gemcitabinebased chemoradiation therapy for resectable invasive ductal carcinoma of the pancreas as an indicator for therapeutic selection and survival[J].Ann Surg,2010,251(3):461-469.
[15] GOONNETILLEKE KS,SIRWARDENA AK.Systematic review of carbohydrate antigen (CA 19-9) as a biochemical marker in the diagnosis of pancreatic cancer[J].Eur J Surg Oncol,2007,33(3):266-270.
[16] TEMPERO MA,MALAFA MP,M AL-HAWARY,et al.NCCN Guidelines Version 2.2016 Pancreatic Adenocarcinoma Version 2[C].2016,08/16/16© National Comprehensive Cancer Network,Inc.2016.
[17] NIMURA Y,NAGINO M,TAKAO S,et al.Standard versus extended lymphadenectomy in radical pancreatoduodenectomy for ductal adenocarcinoma of the head of the pancreas.Long-term results of a Japanese multicenter randomized controlled trial[J].J Hepatobiliary Pancreat Sci,2012,19(3):230-241.
[18] JANG JY,KANG MJ,HEO JS,et al.A prospective randomized controlled study comparing outcomes of standard resection and extended resection,including dissection of the nerve plexus and various lymph nodes,in patients with pancreatic head cancer[J].Ann Surg,2014,259(4):656-664.
[19] SIEGEL R,MA J,ZOU Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[20] National Cancer Network.Clinical practice guidelines in oncology.pancreatic adenocarcinoma.version 2[EB/OL].(2014)[2015-02-01].http://www.nccn.org/professionals /physician_ gls/f_guidelines.asp.
[21] TOL JA,GOUMA DJ,BASSI C,et al.Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma:A consensus statement by the International Study Group on Pancreatic Surgery (ISGPS)[J].Surgery,2014,156(3):591-600.
[22] BOCKHORN M,UZUNOGLU FG,ADHAM M,et al.Borderline resectable pancreatic cancer:a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS)[J].Surgery,2014,155(6):977-988.
[23] HARTWIG W,VOLLMER CM,FINGERHUT A,et al.Extended pancreatectomy in pancreatic ductal adenocarcinoma:definition and consensus of the International Study Group for Pancreatic Surgery (ISGPS)[J].Surgery,2014,156(1):1-14.
[24] ASBUN HJ,CONLON K,FERNANDEZ-CRUZ L,et al.When to performa pancreatoduodenectomy in the absence of positive histology? A consensus statement by the International Study Group of Pancreatic Surgery[J].Surgery,2014,155(5):887-892.
[25] Interventional Organization,Radiology Branch,Chinese Medical Association,China.Guide to intra-arterial infusion chemotherapy for pancreatic cancers (draft text)[J].J Intervent Radiol,2012,21(5):353-355.(in Chinese) 中华医学会放射学分会介入学组.胰腺癌经动脉灌注化疗指南(草案)[J].介入放射学杂志,2012,21(5):353-355.
[26] Japan Pancreas Society.Classification of pancreatic carcinoma[M].2nd English ed.Tokyo:Kanehara & Co,Ltd,2003.
[27] PHILIP PA,BENEDETTI J,CORLESS CL,et al.Phase Ⅲ study comparing gemcitabine plus cetuximab versus gemcitabine in patients with advanced pancreatic adenocarcinoma:Southwest Oncology Group directed intergroup trial S0205[J].J Clin Oncol,2010,28(22):3605-3610.
[28] KINDLER HL,NIEDZWIECKI D,HOLLIS D,et al.Gemcitabine plus bevacizumab compared with gemcitabine plus placebo in patients with advanced pancreatic cancer:phase Ⅲ trial of the Cancer and Leukemia Group B (CALGB 80303)[J].J Clin Oncol,2010,28(22):3617-3622.
[29] MOORE MJ,GOLDSTEIN D,HAMM J,et al.Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer:a phase Ⅲ trial of the National Cancer Institute of Canada Clinical Trials Group[J].J Clin Oncol,2007,25(15):1960-1966.
[30] TANAKA T,SAKAGUCHI H,SHO M,et al.A novel interventional radiology technique for arterial infusion chemotherapy against advanced pancreatic Cancer[J].AJR Am J Roentgenol,2009,192(2):168-177.
[31] CONROY T,DESSEIGNE F,YCHOU M,et al.FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J].N Engl J Med,2011,364(19):1817-1825.
[32] KULKE MH,TEMPERO MA,NIEDZWIECKI D,et al.Randomized phase II study of gemcitabine administered at a fixed dose rate or in combination with cisplatin,docetaxel,or irinotecan in patients with metastatic pancreatic cancer:CALGB 89904[J].J Clin Oncol,2009,27(3):5506-5512.
[33] CUNNINGHAM D,CHAU I,STOCKEN DD,et al.Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer[J].J Clin Oncol,2009,27(33):5513-5518.
[34] LOUVET C,LABIANCA R,HAMMEL P,et al.Gemcitabine in combination with oxaliplatin compared with gemcitabine alone in locally advanced or metastatic pancreatic cancer:results of a GERCOR and GISCAD phase III trial[J].J Clin Oncol,2005,23(15):3509-3516.
[35] OETTLE H,RICHARDS D,RAMANATHAN RK,et al.A phase III trial of pemetrexed plus gemcitabine versus gemcitabine in patients with unresectable or metastatic pancreatic cancer[J].Ann Oncol,2005,16(10):1639-1645.
[36] ABOU-ALFA GK,LETOURNEAU R,HARKER G,et al.Randomized phase III study of exatecan and gemcitabine compared with gemcitabine alone in untreated advanced pancreatic cancer[J].J Clin Oncol,2006,24(27):4441-4447.
[37] TEMPERO M,PLUNKETT W,RUIZ van HAPEREN V,et al.Randomized phase II comparison of dose-intense gemcitabine:thirty-minute infusion and fixed dose rate infusion in patients with pancreatic adenocarcinoma[J].J Clin Oncol,2003,21(18):3402-3408.
[38] MENON KV,GOMEZ D,SMITH AM,et al.Impact of margin status on survival following pancreatoduo-denectomy for cancer:the Leeds Pathology Protocol (LEEPP)[J].HPB (Oxford),2009,11(1):18-24.
[39] XU YC,ZHAO TJ,QIAN ZF,et al.CT-guided percutaneous implantation of125I seed for carcinoma of head of pancreas[J].Chin J Min Inv Surg,2013,13(10):865-868.(in Chinese) 徐元昌,赵铁军,乔占峰,等.CT引导经皮穿刺125I粒子植入治疗胰头癌[J].中国微创外科杂志,2013,13(10):865-868.
[40] LU J,WANG ZM,CHEN KM.CT-guided radioactive125I-seed implantation for the treatment of pancreatic carcinoma:a clinical observation of 19 cases[J].J Intervent Radiol,2010,19(7):550-553.(in Chinese) 陆健,王忠敏,陈克敏.CT导引下植入125I粒子治疗19例晚期胰腺癌的疗效观察[J].介入放射学杂志,2010,19(7):550-553.
[41] LUNDIN J,ROBERTS PJ,KUUSELA P,et al.Prognostic significance of serum CA242 in pancreatic cancer.A comparison with CA19-9[J].Anticancer Res,1995,15(5B):2181-2186.
[42] BALZANO G,di CARLO V.Is CA 19-9 useful in the management of pancreatic cancer?[J].Lancet Oncol,2008,9(2):89-91.
[43] LIU LX,WANG JH,WANG XL,et al.Treatment of advanced pancreatic cancer by transarterial infusion of gemcitabine[J].Chin Comput Med Imag,2007,13(3):202-207.(in Chinese) 刘凌晓,王建华,王小林,等.中晚期胰腺癌动脉灌注吉西他滨化疗的疗效分析[J].中国医学计算机成像杂志,2007,13(3):202-207.
[44] SHI HF,JIN ZY,ZHOU ZQ,et al.Transarterial infusion chemotherapy with a combination of gemcitabine and 5-fluorouracil in advanced pancreatic carcinoma[J].Chin J Radiol,2002,36(12):1072-1074.(in Chinese) 石海峰,金征宇,周智强,等.经动脉灌注盐酸吉西他滨和5-氟尿嘧啶治疗中晚期胰腺癌的疗效分析[J].中华放射学杂志,2002,36(12):1072-1074.
[45] HUANG J,TIAN DH,ZHANG J,et al.Therapeutic effects of gemcitabine regional artery perfusion combined with systemic chemotherapy for late-stage cancer of pancreas[J].Chin J Gen Surg,2007,16(5):471-473.(in Chinese) 黄洁,田大广,张捷,等.吉西他滨区域性动脉灌注联合全身化疗治疗晚期胰腺癌[J].中国普通外科杂志,2007,16(5):471-473.
[46] LIU LX,WANG JH,WANG XL,et al.A retrospective analysis of patients with unresectable pancreatic cancer treated with combined transarterial intervention and three dimensional conformal radiotherapy[J].China Oncol,2011,21(1):46-51.(in Chinese) 刘凌晓,王建华,王小林,等.介入治疗联合三维适形放疗治疗不能手术切除的胰腺癌患者疗效分析[J].中国癌症杂志,2011,21(1):46-51.
[47] VINCENT A,HERMAN J,SCHULICK R,et al.Pancreatic cancer[J].Lancet,2011,378(9791):607-620.
[48] LI D,XIE K,WOLFFR R,et al.Pancreatic cancer[J].Lancet,2004,363(9414):1049-1057.
[49] BERGER AC,GARCIA M Jr,HOFFMAN JP,et al.Postresection CA 19-9 predicts overall survival in patients with pancreatic cancer treated with adjuvant chemoradiation:a prospective validation by RTOG 9704[J].J Clin Oncol,2008,26(36):5918-5922.
引证本文:Committee of Interventional Medicine,Cancer Foundation of China.Clinical practice guidelines for the interventional treatment of advanced pancreatic carcinoma (on trial)[J].J Clin Hepatol,2017,33(2):221-232.(in Chinese)
中国癌症研究基金会介入医学委员会.晚期胰腺癌介入治疗临床操作指南(试行)[J].临床肝胆病杂志,2017,33(2):221-232.
(本文编辑:林 姣)
Clinical practice guidelines for the interventional treatment of advanced pancreatic carcinoma (on trial)
CommitteeofInterventionalMedicine,CancerFoundationofChina
pancreatic neoplasms; interventional treatment; practice guideline
10.3969/j.issn.1001-5256.2017.02.003
2016-12-22;
2016-12-22。
李茂全,电子信箱:cjr.limaoquan@vip.com。
R735.9
B
1001-5256(2017)02-0221-12
