极大螺旋藻高光合速率藻种的紫外诱变筛选
2017-02-08杨生辉祖廷勋罗光宏王丹霞陈天仁高自成
杨生辉,祖廷勋,罗光宏,*,王丹霞,陈天仁,高自成
极大螺旋藻高光合速率藻种的紫外诱变筛选
杨生辉1,祖廷勋1,罗光宏1,*,王丹霞1,陈天仁1,高自成2
(1.河西学院凯源生物中心,甘肃省微藻工程技术研究中心,甘肃省河西走廊特色资源利用重点实验室,甘肃 张掖 734000;2.张掖市生产力促进中心,甘肃 张掖 734000)
目的:筛选高光合速率极大螺旋藻藻种。方法:结合自然分离筛选、超声处理、紫外诱变和高CO2条件胁迫等方法进行诱变筛选。结果:得到3 株极大螺旋藻突变株KYZ1、KYZ2、KYZ3,通过藻丝形态、生长量、CO2利用率、蛋白质含量、叶绿素含量等因素对比,并采用综合评分法,筛选出1株优质藻株KYZ2。结论:与出发藻株相比具有藻丝长度均明显变长、藻丝个体大、生长速度快、光合速率高、蛋白质和叶绿素含量高等优点,是一株具有工业养殖潜力的藻株。
极大螺旋藻;紫外诱变;突变藻株
螺旋藻(Spirulina)是一种螺旋状、不分枝的多细胞丝状微藻(Microalga),藻体长200~500 μm,宽5~10 μm,系蓝藻门(Cyanophyta)、段殖体目(Hormogonales)、颤藻科(Oscilatoriaceae)、螺旋藻属(Spirulina)的古老低等原核生物[1]。它含有丰富蛋白质、不饱和脂肪酸和各种维生素等多种营养成分,具有极高的营养保健价值。同时螺旋藻中还含有多种生物活性物质,具有增强机体免疫功能、防治癌症、降低血脂、减肥等多种临床功效[2-4]。
20世纪90年代初以来,螺旋藻已成为全球范围内产业开发最为成功的微藻[5]。目前螺旋藻的产业化培养中应用的碳源主要是NaHCO3,张峰等[6]的研究表明:CO2替代NaHCO3,不仅使碳源成本减少58%、产量提高20%,还可使铅、砷、汞等重金属元素含量远远低于利用NaHCO3作碳源生产的螺旋藻的重金属含量。对于生产而言,优良的螺旋藻藻种是关键。目前螺旋藻的诱变育种主要集中于耐低温、富含某种功能成分等方面,尚鲜见对高光合速率螺旋藻藻种进行诱变育种的报道。本研究采用超声处理极大螺旋藻,制备单细胞悬液,用紫外线对该单细胞体进行诱变,并利用高浓度CO2进行胁迫处理,筛选获得优良的高光合速率极大螺旋藻藻种。
1 材料与方法
1.1 材料与培养基
极大螺旋藻(Spirulina maxima Setch. et Gardn)藻种:KY1,本实验室保存。
液体培养基为本实验室改进型的Zarrouk培养基。实验培养基为改进型的Zarrouk培养基配方中不添加NaHCO3,其他成分不变。因pH 9.0~10.0是螺旋藻最适生长pH值,而pH值低于9.3会影响CO2的吸收速率[7],因此用NaOH调节pH值为9.5。
1.2 仪器与设备
SY-200型超声处理器 上海宁商超声仪器有限公司;DR6000紫外-可见分光光度计 美国哈希公司;SP-1500型喷雾干燥机 上海顺义实验设备有限公司。
1.3 方法
1.3.1 藻丝单丝筛选扩大培养
培养7 d螺旋藻培养液,用培养基稀释50 倍,在40 倍体式显微镜下用挑针挑取健壮、长度较长、形态规则的单株藻丝,放入含适量培养基的试管中培养30 d,培养条件:光照3 000 lx、温度25~27 ℃、光暗周期14∶10;再加入少量新鲜培养基,继续培养15 d。转入250 mL三角瓶加入50 mL新鲜培养基培养7 d,再加入50 mL新鲜培养基继续培养7 d,培养条件:光照8 000 lx、温度30~32 ℃、光暗周期14∶10。筛选出生长速度较快的1 株作紫外诱变的出发藻株。前期为单丝培养,强光容易造成藻体灼伤死亡,选择弱光和中温,有利于生长繁殖;后期藻丝体数量增加,相互间有光遮蔽效应,选择较高的光强和温度,更有利于生长。
1.3.2 CO2胁迫预实验
培养好的藻液过滤,藻体用实验培养基清洗,接入1 000 mL三角瓶,加入500 mL实验培养基,用橡皮塞密封,于光照8 000 lx、温度30~32℃、光暗周期14∶10的条件下培养10 d。分别通入含0.25%、0.5%、0.75%、1% CO2的空气(质量分数),通气频率2 s/min(光周期),流量为0.2~0.25 L/min,设置3 个平行,根据藻体对CO2的利用率,确定实验通入空气的CO2含量。
1.3.3 单细胞液制备
取生长期6~7 d的极大螺旋藻培养液5 mL,在冰浴条件下,利用20 kHz、200 W的超声细胞破碎仪处理藻体,使藻丝体断裂。超声处理1、2、4、8、10 s,显微镜观察处理效果。使藻丝体断裂成1~3 个细胞长度的藻丝段为最佳。
1.3.4 紫外诱变
取超声处理最好的一组,用培养基调节螺旋藻细胞密度为106~107CFU/mL,将8 mL单细胞悬液置于无菌直径10 mm培养皿中,厚度约1 mm,用紫外灯进行远紫外线辐照,照射时间分别为0、30、60、90、120、150 s,紫外灯功率为20 W,样品与紫外灯的距离为20 cm。
1.3.5 突变藻株筛选
将紫外辐照后的藻悬液在暗处静置24 h,加入10 倍体积实验培养基,移入250 mL三角瓶,用橡皮塞密封,根据预实验结果通入含1% CO2的空气,通气频率2 s/min(光周期),流量为0.2~0.25 L/min,于光照8 000 lx、温度30~32 ℃、光暗周期14∶10的条件下培养,隔日显微镜观察一次;挑选形态和长度恢复较快的单株藻丝段于试管中加适量实验培养基,并通入预实验确定的含CO2的空气,通气频率2 s/h(光周期),流量为0.1~0.15 L/min,于光照3 000 lx、温度25~27 ℃、光暗周期14∶10的条件下培养。在此条件下进行反复筛选,根据生长期内平均生长速率挑选高光合速率的突变藻株。
1.3.6 突变藻株培养
筛选出的藻株,移入1 000 mL三角瓶,加入500 mL实验培养基,用橡皮塞密封,根据预实验结果通入含CO2的空气,通气频率2 s/min(光周期),流量为0.2~0.25 L/min,于光照8 000 lx、温度30~32℃、光暗周期14∶10的条件下培养10 d。同时以出发藻株做对比实验。
1.3.7 CO2用量计算
CO2用量/g=通气频率×流量×通气时间×通入空气中CO2含量×1.977 (1)
式中:1.977为CO2密度/(g/L)。
1.3.8 指标测定
1.3.8.1 形态特征观测
镜检观察测定突变株藻体长、螺旋宽、螺距、藻丝宽、螺旋数,每个参数测定50 条藻丝。
1.3.8.2 生长量的测定
取突变藻株培养液3 mL,紫外-可见分光光度计测定560 nm波长处吸光度(A560nm)。
1.3.8.3 CO2利用率的测定
根据李夜光等[8]测定螺旋藻对CO2利用率测定的方法,按公式(2)计算CO2的利用率。

式中:C为CO2的利用率/%;B为干藻量/g;Qg为CO2用量/g;0.47为螺旋藻含碳量系数;0.27为CO2含碳量系数。
1.3.8.4 蛋白质含量的测定
参照GB 5009.5—2010《食品中蛋白质的测定》第一法。
1.3.8.5 叶绿素含量的测定
将突变藻株和出发藻株用带盖的5 L广口瓶(装液量4 L),按1.3.6节条件培养10 d,用300 目尼龙网过滤清洗采收,利用SP-1500型实验喷雾干燥机干燥成粉,干燥条件:进风温度150 ℃、出风温度60 ℃。称取3.0 g螺旋藻粉,在45 ℃避光条件下烘干1.5 h, 然后置干燥器中冷却至室温,精确称取0.050 g藻粉样品于50 mL的具塞玻璃刻度试管中,加入20 mL浸提液(85%丙酮-95%乙醇体积比1∶1),34 ℃恒温避光浸提6 h,每隔2 h搅动3~5 min,静置后沉淀30 min,浸出浸提液于25 mL的棕色容量瓶中,用浸提液定容于刻度线,并记录定容液的体积(mL)。以浸提液作空白,用带塞的1 cm的玻璃比色皿在652 nm波长处测定吸光度(A652nm),根据公式(3)、(4)计算叶绿素含量。

式中:C为测定液中叶绿素含量/(mg/L);V为色素提取丙酮和乙醇混合液的体积/mL;N为测定叶绿素时稀释倍数;M为样品的质量/g。
1.3.8.6 综合评价
参照胡海燕等[9]的综合评价方法,以螺旋藻的蛋白质含量和生长速率为评价指标,权重系数分别设为0.6和0.4,按公式(5)进行评分,对突变藻株进行综合评价。
1.3.8.7 突变藻株的传代稳定性分析
将确定的优良突变藻株接入新鲜实验培养基,按1.3.6节方法连续培养10代,对第10代藻株用1.3.8.1节方法观测形态特征、用1.3.8.2节方法测定其生长量、用1.3.8.4节方法测定其蛋白质含量、用1.3.8.5节方法测定叶绿素含量,与第1代突变藻株比较。
1.4 数据处理
数据采用Excel结合SPSS软件进行处理。
2 结果与分析
2.1 CO2胁迫预实验结果
出发藻株按1.3.2节方法培养,通入空气中CO2含量不同,采收的干藻量和CO2利用率不同,结果见表1。

表1 出发藻株CO2胁迫预实验结果Table1 Biomass and CO2 utilization rate of the parental strain under extremely highh CO2 conditiioonnss
由表1可知,通入空气中的CO2含量为0.25%时,CO2利用率最高,但收获的干藻量较少,可能是CO2含量较少,不能满足藻体光合作用需要导致;随着空气中CO2的含量升高,收获的干藻量逐渐增加,但CO2的利用率降低;当空气中CO2的含量达到0.75%时,收获的干藻量和CO2的利用率均降低,可能是极大螺旋藻对高浓度CO2的培养环境不适应造成的,为了得到在高CO2质量分数条件下高光合速率的突变藻株,选择实验CO2质量分数为1%。
2.2 超声处理对藻细胞的影响
采用超声处理使螺旋藻藻丝体破碎成1~3 个细胞的藻丝段,通过镜检不同处理时间的藻液发现,以超声处理8 s效果最好,仅有少量细胞破碎;而超声处理时间过短,螺旋藻丝状体仅断裂成稍短的藻丝段;处理时间过长,螺旋藻细胞则完全破碎。因此超声处理时间为8 s。
2.3 突变藻株形态特征
突变藻株经多次筛选和传代培养,获得了3株生长速度较快藻株,编号为KYZ1、KYZ2、KYZ3。按1.3.8.1节方法镜检观察,发现藻丝形态发生变异:藻丝长度变化明显、藻丝宽度和螺旋数量增加,测定结果见表2。而较大形体使螺旋藻藻丝体更易被过滤采收,因此藻丝体变长是理想特征之一。

表2 出发藻种和突变藻种主要形态特征比较Table2 Comparison of the main morphological characteristics between the parental strain and the mutants
2.4 突变藻株与出发藻株生长速度比较
突变藻株与出发藻株相比,不但形态有明显差异,生长速度也发生了明细变化,用实验培养基,通入含1% CO2的空气,按1.3.6节方法培养10 d,用1.3.8.2节方法每2 d测定A560nm,结果见图1。
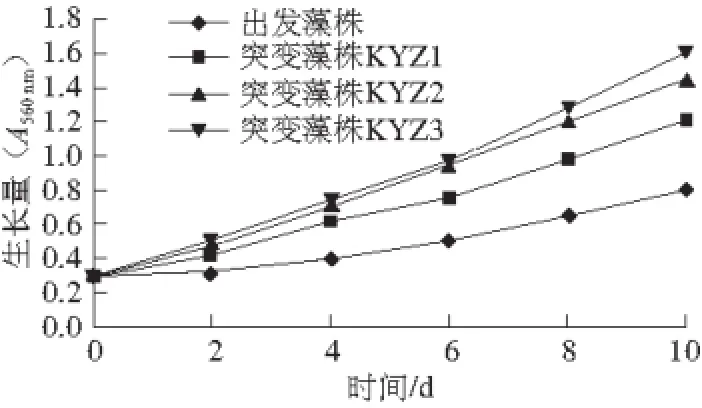
图1 出发藻株和突变藻株在实验培养基条件下的生长曲线Fig. 1 Growth curves of the parental strain and the mutants in the culture medium used in this experiment
3 株突变藻株生长速度明显快于出发藻株,KYZ3生长速度最快,KYZ1和KYZ2生长速度接近,生长高峰出现在6 d以后。
出发藻株用普通培养基,在光照8 000 lx、温度30~32 ℃、光暗周期14∶10的条件下培养,其生长速度高于实验培养基条件,对比结果见图2。

图2 出发藻株在普通培养和实验培养基条件下生长曲线对比Fig. 2 Comparison of the growth curves of the parental strain in a common culture medium and in the culture medium used in this investigation
图1 、2表明,3 株突变藻株在高质量分数CO2条件下生长较快,出发藻株则对高质量分数CO2条件不适应,生长较慢。2.5 突变藻株与出发藻株CO2利用率比较
将突变藻株和出发藻株按1.3.6节方法培养至10 d采收烘干,根据采收的干藻量和CO2用量,用1.3.8.3节中公式计算CO2利用率,结果见表3。

表3 突变藻株与出发藻株CO利用率比较Table3 Comparison of the CO2availability between the mutants and the parental strain
由表3可知,所有突变藻株中CO2利用率比出发藻株平均高52%左右,其中最高的是KYZ3,比出发藻株高出56%。
2.6 突变藻株与出发藻株蛋白质含量和叶绿素含量比较
测定采收烘干的藻粉蛋白质和叶绿素含量,由表4可知,所有突变藻株中蛋白质含量比出发藻株平均高2.5%左右,其中最高的是KYZ2,比出发藻株高出13%,含量最低的KYZ3比出发藻株低6.5%;叶绿素含量出发藻株平均高13.3%左右,其中最高的是KYZ2,比出发藻株高出24.6%。

表4 突变藻株与出发藻株蛋白质含量和叶绿素含量比较Table4 Comparison of the contents of protein and chlorophyll between the mutants and the parental strain
出发藻株应用普通培养基,在光照8 000 lx、温度30~32 ℃、光暗周期14∶10的条件下培养,烘干后的藻粉其蛋白质和叶绿素含量分别为61.2%、7.9 g/kg,高于实验培养基条件。
2.7 综合评价
综合评分法是当评价指标无法用统一的量纲进行定量分析时使用的一种分析方法。评分时以各指标的最大值为参照将数据进行归一化,再给每个指标一个权重,权重的大小根据各指标在总体中的贡献比重给定[10]。对突变藻株进行综合评分,结果见表5。

表5 突变藻株综合评分情况Table5 Comprehensive evaluation of the mutants
由表5可以看出,突变藻株KYZ2的生长速率、蛋白质含量和综合评分最高,分别为0.132 g/(L·d)、65.9%、98.3。因此,突变藻株KYZ2可以作为工业化培养的藻株。
2.8 优良突变藻株传代稳定性分析

表6 突变藻株主要形态特征稳定性测试Table6 Stability of the main morphological characteristics of the mutant KKYYZZ22

图3 突变藻株KYZ2第1代与第10代生长曲线比较Fig. 3 Comparison of the growth curves of the 1stgeneration and 10thgeneration of the mutant strain KYZ2
突变藻株的稳定性分析见表6和图3。对优良突变藻株KYZ2经过10 代的传代培养,藻体形态保持稳定,第1代和第10代生长曲线未发生明显变化,蛋白质和叶绿素含量下降对比不显著(表7),表明这是一株性状稳定的突变藻株。

表7 突变藻株第1代与第10代蛋白质含量和叶绿素含量比较Table7 Comparison of the contents of protein and chlorophyll between thhee 11ssttgeneration and10tthhgeneration of the mutant strain KYZ2
3 讨 论
螺旋藻生产中藻种混杂退化、生长慢、单位面积产量低、质量不稳定、采收困难等问题,已严重阻碍螺旋藻产业的发展[10]。目前国内外学者采用驯化、自然选择、物理或化学诱变、基因工程等方法已筛选出一些新品系[11]。紫外线诱变是一种有效的育种方法[12],紫外诱变技术以其简便快捷和效果显著,备受诱变育种研究者的青睐[13]。陈新美等[14]用紫外线诱变钝顶螺旋藻,结果表明,与出发藻株相比,藻丝长度均明显变长,螺旋数超过40个,形体较大,易于采收;王妮等[15]通过紫外线诱变筛选出2株耐低温钝顶螺旋藻藻种;李建宏等[16]成功利用紫外诱变获得优良稳定钝顶螺旋藻突变藻株。
本研究通过超声处理后,利用紫外诱变和高CO2条件胁迫,筛选出的3株极大螺旋藻藻株KYZ1、KYZ2、KYZ3,利用实验培养基培养10 d后的藻细胞生长量(A560nm)平均比通过单细胞分离的出发藻株KY1高出约75.7%,CO2利用率高52%,这与陈明明等[17]的研究结果紫外诱变育种技术可以提高微藻的生长速率、耐受CO2浓度以及固定CO2效率及叶丽[18]的研究结果三角褐指藻经紫外辐射处理后生长速率提高相符;在这3 株藻中,KYZ3的生长速率提高的最多,但其蛋白质含量低于出发藻株,与刘晓娟[19]的研究结果采用紫外诱变的方法筛选微绿球藻突变藻株,蛋白质含量有所下降相符;KYZ2的蛋白质含量提高,与叶丽等[20]的研究结果紫外诱变的突变藻株与出发藻株相比可以提高绿藻蛋白质及梁译之等[21]的研究结果利用单细胞分离技术和紫外诱变技术,筛选获得海水小球藻和盐生杜氏藻,胞内蛋白含量分别高于对照组18.2%和14.5%的结果相符。引起这些变化的原因尚需继续研究。出发藻株在普通培养基下培养,其生长速度、蛋白质和叶绿素含量与在实验培养基条件下差别显著,说明出发藻株不适应高质量分数CO2条件、光合速率低,而3株突变藻株与出发藻株相比是适应高质量分数CO2条件、光合速率高的藻株。
适合固定高用量CO2的微藻,其最适宜生长的CO2用量约在10%~20%[22]。Yun等[23]在利用渐增CO2浓度法来提高小球藻对CO2的耐受性的研究中所获得的最大CO2固定速率为0.936 g/(L·d);Sung等[24]分离出最大CO2固定速率达1.859 g/(L·d)的小球藻藻种KR-1;Kodama等[25]从海水中分离出最高可耐受60% CO2含量的海滩绿球藻(Chlorococcum littorale);黄云[26]釆用60Co-Y射线核诱变和高用量CO2梯度驯化的方法提高了蛋白核小球藻对高用量CO2的适应性,提高了诱变藻种的生物质产量和固碳效率,微藻的生物质产量提高了115%,达到2.41 g/L,对15%高用量CO2固定速率和效率分别达到1.538 g/(L·d)和32.7%;杨闯[27]通过紫外诱变选育的方法,筛选出耐受20% CO2的小球藻藻株。可以看出提高经济微藻CO2的耐受性和固定速率还有很大的提升空间。夏建荣等[28]研究认为高用量CO2可减轻极大螺旋藻的光抑制,提高强光条件下其光合速率。因此在后续的工作中采取新的方法进行藻种选育,提高螺旋藻对CO2的耐受性、固定速率和光合速率是亟需解决的问题,也是螺旋藻藻种选育的方向。
4 结 论
本实验通过比较出发藻株和突变藻株的主要生长性能和品质(藻丝形态、生长量、CO2利用率、蛋白质和叶绿素含量),并采用综合评分法,从3 株突变藻株中筛选出1 株优质藻株KYZ2。此突变藻株主要具生长速度快、光合速率高、蛋白质和叶绿素含量高、藻丝个体大等优点,是一株具有工业化养殖潜力的藻株。
[1] CIFERRI O. Spirulina, the edible microorganism[J]. Microbiological Reviews, 1983, 47(4): 551-578.
[2] 王勇, 钱峰, 钱凯先, 等. 藻蓝蛋白的抗癌活性研究[J]. 浙江大学学报(工学版), 2003, 35(6): 672-675. DOI:10.3785/j.issn.1008-973X.2001.06.018.
[3] HAYASHI K, HAYASHI T, MORITA N, et al. An extractfrom spirulina platensisis a selective inhibitor of herpes simplexvirus type 1 penetration into HeLa cells[J]. Phytotherapy Research, 1993, 7(1): 76-80. DOI:10.1002/ptr.2650070118.
[4] IM H M, LEE E H, CHO H H, et al. Inhibitory effect of mast cellmediated immediate type allergic reactions in rats by spirulina[J]. Biochem Pharmacol, 1998, 55(7): 1071-1076. DOI:10.1016/S0006-2952(97)00678-3.
[5] LI D M, QI Y Z. Spirulina industry in China: presentstatus and future prospects[J]. Applied Phycology, 1997, 9(1): 25-28. DOI:10.1023/ A:1007973823532.
[6] 张峰, 向文洲, 萧邶, 等. 耦合二氧化碳减排的微藻产业化培养技术[J]. 微生物学报, 2012, 52(11): 1378-1384. DOI:10.13343/j.cnki. wsxb.2012.11.007.
[7] 李夜光, 胡鸿钧. 螺旋藻培养液吸收CO2特性的研究[J]. 武汉植物学研究, 1996, 14(3): 253-260.
[8] 李夜光, 胡鸿钧, 张良志, 等. 以CO2为碳源工业化生产螺旋藻工艺技术的研究[J]. 武汉植物学研究, 1996, 14(4): 349-356.
[9] 胡海燕, 张静, 徐晶, 等. 螺旋藻培养液中碳、氮、磷的优化及其效应评价[J]. 食品科技, 2012, 37(1): 29-33. DOI:10.13684/j.cnki. spkj.2012.01.001.
[10] 吴晓娟, 钟华, 刘海燕, 等. 螺旋藻优良藻株的选育[J]. 食品发酵与工业, 2013, 39(7): 104-108. DOI:10.13995/j.cnki.11-1802/ ts.2013.07.016.
[11] 王妮, 王素英, 师德强. 螺旋藻诱变育种研究进展[J]. 食品研究与开发, 2009, 30(2): 139-142. DOI:10.3969/j.issn.1005-6521.2009.02.041.
[12] 陈必链, 施巧琴. 螺旋藻藻种选育研究进展[J]. 食品与发酵工业, 2002, 26(3): 78-81. DOI:10.3321/j.issn:0253-990X.2000.03.016.
[13] 夏金兰, 宁进军, 陈程浩, 等. 耐高温小球藻紫外诱变育种及其耐高温性质研究[J]. 中南大学学报(自然科学版), 2013, 44(3): 867-873.
[14] 陈新美, 梅兴国. 钝顶螺旋藻藻种的紫外诱变初步筛选[J]. 生物技术, 2006, 16(2): 51-54. DOI:10.3969/j.issn.1004-311X.2006.02.021.
[15] 王妮, 王素英, 师德强. 耐低温螺旋藻新品系的诱变选育[J].安徽农业科学, 2008, 36(29): 12552-12553. DOI:10.3969/ j.issn.0517-6611.2008.29.006.
[16] 李建宏, 郑卫, 倪霞. 两株钝顶螺旋藻紫外诱变株的特征[J]. 水生生物学报, 2001, 25(5): 486-490. DOI:10.3321/j.issn:1000-3207.2001.05.009.
[17] 陈明明, 杨忠华, 吴高明, 等. 利用微藻技术减排CO2的研究[J].武汉科技大学学报, 2009, 32(4): 436-440. DOI:10.3969/ j.issn.1674-3644.2009.04.022.
[18] 叶丽. 3 种富 EPA 海洋微藻的诱变育种[D]. 宁波: 宁波大学, 2014: 12-23.
[19] 刘晓娟. 拟微绿球藻髙脂藻株的紫外、激光诱变育种研究[D].福州: 福建师范大学, 2014: 35-45.
[20] 叶丽, 蒋霞敏, 孙志鹏, 等. 紫外诱变对微绿球藻生长和营养成分的影响[J]. 生 物 学 杂 志, 2014, 31(1): 56-59. DOI:10.3969/ j.issn.2095-1736.2014.01.056.
[21] 梁译之, 范禹辰, 高杨, 等. 利用紫外诱变技术获得海水小球藻和盐藻生长优势株的研究[J]. 生物技术世界, 2012(9): 7.
[22] 杨启鹏, 岳丽宏, 康阿青. 微藻固定高浓度CO2技术的研究进展[J]. 青岛理工大学学报, 2009, 30(5): 69-74. DOI:10.3969/ j.issn.1673-4602.2009.05.014.
[23] YUN Y S, PARK J S, YANG J W. Enhance of CO2tolerance of Chloerlla vulgaris by gradual increase of CO2concentration[J]. Biotechnology Techniques, 1996, 10(9): 713-716. DOI:10.1007/ BF00168486.
[24] SUNG K D, LEE J S, SHIN C S, et al. Isolation of a new highly CO2[sup2]tolerant fresh water microalga Chlorella sp KR-1[J]. Renewable Enengy: An International Journal, 1999, 16(1): 1019. DOI:10.1016/S0960-1481(98)00362-0.
[25] KODAMA M, IKEMOTO H, MIAYCHI S. A new species of highly CO2-tolerant fast-growing marine microalga suitable for high-density culture[J]. Journal of Marine Biotechnology, 1993, 1(1): 21-25.
[26] 黄云. 微藻固定烟气高浓度CO2的藻种改良和过程优化调控[D].杭州: 浙江大学, 2014: 47-70.
[27] 杨闯. 紫外线诱变选育耐高浓度CO2的微藻及不同株系的rbcL基因序列差异性分析[D]. 青岛: 青岛理工大学, 2010: 20-25.
[28] 夏建荣, 高坤山. 高浓度CO2条件下极大螺旋藻光抑制研究[J]. 水生生物学报, 2002, 26(1): 14-18. DOI:10.3321/j.issn:1000-3207.2002.01.003.
UV-Induced Mutagenesis and Screening of Spirulina maxima for High Photosynthetic Rate
YANG Shenghui1, ZU Tingxun1, LUO Guanghong1,*, WANG Danxia1, CHEN Tianren1, GAO Zicheng2
(1. Kai-yuan Biotechnology Center, Gansu Engineering Research Center for Microalgae, Key Laboratory of Hexi Corridor Resources Utilization of Gansu, Hexi University, Zhangye 734000, China; 2. Zhangye Productivity Promotion Center, Zhangye 734000, China)
Purpose: To screen a mutant strain of Spirulina maxima with high photosynthetic rate. Methods: The mutagenesis and screening were conducted by a combination of spontaneous isolation, ultrasonic treatment, UV irradiation and extremely high CO2stress. Results: Three mutants, namely KYZ1, KYZ2 and KYZ3, were obtained. The filament morphology, biomass, CO2availability, and protein and chlorophyll contents of these three mutants were compared. Finally, KYZ2 was screened as the best strain. Conclusions: Strain KYZ2 revealed longer and larger filaments, faster growth, higher photosynthetic rate, and higher contents of protein and chlorophyll compared with the starting strain. Thus, the mutant strain could have potential for industrial culture.
Spirulina maxima; UV irradiation; mutant strain
10.7506/spkx1002-6630-201702018
Q949.2
A
1002-6630(2017)02-0109-06
杨生辉, 祖廷勋, 罗光宏, 等. 极大螺旋藻高光合速率藻种的紫外诱变筛选[J]. 食品科学, 2017, 38(2): 109-114. DOI:10.7506/spkx1002-6630-201702018. http://www.spkx.net.cn
YANG Shenghui, ZU Tingxun, LUO Guanghong, et al. UV-induced mutagenesis and screening of Spirulina maxima for high photosynthetic rate[J]. Food Science, 2017, 38(2): 109-114. (in Chinese with English abstract)
10.7506/spkx1002-6630-201702018. http://www.spkx.net.cn
2016-03-31
2014年甘肃省农业领域知识产权优势企业培育项目(14OPIPG002);甘肃省工程技术研究中心专项(1009FTGG017);河西学院科研创新与应用校长基金项目(XZ2011-08);张掖市科技重大专项(144JTCG254-08)
杨生辉(1976—),男,副教授,硕士,研究方向为特色农产品加工及螺旋藻生产及其产品开发。E-mail:15025888518@163.com
*通信作者:罗光宏(1965—),男,教授,硕士,研究方向为植物资源利用与产业化开发。E-mail:13993693452@163.com
