HIF1α和HIF2α调控低氧诱导的MCF-7和HepG2细胞PAI-1表达
2017-02-06崔冠一李一鸣沈国民
崔冠一,彭 战,李一鸣,沈国民
纤溶酶/纤溶酶原激活物系统在肿瘤细胞的迁移过程中起着至关重要的作用。纤溶酶原激活物抑制剂(plasminogen activator inhibitors,PAIs),属于丝氨酸蛋白酶抑制剂家族成员,抑制纤溶酶原激活物的活性,限制活性纤溶酶的产生[1]。PAI主要有两种类型,PAI-1和PAI-2。其中PAI-1与肿瘤细胞表型密切相关,参与肿瘤细胞的迁移和血管形成,同时抑制肿瘤细胞的凋亡,是一个肿瘤预后因子。肿瘤细胞快速增殖导致实体瘤内部形成低氧微环境,低氧引起一系列低氧应答反应,低氧诱导因子(hypoxia inducible factor,HIF)在此过程中起着至关重要的作用[2-3]。HIFα亚基有两种亚型:HIF1α、HIF2α,都含有bHLH和PAS结构域,有研究报道HIF1α调节PAI-1的表达[4],也有研究称PAI-1是HIF2α的靶基因[5]。因此,本研究用人肝癌细胞系(HepG2)和人乳腺癌细胞系(MCF-7)研究低氧条件下HIF1α和HIF2α对PAI-1表达的影响,揭示PAI-1在肝癌肿和乳腺癌瘤细胞中表达升高的机制,现报道如下。
1 材料与方法
1.1材料药品与试剂:M-MLV Reverse Trancriptase及Ribonuclease Inhibitor为Promega 公司产品;TransStar SYBR Green qPCR SuperMix购自全式金公司;BCA蛋白浓度测定试剂盒为威格拉斯公司产品;Human PAI-1 ELISA kit为Bender公司产品。Dharma FECT siRNA 转染试剂为Thermo Scientific Dharmacon产品。HIF1α(sc-53546)抗体为鼠源单抗,二抗为辣根过氧化物酶(HRP)标记的抗小鼠IgG、抗兔IgG均购自Santa Cruz。HIF2α(NB100-122)抗体为兔源多抗,购自Novus。β-Actin(60008-1-1g)抗体为鼠源单抗,购自ProteinTech。丙烯酰胺、N’N’-亚甲基双丙烯酰胺、过硫酸铵(AP)、Penicillin、Streptamycin和 SDS 均为Sigma公司产品,三羟甲基氨基甲烷(Tris)、细胞培养基DMEM、MEM均为Gibco BRL公司产品;胰酶(Trypsin-EDTA)和Trizol为Invitrogen公司产品;胎牛血清(FBS)为PAA产品。蛋白分子量标准为MBI公司产品。
1.2实验方法
1.2.1细胞培养HepG2和MCF-7分别生长于MEM-NEAA、DMEM培养基中,含有10%的胎牛血清(FBS),100 U·mL-1青霉素,100 μg·mL-1链霉素,2.5 mM L-Gln,培养条件均为37 ℃,5%CO2及饱和湿度。低氧培养箱为YCP系列三 气培养箱(1%O2, 5%CO2, 94%N2)(长沙华曦电子科技有限公司)。HepG2和MCF-7分别在常氧(21%O2)、低氧(1%O2)下培养24 h后,收集细胞,提蛋白用于Western blot;提取总RNA用于实时定量PCR(RT-PCR),收集培养基上清用于ELISA实验。
1.2.2siRNA转染转染前24 h传代到6孔板,第2天细胞密度约50%~70%。siRNA转染按厂家说明进行。转染24 h后给细胞换含有10%FBS的双抗完全培养基,然后放入低氧箱,再过24 h,收培养基上清、RNA和蛋白,分别用于ELISA、Realtime PCR和Western blot分析。
1.2.3PAI-1含量测定按ELISA试剂盒方法进行。
1.2.4RealtimePCR检测PAI-1mRNA的表达用Bio-Rad iQ5 PCR仪进行扩增,条件为95 ℃ 3 min预变性; 95 ℃10 s,60 ℃30 s,共40个循环。HIF1α:上游引物5’-AGGTGGATATGTCTGGGTTG-3’;下游引物5’-AAGGACACATTCTGTTTGTTG-3’。HIF2α:上游引物5’-GTCTCTCCACCCCATGTCTC-3’;下游引物5’-GGTTCTTCATCCGTTTCCAC-3’。PAI-1:上游引物5’-TCTGCCCTCACCAACATTCTG-3’;下游引物5’-TGTCGGTCATTCCCAGGTTCT-3’。β-Actin:上游引物5’-CTGGCACCACACCTTCTACA-3’;下游引物5’-AGCACAGCCTGGATAGCAAC-3’。
1.2.5HIF1α和HIF2α表达蛋白免疫印迹收集6孔板细胞,用SDS裂解液(50 mM Tri-Cl pH6.8,2%SDS,10%glycerol)提取总蛋白进行蛋白的SDS-PAGE电泳,每孔上样量为100 μg全细胞抽提物。之后蛋白转移到PVDF膜。电转完毕的PVDF膜在TBST (20 mM Tris 8.0, 100 mM NaCl, 0.1%Tween-20)溶液中洗涤5 min。将PVDF膜放于含有5%脱脂奶粉的TBST中室温封闭2 h。再将膜放于封闭稀释的一抗溶液中,4 ℃孵育过夜。第2天TBST洗膜3次,每次10 min。再将膜放于封闭稀释的二抗溶液中,室温孵育1~2 h。TBST洗膜3次,每次10 min。之后用ECL试剂显影,在暗室中压X线片,曝光时间3 s~5 min,然后分别用显影液和定影液显影和定影。
2 结果
2.1低氧诱导HepG2和MCF-7细胞中PAI-1的表达Western blot结果显示,低氧时HepG2和MCF-7中,HIF1α和HIF2α蛋白表达量均明显升高,而内参β-Actin的表达无明显变化(图1A)。实时定量PCR检测低氧时PAI-1 mRNA升高(图1B)。ELISA检测培养基上清中PAI-1蛋白水平明显增加(图1C)。在HepG2细胞中,低氧时PAI-1 mRNA水平与常氧下相比,升高了约59倍(图1B),培养基上清中PAI-的含量上升了约114倍(图1C)。在MCF-7细胞中,低氧时PAI-1 mRNA水平与常氧下相比,升高了约11倍(图1B),培养基上清中PAI-1的含量升高了约3倍(图1C)。
2.2在HepG2中低氧下HIF2α主要调节PAI-1的表达HIF1α或者HIF2α特异性的siRNA处理过HepG2细胞以后,低氧时HIF1α或HIF2α的mRNA和蛋白水平都显著降低了(图2A, 2B)。用实时定量PCR检测PAI-1mRNA的表达,在HepG2中敲低 HIF2α显著降低PAI-1 mRNA水平,而敲低 HIF1α对PAI-1 mRNA水平无明显变化。用ELISA检测培养基上清中PAI-1蛋白水平的表达,敲低 HIF2α显著降低PAI-1水平,而敲低 HIF1α对PAI-1表达无明显变化(图3C)。

A:Western blot检测HIF1α和HIF2α在HepG2和MCF-7中低氧和常氧下的表达;B:低氧诱导PAI-1 mRNA升高;C:低氧诱导培养基上清中PAI-1的蛋白水平明显增加。图1 低氧诱导HepG2和MCF-7细胞系高表达PAI-1
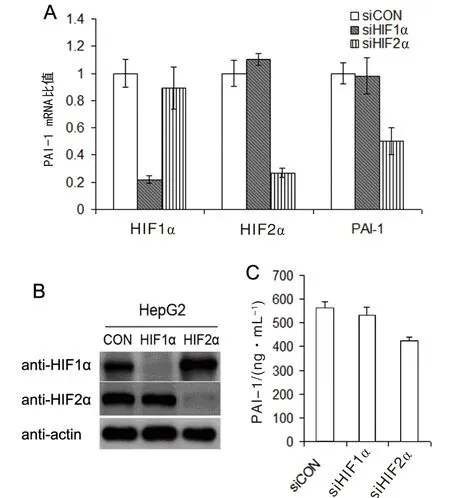
A:低氧下敲低HIF2α显著降低PAI-1 mRNA 的表达;B:HIF1α和HIF2α的siRNA 特异敲低HIF1α和HIF2α的蛋白表达;C:低氧下敲低HIF2α显著降低PAI-1的蛋白水平。图2 在HepG2中低氧下HIF2α主要调节PAI-1的表达
2.3在MCF-7中低氧下HIF1α主要调节PAI-1的表达HIF1α或者HIF2α特异性的siRNA处理过MCF-7细胞后,低氧时HIF1α或HIF2α的mRNA和蛋白水平都显著降低了(图3A,3B)。用实时定量PCR检测PAI-1mRNA的表达,发现敲低 HIF1α显著降低PAI-1 mRNA水平,而敲低 HIF2α对PAI-1 mRNA水平无明显变化(图3C)。用ELISA检测培养基上清中PAI-1蛋白水平的表达,发现敲低 HIF1α显著降低PAI-1水平,而敲低 HIF2α对PAI-1表达无明显变化。

A:低氧下敲低HIF1α显著降低PAI-1 mRNA 的表达水平;B:HIF1α和HIF2α的siRNA 特异敲低HIF1α和HIF2α的蛋白表达;C:低氧下敲低HIF1α显著降低PAI-1的蛋白水平。图3 在MCF-7中低氧下HIF1α主要调节PAI-1的表达
3 讨论
肿瘤细胞快速增殖导致实体瘤内部形成低氧微环境,低氧引起一系列低氧应答反应,HIF在此过程中起着至关重要的作用[4-5]。HIF是一种异源二聚体转录因子,它由两个碱性螺旋—环—螺旋(bHLH)亚基组成:HIFα和HIFβ。HIFα亚基有两种亚型:HIF1α、HIF2α。HIF1α和HIF2α具有相似的结构,都含有bHLH和PAS结构域,这两个结构域分别负责与DNA结合以及与HIFβ二聚化,同时HIF1α和HIF2α蛋白都含有氧依赖的降解结构域(ODDD),因此α亚基在常氧下被迅速降解[6-7]。β亚基是不依赖于氧气的组成型表达蛋白。低氧、铁螯合剂以及α-酮戊二酸类似物均能引起HIFα蛋白的稳定,从而与HIFβ亚基二聚化,该复合体转位到细胞核,结合于靶基因的顺式反应元件(低氧反应元件,HRE,核心模体序列为5’-(A/G)CGTG-3’),从而引起靶基因的转录。尽管低氧下HIF1α和HIF2α可能共同参与某个特定基因的表达,但二者并不冗余。有报道HIF1α和HIF2α具有不同的反式激活结构域,这表明二者可能有各自独特的靶基因,而这种特异性可能取决于细胞类型和基因种类[6-10]。
PAI-1是一个分子量约为52 kDa的糖蛋白,最初是定位于内皮细胞的一种蛋白。现已证实体外低氧条件下会引起PAI-1基因的表达上调[2,7]。本研究在HepG2细胞中,低氧时PAI-1 mRNA水平与常氧下相比,升高了约59倍,培养基上清中PAI-的含量上升了约114倍。在MCF-7细胞中,HIF1α或者HIF2α特异性的siRNA处理过HepG2细胞以后,低氧时HIF1α或HIF2α的mRNA和蛋白水平都显著降低了。在HepG2中敲低 HIF2α显著降低PAI-1 mRNA水平,而敲低HIF1α对PAI-1 mRNA水平无明显变化。敲低 HIF2α显著降低PAI-1蛋白水平,而敲低 HIF1α对PAI-1蛋白表达无明显变化。结果表明HIF1α或者HIF2α特异性的siRNA处理过MCF-7细胞后,低氧时HIF1α或HIF2α的mRNA和蛋白水平都显著降低了。用实时定量PCR检测PAI-1mRNA的表达,发现敲低 HIF1α显著降低PAI-1 mRNA水平,而敲低 HIF2α对PAI-1 mRNA水平无明显变化。用ELISA检测培养基上清中PAI-1蛋白水平的表达,发现敲低 HIF1α显著降低PAI-1水平,而敲低 HIF2α对PAI-1表达无明显变化。结果与之前的报道一致[2-4]。本研究发现低氧下在HepG2细胞系中HIF2α主要调节PAI-1的表达,而在MCF-7中HIF1α主要调节PAI-1的表达。PAI-1基因,像其他低氧反应基因一样,在其启动子区含有低氧反应元件,被HIF结合后促进其转录。然而PAI-1在不同肿瘤中的表达调控机制可能有差异。有报道HIF1α调节PAI-1基因的表达[11-12],也有文献报道PAI-1是HIF2α的靶基因[3]。本研究说明在肝癌和乳腺癌中,PAI-1的高表达机制是不一样的。因此在肝癌和乳腺癌的治疗中要针对不同的靶标来抑制PAI-1的表达,从而达到抑制肿瘤增殖和转移的目的。
[1]PannekoekH,VeermanH,LambersH,et al.Endothelial plasminogen activator inhibitor (PAI):a new member of the Serpin gene family[J].EMBO J,1986,5(10):2539-2544.
[2]Chi JT,Wang Z,Nuyten DS,et al.Gene expression programs in response to hypoxia:cell type specificity and prognostic significance in human cancers[J].PLoS Med,2006,3(3):47.
[3]Schilling D,Bayer C,Geurts-Moespot A,et al.Induction of plasminogen activator inhibitor type-1 (PAI-1) by hypoxia and irradiation in human head and neck carcinoma cell lines[J].BMC Cancer,2007,7(1):143.
[4]Fink T,Kazlauskas A,Poellinger L,et al.Identification of a tightly regulated hypoxia-response element in the promoter of human plasminogen activator inhibitor-1[J].Blood,2002,99(6):2077-2083.
[5]Sato M,Tanaka T,Maemura K,et al.The PAI-1 gene as a direct target of endothelial PAS domain protein-1 in adenocarcinoma A549 cells[J].Am J Respir Cell Mol Biol,2004,31(2):209-215.
[6]Raval RR,Lau KW,Tran MG,et al.Contrasting properties of hypoxia-inducible factor 1 (HIF-1) and HIF-2 in von Hippel-Lindau-associated renal cell carcinoma[J].Mol Cell Biol,2005,25(13):5675-5686.
[7]Elvidge GP,Glenny L,Appelhoff RJ,et al.Concordant regulation of gene expression by hypoxia and 2-oxoglutarate-dependent dioxygenase inhibition:the role of HIF-1 alpha,HIF-2alpha,and other pathways[J].J Biol Chem,2006,281(22):15215-15226.
[8] Taniguchi CM,Miao YR,Diep AN,et al.PHD inhibition mitigates and protects against radiation-induced gastrointestinal toxicity via HIF2[J].Sci Transl Med,2014,6(236):236-264.
[9] Chen W,Hill H,Christie A,et al.Targeting renal cell carcinoma with a HIF-2 antagonist[J].Nature,2016,539(7627):112-117.
[10]Shah T,Krishnamachary B,Wildes F,et al.HIF isoforms have divergent effects on invasion, metastasis, metabolism and formation of lipid droplets [J].Oncotarget,2015,6(29):28104-28119.
[11]Kimura D,Imaizumi T,Tamo W,et al.Hypoxia enhances the expression of plasminogen activator inhibitor-1 in human lung cancer cells,EBC-1[J].Tohoku J Exp Med,2002,196(4):259-267.
[12]Jung SY,Song HS,Park SY,et al.Pyruvate promotes tumor angiogenesis through HIF-1-dependent PAI-1 expression[J].Int J Oncol,2011,38(2):571-576.
