过氧化钠与干燥的二氧化碳不能反应的实验探讨
2017-01-19吴正帅丁元东
吴正帅+丁元东
1 问题的提出
普通高中课程标准实验教科书化学(必修1)教材介绍过氧化钠与二氧化碳的反应时,这样叙述:“过氧化钠与二氧化碳起反应,生成碳酸钠和氧气:2Na2O2+2CO2=2NaCO3+O2。因此,它用在呼吸面具上和潜水艇里作为氧气的来源。”近年来,与此反应有关的习题、实验在各种书刊、专题中屡见不鲜,大都涉及到了过氧化钠与干燥的二氧化碳能否反应?这些习题及实验的出现给读者(学生)是否会带来一些负面效应呢?基于此,笔者进行了实验验证和理论分析。
2 实验验证
2.1 实验用品
多用V形试管、硬质玻璃管、U型管、125 mL气体洗瓶、125 mL集气瓶、水槽、铁架台、铁夹(万能夹)、胶塞(带玻璃导管)、乳胶管。
盐酸(1∶1)、小块大理石、过氧化钠、浓硫酸(98%)、饱和碳酸氢钠溶液、氢氧化钠溶液。
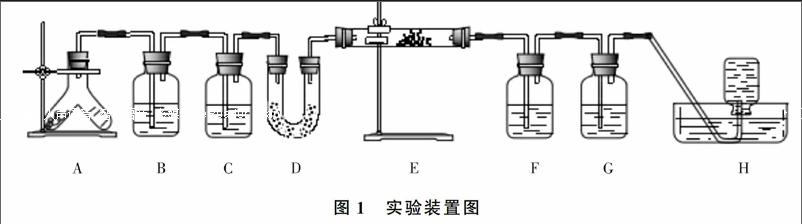
2.2 实验装置图
实验装置如图1所示。
2.3 实验步骤
(1)检查整套装置的气密性。
(2)于V形试管中分别装入约4 g大理石及12 mL1∶1的盐酸;于4个气体洗瓶中分别加入约115 mL饱和碳酸氢钠溶液(B)、浓硫酸(C、F)、氢氧化钠溶液(G);于U型管(D)中加入无水硫酸铜;于硬质玻璃管(E)中加入约2 g过氧化钠粉末,使其平铺硬质玻璃管中,水槽中装入适量水,备好集气瓶。
(3)按装置图连接好各仪器。
(4)倾斜V形试管,盐酸与大理石接触,即产生大量气泡。依次观察到图中B、C、F、G各气体洗瓶中均有气泡翻动;D中颜色无变化,H中基本没有现象;E中过氧化钠未有任何变化。
(5)从装置中删去C、D、F干燥二氧化碳的气体洗瓶,重新将装置连接好,重复前面操作。除E外,各装置中均有气泡产生。观察E中的过氧化钠会发现管壁渐渐模糊(即有水进入),浅黄色过氧化钠粉末先变深后又变白(水多时可明显看到气泡)。检验集气瓶H中收集到的气体,是氧气。
2.4 实验原理
(1)用A来产生二氧化碳,B可除去混入二氧化碳中的氯化氢气体;C干燥二氧化碳;D检验二氧化碳中是否存在水蒸气:F防止空气中水蒸气进入;G可吸收二氧化碳;H收集氧气。
(2)实验步骤4中的现象说明过氧化钠没有与干燥的二氧化碳反应。
(3)实验步骤5说明过氧化钠与不经过干燥的二氧化碳发生了反应。
2.5 实验结论
实验证实过氧化钠与二氧化碳反应必须有水参加,否则反应难以发生。
2.6 几点说明
(1)要控制好二氧化碳气流的大小,以保证其绝对干燥。
(2)所用的过氧化钠试剂要纯。
(3)若实验失败,说明二氧化碳干燥不够,可再增加一个干燥装置,串接于装置B的后面。
3 理论分析
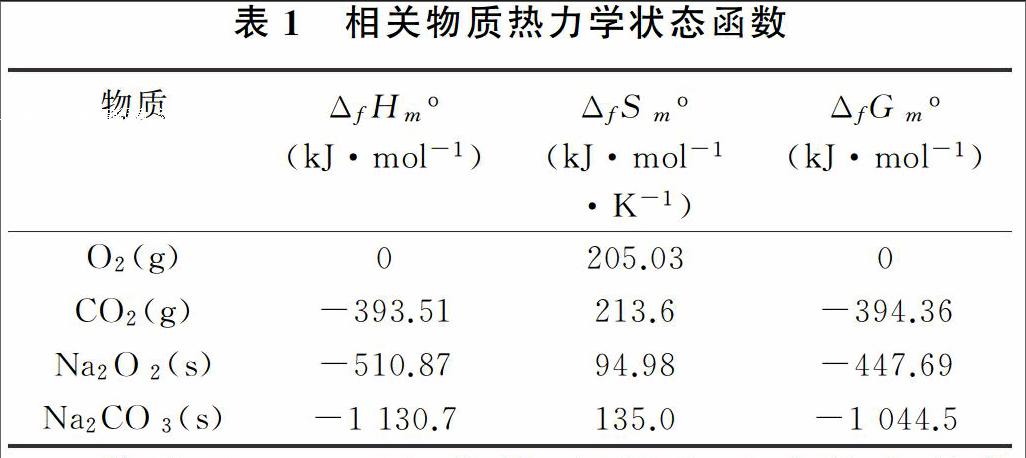
298 K,101 kPa时相关物质的热力学状态函数,见表1。
若取1 mol过氧化钠,根据表1中的有关数据、ΔGo=ΔHo—TΔSo,求得反应的有关数据为:
ΔHo=-226.32 kJ·mol-1<0;
ΔSo=-71.07 kJ·mol-1·K-1<0;
ΔGo=-202.45 kJ·mol-1<0。
由计算数据可以说明:反应低温自发进行,又由于ΔGo为负值,所以在低温条件下,这是一个可以自发进行的放热反应。
那么为何会出现过氧化钠跟干燥二氧化碳不反应的实验现象呢?其实,热力学只能告诉我们,在某种条件下变化是否能够发生,进行到什么程度,但不能告诉我们变化所需的时间、变化发生的根本原因以及经历的历程。一个化学反应既受热力学因素的影响也受动力学因素影响,同位素原子示踪实验证明Na2O2与C18O2在有H182O存在的条件下反应机理为:
Na2O2+C18O2+H182O=Na2C18O3+2H2O+O2。
笔者认为,虽然从热力学方面分析,这个反应是可以进行的,但由于受动力学因素的影响,上述反应在干燥条件下反应速率很慢,几乎无实质性变化。所以会得出过氧化钠与干燥二氧化碳不反应的结论。尤为值得注意的是:即使一个反应的热力学计算是自发的反应,但在实际过程中会由于动力学因素而不会有反应发生。
4 结论
当过氧化钠与二氧化碳有水存在时,引发以下反应:
反应为:第一步,Na2O2与H2O反应生成H2O2。
Na2O2+2H2O=2NaOH+H2O2。
第二步:H2O2不稳定随即发生分解。
反应为:2H2O2=2H2O+O2↑。
第三步:CO2与第一步反应中生成的NaOH反应。
2NaOH+CO2=Na2CO3+H2O。
以上3个反应合并,便得出总反应方程式:
2Na2O2+4H2O+2CO2=2Na2CO3+4H2O+O2。
即:2Na2O2+2CO2=2NaCO3+O2。
从反应历程来看,三步反应均为快速反应,有水存在就加快了整个反应的速率;从合并的化学方程式看,在反应过程中,水既是反应物又是生成物,且反应前后总量不变,相当于起了正催化剂的作用。事实上在实际实验操作过程中,并不是加入一滴水就可以使反应持续进行到底的,一方面该反应是一个放热反应会由于放热而带走水分,另一方面实验过程中产物会因水而结成块状,进而覆盖在过氧化钠表面而使反应终止。另外,过氧化钠是强吸湿性物质,在实验过程中,实验者有时会忽略这种物质的自身性质,在药品存在湿存水、药品因暴露在空气中而吸潮等客观因素的干扰下做实验,误认为过氧化钠跟二氧化碳在无水条件下也起反应。
收稿日期:2016-09-13
