siRNA干扰ΔNp63基因表达对人宫颈癌Siha细胞增殖及凋亡影响研究
2017-01-18周福兴刘海霞罗天爱陈必良
李 娜,刘 玉,马 芮,周福兴,刘海霞,罗天爱,陈必良
(第四军医大学西京医院妇产科,陕西 西安 710032)
siRNA干扰ΔNp63基因表达对人宫颈癌Siha细胞增殖及凋亡影响研究
李 娜,刘 玉,马 芮,周福兴,刘海霞,罗天爱,陈必良
(第四军医大学西京医院妇产科,陕西 西安 710032)
目的 通过抑制宫颈癌细胞株Siha中ΔNp63的表达,探讨ΔNp63对宫颈癌细胞增殖及凋亡的影响。方法 将宫颈癌细胞株Siha分为实验组和对照组,实验组转染ΔNp63的特异性siRNA,对照组转染阴性对照siRNA。实时荧光定量PCR(QRT-PCR)及蛋白质印迹法检测Siha细胞转染前后ΔNp63基因在mRNA及蛋白水平的变化;CCK8法检测细胞增殖,流式细胞仪测定细胞凋亡率。结果 实验组Siha细胞转染siRNA后,ΔNp63的mRNA表达为0.32±0.06,低于阴性对照组0.95±0.08(t=10.92,P<0.05)。实验组Siha细胞转染siRNA后,ΔNp63的蛋白表达为0.32±0.09,低于阴性对照组1.00±0.06(t=9.78,P<0.05)。实验组Siha细胞生长速度明显低于阴性对照组,实验组Siha细胞凋亡率为2.13±0.75,低于阴性对照组14.19±1.36(t=15.36,P<0.05)。结论 人宫颈癌细胞株中存在ΔNp63的表达,特异性siRNA可下调宫颈癌细胞株Siha中ΔNp63基因的表达,对细胞的增殖具有负性调节作用,并能诱导细胞凋亡。
宫颈癌;ΔNp63;RNA干扰;细胞增殖;细胞凋亡
p63是近年发现的p53 家族成员之一。由于启动子的不同和3'端剪切方式的不同,p63基因编码多种具有不同活性的异构体,可分成两大类:具有反式激活区的TA异构体和N 末端截短的ΔN异构体[1]。TA 异构体具有p53 样活性诱导细胞周期停滞和凋亡,ΔN异构体可以抑制p53的功能促进转化细胞的生长[2-3]。最初发现,ΔNp63是鳞状上皮基底细胞中极为重要的表达蛋白,可拮抗p53的抑瘤作用,在许多的上皮恶性肿瘤中都有过表达。目前,有关ΔNp63在宫颈癌中的作用机制报道尚少。为了研究ΔNp63在宫颈癌中发挥的作用,本研究利用RNA干扰(RNA interference,RNAi)技术,针对人ΔNp63基因设计并合成小干扰RNA用以沉默ΔNp63基因,观察ΔNp63基因对宫颈癌细胞Siha细胞增殖和凋亡能力的影响。
1 资料与方法
1.1材料
宫颈癌细胞株Siha细胞为第四军医大学西京医院妇产科实验室保存,小鼠抗人ΔNp63单克隆抗体、小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体购自BioLegend公司,极限最低培养基(minimum essential medium,MEM)培养基购自HyClone公司,胎牛血清购自浙江天杭公司,脂质体Lipo-2000购自Invitrogen公司,细胞计数试剂盒(Cell Counting Kit-8,CCK8)购自上海七海复泰生物公司,逆转录试剂盒、实时定量-聚合酶链反应(real-time polymerase chain rection,RT-PCR)试剂盒购自大连TaKaRa公司。ΔNp63引物序列:上游5′-CCAAAGCGAGGCACCCTTAC-3′;下游5′-CATTGAGCTG ̄AGGCCACAAGA-3′。内参Actin引物序列:5′-ACAGAGC ̄CTCGCCTTTGC-3′;下游5′-CGCGGCGATATCATCATCCA-3′。 针对ΔNp63的特异性siRNA序列为5′-UGCCCAGAC ̄UCAAUUUAGU-3′[4],阴性对照siRNA序列为5′-UUCUC ̄CGAACGUGUCACGUTT-3′。引物及siRNA均委托上海生工公司合成。流式细胞术检测在第四军医大学口腔医院实验室进行。
1.2细胞培养
Siha细胞培养于含10%胎牛血清的MEM培养基中,在37°、5% CO2的培养箱中常规培养,并取对数生长期的细胞用于实验。
当宫颈癌Siha细胞生长密度为80%~90%时,胰酶消化后均匀铺于6、96孔板上,按照Lip-2000试剂说明书将特异性siRNA及对照组siRNA分别转染到Siha细胞中,其转染终浓度均为100nmol/L。
1.3 siRNA瞬时转染
取对数生长期的Siha细胞按每孔1×105的密度接种于6孔板中,待细胞生长至60%时进行转染。将Siha细胞分为两组:实验组和对照组,分别转染特异性siRNA和阴性对照siRNA。转染时用Opti-MEM无血清培养基稀释Lip-2000与siRNA序列,具体按Lip-2000说明书进行,转染终体积为每孔2mL培养基,siRNA转染终浓度为每孔100nmol/L。转染6小时后换正常培养基,转染48h后,收集细胞,进行相应实验。
1.4实时定量PCR检测
按1.3方法转染48h后,按照TaKaRa RNA提取试剂盒提取Siha细胞的总RNA,细胞RNA的提取严格按照说明书在冰上进行,以防RNA降解。取A260/280值在1.8~2.0之间的纯度较好的RNA原液放置于-80°保存。测量RNA浓度,逆转录为cDNA,进行RT-PCR反应。反应体系为20μL体系,反应条件:95° 3min,95°变性30s,55°退火20s,72°延伸20s ,40个循环,最后72°再次延伸10min。实验重复3次。
1.5蛋白印迹法检测
按1.3方法转染48h后,取实验组及对照组细胞置于冰上裂解细胞提取总蛋白并进行BCA定量,调整蛋白浓度。按每孔30μg总蛋白量上样,行SDS-聚丙烯酰胺凝胶电泳,300mA电流恒转2h,5%脱脂奶粉封闭2h,抗ΔNp63和抗GAPDH抗体 4°孵育过夜,次日用相应二抗室温孵育2h,滴加化学发光底物进行检测,并用Quantity One软件进行分析。实验重复3次。
1.6细胞增殖检测
采用CCK8方法进行细胞增殖实验。取对数生长期的Siha细胞按每孔103的密度接种于96孔板中,每孔取5个平行孔进行检测,培养过夜后,按1.3的转染方法进行转染,分组同1.3。转染48h后每孔按100:10比例加入正常培养基和CCK8试剂,37°孵育2h,在酶联免疫检测仪上450nm下测各孔的吸光度值(optical density,OD450)。对转染6h、24h、48h、72h分别进行检测。实验重复3次。
1.7细胞凋亡检测
采用流式细胞仪检测细胞凋亡。取对数生长期Siha细胞按每孔1×105的密度接种于6孔板中,转染方法及分组同1.3。待转染48h后,用不含乙二胺四乙酸(ethylene dDiamine tetraacetic acid,EDTA)的胰酶消化后离心,收集细胞。用冷PBS洗涤细胞两次,尽可能吸尽PBS。用400μL l×Annexin V结合液悬浮细胞,浓度大约为1×106。在细胞悬液中加入5μL Annexin V-FITC染色液,轻轻混匀于2~8°避光条件下孵育15min。加入10μL PI染色液轻轻混匀后2~8°避光条件下孵育5min。立即用流式细胞仪检测。实验重复3次。
1.8 统计学方法

2结果
2.1特异性siRNA对ΔNp63 mRNA表达水平的影响
特异性siRNA转染48h后,RT-PCR检测结果显示,实验组和对照组ΔNp63 mRNA的表达分别为0.32±0.06和0.95±0.08,两组相比差异有统计学意义(t=10.92,P<0.05),见图1。

图1 RT-PCR方法检测特异性siRNA对Siha细胞ΔNp63 mRNA表达的影响
Fig.1 RT-PCR analysis of the effect of siRNA on ΔNp63 mRNA expression in Siha cells
2.2特异性siRNA对ΔNp63蛋白表达水平的影响
特异性siRNA转染48h后,Western blot检测结果显示,实验组和对照组ΔNp63蛋白表达水平分别为0.39±0.09和1.00±0.06,两组相比差异有统计学意义(t=9.78,P<0.05),见图2。

图2 Western blot方法检测特异性siRNA对Siha细胞ΔNp63蛋白表达的影响
Fig.2 Western blot analysis of the effect of siRNA on ΔNP63 protein expression in Siha cells
2.3特异性siRNA干扰ΔNp63表达对细胞增殖的影响
用CCK8法分别检测转染6h、24h、48h、72h后Siha细胞的增殖情况,检测结果显示,实验组和对照组OD490/6h分别为0.23±0.04、0.26±0.02;OD490/24h分别为0.39±0.04、0.52±0.06;OD490/48h分别为0.74±0.04、1.04±0.05;OD490/72h分别为0.99±0.03、1.52±0.03。在转染24h、48h、72h后,所测吸光度值有统计学意义。实验组细胞生长曲线较为平缓,细胞生长速度较对照组相比明显减慢(t6h=1.16,P>0.05;t24h=3.12,P<0.05;t48h=8.12,P<0.05;t72h=21.64,P<0.05),见图3。
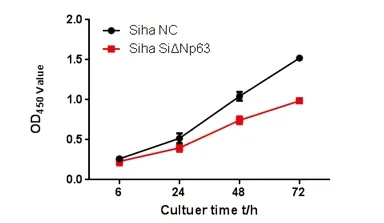
图3 CCK8法检测特异性siRNA干扰ΔNp63 基因后Siha细胞的生长曲线
Fig.3 CCK8 analysis of growth curve of Siha cells after siRNA interfering ΔNp63 gene
2.4特异性siRNA干扰ΔNp63表达对细胞凋亡的影响
特异性siRNA转染48h后进行流式细胞仪检测实验,结果显示,实验组和对照组Siha细胞凋亡率分别为14.19±1.36和2.13±0.75,t=15.36,P<0.05,差异有统计学意义,见图4。

图4 流式细胞仪检测特异性siRNA对Siha细胞凋亡的影响
Fig.4 FACS analysis of the effect of siRNA on Siha cells apoptosis
3讨论
3.1 p63基因的结构与功能
p63分为TA和ΔN两个亚型,根据C端的不同剪切TA和ΔN又分为α、β、γ三种亚型[5-7]。ΔNp63与p53的同源性高达60%,如核心DNA结合区、寡聚化区,与p53不同的是ΔNp63还具有独特的N-末端的转录激活区和C-末端SAM区[8-9]。有研究表明,ΔNp63可能是通过与p53竞争性结合DNA靶点区来拮抗p53的抑癌作用,从而通过对增殖、凋亡进行调节而影响肿瘤的发生发展[9]。因此,ΔNp63蛋白并不是一种肿瘤抑制基因,而是致癌基因。p63主要分布于各种上皮组织的增生区,如食管、口腔黏膜、皮肤、子宫颈的复层膜和生精小管上皮都有很强的核染色,其中转录活性最强的是ΔNp63[10]。近年来,越来越多的学者发现,ΔNp63的过表达与多种肿瘤的发生相关,如口腔癌、头颈部癌、肺癌、膀胱癌等[11-14]。在宫颈癌组织中,几乎所有的宫颈癌细胞都表达ΔNp63蛋白,提示ΔNp63蛋白与宫颈癌的发生发展密切相关[15]。
3.2利用RNAi技术下调ΔNp63的表达后,对宫颈癌细胞生物学功能的影响
本研究通过RNAi技术,将特异性的siRNA转染入人宫颈癌细胞株Siha中,通过RT-PCR技术和蛋白质印迹技术分别检测特异性siRNA干扰后ΔNp63 mRNA和蛋白的表达情况。结果显示,转染siRNA后,Siha细胞的ΔNp63 mRNA、蛋白的表达水平均明显降低,提示特异性siRNA可有效抑制Siha细胞中ΔNp63基因的表达。随后,我们利用RNAi技术对ΔNp63在细胞增殖及凋亡中的作用进行了初步探讨,结果显示转染特异性siRNA的实验组与转染阴性对照siRNA的对照组相比,其增殖率明显受到抑制,凋亡率显著增加。
本研究结果表明,宫颈癌细胞中存在ΔNp63的表达,特异性siRNA可有效抑制ΔNp63基因的表达,并抑制细胞增殖,促进细胞凋亡,但其机制目前并不明确。本研究为进一步的机制研究提供了一定的实验基础。
[1]Bornachea O,López-Calderón F F,Dueas M,etal.The downregulation of ΔNp63 in p53-deficient mouse epidermal tumors favors metastatic behavior[J].Oncotarget,2015,6(27):24230-24245.
[2]Zhao W,Wang H,Han X,etal.ΔNp63α attenuates tumor aggressiveness by suppressing miR-205/ZEB1-mediated epithelial-mesenchymal transition in cervical squamous cell carcinoma[J]. Tumour Biol,2016,37(8):10621-10632.
[3]Arason A J,Jonsdottir H R,Halldorsson S,etal.deltaNp63 has a role in maintaining epithelial integrity in airway epithelium[J].PLoS One,2014.9(2):e88683.
[4]Suarez-Carmona M,Hubert P,Gonzalez A,etal.ΔNp63 isoform-mediated β-defensin family up-regulation is associated with (lymph)angiogenesis and poor prognosis in patients with squamous cell carcinoma[J].Oncotarget,2014,5(7):1856-1868.
[5]Bid H K,Roberts R D,Cam M,etal.ΔNp63 promotes pediatric neuroblastoma and osteosarcoma by regulating tumor angiogenesis[J].Cancer Res,2014,74(1):320-329.
[6]Moergel M,Goldschmitt J,Stockinger M,etal.ΔNp63 expression in four carcinoma cell lines and the effect on radioresistance--a siRNA knockdown model[J].Clin Oral Investig,2014,18(4):1259-1268.
[7]Kim K H,Cho E G,Yu S J,etal.ΔNp63 intronic miR-944 is implicated in the ΔNp63-mediated induction of epidermal differentiation[J].Nucleic Acids Res,2015,43(15):7462-7479.
[8]Ho J Y,Chang F W,Huang F S ,etal.Estrogen Enhances the Cell Viability and Motility of Breast Cancer Cells through the ERα-ΔNp63-Integrin β4 Signaling Pathway[J].PLoS One,2016,11(2):e0148301.
[9]Lena A M,Duca S,Novelli F,etal.Amino-terminal residues of ΔNp63, mutated in ectodermal dysplasia, are required for its transcriptional activity[J].Biochem Biophys Res Commun,2015,467(2):434-440.
[10]Orzol P,Nekulova M,Holcakova J,etal.ΔNp63 regulates cell proliferation, differentiation, adhesion, and migration in the BL2 subtype of basal-like breast cancer[J].Tumour Biol,2016,37(8):10133-10140.
[11]Curtis K M,Aenlle K K,Frisch R N,etal.TAp63γ and ΔNp63β promote osteoblastic differentiation of human mesenchymal stem cells: regulation by vitamin D3 metabolites[J].PLoS One,2015,10(4):e0123642.
[12]Kakuki T,Kurose M,Takano K,etal.Dysregulation of junctional adhesion molecule-A via p63/GATA-3 in head and neck squamous cell carcinoma[J].Oncotarget,2016,7(23):33887-33900.
[13]Bretz A C,Gittler M P,Charles J P,etal.ΔNp63 activates the Fanconi anemia DNA repair pathway and limits the efficacy of cisplatin treatment in squamous cell carcinoma[J].Nucleic Acids Res,2016,44(7):3204-3218.
[14]Gaya J M,López-Martínez J M,Karni-Schmidt O,etal.ΔNp63 expression is a protective factor of progression in clinical high grade T1 bladder cancer[J].J Urol,2015,193(4):1144-1150.
[15]Zhou Y,Xu Q,Ling B,etal.Reduced expression of ΔΝp63α in cervical squamous cell carcinoma[J].Clin Invest Med,2011,34(3):E184-E191.
[专业责任编辑:杨筱凤]
Effects of small RNA interfering the expression of ΔNp63 on the proliferation and apoptosis in Siha cells
LI Na, LIU Yu, MA Rui, ZHOU Fu-xing, LIU Hai-xia, LUO Tian-ai, CHEN Bi-liang
(Department of Gynecology and Obstetrics, Xijing Hospital, Fourth Medical University, Shaanxi Xi’an 710032, China)
Objective To detect the effect of ΔNp63 on proliferation and apoptosis on human cervical cancer cells by suppressing the expression of ΔNp63 in cell line Siha. Methods Siha cell lines were divided into experimental group (siRNA with transfected ΔNp63) and control group (transfected negative controlled siRNA). Real-time reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were used to detect the expressions of ΔNp63 in mRNA and protein before and after transfection. CCK8 was used to detect the proliferation of Siha cells and apoptosis was measured by flow cytometry. Results After Siha cells transfected siRNA in the experimental group, mRNA expression of ΔNp63 was 0.32±0.06, which was lower than 0.95±0.08 in the control group(t=10.92,P<0.05), and the protein expression of ΔNp63 was 0.32±0.09, which was lower than 1.00±0.06 in the control group(t=9.78,P<0.05). The growth speed of Siha cells was significantly lower in the experimental group than in the control group, and the apoptosis ratio of Siha cell in the experimental group (2.13±0.75) was lower than that in the control group (14.19±1.36) (t=15.36,P<0.05).Conclusion ΔNp63 exists in human cervical cancer cells. Specific siRNA can downregulate the expression of ΔNp63 in Siha, inhibit cell proliferation and induce apoptosis.
cervical cancer; ΔNp63; RNA interfering; proliferation; apoptosis
2016-09-12
李 娜(1992-),女,硕士研究生,主要从事妇科肿瘤的研究。
陈必良,主任医师/教授。
10.3969/j.issn.1673-5293.2016.12.013
R711.74
A
1673-5293(2016)12-1469-03
