水热预处理提高花生分离蛋白酶解效率及其机理分析
2017-01-17陈建设于泓鹏吴克刚
陈 林,陈建设,于泓鹏,吴克刚※
(1. 广东工业大学轻工化工学院食品系,广州 510006;2. 浙江工商大学食品与生物工程学院,杭州 310018)
水热预处理提高花生分离蛋白酶解效率及其机理分析
陈 林1,陈建设2,于泓鹏1,吴克刚1※
(1. 广东工业大学轻工化工学院食品系,广州 510006;2. 浙江工商大学食品与生物工程学院,杭州 310018)
为了提高花生分离蛋白的酶解效率,该文采用水热法对花生分离蛋白进行预处理,利用响应面试验设计优化预处理工艺,并研究比较了预处理前后花生分离蛋白酶解敏感性和空间构象的变化。结果表明:优化后的最佳预处理条件为水热压力90 MPa、水热温度85℃、水热时间20 min,此条件下酶解产物水解度达到16.3%,相对未经预处理的酶解产物提高了 8 .1个百分点。水热预处理提高了花生分离蛋白的主要组分花生球蛋白和伴球蛋白的酶解敏感性,使酶解产物蛋白质回收率提高了31.9个百分点。进行荧光光谱和红外光谱分析发现水热预处理使花生分离蛋白三级结构展开、二级结构紧密程度下降,可能是其酶解敏感性提高的主要原因。因此水热预处理是一种辅助提高花生分离蛋白酶解效率行之有效的方法。
蛋白;热处理;优化;水热预处理;花生分离蛋白;酶解敏感性;空间构象
0 引 言
花生蛋白是中国大宗优质植物蛋白资源,具有较高的营养效价和丰富的功能特性。花生分离蛋白(peanut protein isolate,PPI)是一种花生蛋白的精制产品,蛋白质量分数在90%以上,是一种重要的食品工业基础原料。其中主要的蛋白质组分为花生伴球蛋白和花生球蛋白,约占PPI总蛋白含量的90%[1]。目前国内PPI的产量不断增加,然而市场对于传统PPI的需求已趋于饱和,由于商品化 P PI的溶解性较差,导致其在食品和非食品领域的应用受到限制[2]。国外已对PPI的分子结构、功能特性、改性技术等进行了大量而深入的研究,美国和日本已利用PPI开发出了蛋白乳化剂、降血压多肽、可食性膜等深加工产品,但这些技术基本没有申请专利,属于技术机密,对中国PPI生产技术的研究帮助较少[3-4]。探索花生蛋白改性技术及改善其功能特性,对开辟花生蛋白新的利用途径,提高其使用价值,满足人们健康需求,具有重要意义。
蛋白质酶解是利用蛋白水解酶在温和条件下催化蛋白质水解成氨基酸和小肽。酶解反应速度快、条件温和、专一性强、无氨基酸破坏和有害物质产生,故被认为是水解食品蛋白的最佳方法[5-6]。蛋白质经适度酶解后除了保留甚至提高其生物价外,功能特性明显优于原始蛋白质[7-8];利用蛋白酶解制备生物活性肽更是成为国内外研究的热点[9-10]。然而由于花生蛋白特殊的组成和结构,蛋白分子高度压缩、结构紧密,对蛋白酶的水解作用有很强的抵抗力,导致酶解反应速度慢、产物水解度低、酶解不彻底等问题,大大制约了花生蛋白酶解改性的实际效果[11-13]。因此寻求花生蛋白高效酶解技术是花生蛋白改性的关键。
水热处理是在密闭的压力容器中(如高压反应釜),在高压条件下对蛋白样品进行加热处理[14]。据报道,在水热处理过程中蛋白质同时经历高温、高压两种作用导致其分子结构发生显著变化[15-19]。如叶荣飞等[15]研究发现水热处理可破坏大豆蛋白的内部基团,导致其亚基解离,从而使蛋白溶解性显著提高。Tedford等[16-17]发现与常压热处理相比,水热处理中高温和高压相联合对维持β-乳球蛋白高级结构的次级键和二硫键有协同增效的破坏作用,因此使其分子结构发生了更为显著的变化。水热处理可破坏蛋白质的高级结构,诱导蛋白亚基解离,有可能使被包埋的酶解位点暴露,提高蛋白的酶解敏感性。然而针对花生蛋白,以往的研究多集中在水热处理对蛋白功能特性的影响,而水热处理后花生蛋白酶解特性的变化研究报道的很少。因此本文旨在研究水热预处理对PPI酶解特性的影响,并通过研究比较预处理前后PPI及其酶解产物理化性质和结构的变化,探讨水热处理提高PPI酶解敏感性的潜在机理。阐明该机理对提高花生蛋白的酶解效率、改善其功能特性具有重要的理论和现实意义,可为花生蛋白深加工提供理论和方法指导。
1 材料与方法
1.1 材料与仪器
花生分离蛋白(蛋白质量分数为92.7%±0.7%,干基),青岛长寿食品有限公司;复合蛋白酶Protamex(酶活力为 1 .5 AU/g),丹麦诺维信公司;其他试剂均为国产分析纯。
高压反应釜(CJ-200,威海新元化工机械有限公司);自动电位滴定仪(TIM840,美国Radiometer公司);电泳系统(Mini-protean IV,美国Bio-Rad公司);荧光分光光度计(FluoroMax-4,法国HORIBA Jobin Yvon公司);傅里叶红外光谱仪(Nicolet 6700,美国Thermo fisher公司)。
1.2 试验方法
1.2.1 响应面试验设计优化水热预处理工艺
将PPI分散到去离子水中配制成50 g/L的分散液,常温下(25℃左右)搅拌2h使其充分分散,然后置于CJ-200高压反应釜中进行水热预处理,处理过程中设定搅拌速率为20 r/min。通过单因素预试验发现水热处理压力(X1)、温度(X2)和时间(X3)为影响酶解产物水解度(degree of hydrolysis,DH)的3个主要因素,并确定了它们适宜的水平范围。响应面法优化试验(response surface methodology,RSM)根据螺旋中心组合设计原理,采用软件Design-expert 8.0.6中Box-Behnken模型进行三因素三水平试验,以 D H为响应值,各因素水平如表1所示。水热处理后的PPI样品(hydrothermally cooked PPI,HPPI)立即进行蛋白酶水解。部分样品经真空冷冻干燥(真空度为15 Pa,冷阱温度为-60 ℃)得到粉末,粉碎后过60目筛,于密闭干燥容器中保藏备用。

表1 响应面试验设计中水热预处理工艺各因素和水平编码表Table 1 Coded settings of process parameters for hydrothermal pretreatment in RSM
1.2.2 蛋白酶解反应及水解度的测定
为了识别水热预处理后花生蛋白暴露出的酶解位点,本文采用酶切位点比较广泛的复合蛋白酶Protamex[20],酶解过程如下:将样品分散液调节至Protamex的最适酶解pH值(6.8),并将恒温水浴温度调节至最适酶解温度(50 ℃)。启动磁力搅拌器,预热10 min,然后加入Protamex开始酶解,蛋白酶/底物比例为0.5%(质量比)。酶解过程采用自动电位滴定仪自动滴加0.2 mol/L NaOH溶液入样品分散液,从而维持酶解过程中样品pH值在6.8±0.1。酶解120 min后,记录碱液消耗量,采用pH-stat法测定DH[20]。酶解液于95 ℃水浴中灭酶10 min,冷却至室温(25 ℃左右)后备用。部分样品经真空冷冻干燥(真空度为15 Pa,冷阱温度为-60 ℃)得到粉末,粉碎均匀后过60目筛,于密闭干燥容器中保藏备用。
1.2.3 蛋白质回收率(protein recovery,PR)的测定
样品酶解液经4 000×g离心20 min,取上清液。采用半微量凯氏定氮法测定上清液中蛋白质含量。蛋白质回收率(PR)的计算公式为:PR=[样品中水溶性蛋白质量(g)/样品中总蛋白质量(g)]×100%。
1.2.4 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)
参照Laemmli报道的方法[21],浓缩胶质量分数为4%,分离胶为质量分数4%~15%的梯度胶。将冷冻干燥后的蛋白样品溶解于样品缓冲液(0.0625 mol/L Tris-HCl buffer (pH值6.8),20 g/L SDS,5%(体积分数)巯基乙醇,25%(体积分数)甘油和0.1 g/L 溴酚蓝)中配置成质量浓度为10 mg/mL的分散液。95 ℃下水浴加热5 min,离心后(4 000×g,20 min)取上清液。每个样品的上样量为10 μL。凝胶电泳在恒压下进行,在浓缩胶中的电压为60 V,进入分离胶后增至120 V。电泳结束后,采用考马斯亮蓝(R-250)对凝胶染色,再用甲醇和醋酸混合液脱色,最后在凝胶成像系统中进行成像处理。蛋白标准品的分子量为14.4~97.4 kDa。
1.2.5 荧光光谱分析
将蛋白样品用0.01 mol/L的磷酸盐缓冲液(pH值7.0)配制成质量浓度为0.15 mg/mL的溶液。荧光发射光谱分析以蛋白分子中的荧光基团(色氨酸残基)为探针[22]。为了降低酪氨酸的干扰,以295 nm为激发波长,在300~400 nm范围内进行扫描,激发和发射狭缝宽均为5 nm,以缓冲液作为空白。
1.2.6 傅里叶变换红外光谱分析
称取冷冻干燥后的蛋白样品2~6 mg,加入0.2 g左右的KBr,一起研磨混制均匀,压片,平衡2 min。以干燥空气为背景,采用红外附件 A TR(衰减全反射)将蛋白样品在傅里叶红外光谱仪上做全波段(4 000~400 cm-1)扫描,扫描次数为32次,分辨率为4 cm-1。参照Cruz-Angeles等[23]的方法,用PeakFit v4.12软件对位于1 600~1 700 cm-1波段属于酰胺I带特征峰的图谱进行分析。校正基线,采用Gaussian去卷积,由二阶导数拟合,多次拟合使残差最小。根据子峰面积计算各部分二级结构的相对含量。其中各子峰与二级结构对应关系为:1 615~1 637 cm-1、1 682~1 700 cm-1为β-折叠;1 648~1 664 cm-1为α-螺旋;1 637~1 648 cm-1为无规则卷曲;1 664~1 681 cm-1为β-转角[24]。
1.2.7 数据分析
试验中所有数据都是3次测定的平均值,通过SPSS 13.0进行方差分析,采用Duncan多重范围检验,P<0.05时表明差异显著。
2 结果与分析
2.1 响应面试验设计结果分析及模型拟合
根据 B ox-Benhken的中心组合设计原理,设计了三因素三水平的二次回归旋转正交试验,共17个试验点,其中12个为析因点,5个为0点,析因点为自变量取值在水热压力(X1)、水热温度(X2)、水热时间(X3)所构成的三维顶点,0点为区域的中心点,0点重复5次,用以估算试验误差,试验设计方案及结果见表2。
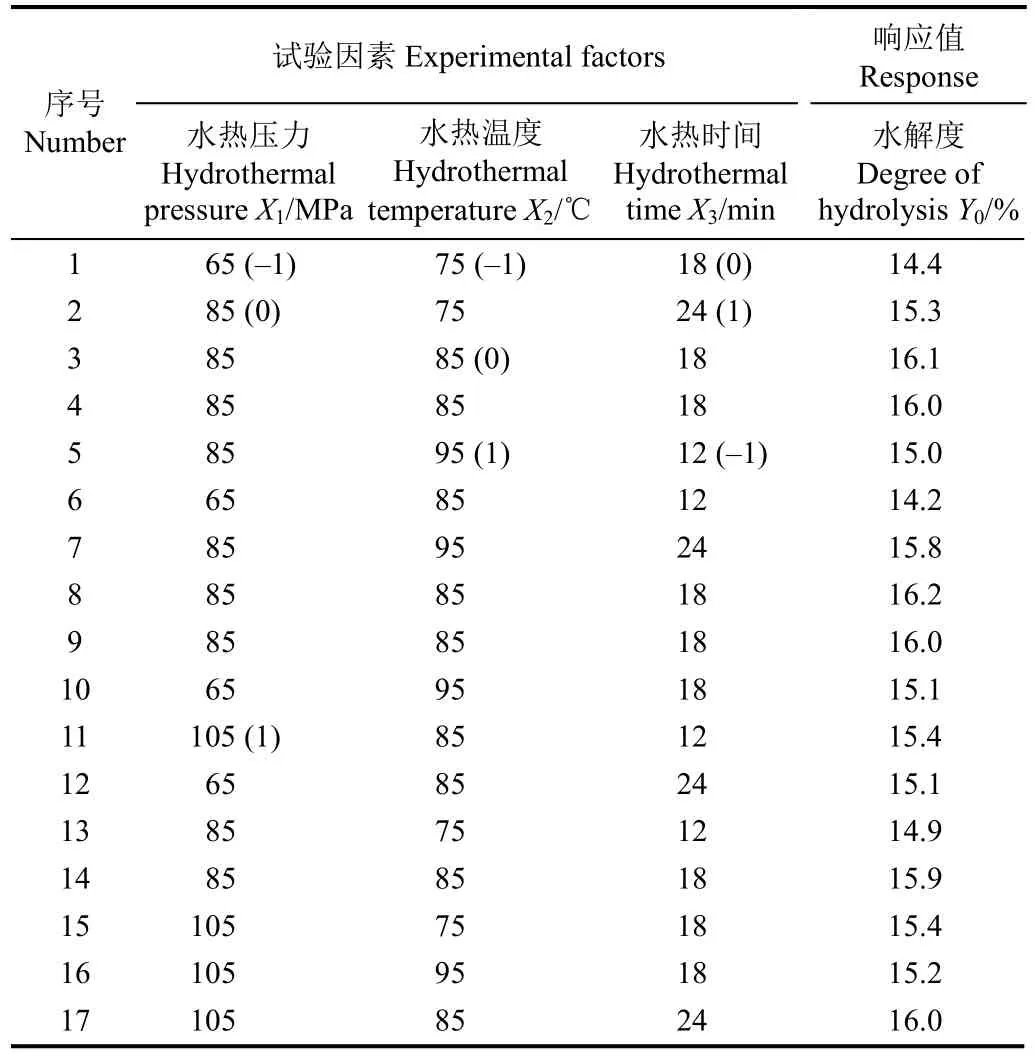
表2 Box-Behnken设计方案及试验结果Table 2 Box-Behnken design matrix and experimental results
运用Design-expert 8.0.6软件对试验数据进行回归拟合,得到响应值Y0(水解度,%)对试验因素X1(水热压力,MPa)、X2(水热温度,℃)、X3(水热时间,min)的回归方程为:
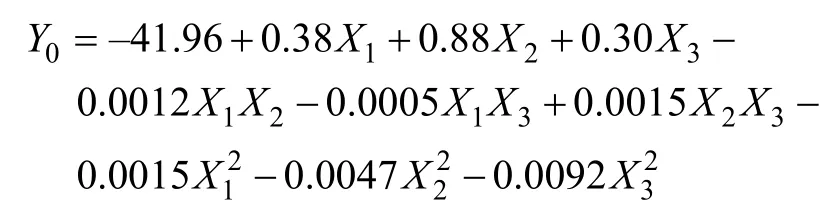
对该回归方程进行方差分析,结果见表3。回归方程模型F检验非常显著(P<0.01),失拟项不显著(P>0.1),决定系数R2=0.97>0.95,说明其他因素对试验结果干扰较小,试验误差小,该回归方程与实测值拟合度高,可以用该模型来分析和预测水热预处理条件对PPI酶解产物DH的影响。此外,由表3中F值大小可知,本试验三因素对响应值DH的影响主次顺序为:X1(水热压力)>X3(水热时间)>X2(水热温度),即水热预处理压力对DH的影响最为显著。
根据回归模型做出相应的响应面图,即分别将模型中X1、X2和X3中的一个因素固定在0水平,可得到另外两个因素对DH的交互影响。由表3可知,X1X2间交互作用显著(P<0.05),而X1X3和X2X3间交互作用不显著(P>0.05),即水热压力(X1)与水热温度(X2)对水解度(Y0)存在显著的交互作用。由图1可见,随着预处理各因素水平增大,DH呈现出先增加后降低的趋势,最大值集中在中心区域。这可能是因为水热预处理过程中,PPI同时受到高温、高压的作用,其蛋白质高级结构和分子间聚集状态发生改变,紧密的结构松散开,暴露出更多的酶解位点,从而使PPI的酶解敏感性提高;然而若水热处理条件过度,会使展开的蛋白分子因疏水相互作用或形成-S-S-重新聚集成致密的网状结构,酶解位点反而被包埋[15-19]。响应面模型预测的最优水热预处理条件为水热压力90.57 MPa、温度86.56 ℃、时间20.99 min,在此条件下预测DH可达到16.2%。为检验优化结果的可靠性,对以上试验结果进行了近似验证试验,考虑到试验可操作性,以减少能耗和反应时间为基准,选择水热压力90 MPa、温度85 ℃、时间20 min条件下进行3次平行验证试验,实际测定DH为16.3%±0.2%,验证试验测得数据与预测值无显著差异(P>0.05),且显著(P<0.05)高于未经预处理酶解产物的DH 8.2%±0.2%,提高了8.1个百分点,再次证明 B ox-Behnken模型适用于优化该反应条件,优化结果准确可靠,具有实用价值。
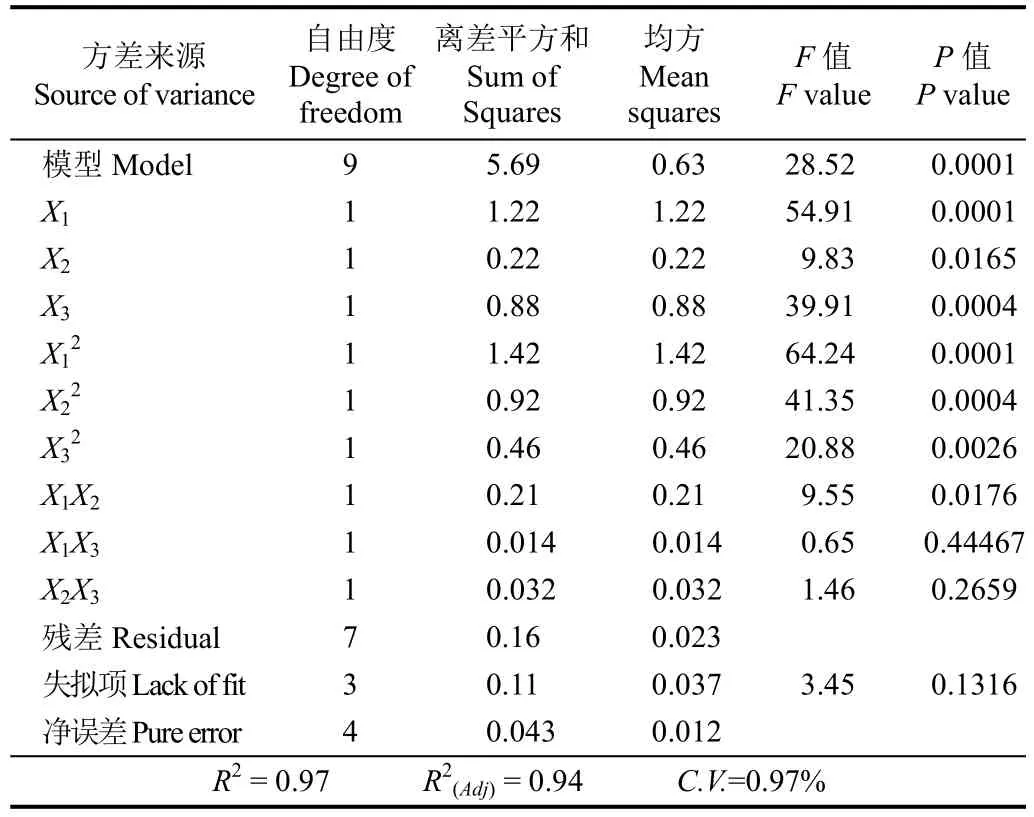
表3 响应面模型的回归方差分析Table3 Analysis of variance of regression equation for response surface quadratic model
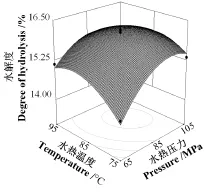
图1 水热压力与水热温度交互作用对PPI酶解产物水解度影响的响应面图Fig.1 Interactive effects of hydrothermal pressure and hydrothermal temperature on response degree of hydrolysis of PPI hydrolysate
2.2 水热预处理对PPI酶解敏感性的影响
由响应面试验设计结果分析可知水热预处理压力是影响PPI酶解产物水解度的最主要因素,因此本试验通过研究PPI酶解产物(PPI hydrolysate,PPIH)和HPPI酶解产物(hydrothermally cooked PPI hydrolysate,HPPIH)的亚基降解、水解度(DH)和蛋白质回收率(PR),分析水热预处理对PPI酶解敏感性的影响。图2展示了对照PPI、HPPI(水热压力为65~105 MPa,水热温度为85℃,水热时间为20 min)、PPIH和HPPIH的SDS-PAGE图谱。对照PPI含有5条颜色较深的亚基条带(S1~S5)。通过分子量标记计算其分子量,并与文献报道的花生蛋白的亚基组成进行比对,结果发现S1(64 kDa)为花生伴球蛋白(conarachin),S2~S4(40,39,37 kDa)为花生球蛋白(arachin)中的酸性亚基,S5(25 kDa)为花生球蛋白中的碱性亚基[11-13]。与对照PPI相比,经不同压力水热处理后,HPPI中各亚基条带都有所消褪,并伴随着一系列较低分子量蛋白多肽的生成。进一步测定HPPI的DH发现,HPPI-65 MPa、HPPI-90 MPa、HPPI-105 MPa的DH分别为1.7%、2.8%、3.0%,而对照PPI的DH仅为0.2%(见表4)。这表明在水热处理下,花生蛋白发生了一定程度的自发水解。这一发现与之前的一些研究报道相似,如Tedford等[16-17]、Wang等[18]也都发现食品蛋白在高温高压联合作用下会发生轻度水解。这可能是因为在蛋白质的自发水解反应中,水解速率与反应体系的温度和压力呈正相关,即高温高压条件会加速蛋白的自发水解反应[17]。
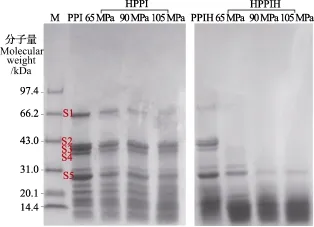
图2 水热预处理前后花生分离蛋白及其酶解产物的聚丙烯酰胺凝胶电泳图谱Fig.2 Sodium dodecyl sulphate-polyacrylamide gel electrophoresis profiles of hydrothermally pretreated peanut protein isolate and their hydrolysates
经过Protamex酶解后,对照PPI中不同亚基表现出不同的酶解敏感性。在PPIH中,花生伴球蛋白(S1)条带基本完全消失,而花生球蛋白的酸性亚基(S2~S4)和碱性亚基(S5)均未被完全酶解。由此可见,花生蛋白中的酸性亚基和碱性亚基对Protamex的酶解作用有较强的抵抗力,这与之前文献报道一致[11-13]。与之相对照的是,HPPIH中花生伴球蛋白和花生球蛋白酸性亚基条带已经完全消失,且HPPIH-90 MPa和HPPIH-105 MPa中花生球蛋白的碱性亚基也仅有少量残留。这说明经过水热预处理后,PPI的主要组分花生球蛋白和伴球蛋白的酶解敏感性明显提高了。据报道,水热处理过程中高压和高温相联合对维持蛋白质高级结构的次级键和二硫键有协同增效的破坏作用,可使球蛋白分子的致密结构展开,甚至可使已变性聚集的蛋白分子变得松散,从而暴露出原来被掩蔽的酶解位点[15-19]。
表4展示了不同压力水热预处理后PPI、HPPI、PPIH和HPPIH的DH和PR。本研究采用的商品化PPI在制备过程中经历了喷雾干燥等高温处理,可能发生了变性聚集[25],导致蛋白质回收率较差(对照PPI的PR为17.6%)。经水热处理后,HPPI的PR显著提高(P<0.05),HPPI-90 MPa的PR为27.5%。Wang等[13]也发现热变性大豆分离蛋白经水热处理(90 MPa,154℃,4 min)后,PR由13%提高到了35%,这表明水热处理对已变性聚集蛋白产品的PR有明显的改善作用。酶解后PPIH和HPPIH的DH和PR都增加了。然而与PPIH相比,HPPIH的DH和PR明显更高。当水热压力为90 MPa时,HPPIH的DH和PR分别达到了16.3%和73.4%,显著高于 P PIH(DH=8.2%,PR=41.5%)(P<0.05),其中PR提高了31.9个百分点。这可能是因为水热预处理提高了PPI主要组分花生球蛋白和伴球蛋白的酶解敏感性,使Protamex对PPI的酶解作用不仅变得强烈(DH更高),而且更加广泛(PR更高):在相同的酶解条件下,有更多的花生蛋白在水热预处理后可被Protamex酶解而变得可以溶解。
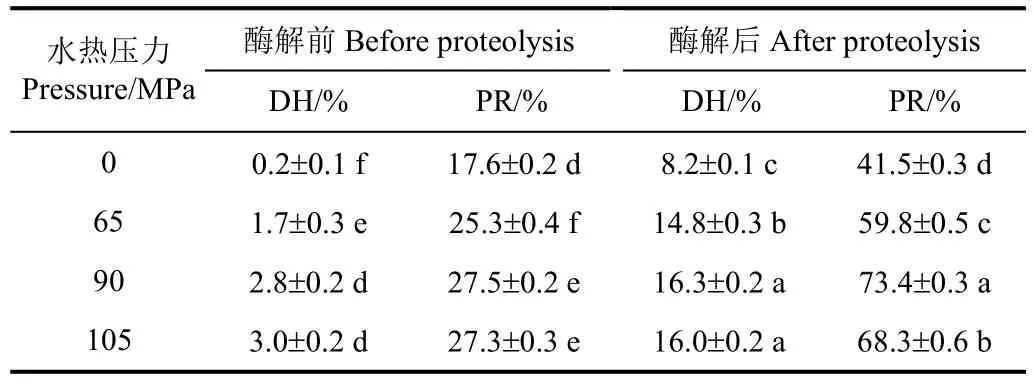
表4 水热预处理对花生分离蛋白及其酶解产物水解度和蛋白质回收率的影响Table 4 Effects of hydrothermal pretreatment on degree of hydrolysis and protein recovery of peanut protein isolate and its hydrolysate
2.3 水热预处理对PPI空间构象的影响
蛋白质的空间构象与其酶解敏感性密切相关。本研究采用荧光光谱和红外光谱分析水热预处理前后 P PI空间构象的变化,试图从分子水平上解析水热预处理提高PPI酶解敏感性的潜在机理。
2.3.1 荧光光谱分析
本研究采用295 nm作为激发波长,所得到的是色氨酸(Trp)残基为发射基团的荧光光谱,其荧光强度和最大吸收波长反映了Trp残基所处微环境的变化[13,22,26]。当蛋白质三级结构展开时,内部的Trp残基暴露于极性环境中,最大吸收波长增大(即红移)[13,22]。水热预处理前后PPI的荧光发射光谱如图3所示。对照PPI具有323 nm处的最大荧光发射峰和332 nm处的副峰,表明Trp残基主要位于PPI结构内部,因为包埋于蛋白质分子内部的Trp残基的荧光发射峰通常在323~335 nm之间[22,26]。与PPI相比,HPPI在323 nm处的荧光峰强度明显减弱,负峰则红移至339 nm且强度明显增加,这表明水热处理使PPI中Trp残基所处的微环境极性增加(包埋于蛋白内部的Trp残基暴露于水溶液中),意味着PPI的三级结构展开,之前被掩蔽的酶解位点也很可能因此暴露出来。此外,随着水热压力的增大,339 nm处的荧光峰强度先增加,然后稍稍下降,这说明水热处理压力对PPI三级结构的松散程度有重要影响。
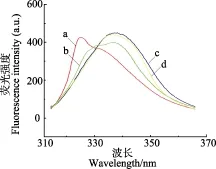
图3 水热预处理对花生分离蛋白内源荧光发射光谱的影响Fig.3 Influences of hydrothermally pretreatment on the intrinsic emission fluorescence spectra of peanut protein isolate
2.3.2 红外光谱分析
蛋白质红外光谱中酰胺I带(1 600~1 700 cm-1)频率的迁移与蛋白质二级结构密切相关[27]。如图4a所示,将对照PPI红外光谱中酰胺I带进行Gaussian去卷积、二阶导数拟合,得到 6 个子峰,分别归属为蛋白二级结构中的4种构象:α-螺旋(1 658 cm-1)、β-折叠(1 619 cm-1、1 632 cm-1、1 685 cm-1)、β-转角(1 671 cm-1)和无规则卷曲(1 645 cm-1)[24]。通过计算每种构象的峰面积与酰胺I带的总峰面积之比即可得到每种构象所占的百分含量。由表5可见,对照PPI二级结构中α-螺旋、β-折叠、β-转角、无规则卷曲的含量分别为24.6%、36.2%、21.3%、17.9%。此结果与之前的文献报道相似,表明PPI含有较多的α-螺旋和β-折叠结构[28]。经过水热处理后,HPPI中α-螺旋和β-转角的含量显著(P<0.05)降低,而β-折叠和无规则卷曲的含量显著(P<0.05)升高。在蛋白质二级结构中,无规则卷曲与其他几种构象相比显然是一种更加松散的结构[29]。本研究结果与文献报道[16-17]的相似,表明适当的水热处理可使植物蛋白二级结构中无规则卷曲的含量增加。α-螺旋和β-转角都呈紧密无空腔结构,对蛋白酶的水解作用有很强的抵抗力,而β-折叠的紧密程度和构象稳定性都相对较低,因此酶解敏感性较高[30]。此外,值得注意的是与对照PPI相比,虽然HPPI中β-折叠总含量增加,但是1 685 cm-1处的β-折叠含量却下降了。据Cruz-Angeles等[23]研究发现,1 682~1 700 cm-1处的β-折叠要比1 615~1 637 cm-1处的β-折叠结构更加紧密。由上述结果分析可知,水热预处理可使花生分离蛋白二级结构变得松散、紧密程度下降。另一方面,HPPI-105 MPa的无规则卷曲含量显著(P<0.05)低于HPPI-90 MPa,表明水热压力过高可能会导致蛋白二级结构重新聚集。
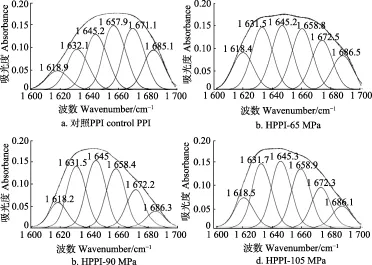
图4 水热预处理前后花生分离蛋白红外光谱中酰胺I带拟合曲线Fig.4 Deconvoluted infrared amide I band of unpretreated and hydrothermally pretreated peanut protein isolate
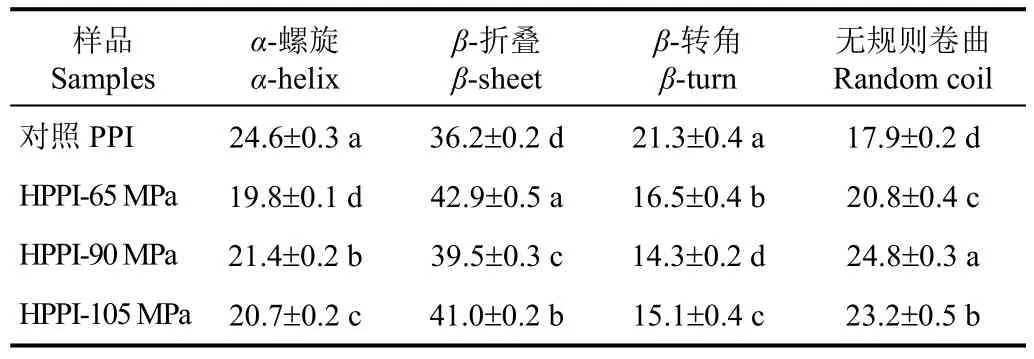
表5 水热预处理前后花生蛋白二级结构百分比Table 5 Secondary structure percentage of unpretreated and hydrothermally pretreated peanut protein isolate %
荧光光谱和红外光谱分析结果都表明水热处理后PPI的空间构象发生了明显变化,适当压力的水热处理可使其三级结构展开、二级结构紧密程度下降。这可能是因为水热处理破坏了维持蛋白质高级结构的次级键和二硫键,从而使花生蛋白的高级结构展开、蛋白聚集体破碎。此外,如前所述水热处理过程中,PPI发生了轻度自发水解,使其分子量降低、带电基团增多,也可能是其空间构象变得松散的重要原因之一。与致密的蛋白结构相比,松散的蛋白结构显然具有更多的酶解位点,而且空间位阻较小,更容易与蛋白酶接触反应,因此具有更高的酶解敏感性[30-31]。
3 结 论
1)利用Design Expert 8.0.6设计软件中Box-Behnken模型对水热预处理条件进行了优化,经检验证明该模型是合理可靠的(R2=0.97>0.95),能够较好地预测花生分离蛋白酶解产物的水解度。优化后的水热预处理条件为水热压力90 MPa、温度85℃、时间20 min,此条件下酶解产物水解度为16.3%,相对未经预处理的酶解产物提高了8.1个百分点。
2)水热预处理提高了花生分离蛋白(peanut protein isolate,PPI)主要组分花生球蛋白和伴球蛋白的酶解敏感性,使更多的花生蛋白可被Protamex酶解而变得可以溶解。在最优水解预处理条件下,酶解产物蛋白质回收率为73.4%,相对未经预处理的酶解产物提高了31.9个百分点。
3)水热处理后,PPI的空间构象发生了明显的变化,适当压力的水热处理可使其三级结构展开、二级结构紧密程度下降,可能是其酶解感性提高的主要原因。
综上所述,水热预处理是一种辅助提高花生分离蛋白酶解效率行之有效的方法,可使酶解产物水解度和蛋白质回收率大大提高,为蛋白高效酶解改性提供技术参考和理论依据。
[1] Phillips G O,Williams P A. Handbook of Food Proteins[M]. Cambridge:Woodhead Publishers,2011,242-246.
[2] 赵晓燕,孙秀平,陈峰亮,等. 花生蛋白的研究进展及开发利用现状[J]. 中国粮油学报,2011,26(12):118-122. Zhao Xiaoyan,Sun Xiuping,Chen Fengliang,et al. Research progress and application of peanut protein[J]. Journal of the Chinese Cereals and Oils Association,2011,26(12):118-122.(in Chinese with English abstract)
[3] Zhao X Y,Chen J,Du F L. Potential use of peanut by-products in food processing:a review[J]. International Journal of Food Science and Technology,2012,49:521-529.
[4] 魏红艳,卞科. 花生蛋白的研究与开发[J]. 农产品加工(创新版),2010,(5):46-51. Wei Hongyan,Bian Ke. Research and development of peanut protein[J]. Innovational Edition of Farm Products Processing,2010,(5):46-51.(in Chinese with English abstract)
[5] Tavano O L. Protein hydrolysis using proteases:An important tool for food biotechnology[J]. Journal of Molecular Catalysis B:Enzymatic,2013,90:1-11.
[6] 陈林,吴克刚,柴向华,等. 物理预处理改善食品蛋白酶解特性的研究进展[J]. 食品与发酵工业,2013,39(10):33-38. Chen Lin,Wu Kegang,Chai Xianghua,et al. Progress on improving the enzymatic hydrolysis of food protein using physical pre-treatment[J]. Food and Fermentation Industries,2013,39(10):33-38.(in Chinese with English abstract)
[7] Chen L,Chen J S,Yu L,et al. Improved emulsifying capabilities of hydrolysates of soy protein isolate pretreated with high pressure microfluidization[J]. LWT-Food Science and Technology,2016,69:1-8.
[8] 陈林,吴克刚,柴向华,等. 微射流均质预处理提高大豆分离蛋白酶解效率及酶解产物乳化性能[J]. 农业工程学报,2015,31(5):331-338. Chen Lin,Wu Kegang,Chai Xianghua,et al. Microfluidization pretreatment improving enzymatic hydrolysis of soy isolated protein and emulsifying properties of hydrolysates[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2015,31(5):331-338.(in Chinese with English abstract)
[9] 张宇昊,王强. Alcalase 酶水解花生蛋白制备花生短肽的研究[J]. 农业工程学报,2007,23(4):258-263. Zhao Yuhao,Wang Qiang. Peanut protein hydrolyzing by Alcalase to prepare peanut oligopeptides[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2007,23(4):258-263.(in Chinese with English abstract)
[10] Tsou,M J,Lin W T,Lu H C,et al. The effect of limited hydrolysis with Neutrase and ultrafiltration on the antiadipogenic activity of soy protein[J]. Process Biochemistry,2009,45(2):217-222.
[11] Gall M L,Guguen J,Sve B,et al. Effects of grinding and thermal treatments on hydrolysis susceptibility of pea proteins(Pisum sativum L.)[J]. Journal of Agricultural and Food Chemistry,2005,53:3057-3064.
[12] Govindaraju H,Srinivas H. Studies on the effects of enzymatic hydrolysis on functional physico-chemical properties of arachin[J]. LWT-Food Science and Technology,2006,39(1):54-56.
[13] Zhao G L,Liu Y,Zhao M M,et al. Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J]. Food Chemistry,2011,127(4):1438-1443.
[14] Stanojevic S P,Barac M B,Pesic M B,et al. Bioactive proteins and energy value of Okara as a byproduct in hydrothermal processing of soy milk[J]. Journal of Agricultural and Food Chemistry,2013,61(38):9210-9219.
[15] 叶荣飞,杨晓泉,郑田要,等. 热变性和热聚集对大豆分离蛋白溶解性的影响[J]. 食品科学,2008,29(7):106-108. Ye Rongfei,Yang Xiaoquan,Zheng Tianyao,et al. Effects of thermal denaturation and aggregation on solubility of soy protein isolates[J]. Food Science,2008,29(7):106-108.(in Chinese with English abstract)
[16] Tedford L A,Kelly S M,Price N C,et al. Combined effects of thermal and pressure processing on food protein structure[J]. Food and Bioproducts Processing,1998,76(2):80-86.
[17] Tedford L A,Kelly S M,Price N C,et al. Interactive effects of pressure,temperature and time on the molecular structure of beta-lactoglobulin[J]. Journal of Food Science,1999,64(3):396-399.
[18] Wang H,Wang T,Johnson L A. Mechanism for refunctionalizing heat-denatured soy protein by alkaline hydrothermal cooking[J]. Journal of the American Chemists’Society,2006,83(1):39-45.
[19] Aouzelleg A,Bull L A,Price N C,et al. Molecular studies of pressure/temperature-induced structural changes in bovine beta-lactoglobulin[J]. Journal of the Science of Food and Agriculture,2004,84(5):398-404.
[20] Adler-Nissen J. Enzymic Hydrolysis of Food Proteins[M]. London:Applied Science Publishers,1986.
[21] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227:680-685.
[22] 魏慧敏,张年辉,杜林方. 用蛋白内源荧光考察溶液pH对PSII两种外周蛋白构象的影响[J]. 四川大学学报:自然科学版,2004,41(5):1059-1063.Wei Huimin,Zhang Nianhui,Du Linfang. Effects of pH on conformations of the two extrinsic proteins in photosystem II examined by the influorescence[J]. Journal of Sichuan University:Natural Science Edition,2004,41(5):1059-1063.(in Chinese with English abstract)
[23] Cruz-Angeles J,Martinez L M,Videa M. Application of ATR-FTIR spectroscopy to the study of thermally induced changes in secondary structure of protein molecules in solid state[J]. Biopolymers,2015,103(10):574-484.
[24] 卢雁,张玮玮,王公轲. FTIR用于变性蛋白质二级结构的研究进展[J]. 光谱学与光谱分析,2008,28(1):88-93. Lu Yan,Zhang Weiwei,Wang Gongke. Progress in study of secondary structure of denaturized protein by FTIR[J]. Spectroscopy and Spectral Analysis,2008,28(1):88-93.(in Chinese with English abstract)
[25] Yu J M,Ahmedna M,Goktepe I. Peanut protein concentrate:production and functional properties as affected by processing[J]. Food Chemistry,2007,103(1):121-129.
[26] 仇超颖,孙为正,崔春,等. 干燥方式对脱酰胺小麦面筋蛋白特性的影响[J]. 华南理工大学学报:自然科学版,2014,42(6):129-135. Qiu Chaoying,Sun Weizheng,Cui Chun,et al. Effects of drying methods on characteristics of deamidated wheat gluten[J]. Journal of South China University of Technology:Natural Science Edition,2014,42(6):129-135.(in Chinese with English abstract)
[27] Li X J,Liu T H,Song L J. Influence of high-molecularweight glutenin subunit composition at Glu-A1 and Glu-D1 loci on secondary and micro structures of gluten in wheat(Triticum aestivum L.)[J]. Food Chemistry,2016,213:728-734.
[28] Zhang Q T,Tu Z C,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92:30-37.
[29] Lee S H,Lefèvre T,Subirade M,et al. Changes and roles of secondary structures of whey protein for the formation of protein membrane at soy oil/water interface under highpressure homogenization[J]. Journal of Agricultural and Food Chemistry,2007,55(26),10924-10931.
[30] Chen L,Chen J S,Ren J Y,et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2600-2609.
[31] O’Loughlin I B,Murray B A,Kelly P M,et al. Enzymatic hydrolysis of heated aggregates of whey protein isolate[J]. Journal of Agricultural and Food Chemistry,2012,60(12):4895-4904.
Hydrothermal pretreatment improving proteolysis efficiency of peanut protein isolates and its mechanism analysis
Chen Lin1,Chen Jianshe2,Yu Hongpeng1,Wu Kegang1※
(1. Department of Food Science,College of Chemical Engineering and Light Industry,Guangdong University of Technology,Guangzhou 510006,China;2. School of Food Science and Biotechnology,Zhejiang Gongshang University,Hangzhou 310018,China)
The use of peanut protein has attained an increasing attention,primarily attributed to its high nutrition value,steady supply,and low cost compared with other proteins with different sources. Peanut protein isolate(PPI) is the most refined peanut protein product,containing 90% protein on a moisture-free basis,and is used as a kind of important protein material in food industry. However,the poor protein solubility and functional properties of commercial PPI limit its application in food and non-food products. Because of small side reactions and safeness,proteolysis has been widely used to improve protein functionalities and to prepare bioactive peptides. However,peanut proteins are resistant to proteolysis due to their compact structures that protect many of the hydrolysis sites. Recently,several studies have reported that hydrothermal treatment could not only alter the spatial conformations of globular proteins,but also break up protein aggregates into smaller pieces,which may cause the exposure of previously buried hydrolysis sites. However,little work has been done so far to investigate this possibility. Therefore,this work aimed to investigate the influences of hydrothermal pretreatment on the proteolysis pattern and the structure of PPI. Hydrothermally cooked PPI(HPPI) was prepared using a CJ-200 autoclave,and protease Protamex was used for the preparation of PPI hydrolysates(PPIH) and HPPI hydrolysates(HPPIH). Response surface methodology(RSM) was used to optimize the processing conditions of hydrothermally cooking,and the optimal conditions were as follows:the pressure was 90 MPa,the temperature was 85 ℃,and the time was 20 min. The actual degree of hydrolysis(DH) of HPPIH obtained under this pretreatment condition was 16.3%±0.2%,which was not significantly different(P>0.05) from the predicted value(DH=16.2%). And the analysis of variance of the regression equation for the response surface quadratic model showed that the sequence of the importance for influential factors was pressure > temperature > time. The analysis of sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE) profiles of PPI,HPPI,PPIH and HPPIH showed that hydrothermal pretreatment substantially improved the enzymatic accessibility of the major subunits of conarachin and arachin in PPI,which were initially resistant to Protamex hydrolysis. As a result,more peanut proteins in HPPI could be readily hydrolyzed and become soluble,causing a strong increase in protein recovery(PR) for HPPIH. Under the 90 MPa pressure,HPPIH showed a much higher PR of 73.4% than that of PPIH(PR=41.5%). In addition,it was somewhat surprising that the observations of SDS-PAGE profiles and DH measurement both showed that hydrothermal pretreatment enhanced the spontaneous hydrolysis of PPI. Analysis of the intrinsic emission fluorescence spectra of PPI and HPPI demonstrated that compared with the control PPI,HPPI showed a decrease in the intensity of the fluorescence peak at 323 nm,and a red-shift for the peak at 332 nm,which suggested that hydrothermal treatment caused the unfolding of tertiary structure for PPI. Analysis of Fourier transform infrared spectra(FTIR) of PPI and HPPI demonstrated that compared with the control PPI,HPPI showed a significant decrease in α-helix and β-turn,and an increase in β-sheet and random coil,which suggested that hydrothermal treatment could loosen the secondary structure of peanut protein. So it is inferred that the unfolded tertiary structure and the loosened secondary structure for HPPI after hydrothermal pretreatment may be the main causes for its improved enzymatic accessibility. In conclusion,this study shows that hydrothermal pretreatment is a highly effective technique to accelerate and enhance the proteolysis of PPI.
proteins;heat treatment;optimization;hydrothermal pretreatment;peanut proteins isolates;proteolytic susceptibility;protein conformation
10.11975/j.issn.1002-6819.2017.01.038
TS201.1
A
1002-6819(2017)-01-0278-07
陈 林,陈建设,于泓鹏,吴克刚. 水热预处理提高花生分离蛋白酶解效率及其机理分析[J]. 农业工程学报,2017,33(1):278-284.
10.11975/j.issn.1002-6819.2017.01.038 http://www.tcsae.org
Chen Lin,Chen Jianshe,Yu Hongpeng,Wu Kegang. Hydrothermal pretreatment improving proteolysis efficiency of peanut protein isolates and its mechanism analysis[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2017,33(1):278-284.(in Chinese with English abstract)doi:10.11975/j.issn.1002-6819.2017.01.038 http://www.tcsae.org
2016-07-09
2016-10-30
广东省科技计划项目(2016A020210113);高等学校博士学科点专项科研基金项目(20134420120008)。
陈 林,男,广东广州人,讲师,博士,2008年赴英国利兹大学研修,主要从事食品生物技术、蛋白质化学与工程方面的研究。广州广东工业大学轻工化工学院食品系,510006。Email:l.chen@gdut.edu.cn
※通信作者:吴克刚,男,贵州人,教授,博士,主要从事食品生物技术方面的研究。广州广东工业大学轻工化工学院食品系,510006。Email:kgwu@gdut.edu.cn
