有氧呼吸条件下粪肠球菌LD33高密度增殖的研究
2017-01-14焦月华张兰威刘飞张爽
焦月华,张兰威,刘飞,张爽
(1.哈尔滨工业大学化工与化学学院,哈尔滨150090;2.黑龙江中医药大学药物安全性评价中心,哈尔滨150040;3.东北农业大学食品学院,哈尔滨150030)
有氧呼吸条件下粪肠球菌LD33高密度增殖的研究
焦月华1,2,张兰威1,刘飞3,张爽3
(1.哈尔滨工业大学化工与化学学院,哈尔滨150090;2.黑龙江中医药大学药物安全性评价中心,哈尔滨150040;3.东北农业大学食品学院,哈尔滨150030)
为获得高活菌数的粪肠球菌LD 33的发酵液,首先通过优化粪肠球菌LD 33的有氧呼吸代谢培养条件,随后利用单因素和正交实验对粪肠球菌LD 33的高密度增殖培养基组分进行研究。结果表明,粪肠球菌LD33的最优增殖培养基为乳清60 g/L,葡萄糖30 g/L,蛋白胨20 g/L和酵母粉10 g/L(均为质量浓度);当接种量为1%,初始pH值为6.4且转速为220 r/min时,在37℃下培养24 h后,发酵液中粪肠球菌LD33的活菌数可以达到6.37×109mL-1。
粪肠球菌;高密度培养;有氧呼吸
0 引 言
粪肠球菌是主要定植于人类和动物肠道以及部分来源于传统发酵食品中的乳酸菌。它们产生多种肠球菌素,能够抑制革兰氏阳性致病菌和其他食源性致病菌的生长[1]。本实验室在筛选用于制作的发酵剂菌株过程中,发现1株粪肠球菌LD 33对志贺氏痢疾杆菌有很强的抑制能力,经过过氧化氢和有机酸干扰排除试验以及蛋白酶作用试验后,证明发挥抑菌作用的物质为抗菌肽。此外,该菌株在进行有氧呼吸代谢时能够显著提高生物量和存活率[2]。本研究以粪肠球菌LD 33为研究对象,在优化其有氧呼吸代谢条件的同时采用单因素和正交试验对其高密度增殖培养基成分进行了优化,确定高密度培养工艺,以期为后期大规模工业化生产优质的益生菌制剂奠定基础。
1 实 验
1.1 材料与设备
1.1.1 菌株来源
粪肠球菌LD 33(Enterococcus faecalis),本实验室保存。分离自内蒙古传统发酵稀奶油制品,能够抑制食源性致病菌,经前期实验已初步确定能够产生抗菌肽。
1.1.2 试剂和培养基
脱脂乳粉(进口),酵母粉,牛肉膏,蛋白胨,琼脂粉,血红素,大豆蛋白胨,胰蛋白胨,M 17培养基,葡萄糖,蔗糖,乳糖,麦芽糖,其余试剂均为国产分析纯。
基础增殖培养基:按照文献[3]中方法进行配制并进行部分修改,其中乳清粉60 g,KH2PO4和Na2HPO4均为7.5 g,加蒸馏水至1 L,110℃高压灭菌10min。
血红素溶液[4]:配置100 mL浓度为0.05 m o l/L的NaOH水溶液,称取0.05 g血红素,将其溶于NaOH水溶液中,即为质量浓度为0.5 g/L的血红素溶液,随后倒入棕色广口瓶中,4℃下保存备用。
1.1.3 仪器和设备
恒温培养振荡器(ZWY-240),生化培养箱(DHP-P272),超净工作台(VD-1320),高压灭菌锅(HVE-50),紫外/可见光分光光度计(DU 800),pH计(Delta 320)。
1.2 方法
1.2.1 菌体的活化
将本实验室保存的粪肠球菌LD 33按照体积分数为1%的接种量接入到M 17液体培养基中,37℃下培养,每24 h传代一次,活化两次。
1.2.2 有氧呼吸代谢条件优化
将活化后的粪肠球菌LD33以体积分数为1%的接种量,接种到灭菌后的M 17液体培养基中(三角瓶中M 17液体培养基的含量为瓶体容积的1/10,在灭菌之前以2%的体积比向培养基中添加血红素溶液),振荡培养8 h(稳定期初期)。通过测定OD 600nm的吸光度值来比较不同温度(30,37,42℃)、不同转速(200,220,250 r/min)及初始pH值(6.0,6.4,6.8)对其增殖效果的影响。
1.2.3 碳氮源对菌体密度的影响
根据文献[5],在基础增殖培养基中分别添加质量浓度为20 g/L葡萄糖、蔗糖、乳糖、麦芽糖作为碳源,或者在基础增殖培养基中分别添加质量浓度为25 g/L的大豆蛋白胨、牛肉膏、胰蛋白胨、蛋白胨作为氮源,以活菌数来反映不同碳氮源对粪肠球菌LD 33增殖效果的影响。
1.2.4 发酵培养基优化
在基础培养基的基础上,采用三因素三水平的正交试验优化增殖培养基,其中碳氮源的因素水平设计除了根据1.2.3的实验结果之外,还根据单因素的变化趋势,综合考虑效果和成本因素而定。另外,考虑到有氧呼吸条件下粪肠球菌增殖速率显著增加,在生长过程中随着菌体生物量的不断增加,其对矿物质元素和维生素的需求量也会相应的增加,因此根据文献[3,6]选择酵母粉作为第三个因素。通过测定培养24 h后的活菌数来确定最佳增殖培养基。具体的因素水平如表1所示。
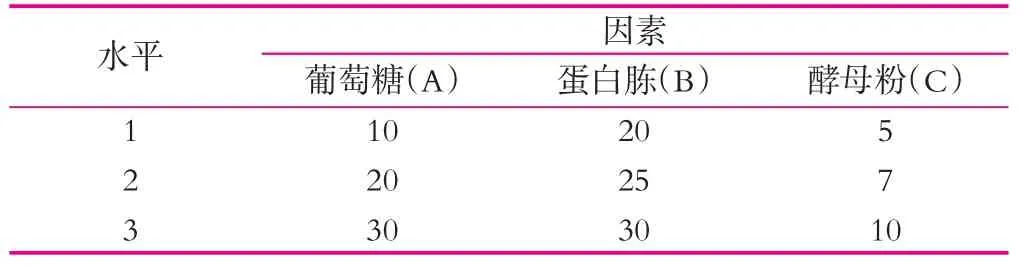
表1 因素水平编码 g/L
1.2.5 菌体活菌计数方法
取1 mL发酵液,利用梯度稀释平板活菌计数法[20],选择适宜稀释度涂布M 17平板,随后将平板37℃下培养48 h后计活菌数。
1.3 统计分析
试验数据采用SPSS 17.0软件进行单因素方差分析,并用Duncan's法进行多重比较,结果以“平均值±标准误差”表示。
2 结果与分析
2.1 培养条件对增殖效果的影响
温度对粪肠球菌LD 33增殖的影响结果如图1所示。由图1可以看出,粪肠球菌LD 33在30,37和42℃下生长时均有4 h左右的生长迟缓期,其中当30℃下培养时,粪肠球菌LD 33的生物量显著低于在37℃下培养的生物量,随后菌体的生物量都随着时间的推移而不断增加,到8 h为止,在30℃和42℃下培养的菌体的生物量差异不显著,菌体在37℃培养时生物量增加的最大。细菌的生长繁殖是同化作用超过异化作用,细胞原生质的量不断增加,体积增大,随后细胞分裂导致个体数目增加,这是一个紧密联系又很难划分的过程,它取决于个体菌株的生长速率,也即胞内酶的代谢活性,而这又与培养温度具有密切关系,最适增殖温度随菌株不同而异。粪肠球菌一般来源于哺乳动物肠道,属于嗜温菌,因此,结合图1的结果选择37℃作为粪肠球菌LD 33高密度培养的温度。
图1 温度对粪肠球菌LD 33增殖的影响
图2 为不同初始pH对粪肠球菌LD 33增殖的影响。由图2可以看出,粪肠球菌LD 33在不同初始pH值培养基中培养时,在前4 h内均处于生长迟缓期,此后其生物量开始迅速增长。6 h时,在初始pH 6.4和pH 6.8下培养时的生物量显著高于其在初始pH 6.0培养时的生物量,然而,当培养基初始酸度高于pH 6.4,当进入稳定期初期后,生物量的增长并没有显著的差异。由于粪肠球菌LD 33具有作为益生菌制剂应用的潜力,为了让其更适应胃肠道的酸性环境。因此,增殖培养基的初始pH值为6.4比较适宜。

图2 初始pH值对粪肠球菌LD 33增殖的影响
图3为不同转速对粪肠球菌LD 33增殖的影响。由图3可以看出,当摇床转速为200 r/min时,粪肠球菌LD 33的生物量最低,在转速为220 r/min和250 r/min时,菌株的吸光度值一样,也即生物量一样。这是由于虽然粪肠球菌LD 33能够在血红素存在的情况下进行有氧呼吸代谢,但是当通气过多,未被利用的氧气分子仍然会对其菌体细胞造成损伤。因此,摇床的转速不宜过高,确定摇床的最适转速为220 r/min。

图3 摇床转速对粪肠球菌LD 33增殖的影响
2.2 不同碳源对乳酸菌生长的影响
图4为不同碳源对粪肠球菌LD 33增殖的影响。由图4可以看出,葡萄糖促生长效果最明显,乳糖次之,而麦芽糖和蔗糖的增殖效果明显低于乳糖和葡萄糖,其中麦芽糖对粪肠球菌LD 33的生长几乎没有促进作用,因此选择葡萄糖作为碳源。

图4 不同碳源对粪肠球菌LD33增殖的影响
2.3 不同氮源对乳酸菌生长的影响
图5为不同氮源对粪肠球菌LD 33增殖的影响。由图4可以看出,牛肉膏促进粪肠球菌LD 33增殖的效果最明显,而其他三种氮源的促生长效果没有显著差异。这是可能是由于牛肉膏中含有乳酸菌快速增殖生长所需要多肽和核苷酸等。综合考虑氮源的促增殖效果和成本,选择价格较便宜的蛋白胨,其增菌效果也比较明显,粪肠球菌LD 33的活菌数达到了1.29× 109mL-1。
2.4 发酵培养基优化
粪肠球菌LD 33高密度增殖培养基的正交试验的极差分析结果如表2所示。
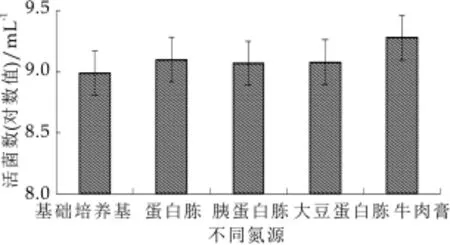
图5 不同氮源对粪肠球菌LD33增殖的影响

表2 优化培养基的正交实验结果
由表2可以看出,在优化培养基中,优选的三个因素,按照极差大小主次顺序为B>A>C,即蛋白胨对粪肠球菌LD 33增殖的影响最大,葡萄糖影响次之,酵母粉最小。最佳增殖培养基配方为A3B3C3,然而由于A3B3C3不在设计的正交试验组中,需要对其进行验证实验,验证实验结果表明,粪肠球菌LD 33的活菌数为6.37×109mL-1,高于试验组中的活菌数最大的组合A3B3C2。因此得出A3B3C3为最佳增殖培养基成分组合,即:乳清60 g/L,葡萄糖30 g/L,蛋白胨30 g/L,酵母粉10 g/L(均为质量浓度)。
3 讨 论
乳酸菌属于兼性厌氧菌,在进行厌氧发酵过程中容易受到环境中氧气的胁迫作用,在细胞内会形成超氧阴离子、羟自由基、过氧化氢和臭氧等活性氧簇,它们会攻击蛋白质、核酸和脂类等胞内物质,导致菌体细胞受到损伤,进而引起细胞老化和衰亡[7]。然而,目前研究表明部分乳酸菌在进行有氧呼吸代谢时能够增加菌体细胞的存活率和生物量[8],这是由于它们能够通过呼吸链将质子传递给培养环境中的分子氧并转化为水,不但细胞内氧含量降低从而避免了氧分子对其菌体细胞的损伤,而且还无需再通过F0F1-ATPase利用水解ATP产生的能量将质子外排,此外,研究还表明F0F1-ATP合成酶的“角色”还可能会发生反转,通过重新收回有氧呼吸链外排的质子来合成ATP[9-10]。研究结果表明[2,8],粪肠球菌也能够进行有氧呼吸代谢,因此本研究中通过优化有氧呼吸培养条件来提高粪肠球菌LD 33的生物量和存活率。乳清粉是干酪生产的副产物,不但来源丰富,而且价格相对较为便宜。有研究表明[3,6],当乳清粉是增殖培养基的主要成分时,在其中生长的乳酸菌菌体细胞能够达到相对较高的浓度。然而乳清粉缺陷之处在于,其主要含有乳清蛋白和乳糖,因此,在乳清培养基中还需要加入多种供乳酸菌生长所需的生长因子,同时加入缓冲盐类提高增殖培养基的缓冲能力,从而将发酵液的pH值控制在适宜的范围内。因此,本研究利用乳清磷酸盐缓冲液作为基础培养基,通过正交优化来确定酵母粉、葡萄糖和蛋白胨在高密度增殖培养基中的添加量。
4 结 论
本研究通过优化得出有氧呼吸条件下粪肠球菌LD 33的高密度增殖培养基的最佳成分为:乳清60 g/L,蛋白胨30 g/L,葡萄糖30 g/L,酵母粉10 g/L(均为质量浓度);当接种量为1%,初始pH值为6.4且转速为220 r/min时,在37℃下培养24 h后,发酵液中粪肠球菌LD 33的活菌数可以达到6.37×109mL-1,为益生菌制剂的开发和应用奠定了基础。
[1]MORENO M F,SARANTINOPOULOS P,TSAKALIDOU E,et al.The role and application of Enterococci in food and health[J].International journal of food microbiology,2006,106:1-24.
[2]JIAO Y H,ZHANG L W,LIU F.Screening of lactic acid bacteria strains with respiration ability in the present of heme[J].Advanced Materials Research.Trans Tech Publications,Switzerland,2013,726-731:448-451.
[3]李艾黎,代敏,霍贵成.利用乳清培养基生产乳品发酵剂的研究[J].食品科学,2006,27(4):34-36.
[4]付良,刘飞,霍贵成.一株能够利用血红素进行有氧呼吸的乳酸乳球菌[J].微生物学报,2008,48(9):1256-1269.
[5]冯慧杰,沐万孟,张涛,等.乳酸乳球菌的高密度发酵研究[J].食品工业科技,2014,14:197-201.
[6]李艾黎,杜鹏,霍贵成.酵母粉浓度对酸奶菌株发酵动力学参数的影响[J].食品工业科技,2009,30(4):166-168,170.
[7]付龙云.乳酸菌抗氧胁迫及有氧生长的研究[D].山东大学,2013.
[8]PEDERSEN M B,GAUDU P,LECHARDEUR D,et al.Aerobic respiration metabolism in lactic acid bacteria and uses in biotechnology [J].Annual review of food science and technology,2012,3:37-58.
[9]KOEBMANN B,BLANK L M,SOLEM C,et al.Increased biomass yield of Lactococcus lactis during energetically limited growth and respiratory conditions[J].Biotechnology and applied biochemistry, 2008,50(1):25-33.
[10]LECHARDEUR D,CESSELIN B,FERNANDEZ A,et al.Using Heme as an Energy Boost for Lactic Acid Bacteria[J].Current opinion in biotechnology,2011,22(2):143-149.
Study of high density culture of Enterococcus faecalis LD 33 undergoing aerobic respiration
JIAO Yue-hua1,2,ZHANG Lan-wei1,LIU Fei3,ZHANG Shuang3
(1.School of Chemistry and Chemical Engineering,Harbin Institute of Technology,Harbin 150090,China;2.Center of Drug Safety Evaluation,Heilongjiang University of Chinese Medicine,Harbin 150040,China;3.Food College, Northeast Agricultural University,Harbin 150030,China)
In order to prepare highly concentrated Enterococcus faecalis LD33 cell culture,at first optimization of fermentation conditions was carried out,then single factor test and orthogonal test was applied to find the optimal high density proliferation medium of Enterococcus faecalis LD33.Results showed that the optimal medium for proliferation of Enterococcus faecalis LD33 cells was composed of60 g/L whey,30 g/L glucose,20 g/L peptone and 10 g/L yeast powder.And when the inoculation amount was 1%,the initial pH was6.4 and the rotational speed of shaking incubator was220 r/min,the number of viable bacteria cell of Enterococcus faecalis LD33 in the fermentation broth could reach 6.37× 109CFU/mL after cultivated at37°C for 24 h.
Enterococcus faecalis;high density culture;aerobic respiration
Q 93-335
A
1001-2230(2016)05-0012-03
2016-04-25
国家自然科学基金(31401512),黑龙江省教育厅科学技术研究项目(12541768)。
焦月华(1981-),女,助理研究员,研究方向为食品微生物。
张兰威
