关节腔注射用雷公藤甲素微球的制备与毒性评价
2017-01-07王丽娟车坷科张如
王丽娟++++++车坷科++++++张如超


[摘要]目的 评价关节腔注射用雷公藤甲素微球的质量和毒性。方法 采用乳化溶剂挥发法制备雷公藤甲素微球,透射电镜观察微球表面形态和大小,红外光谱仪考察微球形成情况,马尔文粒度仪测定微球粒度分布,HPLC测定包封率、载药量,数学模型拟合微球体外释放规律,血液学参数和生化指标评价微球毒性。结果 微球形态圆整,大小均一,平均粒径、包封率和载药量分别为4.75 μm、(74.37±2.30)%、(1.53±0.27)%,微球释放更符合Ritger-Peppas方程,与空白对照组相比,各项血液学参数和生化指标未发生明显改变。结论 雷公藤甲素微球可以作为关节腔注射用缓释制剂的新型制剂。
[关键词]雷公藤甲素;微球;毒性;关节腔注射
[中图分类号] R943 [文献标识码] A [文章编号] 1674-4721(2016)10(c)-0004-05
[Abstract]Objective To evaluate the quality and toxicity of triptolide microspheres for intra-articular injection.Methods Triptolide microspheres was prepared by emulsion solvent evaporation method.Surface morphology and size of microspheres were observed by transmission electron microscope.The formation of microspheres was investigated with infrared spectrometer.Entrapment efficiency and drug loading was determined by HPLC.The release of microspheres in vitro was fitted by mathematical model.The toxicity of microspheres was evaluated using hematological parameters and biochemical indexes.Results The microspheres were spherical in shape with uniform size.The mean diameter,encapsulation efficiency and drug loading was 4.75 μm,(74.37±2.30)% and (1.53±0.27)% respectively.The release of microspheres was fit for Ritger-Peppas equation.There were no significant differences of blood test between microspheres and control group.Conclusion Triptolide microspheres might be used as a new preparation for intra-articular injection.
[Key words] Triptolide;Microspheres;Toxicity;Intra-articular injection
类风湿性关节炎(rheumatoid arthritis,RA)是一种发病率高、致残率高、严重影响患者生活质量的慢性全身性自身免疫性疾病,常出现一个或几个关节尤其是负重大关节反复肿胀、积液,因此,针对RA的局部关节靶向治疗[1-3]具有重要的临床意义。目前,关节腔内注射是局部靶向治疗RA最有效的给药途径,它将药物直接输送至受累关节,避免或减轻全身副作用,延长药物在关节内的维持时间,以较小剂量发挥最大药效。雷公藤甲素(triptolide,TPL),又叫雷公藤内酯醇,是卫矛科植物雷公藤的主要活性成分之一。基于TPL疗效好但毒副作用大的特点,本文设计了TPL微球,即以TPL为模型药物,以聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)为载体材料,制成关节腔内注射用缓释微球,以达到局部靶向于病变关节,延缓药物释放、减少给药次数、减少全身副作用、增加治疗效果和患者顺应性的目的。
1材料与方法
1.1药品与试剂
雷公藤甲素(纯度99.8%,中国食品药品检定研究院,201404);聚乳酸-羟基乙酸共聚物(50∶50,MW=15 000,山东医疗器械研究所,14092703),聚乙烯醇(PVA1788,山西三维集团股份有限公司),吐温-80(四川金山制药有限公司),0.9%氯化钠注射液(天圣制药集团股份公司),甲醇为色谱纯,其他试剂均为分析纯。
1.2仪器
电子分析天平(AR2140万分之一,瑞士梅特勒-托利多),恒温水浴磁力搅拌器(ZNCL-GS,河南爱博特科技发展有限公司),高速冷冻离心机(Avanti J-26XP,美国Beckman公司),冷冻干燥机(Coolsafe110-4pro型,丹麦labogene-Scanvac),shimadzu高效液相色谱仪(LC-10AT,日本岛津公司),透射电子显微镜(JEM 2010,日本日立公司),马尔文动态粒度分析仪(Malvern ZEN 3600,英国马尔文公司),傅里叶红外光谱仪(Nicolet iS50,Thermo Fisher公司),压片机(YP-2,上海山岳科技仪器有限公司),超纯水机(Milli-Q Biocel A-10,美国Millipore公司)。
1.3实验动物
健康新西兰兔,雌雄不限,体重(2.1±0.2)kg,由重庆医科大学实验动物中心提供,合格证号XCXK(渝)20120001。
1.4方法
1.4.1微球制备
采用溶剂挥发法制备TPL微球,将适量PLGA和TPL溶于二氯甲烷/甲醇的油相中,搅拌条件下缓慢滴加到含有一定量PVA的水相中,滴毕,继续搅拌5~10 min,形成油/水(O/W)乳剂,加入同体积超纯水,降低转速,继续搅拌4~6 h,待有机溶剂挥发完全后,微球固化。超速冷冻离心(12 000 r/min,4℃),洗涤,收集微球,冷冻干燥后即得微球干燥粉末。空白微球制备方法同上,不加TPL。
1.4.2微球形态观察
取1滴微球混悬液,超纯水分散,置铜网上,2%磷钨酸溶液染色,室温晾干,用透射电子显微镜(TEM)观察微球形态。
1.4.3微球粒径大小及其分布
取适量微球混悬于生理盐水中,用马尔文动态粒度分析仪测定粒径分布及平均粒径。
1.4.4傅里叶变换红外光谱(FT-IR)分析
对TPL、PLGA、TPL及PLGA物理混合物、TPL-PLGA微球,进行FT-IR分析,采用溴化钾压片法,扫描范围400~4000 cm-1,扫描次数64次,分辨率为4 cm-1。
1.4.5包封率及载药量的测定
1.4.5.1色谱条件 SHIMADZU SPD-10AP 紫外检测器,Hypersil ODS C18柱(250 mm×4.6 mm,5 μm);甲醇-水(46∶54)为流动相;检测波长218 nm;柱温 30℃;流速 1.0 ml/min;进样量20 μl,外标法定量。
1.4.5.2方法学考察 配制浓度分别为10、20、40、50、80 μg/ml的标准品溶液,以TPL浓度(C)对峰面积(A)进行线性回归。取10、40、80 μg/ml的TPL标准品溶液,测定日内(1 d内测5次)和日间精密度(连续测定5 d)。精密量取浓度约为200 μg/ml的标准品溶液0.5、2、4 ml至10 ml容量瓶中,加入10 mg空白微球,流动相稀释,以测定量与实际加入量之比计算回收率。
1.4.5.3测定方法 精密称取适量微球,加入少量二氯甲烷∶甲醇(9∶1),使微球完全溶解,超声破坏、反复涡旋,待微球内的药物完全溶解,定容,离心,取上清液过滤后进样,代入标准曲线方程计算TPL量,按公式计算包封率和载药量:包封率=WTPL/W投×100%;载药量= WTPL/W总×100%[WTPL:微球中包裹药物量(mg);W投:投药量(mg);W总:微球的总重量(mg)]。
1.5微球体外释放
取微球适量,加2 ml生理盐水,超声分散,置透析袋内,紧密封口,悬于10 ml释放介质中(PBS,pH=7.40,含1%吐温-80)。释放介质安放于37℃恒温水浴中,搅拌下分别于1、4、8 h,1、2、3、4、5、10 d取释放介质0.5 ml(取后补充等量新鲜释放介质),离心,上清液过滤后测定,以累积释放率(Q)为纵坐标,释放时间(t)为横坐标绘制体外释放曲线并进行数学模型拟合。
1.6 微球毒性评价
12只新西兰兔随机分为3组(对照组、空白微球组、TPL微球组),TPL微球组按1 mg/kg的剂量关节腔内注射TPL微球,空白微球组注射同重量的空白微球,对照组注射0.9%氯化钠溶液。注射后每日观察兔的精神、活动、食欲、体温、皮毛和粪便情况。1周后,耳缘静脉取血检查,血液学检查项目包括白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)、淋巴细胞百分比(L%)、中性粒细胞百分比(N%);血液生化方面的指标包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、血清尿素氮(BUN)、肌酐(Cr)。
1.7统计学方法
数据采用SPSS 22.0,计量资料用x±s表示,组间差异采用F检验,以P<0.05为差异有统计学意义。
2结果
2.1微球制备条件的优化
乳化-溶剂挥发法[4,5-7]是目前制备微球最常用的方法,本文考察了3个因素[8](水相和油相体积比、油相PLGA的浓度[9]、水相PVA的浓度[10])对微球性质的影响。最终确定TPL微球的制备条件是水相与油相的体积比为4∶1,TPL与PLGA在油相中的比例为1∶9(w/w),PLGA浓度为100 mg/ml,PVA浓度为3%。
2.2微球粒径测定和形态观察
透射电子显微镜结果显示,微球呈圆形,形态规整,大小均匀,微球与微球之间无粘连,粒径约为5 μm(图1),马尔文粒度测定仪测得微球平均粒径为4.75 μm。
2.3傅立叶红外光谱分析
图2A中,TPL在1750 cm-1、3500 cm-1附近有较强的两个特征吸收峰,分别是TPL的内酯羰基峰和羟基峰[11];图2B中,PLGA在1600~1700 cm-1、2950~3000 cm-1、3500~3600 cm-1出现三个较强吸收,分别是羰基峰、C-H伸缩振动和羟基峰;图2C中,表现出TPL和PLGA的双重特征吸收,1700 cm-1和3500 cm-1处的吸收变强、变宽;图2D中,1750 cm-1处的特征吸收已经消失,表现为PLGA的特征,3500 cm-1附近的吸收明显变宽,这说明TPL已经被包裹在PLGA中,且可能产生了相互作用。
2.4包封率和载药量的测定
TPL的保留时间约为6.9 min,峰形较好,杂质在该处无干扰。TPL在10.4~83.2 μg/ml范围内,浓度(C)与其峰面积(A)之间有良好的线性关系,标准曲线方程为:A=80.89C-95.6(r=0.9987,n=5)。高、中、低三个浓度日内和日间精密度RSD(%)分别为1.61%、1.37%、0.93%和2.31%、1.10%、0.99%(n =5),高、中、低三个浓度回收率分别为96.22%、98.58%、99.21%(n=3),RSD(%)分别为1.64%、0.63%、0.98%。以优化条件制备了三批TPL-PLGA微球,平均包封率和载药量分别为(74.37±2.30)%、(1.53±0.27)%。
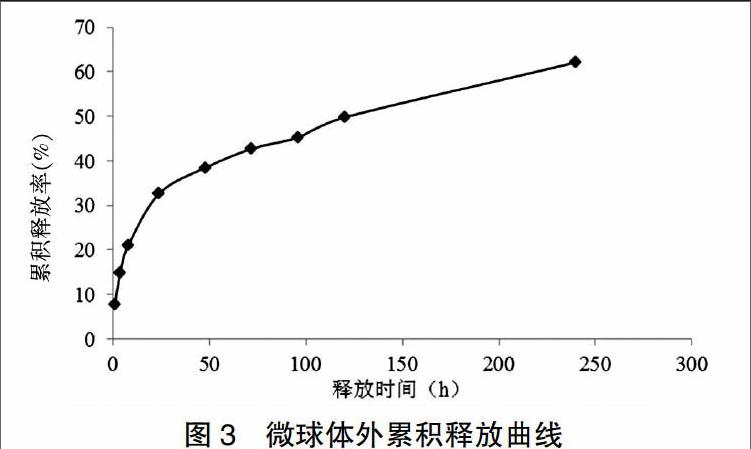
2.5体外释放考察
根据累积释放率绘制微球体外释放曲线(图3)。数学模型拟合结果见表1。
2.6毒性研究
2.6.1兔全身情况
所有实验兔均存活,进食情况正常,未见脱毛或腹泻等现象,除注射第1天有5只兔体温略高之外,其余时间体温均正常。3组兔体重无明显降低。
2.6.2 TPL微球对血常规指标的影响
表2是对照组、空白微球组和TPL微球组注射1周后测得的血常规各项指标,结果显示,除TPL微球组有2只动物WBC水平略高于正常范围之外,其余各项指标均在正常范围内。3组血常规指标之间均差异无统计学意义(P>0.05)。
2.6.3 TPL微球对肝、肾功能的影响
表3是对照组、空白微球组和TPL微球组注射1周后测得的肝功能、肾功能指标检测结果:除TPL微球组有1只动物肝功能、肾功能异常(ALT、BUN水平略高于正常范围,Cr水平略低于正常范围)之外,其余各项指标均在正常范围内。3组肝功能、肾功能指标之间均差异无统计学意义(P>0.05)。
3讨论
实验结果显示,药物的溶解性、有机溶剂的组成与性质、有机相与水相的比例、温度、成球材料的浓度与组成、乳化剂的种类与浓度等均可影响微球质量。水相体积增大(油/水比例降低),微球粒径、包封率和载药量呈现减小趋势;PLGA浓度增加,微球粒径、包封率和载药量均有所增加;PVA浓度增大,粒径、包封率和载药量均趋向减小。
药物体外释放存在两个阶段,前24小时处于突释阶段[12-13],TPL在此阶段累积释放量达32.61%,此后进入缓慢释放阶段,到第10天时,总累积释放率达62.14%。突释原因可能是少量TPL结合在微球表面或包封在微球浅表层。后期缓释阶段,可能是由于微球内部骨架结构阻止了TPL扩散,释放速度主要依赖于PLGA骨架的降解,推测如果采用分子量更高的PLGA可能进一步延缓TPL释放[14]。微球体外释药更符合Ritger-Peppas模型[15],即药物释放是药物扩散和骨架溶蚀协同作用的结果。
目前临床上使用的雷公藤总皂苷片,其副作用主要表现在血液、肝肾功能和生殖系统方面的毒性[16-18],因此,有必要对TPL微球是否可以改善这些方面的副作用进行考察。表2显示,除TPL微球组有2只动物WBC水平略高于正常范围之外,其余各项指标均在正常范围内,3组血常规指标之间均差异无统计学意义,表明TPL微球对血常规指标无明显影响。表3显示,除TPL微球组有1只动物肝功能、肾功能异常(ALT、BUN水平略高于正常范围,Cr水平略低于正常范围)之外,其余各项指标均在正常范围内,经统计学分析,3组肝功能、肾功能指标之间均差异无统计学意义(P>0.05),表明TPL-PLGA微球对兔的肝功能、肾功能无明显影响。
综上所述,本文采用乳化-溶剂挥发法制备了形态圆整的TPL微球,平均粒径、包封率和载药量分别为4.75 μm、(74.37±2.30)%和(1.53±0.27)%,体外释放研究显示微球第10天的总累积释放率达62.14%,释放行为符合Ritger-Peppas方程,毒性试验显示微球对血常规、血生化等各项指标无明显影响。
[参考文献]
[1]Horisawa E,Hirota T,Kawazoe S,et al.Prolonged anti-inflammatory action of DL-lactide/glycolide copolymer nanospheres containing betamethasone sodium phosphate for an intra-articular delivery system in antigen-induced arthritic rabbit[J].Pharm Res,2002,19(4): 403-410.
[2]Horisawa E,Kubota K,Tuboi I,et al.Size-dependency of DL-lactide/glycolide copolymer particulates for intra-articular delivery system on phagocytosis in rat synovium[J].Pharm Res,2002,19(2):132-139.
[3]Fernández-Carballido A,Herrero-Vanrell R,Molina-Martínez IT,et al.Biodergradable ibuprofen-loaded PLGA microspheres for intraarticular administration.Effect of Labrafil addition on release in vitro[J].Int J Pharm,2004,279(1-2):33-41.
[4]Li Z,Huang L.Sustained delivery and expression of plasmid DNA based on biodegradable polyester,poly(D,L-lactide-co-4-hydroxy-L-proline)[J].J Contr Rel,2004,98(3):437-446.
[5]Javier RV,Irene BO,Rocío HV,et al.Optimising the controlled release of dexamethasone from a new generation of PLGA-based microspheres intended for intravitreal administration[J].Eur J Pharm Sci,2016,92(9):287-297.
[6]Guo WJ,Quan P,Fang L.Sustained release donepezil loaded PLGA microspheres for injection:preparation,in vitro and in vivo study[J].Asian J Pharm Sci,2015,10(5):405-414.
[7]蒋朝军,杨清敏,胡筱菲,等.新型利培酮PLGA微球的制备及体外释放研究[J].中国药学杂志,2011,46(2):124-127.
[8]Mao S,Shi Y,Li L,et al.Effects of process and formulation parameters on characteristics and internal morphology of poly(d,l-lactide-co-glycolide) microspheres formed by the solvent evaporation method[J].Eur J Pharm Biopharm,2008,68(2):214-223.
[9]Dhakar RC,Maurya SD,Aggarawal S.Design and evaluation of SRM microsphere of metformin hydrochloride[J].Pharmacie Globate,2010,1(7):1-5.
[10]Suhaida MG,Yahya IB,Darmawati MY.Preparation of naltrexone hydrochloride loaded poly(DL-lactide-co-glycolide)microspheres and the effect of polyvinyl alcohol(PVA)as surfactant on the characteristics of the microspheres[J].Med J Malaysia,2004,59(Suppl B):63-64.
[11]刘明,董静,杨亚江,等.雷公藤甲素聚乳酸纳米粒载药体系的研究[J].中国药科大学学报,2004,35(2):117-121.
[12]McGinity JW,O′Donnell PB.Preparation of microspheres by the solvent technique[J].Adv Drug Deliv Rev,1997,28(1):25-42.
[13]O′Hagan DT,Jeffery H,Dams SS.The preparation and characterization of poly (lactide-co-glycolide)microparticles:Ⅲ.Microparticle/polymer degradation rates and the in vitro release of a model protein[J].Int J Pharm,1994,103(1):37-45.
[14]Eliana L,Flavio F,Maria TB.Surface drug removal from ibuprofen-loaded PLA microspheres[J].Int J Pharm,2000, 196(1):1-9.
[15]Ritger PL,Peppas NA.A simple equation for description of solute release Ⅱ.Fickian and anomalous release from swellable devices[J].J Contr Rel,1987,5(1):37-42.
[16]冯群,孙蓉.雷公藤多苷片抗炎作用及伴随肝毒性研究[J].中药新药与临床药理,2014,25(6):713-716.
[17]邱颖文,吴松武,吴贤仁.雷公藤多苷的不良反应[J].西北药学杂志,2004,19(5):220- 222.
[18]贾传春,王秀娟.雷公藤多苷片的临床不良反应[J].中国医院药学杂志,2000,20(5):316-317.
