灯盏花自交不亲和SRK基因编码区甲基化分析*
2017-01-04张薇孟衡玲孟珍贵梁泉魏翔杨生超
张薇,孟衡玲,孟珍贵,梁泉,魏翔,杨生超
(1.云南农业大学 云南省优势中药材规范化种植工程研究中心,云南 昆明 650201;2.红河学院,云南 蒙自 661100)
灯盏花自交不亲和SRK基因编码区甲基化分析*
张薇1,2,孟衡玲2,孟珍贵1,梁泉1,魏翔2,杨生超1
(1.云南农业大学 云南省优势中药材规范化种植工程研究中心,云南 昆明 650201;2.红河学院,云南 蒙自 661100)
为研究灯盏花自交不亲和基因SRK(EbSRK)的DNA甲基化变异,本文利用甲基化敏感限制性内切酶-PCR法,对EbSRK基因中包含CCGG位点的部分编码区进行甲基化分析,同时,利用RT-PCR检测EbSRK基因在灯盏花不同组织中的表达情况。实验结果显示,EbSRK基因中的两个CCGG位点不存在甲基化,而EbSRK基因在不同组织该基因的表达量有显著的差异性。这说明对EbSRK等位基因的抑制不是由于EbSRK基因中CCGG位点甲基化引起,而存在其他的调控机理。
灯盏花;SRK基因;DNA甲基化;MS-RE-PCR;MspⅠ/HpaⅡ;RT-PCR
表观遗传学的相关研究已经成为很多领域关注的焦点[1],DNA甲基化为常见的表观遗传学研究的内容之一,是真核生物中影响基因表达的一种主要的修饰方式,在基因的时空特异性表达、自交不亲和、胚胎发育和染色体稳定性等方面扮演重要的角色[2]。DNA甲基化水平不足或过高,都会导致植物生长发育不正常和形态结构异常。DNA甲基化主要通过参与植物基因表达的调控,调节植物的生长发育来发挥重要作用。DNA甲基化通过引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而抑制转录,进而调控基因表达[3]。当基因处于表达状态时甲基化水平往往很低,随着生长发育的进行需要将该基因关闭,就会在该基因的启动子或编码区发生甲基化,使基因转录受到抑制,基因失活,终止其表达。甲基化通常发生在胞嘧啶的C5位,而甲基化的胞嘧啶多位于CpG岛上,形成5-甲基胞嘧啶(5mC)[4]。特定基因甲基化分析有多种方法,包括甲基化特异性PCR[5],结合重亚硫酸盐限制性分析[6~7],基于Sanger法的重亚硫酸氢盐测序[8],以及甲基化敏感限制性内切酶PCR(MS-RE-PCR)法等,其中MS-RE-PCR是一种重要方法,它利用不同限制性内切酶对甲基化位点的敏感性差异特点对DNA进行酶切。该方法经常用于分析植物mCCGG位点的甲基化水平[9~10]。
自交不亲和(Self-incompatibility,SI)是指植物为了阻止自交促进异交来保持后代遗传多样性的一种系统。在很多被子植物中SI由S位点控制[11]。其中SRK基因是决定自交不亲和反应的雌性因子,它是S位点发现的第二个基因[12],在开花前的柱头乳突细胞中特异表达[13]。SRK基因的第3至第7个外显子编码它的激酶结构域[14],具有催化活性,能结合下游信号反应分子,是SI信号传导的关键。SRK基因的失活会导致植物自交亲和。前人在甲基化对自交不亲和的作用方面做了大量研究[9~10,15]。在扁桃(Amygdaluscommunis)中,因为转录的差异,SI品种中Sf-RNase被命名为Sfa[16],但在SC品种中为Sfi[17],而Sfa和Sfi在C1-C5编码区及其侧翼中核苷酸序列是一致的[16~18]。在其它的李属(Prunus)中也存在具有相同的S基因型,但表型不同的现象[19~22]。这些现象均受到甲基化的影响。白菜(Brassicapekinensis)自交不亲和株系的显隐性关系也是由于甲基化的作用[4,23]。芸薹(Coriandrumsativum)中显性的SCR等位基因的转录沉默,主要是因为DNA甲基化影响了基因的表达[4]。很多研究表明DNA甲基化在植物自交不亲和中扮演了重要的角色[9~10,15]。
菊科(Asteraceae)植物是典型自交不亲和植物。在20世纪40年代就开始了菊科植物自交不亲和的研究[24~25],而对菊科自交不亲和机理的研究从2000年开始[26],在菊科植物千里光(Senecioscandens)中克隆了3个SRK基因[27],但是未对其具体的功能进行分析研究。后来又在千里光中找到了一些在柱头特异表达的基因[28~29],基因功能仍未确定。至此菊科植物自交不亲和机理仍然是未解之谜。灯盏花[Erigeronbreviscapus(Vant.) Hand.-Mazz]为菊科飞蓬属(Erigeron)多年生植物,是云南省特有的药用植物之一。前期研究表明,灯盏花的自交不亲和反应发生在柱头表面,推测为孢子体型自交不亲和[30]。但是灯盏花自交不亲和性的研究还停留在现象观察的层面,其SI机理没有进行过分子层面的研究。本研究在克隆获得灯盏花SRK基因的全长cDNA基础上,从表观遗传学的角度,用MS-RE-PCR的方法对灯盏花SRK基因的两个CCGG位点进行甲基化分析,并用RT-PCR检测SRK基因不同组织表达情况,以期对灯盏花自交不亲和的机制做进一步的探索。
1 材料与方法
1.1 材料
供试材料为具有典型的自交不亲和特征的灯盏花植株的新鲜叶片、茎、根以及不同花期(花蕾、开花前一天、盛花)的花序材料,采自云南红河千山生物有限公司基地,样品采集后立即置于液氮中,-80℃冰箱保存备用。
1.2 灯盏花基因组DNA和总RNA的提取及反转录
用改良的CTAB法提取灯盏花的基因组DNA。把灯盏花的样品洗净晾干,放入预先灭菌的研钵中,加入液氮和β-巯基乙醇,快速磨碎后转移至离心管中,加入预热的CTAB充分混匀。提取的DNA用1.2%的琼脂糖凝胶电泳检测。总RNA的提取采用TRIzol法,TRIzol试剂购自北京全式金公司,各取0.1g的组织液氮磨碎后进行提取。cDNA第一链合成试剂盒为TaKaRa的1st Strand cDNA Synthesis Kit,合成根据其提供的说明书进行。
1.3 灯盏花SRK基因目的片段扩增
本研究的前期克隆了灯盏花的SRK基因的全长cDNA序列,用该基因和NCBI上的其它物种的SRK基因进行比对。设计了一对包含2个CCGG位点的保守序列的特异性引物,由上海生工合成。上游引物SRK1F:5’-GGGTCTCAGATATTAATGATTCG-3’;下游引物SRK1R:5’-TAATACTCATAGCCAAACTCCAA-3’。PCR反应体系25μL,其中ddH2O 11.8μL,10×buffer 5μL,10 mmol/L dNTP(含Mg2+)5μL,上、下游引物各1μL,模板1μL,Taq酶0.2μL。PCR反应程序为:94℃。预变性5min;94℃变性45s,55℃退火45s,72℃延伸2min,38个循环;72℃延伸10min。PCR结束后用1.2%(W/V)琼脂糖凝胶电泳检测。
1.4 目的片段的克隆测序及限制性酶切分析
目的片段按照全式金回收试剂盒进行。回收的目的片段连接到pEASY-T1载体,连接体系5μL,室温连接25min。连接产物转化大肠杆菌DH5α感受态细胞。预先准备涂有Amp,X-gal和IPTG的平板备用。取80μL重悬菌涂布于备用的平板,正置30min后于37℃倒置培养12-14h。挑白色的单克隆做菌落PCR,检测为阳性的单克隆在接种于含有Amp的LB液体培养基中培养至适合浓度送上海生工测序。2μg gDNA用3μL的酶进行酶切;PCR产物的酶切体系为20μL,2μL的酶。用NEB公司的MspⅠ/HpaⅡ酶切后进行PCR扩增检测酶切的效果。MspI和HpaII是同裂酶,即识别位点相同,切割位点也相同。当MspI和HpaII的识别序列CCGG中外部的C被甲基化时,MspI和HpaII均无法切割识别位点。但是,当识别位点内部的C被甲基化时,MspI就能够切割识别序列,而HpaII则不能。在实验中可以根据酶切后条带大小来判断目的片段有无甲基化。
1.5 灯盏花SRK基因的实时荧光定量分析
Real-time RT-PCR反应用荧光染料SYBR Green Ⅰ,GAPDH为内参基因。上游引物为EbSRKF1:5’-GGGCAGAATCGGACCCTTAC-3’,下游引物为EbSRKR1:5’-TGAGACCCTTCTTCGTTGG-3’,目标片段95bp。PCR反应体系20μL,反应程序:扩增曲线反应94℃ 30s,94℃ 20s,55℃ 20s,72℃ 30s,45个循环,72℃单点检测信号。反应结束后,60℃连续检测信号产生溶解曲线。用Opticon monitor 3.1软件进行数据的记录和分析。每个样品3次重复,灭菌水为空白对照。
2 结果与分析
2.1 灯盏花基因组DNA和总RNA的提取
灯盏花基因组DNA提取后的凝胶电泳检测如图1,条带单一清晰,无拖尾;紫外检测OD260/OD280在1.8~2.0之间,CTAB法较适合灯盏花基因组DNA的提取,完全可以用来做后续试验分析。从灯盏花里提取的总RNA,经紫外检测,OD260/OD280在1.8~2.0之间,说明RNA样品中无杂质污染,纯度较高。电泳检测的凝胶成像如图2所示,28S,18S,5S条带整齐清晰,28S的亮度约为18S的两倍,说明所获得的总RNA较完整,可以满足后续的RT-PCR试验所需。

图1 灯盏花不同组织基因组DNA电泳图

图2 灯盏花不同组织总RNA电泳图
2.2SRK基因目的片段扩增及序列分析
以灯盏花基因组DNA为模板,用SRK基因的cDNA序列设计的引物经过PCR扩增,得到了1 285bp的片段(图3)。
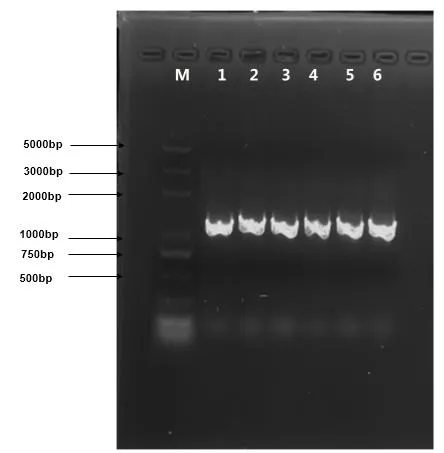
图3 以灯盏花gDNA为模板的PCR产物的琼脂糖电泳图
克隆测序后发现,该片段有两处CCGG位点,分别位于第100bp和第1 081bp。两者相距978bp。和SRK基因的cDNA序列(图4)相比,该片段包含3个内含子序列(613-691bp、800bp-925bp、1 126bp-1 209bp)。图中黄色、绿色、蓝色、红色各代表灯盏花SRK基因的第一、第二、第三、第四外显子。

图4 灯盏花SRK基因部分DNA序列

图5 灯盏花SRK基因部分cDNA序列
对SRK基因的cDNA序列和DNA序列的矩阵图对比见图5。从上述比对矩阵图可以明显看出,gDNA中与cDNA相似的区域被分成4个部分。根据序列比对的细节情况,结合真核生物外显子内含子剪切位点特征,确定严格的分界点。
图6 灯盏花SRK基因部分cDNA序列
大多数真核生物内含子序列的两端分别是GT和AG(GT/AG法则),外显子-内含子剪切位点一般的特征序列规律是:5’端剪切位点:CAG/GTATTC或RG/GTRAGT(R表示嘌呤,斜杠“/”左侧为外显子)3’端剪切位点:TCCAG/G或NCAG/G(N表示任意碱基,斜杠“/”左侧为内含子)。结合以上特征序列规律和序列比对情况,确定了确切的外显子-内含子边界(图7)。

图7 灯盏花SRK基因目的片段内含子外显子分析结果
2.3 灯盏花SRK基因目的片段的MspⅠ/HpaⅡ酶切及甲基化分析
灯盏花SRK基因目的片段的酶切电泳图见图8。
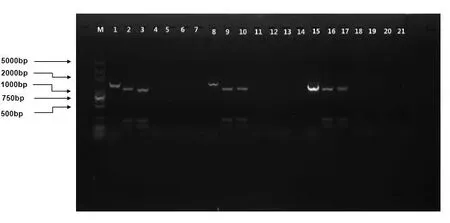
图8 灯盏花SRK基因目标序列的甲基化分析
注:M为Marker DL2000 plus;1为以叶片gDNA为模板的PCR产物;2为MspⅠ酶切后的PCR扩增产物;3为HpaⅡ酶切后的PCR产物;4为MspⅠ酶切后的叶片gDNA;5为HpaⅡ酶切后的叶片gDNA;6为以MspⅠ酶切后的叶片gDNA为模板的PCR产物;7为以HpaⅡ酶切后的叶片gDNA为模板的PCR产物;8为以茎gDNA为模板的PCR产物;9为MspⅠ酶切后的PCR扩增产物;10为HpaⅡ酶切后的PCR产物;11为MspⅠ酶切后的茎gDNA;12为HpaⅡ酶切后的茎gDNA;13为以MspⅠ酶切后的茎gDNA为模板的PCR产物;14为以HpaⅡ酶切后的茎gDNA为模板的PCR产物;15为以花gDNA为模板的PCR产物;16为MspⅠ酶切后的PCR扩增产物;17为HpaⅡ酶切后的PCR产物;18为MspⅠ酶切后的花gDNA;19为HpaⅡ酶切后的花gDNA;20为以MspⅠ酶切后的花gDNA为模板的PCR产物;21为以HpaⅡ酶切后的花gDNA为模板的PCR产物。
Fig.8 The methylation analysis of the target fragment inSRKgene coding region
泳道1~7为以叶片所提的gDNA为材料进行的甲基化分析;8~14为以茎干所提的gDNA为材料进行的甲基化分析;15~21为以花序(开放前一天)所提的gDNA为材料进行的甲基化分析。点样顺序均一致。
由图8可知,泳道1所示的以叶片gDNA为模板进行PCR可以得到清晰的目标带(1 285bp),泳道2和3是把泳道1的PCR产物进行酶切(MspⅠ和HpaⅡ)后的情况。目的片段被消化为3个片段,分别是100bp、982bp、203bp;泳道6和7均无特异性的目标谱带扩出。在以茎干和花序所提的gDNA为材料进行的甲基化分析的结果也和前面的相同。谱带分析表明叶片、茎干、花序的SRK基因目的片段内的CCGG位点均可以被MspⅠ和HpaⅡ限制性酶切,说明这些CCGG位点均未发生甲基化(3’端和5’端均无甲基化)。图8所示的交叉组合式的酶切和电泳结果表明在灯盏花的3种组织中SRK基因的部分编码区可能不存在甲基化现象。
2.4 灯盏花不同组织SRK基因的qRT-PCR分析
对灯盏花的组织酶切实验表明SRK基因在不同组织中都能被MspⅠ和HpaⅡ切开,说明SRK基因在这些组织中没有发生甲基化。因此对灯盏花不同组织里的SRK基因的表达量进行了荧光定量PCR检测,验证酶切实验的结果。
对灯盏花不同组织的qRT-PCR的分析如图9。在灯盏花中的各个组织均有SRK基因的表达,茎和开花前一天的相对表达量最低;根、花蕾和盛花的表达量也较低,均为1.0左右;而叶中SRK基因的表达量最高,和其余样品均有显著性差异(P<0.05)。SRK基因在灯盏花不同组织中均有表达,但在SI反应中的功能还需要进一步研究。
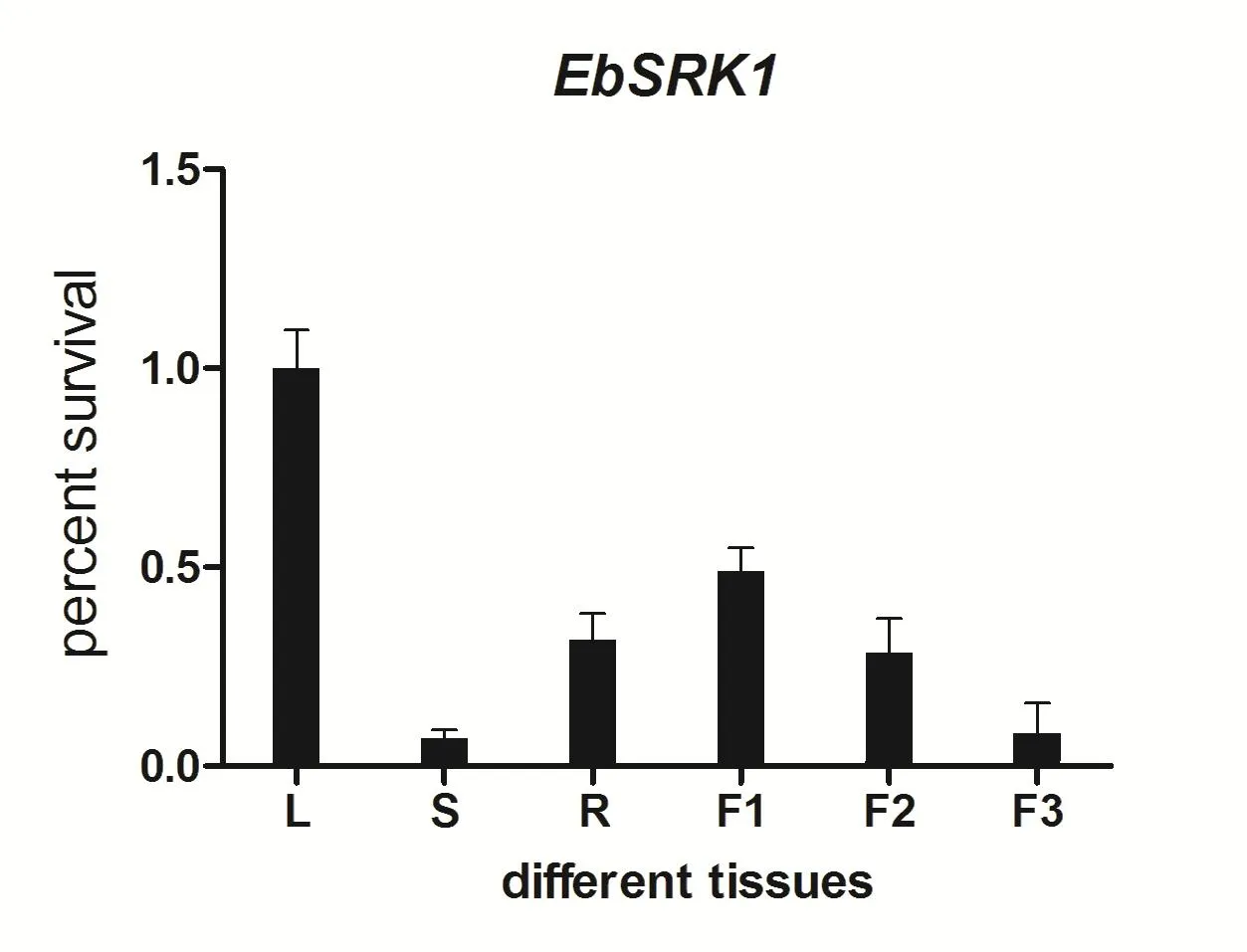
图9 灯盏花不同组织中SRK基因的表达分析
3 结论与讨论
植物DNA甲基化可以抑制基因的表达,当基因表达的时候甲基化程度很低,而生长发育到一定阶段的时候会在该基因的启动子或编码区发生重新甲基化,基因失活[31]。植物的自交不亲和是一个很复杂的过程,有很多的信号分子参与,例如SRK,SCR,SLG,ARC1,THL1/2等。对自交亲和与自交不亲和的种子的基因组DNA甲基化水平的研究揭示了在这两类种子中全甲基化、半甲基化水平都有明显差异,可能和它们的自交亲和与否相关[32]。
本研究对灯盏花SRK基因的两个CCGG位点进行甲基化研究。以基因组DNA为模板,研究前期克隆出的SRK基因的cDNA序列设计特异性引物进行PCR扩增,测序结果显示该扩增片段包括第一外显子的部分,第二外显子、第三外显子及第四外显子的部分,对灯盏花三种组织中(叶、茎、花)的SRK基因的甲基化CCGG位点分析,表明在所选样本的SRK基因片段中均不存在甲基化。
对甘蓝(Brassicaoleracea)的SRK和SLG的甲基化分析发现,在这两个基因的第一编码区均不存在甲基化[9~10]。DNA甲基化在组织间特异性较强,甲基化程度和模式存在很大差异。自交亲和与自交不亲和的羽衣甘蓝(Brassicaoleraceavar.acephalaf.tricolor)的叶片基因组DNA的甲基化分析发现两者的甲基化存在差异,包括与自交不亲和相关的SRK和SCR基因[15],但没有针对甲基化对SRK基因功能的影响进行研究。扁桃中Sf基因的甲基化研究认为该基因具有组织特异性[32~33]。MS-RE-PCR方法也存在局限性,一是由于所采用的酶不能有效地检测外胞嘧啶的甲基化;二是对于非CCGG位点的胞嘧啶甲基化该方法也无法检测。灯盏花具有典型的自交不亲和特性,虽然在本研究中灯盏花SRK基因特定片段中没有发现甲基化的现象,但不排除甲基化在基因的其它编码区或者转录起始阶段的调控作用。另一方面,研究中所用的酶只是针对CCGG位点有特殊的识别性,不能有效地检测外胞嘧啶的甲基化。而对于非CCGG位点的胞嘧啶甲基化都不敏感无法检测。在灯盏花自交不亲和的过程中,是否由于甲基化或者去甲基化的作用使得和SI相关的基因被开启或者关闭从而产生自交不亲和的过程,这还需要进一步的研究。
本研究对叶片、茎干、花序(开花前一天)分析表明3种组织的SRK基因的CCGG位点均未甲基化,但对灯盏花不同组织的SRK基因进行的RT-PCR分析结果表明:在测试的6个样品中都有SRK基因的表达,表达量却有显著的差异性。其中叶片中表达量最高,茎和开花前一天的表达量最低,根和花蕾及盛花的表达量居中。本实验选取的是SRK基因的片段,甲基化的分析存在局限性,因此对灯盏花不同组织的SRK基因的甲基化分析还需要进一步深入,包括启动子功能、非CCGG位点的胞嘧啶甲基化、甲基化在转录起始阶段的调控作用、SRK基因甲基化的特异性等,进一步阐述SRK基因在灯盏花自交不亲和的作用及功能。
[1]Capell B C,Berger S L.Genome-wide epigenetics[J].Journal Invest Dermatol,2013,133(6):3-9.
[2]Umer M,Herceg Z.Deciphering the epigenetic code:an overview of DNA methylation analysis methods[J].Antioxid Redox Signal,2013,18(15):1972-1986.
[3]Li X Y,Wang X F,He K,etal.High-resolution mapping of epigenetic modifications of the rice genome uncovers interplay between DNA methylation,histone methylation,and gene expression[J].Plant Cell,2008,20(2):259-276.
[4]Shiba H,Kakizaki T,Iwano M,etal.Dominance relationships between self-incompatibility alleles controlled by DNA methylation[J].Nature Genet,2006,38:297-299.
[5]Yoshida T,Yamashita S,Takamura-Enya T,etal.Alu and Satalpha hypomethylation in Helicoba cter pylori-infected gastric mucosae[J].Int Journal Cancer,2011,128(1):33-39.
[6]Li Q,Ahuja N,Burger PC,etal.Methylation and silencing of the Thrombospondin-1 promoter in human cancer[J].Oncogene,1999,18(21):3284-3289.
[7]黄朝晖,吴玉玉.甲基化敏感限制酶结合定量PCR检测DNA甲基化方法的建立和应用[J].中华病理学杂志,2011,40(4):263-265.
[8]Ronaghi M.Pyrosequencing sheds light on DNA sequencing[J].Genome Res,2001,11(1):3-11.
[9]张莉,朱利泉,贾华,等.甘蓝S位点受体激酶基因(SRK)编码区的甲基化分析[J].农业生物技术学报,2010,18(3):482-488.
[10]朱利泉.甘蓝花粉SLG基因不存在甲基化封闭[C].中国科协2000年学术年会文集,2000:879-880.
[11]Dreux de Nettancourt.Incompatibility and incongruity in wild and cultivated plants[M].Berlin:Springer,2001.
[12]Stein J C,Howlett B,Boyes D C,etal.Molecular cloning of a putative receptor protein kinase gene encoded at the self-incompatibility locus of Brassica oleracea[J].Proceedings of the National Academy of Sciences,1991,88:8816-8820.
[13]Watanabe M,Takasaki T,Toriyama K,etal.A high degree of homology exists between the protein encoded by SLG and the S receptor domain encoded by SRK in self-incompatibleBrassicacampestrisL.[J].Plant Cell Physiol,1994,35(8):1221-1229.
[14]Goring D R,Rothstein S J.TheS-locus receptor kinase gene in a self-incompatibleBrassicanapusline encodes a functional serine/threonine kinase[J].Plant Cell,1992,4(10):1273-1281.
[15]景欣.羽衣甘蓝自交亲和系及自交不亲和系的基因组DNA甲基化水平差异分析[D].哈尔滨:东北林业大学,2010.
[16]Kodad O,Sociasi Company R,Sánchez A,etal.The expression of self-compatibility in almond may not only be due to the presence of theSfallele[J].Journal of the American Society for Horticultural Science,2009,134:221-227.
[17]Fernándezi Martí A,Hanada T,Alonso J M,etal.A modifier locus affecting the expression of theS-RNase gene could be the cause of breakdown of self-incompatibility in almond[J].Sex Plant Reprod,2009,22:179-186.
[18]Fernándezi Martí A,Hanada T,Alonso JM,etal.The almond Sfhaplotype shows a double expression despite its comprehensive genetic identity[J].Scientia Horticulturae,2010,125:685-691.
[19]Watari A,Hanada T,Yamane H,etal.A low transcriptional level ofSe-RNasein theSe-haplotype confers self-compatibility in Japanese plum[J].Journal of the American Society for Horticultural Science,2007,132:396-406.
[20]Guerra ME,Rodrigo J,López-Corrales M,etal.S-RNase genotyping and incompatibility group assignment by PCR and pollination experiments in Japanese plum[J].Plant Breed,2009,128:304-311.
[21]Wunsch A,Tao R,Hormaza J I.Self-incompatibility in ‘Cristobalina sweet cherry is not associated with duplications or modified transcription levels ofS-locus genes[J].Plant Cell Rep,2010,29(7):715-721.
[22]Guerra M E.Polinizacióny cuajado en ciruelo japonés[D].Universidad de Extremadura,2011.
[23]Tarutani Y,Shiba H,Iwano M,etal.Trans-acting small RNA determines dominance relationships inBrassicaself-incompatibility[J].Nature,2010,466:983-986.
[][]
[24]Little T M,Kantor J H,Robinson B A.Incompatibility studies in Cosmos Bipinnatus[J].Genetics,1940,25:150.
[25]Gerstel D U.Self-incompatibility studies in Guayule[J].Genetics,1950,35:482.
[26]Hiscock S J.Genetic control of self-incompatibility inSeneciosqualidusL.(Asteraceae):a successful colonizing species[J].Heredity,2000,85:10-19.
[27]Hiscock S J,McInnis S M,Tabah D A,etal.Sporophytic self-incompatibility inSeneciosqualidusL (Asteraceae)--the search for S[J].Journal of Experimental Botany,2003,54(380):169-174.
[28]Allen A M,Lexer C,Hiscock S J.Comparative analysis of pistil transcriptomes reveals conserved and novel genes expressed in dry,wet,andsemidry stigmas[J].Plant Physiol,2010,154(3):1347-1360.
[29]Allen A M,Lexer C,Hiscock S J.Characterisation of sunflower-21 (SF21) genes expressed in pollen and pistil ofSeneciosqualidus(Asteraceae) and their relationship with other members of the SF21 gene family[J].Sex Plant Reprod,2010,23(3):173-186.
[30]赵峥.灯盏花有性生殖及其自交不亲和性研究[D].昆明:云南农业大学,2009.
[31]Wassenegger M .RNA-directed DNA methylation[J].Plant Molecular Biology,2000,43(2-3):203-220.
[32]Fernandezi Marti A,Gradziel T M,Sociasi Company R.Methylation of theSf -locus in almond is associated withS-RNase loss of function[J].Plant Molecular Biology,2014,86(6):681-689.
[33]李娜.高压静电场对羽衣甘蓝种子萌发过程DNA甲基化的影响[D].哈尔滨:东北林业大学,2013.
Methylation Analysis on the Coding Region of Self-incompatibilitySRKGene ofErigeronbreviscapus
ZHANG Wei1,2,MENG Heng-ling2,MENG Zhen-gui1,LIANG Quan1,WEI Xiang2,YANG Sheng-chao1
(1.Yunnan Research Center on Good Agricultural Practices for Dominant Chinese Medicinal Materials,Yunnan Agricultural University,Kunming Yunnan 650201,P.R.China;2.Yunnan Honghe College,Mengzi Yunnan 661100,P.R.China)
The study was conducted to identify the variation of DNA methylation ofSRK(EbSRK) gene.With the method of methylation sensitive restriction endonucleases PCR,the methylation of CCGG locus in theEbSRKgene was analyzed,and the expression ofEbSRKgene in different tissues was detected by RT-PCR.The results showed that there was no methylation in two CCGG locus ofEbSRKgene,and it was sighificantly different whenEbSRKgene was expressed in different tissues.This indicates that the inhibition ofEbSRKgene was not caused by CCGG methylation in theEbSRKgene,but by other regulatory mechanisms.
Erigeronbreviscapus;S-locus receptor kinase gene (SRK); DNA methylation; Methylation sensitive restriction endonucleases PCR (MS-RE-PCR);MspⅠ/HpaⅡ; RT-PCR
10.16473/j.cnki.xblykx1972.2016.06.002
2015-10-21
国家自然科学基金(81160499),国家自然科学基金(81503184),云南省中青年学术和技术带头人后备人才2016。
张薇(1977-),女,博士研究生,主要从事药用植物资源及其利用研究。E-mail:zw_biology2@126.com
简介:杨生超(1972-),男,教授,博士生导师,主要从事药用植物资源及其利用研究。E-mail:shengchaoyang@163.com
S 567
A
1672-8246(2016)06-0008-07
