酶解银杏蛋白制备α-葡萄糖苷酶抑制肽的研究
2016-12-29张灿
张 灿
吴彩娥1
范龚健1
李婷婷1
王佳宏1
曹福亮2
(1. 南京林业大学轻工科学与工程学院,江苏 南京 210037; 2. 南京林业大学森林资源与环境学院,江苏 南京 210037)
酶解银杏蛋白制备α-葡萄糖苷酶抑制肽的研究
张 灿1
吴彩娥1
范龚健1
李婷婷1
王佳宏1
曹福亮2
(1. 南京林业大学轻工科学与工程学院,江苏 南京 210037; 2. 南京林业大学森林资源与环境学院,江苏 南京 210037)
为了获得银杏α-葡萄糖苷酶抑制肽,利用木瓜蛋白酶酶解银杏蛋白,以α-葡萄糖苷酶抑制率为指标,考察底物浓度、酶底比、pH值、酶解温度和酶解时间对酶解效果的影响,并且利用超滤截留不同分子量(100,50,30,10,3 kDa)的多肽。结果表明:在pH 7.36,酶解时间4.4 h,酶底比(5 g/100 g),酶解温度57.9 ℃的条件下,α-葡萄糖苷酶抑制率最高为17.18%。分子量小于3 kDa多肽组分的α-葡萄糖苷酶抑制率最高为50.43%。因此,银杏蛋白水解产物或其活性肽可应用在食品中用于高血糖及相关疾病的治疗。
银杏;α-葡萄糖苷酶;酶解;活性多肽
银杏(Ginkgobiloba)为银杏科银杏属多年生落叶乔木,被称为“活化石”“植物界的大熊猫”,在中国的分布极广。银杏种仁又称为白果,可以食用,具有止咳、化痰、润肺平喘的作用[1]。银杏种子营养丰富,其蛋白质含量(干基含量)约为10%,氨基酸组成合理,因此它属于优质蛋白质。已经报道了银杏蛋白具有抗氧化剂[2-3]和抗菌[4-5]的功能。
蛋白质多肽链内蕴含着很多功能活性多肽,经过水解后功能集团就会暴露出来,便显出不同的活性,如调节神经、激素和免疫肽化合物、抗高血压、降低胆固醇、抗癌、抗氧化等作用[6]。近年来,有许多文献报道[7-10]从天然的动植物以及机体分离到降血糖肽,并且研究了它的结构和机制,其中一些已被用作抗糖尿病药物或保健食品。
目前,糖尿病已经成为威胁人类健康的三大慢性病之一。它是胰岛素分泌不足所引起的代谢紊乱[11],目前有效的治疗方法是通过抑制碳水化合物水解酶的活性,如抑制α-葡萄糖苷酶的活性可以延缓餐后对葡萄糖的吸收[12-14]。据报道[15],从蛋清中已经分离得到α-葡萄糖苷酶抑制肽,可以发展为口服抗糖尿病药物以控制高血糖症2型糖尿病,且没有副作用。最近,从蚕蛹[16]、鸡蛋[15,17]、满天星[18]、五味子[19]、牛[20]和益生菌[21]也得到了α-葡萄糖苷酶抑制肽。有关银杏蛋白的研究多集中在抗氧化肽[22]和抑菌肽[23],银杏蛋白制备α-葡萄糖苷酶抑制肽的研究却没有报道。本研究拟利用木瓜蛋白酶制备α-葡萄糖苷酶抑制肽,通过超滤纯化,并验证其降血糖的功能,旨在为银杏资源的深加工和银杏多肽的开发提供理论依据。
1 材料与方法
1.1 试验材料与仪器
白果:产于江苏泰兴;
α-葡萄糖苷酶(100 U):分析纯,美国Sigma公司;
木瓜蛋白酶:分析纯,瑞阳生物工程有限公司;
碱性蛋白酶、风味蛋白酶、胰蛋白酶和胃蛋白酶:分析纯,奥多福尼生物工程有限公司;
对硝基-α-吡喃葡萄糖苷:分析纯,北京索莱宝专业生化公司;
其它试剂国产分析纯;
电热恒温振荡水槽:DKZ-2型,上海精宏试验设备有限公司;
大容量低速离心机:DD-5M型,湖南湘仪实验室仪器开发有限公司;
紫外可见分光光度计:UV-2802型,北京普析通用仪器有限责任公司;
pH计:PP-20-P1型,德国Sartorius公司;
冷冻干燥机:12L型,美国Labconco公司。
1.2 试验方法
1.2.1 工艺流程
银杏→预处理→碱溶酸沉→得沉淀→沉淀复溶→蛋白溶液→酶解→灭酶→离心→取上清→冷冻干燥→银杏多肽
1.2.2 操作要点
(1) 预处理:将新鲜银杏果去壳、去内种皮、去芯,真空冷冻干燥后,将其磨粉并过80目筛。之后用石油醚脱脂,按1∶10(g/mL)混匀,置于4 ℃下处理72 h,隔1~2 h搅拌一次,每隔24 h更换一次石油醚。用蒸馏水浸泡清洗至溶液变为无色,以除去残留的石油醚。真空冷冻干燥48 h,压力降到100 Pa。
(2) 碱溶酸沉:按1∶20(g/mL)料液比将脱脂白果粉溶于纯水中,超声20 min,超声功率为300 W,用1%的NaOH溶液调pH至10.0,45 ℃水浴50 min,3 000 r/min离心15 min,取上清,用0.01%的HCl调pH至蛋白等电点4.62(采用聚丙烯酰胺凝胶等电聚焦电泳法测得其等电点),静置2 h,3 000 r/min离心15 min,取沉淀,真空冷冻干燥48 h,得白果蛋白。
(3) 酶解:往蛋白溶液中加入蛋白酶水浴振荡酶解,酶解后100 ℃灭酶10 min,然后在 3 000 r/min下离心15 min,取上清液。
1.2.3 酶活力的测定 按SB/T 23527—2009执行。
1.2.4α-葡糖苷酶抑制率的测定 在梁凯[24]的方法基础上做一定的修改,加448 μL磷酸钾缓冲液(pH 6.8),再加入 0.2 U/mLα-葡萄糖苷酶溶液 80 μL,45 μL样品溶液(对照组用缓冲液代替),混匀,然后 37 ℃恒温 15 min,加入80 μL 2.5 mmol/L PNPG(4-硝基苯-α-D-吡喃葡萄糖苷),混匀后再 37 ℃恒温反应 15 min。最后加入 0.2 mol/L 的 Na2CO3溶液320 μL,再加入3 mL磷酸缓冲液,于405 nm波长下测定吸光值(A)。α-葡糖苷酶抑制率按式(1)计算:
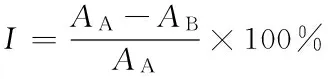
(1)
式中:
I——α-葡糖苷酶抑制率,%;
AA——样 A 的光密度值,样 A 在反应中不加抑制剂,用蒸馏水代替;
AB——样 B 的光密度值,样 B 在反应中加抑制剂。
1.3 试验设计
1.3.1 蛋白酶的筛选 配制一定浓度的银杏蛋白溶液,分别加入碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、风味蛋白酶、胃蛋白酶,酶底比为5%,将其混合均匀,然后分别在各种酶的最适条件下(表1)水解4 h,以α-葡萄糖苷酶抑制率为考察指标,选择最适蛋白酶进行后续的酶解试验。
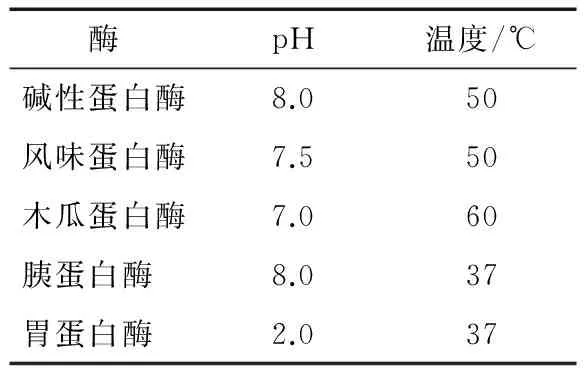
表1 5种蛋白酶的说明书反应条件Table 1 The instruction reaction conditions offive enzymes
1.3.2 酶解制备活性多肽单因素试验 根据蛋白酶筛选的预试验,利用筛选出最适蛋白酶进行酶解试验,考察底物浓度、酶底比两个因素对酶解效果的影响,以α-葡萄糖苷酶抑制率为指标,并对酶解工艺进行优化。
(1) 底物浓度对酶解效果的影响:固定酶底比为5%、pH值为7.0、温度为60 ℃、酶解时间为4 h的条件下,以α-葡萄糖苷酶抑制率为指标,考察底物浓度(0.5%,1.0%,1.5%,2.0%,2.5%,3.0%)对酶解效果的影响。
(2) 酶底比对酶解效果的影响:固定底物浓度为1.5%、pH值为7.0、温度为60 ℃、酶解时间为4 h的条件下,以α-葡萄糖苷酶抑制率为指标,考察蛋白酶底比(1,3,5,7,9,11 g/100 g)对酶解效果的影响。
1.3.3 银杏蛋白酶解工艺优化 在预试验的基础上,以pH值、酶解温度和酶解时间为考察因素,以α-葡萄糖苷酶抑制率为指标,对酶解工艺进行优化。选取pH、酶解温度和酶解时间作为试验因素,以α-葡萄糖苷酶抑制率为指标,设计三因素三水平响应面试验(表2),分析各试验因素及交互作用对α-葡萄糖苷酶抑制率的影响。
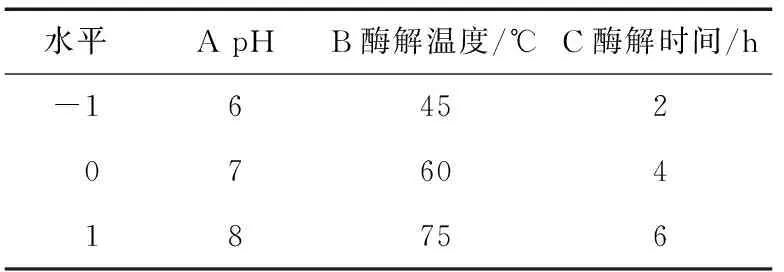
表2 响应面设计因素水平表Table 2 Factors and levels in response surface design
1.3.4 银杏多肽的分离 参照文献[25],采用超滤离心管(100,50,30,10,3 kDa)进行分离。共得到6个组分(>100,50~100,30~50,10~30,3~10,<3 kDa),然后测定不同组分对α-葡萄糖苷酶的抑制率。
1.4 数据分析
采用统计学软件SPSS 20.0进行单因素方差分析,以平均数±标准差表示;采用Design-Expert 7.0软件对响应面设计试验数据进行分析。
2 结果与分析
2.1 酶活力的测定
图1是以酪氨酸浓度为横坐标,吸光度值为纵坐标绘制的标准曲线以测酶活。试验测得碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、风味蛋白酶和胃蛋白酶的酶活力分别为73 527.16,78 579.24,71 098.28,8 551.61,8 229.10 U/g。

图1 酪氨酸标准曲线图Figure 1 Standard curve of tyrosine
2.2 蛋白酶的筛选
由图2可知,木瓜蛋白酶的抑制率最强,碱性蛋白酶其次,风味蛋白酶效果最差。因此,以下试验选择木瓜蛋白酶进行。
2.3 底物浓度的确定
由图3可知,在底物浓度为1.5%时,酶解产物对α-葡萄糖苷酶抑制率达到最大。在0.5%~1.5%时,随着底物浓度的增加,对α-葡萄糖苷酶的抑制率也逐渐增加,这是因为当底物浓度含量较低时,在一定的时间内只有一部分的酶可以与底物结合形成中间产物,但是随着酶浓度增加,底物与酶结合的机会也增加,因此对α-葡萄糖苷酶抑制率变大;在1.5%~3.0%时,随着底物浓度的增加,对α-葡萄糖苷酶抑制率逐渐降低,因为当浓度很大时,反应体系中的酶分子完全与底物结合生产中间产物,此时底物浓度虽然再增加但已经没有可以利用的酶与之结合,因此导致酶解产物对α-葡萄糖苷酶抑制率不再增加。

图2 酶种类对α-葡萄糖苷酶抑制率的影响
Figure 2α-glucosidase inhibitory activities of enzymatic hydrolysates fromGinkgobyproduct protein

图3 底物浓度对α-葡萄糖苷酶抑制率的影响Figure 3 Effect of substrate concentration on papain hydrolization
2.4 酶底比的确定
由图4可知,随着酶底比(E/S)的增加,α-葡萄糖苷酶抑制率先增加,这是由于E/S比例增加时更多的酶能够与底物结合,α-葡萄糖苷酶抑制率明显增加。当E/S的比值超过5 g/100 g时,虽然酶的数量仍在增加,但底物已经充分与酶结合,蛋白酶达到一定量时,大部分蛋白质几乎达到了水解平衡,所以α-葡萄糖苷酶抑制率不再随着E/S增加而增加,其机理目前尚不清楚,有待进一步研究,个人认为酶解反应是在液体环境中进行的,当酶的量越来越多时,会影响酶解反应的环境,受此影响,α-葡萄糖苷酶抑制率会有所下降。因此,最佳酶底比为5 g/100 g。
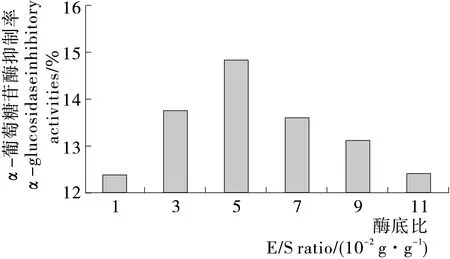
图4 对α-葡萄糖苷酶抑制率的影响Figure 4 Effect of E/S ratio on papain hydrolization
2.5 酶解工艺条件优化
2.5.1 Box-Behnken试验结果 在单因素试验基础上,选pH、酶解温度和酶解时间作为试验因素,以α-葡萄糖苷酶抑制率为响应值,采用Box-Behnken试验设计,试验方案及结果见表3。
2.5.2 Box-Behnken试验结果方差分析 利用Design expert软件对表3数据进行多元回归拟合,得到响应值Y对α-葡萄糖苷酶抑制率为响应关键因素的二次多项回归模型为:
Y=16.74+1.56A-0.70B+1.10C+0.62AB-0.81AC+0.12BC-1.82A2-1.70B2-1.94C2。
(2)
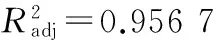
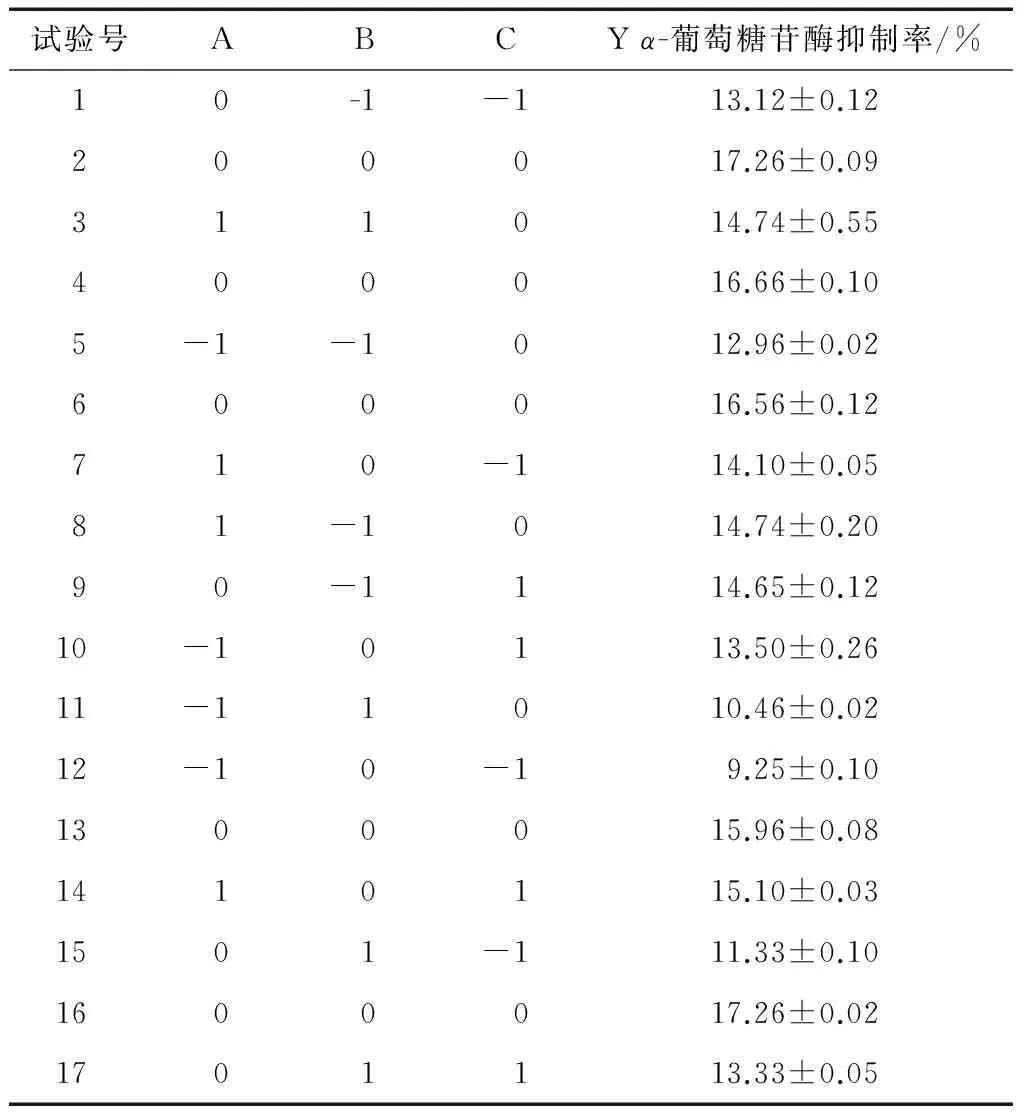
表3 响应面分析试验设计及结果Table 3 The design and results of response surface experiment

表4 α-葡萄糖苷酶抑制率回归模型方差分析Table 4 Significance check of the regression equation
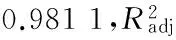
2.5.3 响应面因素的效应分析及优化结果 由图5可知,在选定的试验条件之内,固定一个变量,α-葡萄糖苷酶抑制率的大小先随着另一个变量的升高而增大,在达到最高值后会随着另一个变量的升高而减小。规律符合预试验及方差分析结果。

图5 AB及AC对α-葡萄糖苷酶抑制率交互影响 的响应曲面图
Figure 5 Response surface piotshowing the interactive effects ofpH and temperature, pH and time on α- glucosidase inhibitory rate
通过软件分析:最适pH 值为7.36,酶解时间4.40 h,最适温度57.9 ℃。在此条件下,进行3次实验取平均值,测得α-葡萄糖苷酶抑制率为 17.09%与预测值(17.18%)较接近,证明该模型的可行性和有效性。
2.6 超滤分离
采用超滤离心管对最佳工艺制备出的银杏活性多肽进行分离,得到6个组分,不同组分对α-葡萄糖苷酶抑制率见表5。
表5 不同多肽组分的α-葡萄糖苷酶抑制率
Table 5α-glucosidase inhibitory activities of each peptide fraction ofGinkgoprotein hydrolysates
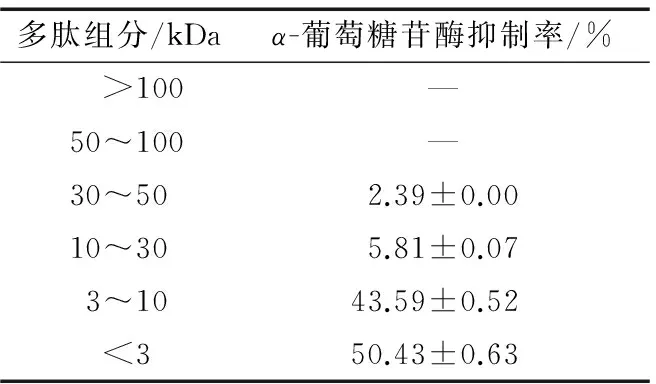
多肽组分/kDaα-葡萄糖苷酶抑制率/% >100—50~100—30~502.39±0.0010~305.81±0.073~1043.59±0.52<350.43±0.63
† “—”表示无α-葡萄糖苷酶抑制率。
由表5可知,分子量<3 kDa组分的α-葡萄糖苷酶抑制率最高,为50.43%;低分子量肽具有更高α-葡萄糖苷酶抑制活性,可能是它们可以与α-葡萄糖苷酶作用的底物对硝基苯-α-D-葡萄糖苷竞争性地抑制,从而降低了α-葡萄糖苷酶活性。
3 结论
本试验结果表明,最佳酶源是木瓜蛋白酶,酶解的最佳工艺为底物浓度1.5%,酶底比5 g/100 g,pH值7.36,酶解时间4.4 h,酶解温度57.9 ℃。此条件下对α-葡萄糖苷酶抑制率为 17.09%。同时经过超滤得到不同分子量大小的组分,其中分子量<3 kDa的组分对α-葡萄糖苷酶抑制率最高为50.43%。
银杏多肽具有抗氧化和抑菌的作用,但有关银杏多肽的降血糖作用的报道几乎没有,本研究体外试验仅证实银杏多肽具有α-葡萄糖苷酶抑制率,但并不能说明其具有体内降血糖活性。研究其对动物的血糖、胆固醇和甘油三酯等方面的影响需做进一步的动物试验。
[1] 曹福亮. 银杏[M]. 北京: 中国林业出版社, 2007: 102-103.
[2] RUAN Gui-hua, CHEN Zheng-yi, WEI Mei-ping, et al. The study on microwave assisted enzymatic digestion of ginkgo protein[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 94: 23-28.
[3] HATANO K I, MIYAKAW T, SAWANO Y, et al. Antifungal and lipid transfer proteins from ginkgo (Ginkgo biloba) seeds[J]. Nuts and Seeds in Health and Disease Prevention, 2011, 63: 527-534.
[4] HUANG Xu, XIE Wei-jun, GONG Zhen-zhen. Characteristics and antifungal activity of a chitin binding protein from Ginkgo biloba[J]. Febs Letters, 2000, 478: 123-126.
[5] WANG Hui, DU Yang-ji, SONG Hua-can.α-Glucosidase andα-amylase inhibitory activities of guava leaves[J]. Food Chemistry, 2010, 123(1): 6-13.
[6] 孔令明, 李芳, 陶永霞, 等. 多肽的功能活性与研究进展[J]. 中国食品添加剂, 2009(3): 71-73.
[7] HEMALATHA P, BOMZAN D P, SATHYENDRA Rao B V, et al. Distribution of phenolic antioxidants in whole and milled fractions of quinoa and their inhibitory effects onα-amylase andα-glucosidase activities[J]. Food Chemistry, 2016, 199: 330-338.[8] LIU Chao, XIANG Wei, YU Yan, et al. Comparative analysis of 1-deoxynojirimycin contribution degree to α-glucosidase inhibitory activity and physiological distribution in Morus alba L[J]. Industrial Crops and Products, 2015, 70: 309-315.
[9] ZHAO Deng-gao, ZHOU Ai-yu, DU Zhi-yun, et al. Coumarins withα-glucosidase andα-amylase inhibitory activities from the flower of Edgeworthiagardneri[J]. Fitoterapia, 2015, 107: 122-127.
[10] CHOI CI, LEE SR, KIM KH. Antioxidant andα-glucosidase inhibitory activities of constituentsfromEuonymus alatustwigs[J]. Ind. Crop Prod., 2015, 76: 1 055-1 060.
[11] SHARMA A K, THANIKACHALAM P V, RAJPUT S K. Albiglutide: Is a better hope against diabetes mellitus?[J]. Biomedicine & Pharmacotherapy, 2016, 77: 120-128.
[12] YANG Dan, XIE Hai-hui, JIANG Yue-ming, et al. Phenolics from strawberry cv. Falandi and their antioxidant andα-glucosidase inhibitory activities[J]. Food Chemistry, 2016, 194: 857-863.
[13] QIAN Jian-ya, BAI Ye-yu, TANG Jing, et al. Antioxidation andα-glucosidase inhibitory activities of barley polysaccharides modified with sulfation[J]. LWT - Food Science and Technology. 2015, 64(1): 104-111.
[15] YU Zhi-peng, YIN Yong-guang, ZHAO Wen-zhu, et al. Novel peptides derived from egg white protein inhibiting alpha-glucosidase[J]. Food Chemistry, 2011, 129(4): 1 376-1 382.
[16] ZHANG Yu, WANG Nan, WANG Wei, et al. Molecular mechanisms of novel peptides from silkworm pupae that inhibit α-glucosidase[J]. Peptides, 2016, 76: 45-50.
[17] YU Zhi-peng, YIN Yong-guang, ZHAO Wen-zhu, et al. Anti-diabetic activity peptides from albumin against α-glucosidase and α-amylase[J]. Food Chemistry, 2012, 135(3): 2 078-2 085.
[18] LUO Jian-guang, WANG Xiao-bing, MA Li, et al. Gypsophin: A novelα-glucosidase inhibitory cyclic peptide from the roots of Gypsophila oldhamiana[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(16): 4 460-4 463.
[19] FANG Lin-lin, CAO Jia-qing, DUAN Li-li, et al. Protein tyrosine phosphatase 1B (PTP1B) and α-glucosidase inhibitory activities of Schisandrachinensis (Turcz.) Baill[J]. Journal of Functional Foods, 2014, 9: 264-270.
[20] BRANDELLI A, DAROIT D J, CORRA A P F. Whey as a source of peptides with remarkable biological activities[J]. Food Research International, 2015, 73: 149-161.
[21] RAMCHANDRAN L, SHAH N P. Influence of addition of Raftiline HP® on the growth, proteolytic, ACE- and α-glucosidase inhibitory activities of selected lactic acid bacteria and Bifidobacterium[J]. LWT - Food Science and Technology, 2010, 43(1): 146-152.
[22] 贾韶千. 银杏抗氧化肽的制备活性研究分离纯化[D]. 南京: 南京林业大学, 2011: 67-81.
[23] 荆贝贝. 银杏种仁抗菌肽的分离纯化、性质鉴定及其总RNA提取[D]. 陕西: 西北农林科技大学, 2006: 45-51.
[24] 梁凯. 汉麻籽粕降血糖肽的酶法制备及其分离纯化[D]. 广州: 华南理工大学, 2011: 39.
[25] POWER O, FERNNDEZ A, NORRIS R, et al. Enzyme-assisted extraction and identification of antioxidative andα-amylase inhibitory peptides from Pinto beans (Phaseolus vulgaris cv. Pinto)[J]. J. Funct. Foods, 2014, 9: 38-47.
Preparation ofα-glucosidase inhibitory peptides derived from Ginkgo biloba by enzymatic method
ZHANG Can1
WUCai-e1
FANGong-jian1
LITing-ting1
WANGJia-hong1宫 号1GONGHao1
CAOFu-liang2
(1.CollegeofLightIndustryScienceandEngineering,NanjingForestryUniversity,Nanjing,Jiangsu210037,China;2.CollegeofForestResourcesandEnvironment,NanjingForestryUniversity,Nanjing,Jiangsu210037,China)
The preparation ofα-glucosidase inhibitory peptides was gotten, which was derived from ginkgobilobaby enzymatic hydrolysis with papain. A factorial design experiment was conducted, while, the effects of concentration of substrate, pH, E/S ratio, extraction temperature and time were studied. And then, it was fractioned by using membrane ultrafiltration with molecular weight cutoffs of 100, 50, 30, 10 and 3 kDa. The results showed: with the concentration of substrate 1.5%, pH 7.36, E/S ratio of 5 g/100 g, temperature of 57.9 ℃ and extraction time of 4.4 h, the inhibitory activities ofα-glucosidase was the highest, and reached 17.18%. The inhibitory activities ofα-glucosidase, peptide fraction <3 kDa, exhibited the highest and reached 50.43%. Therefore, the ginkgo protein hydrolysate or its active peptides can be used in foods against hypertension and related diseases.Keywords:Ginkgobiloba; alpha-glucosidase; enzymatic hydrolysis; bioactive peptide
国家科技支撑计划项目(编号:2012BAD21B04) ;江苏省科技支撑计划重点研发项目(编号:BE2015315);江苏高校优势学科建设工程资助项目(编号:PAPD)
张灿,女,南京林业大学在读硕士研究生。
吴彩娥(1963—),女,南京林业大学教授,博士。 E-mail:wucaie@njfu.edu.cn
2016—07—29
10.13652/j.issn.1003-5788.2016.11.031
