适合牛肉嫰化的微生物菌株的分离、筛选与鉴定
2016-12-29谭雅
谭 雅
李宗军
李 珂
吴根梁
(湖南农业大学,湖南 长沙 410128)
适合牛肉嫰化的微生物菌株的分离、筛选与鉴定
谭 雅
李宗军
李 珂
吴根梁
(湖南农业大学,湖南 长沙 410128)
为筛选得到适合嫩化牛肉的优良菌株,从贵州传统豆豉和甜酒曲分离得到产蛋白酶的细菌22株;以酶活值为主要指标,牛肉的质构特性为参考指标,对菌株进行复筛,最终确定D7为最优菌株,酶活达71.68 U/g。结合16S rDNA序列鉴定及系统发育树分析,对目的菌株进行分子生物学鉴定。结果表明:D7与解淀粉芽孢杆菌(JN700123.1)最为接近,相似度达99%,该菌株鉴定为解淀粉芽孢杆菌。
蛋白酶;酶活;解淀粉芽孢杆菌;质地剖面分析(TPA);16S rDNA
随着人们肉食结构的改变和生活水平的不断提高,牛肉越来越受到消费者的青睐,而牛肉的嫩度是影响消费者评定牛肉质量最重要的一个因素[1],所以肉类嫩化的相关研究逐渐成为人们关注的热点之一。在中国部分役用牛、水牛和山区放养的老龄黄牛也被适时地作为肉用,这类牛肉的质构特性相对较差,但对中国肉食结构的改善是重要的补充。特别是在欠发达地区和中档以下的餐厅具有较大的市场,采取科学、有效、安全的技术措施,改善这类牛肉的品质,具有重要的现实意义。牛肉嫩化的方法主要包括电刺激法[2]、机械嫩化法[3]、高压嫩化法[4]、超声波嫩化法[5]、外源酶嫩化法[6]等,从目前效果来看,外源性蛋白酶技术可使牛肉柔软且易于咀嚼,能很好地提高牛肉的品质。但是目前市场上,嫩肉粉鱼龙混杂,产品质量不一,组成成分各异,存在一定的安全隐患,动植物来源的蛋白酶由于受到原料的限制,实际应用因成本问题而有一定的困难。微生物源的单一蛋白酶对于肉品的嫩化效果不一,难以实现标准化控制。而随着肉品加工业的不断发展,特别是肉类中式菜肴的工业化生产,希望有安全、高效、可控的优质肉类嫩化剂来保障菜肴工业化生产过程中的标准化。生物型嫩化剂是通过筛选特定的微生物,采用现代发酵工程技术手段,获得由多种蛋白酶组成的复合型酶制剂,在理论上可以对牛肉中的不同蛋白质进行可控的降解,从而提高牛肉的嫩度,改善牛肉的风味及加工品质,目前还鲜见文献报道。
本试验拟从贵州传统豆豉和甜酒曲中分离筛选出产蛋白酶的细菌菌株,在特定条件下培养后,用发酵液处理黄牛肉后,经质构特性分析,筛选出适合嫩化牛肉的优良菌株,为开发生物型牛肉嫰化剂提供优质的具有自主知识产权的微生物资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
豆豉:产自贵州省镇远县;
甜酒曲:贵州省玉屏县城关酒曲厂。
1.1.2 培养基
分离培养基:蛋白胨10 g、葡萄糖1 g、氯化钠5 g、氯化钙0.1 g、L-酪氨酸0.1 g、琼脂15 g、酪素5 g、蒸馏水1 000 mL、pH值7.2~7.4,112 ℃灭菌30 min;
发酵培养基:葡萄糖10 g、酵母膏2 g、蛋白胨0.2 g、氯化钠2 g、氯化钙2 g、磷酸氢二钾5 g、磷酸二氢钾1.25 g、硫酸镁0.01 g、硫酸铁0.001 g、蒸馏水1 000 mL、pH值7.0,121 ℃下灭菌20 min;
酪蛋白琼脂培养基:酪蛋白10 g、氯化钠5 g、磷酸氢二钠2 g、琼脂15 g、牛肉膏3 g、蒸馏水1 000 mL、0.4%溴麝香草酚蓝溶液12.5 mL、pH 7.4、121 ℃灭菌20 min。
1.1.3 试剂药品
DNA Marker、细菌提取试剂盒:北京鼎国昌盛生物技术有限公司;
PCR相关试剂:美国Genview公司;
其他试剂为国产分析纯。
1.1.4 设备与仪器
恒温培养箱:SPX-250B5-II型,上海新苗医疗器械制造有限公司;
摇床:SKY-2102C型,上海百典仪器设备有限公司;
显微镜:OLYMPUS型,北京瑞科中仪科技有限公司;
冷冻离心机:TGL-20M型,长沙英泰仪器有限公司;
无菌操作台:SW-CJ-1FD型,苏州江东精密仪器有限公司;
紫外分光光度计:BlueStar型,北京莱伯泰科仪器有限公司;
PCR仪:BIO-RAD型,深圳市宇德立生物科技有限公司;
电泳仪:DYCP-33B型,北京六一仪器厂;
质构仪:TA-XT.Plus型,北京微讯超技仪器技术有限公司。
1.2 试验方法
1.2.1 目的菌株的初筛 准确称取待分离食品样品各10 g,放入盛有90 mL无菌生理盐水并带玻璃珠的250 mL三角瓶中,振摇约20 min,使微生物细胞分散,静置20~30 s,即成10-1稀释液。取上述稀释液用无菌生理盐水梯度稀释成10-2~10-76个梯度,豆豉取10-5~10-7,甜酒曲取10-3~10-5进行平板涂布分离,每个梯度3个平行;涂布量0.1 mL,所得样品于37 ℃恒温培养24~48 h。
1.2.2 目的菌株的复筛 取初筛得到的菌株接种至5 mL液体发酵培养基中,37 ℃下220 r/min摇床培养40 h,10 000 r/min离心10 min,取上清液,以0.5 cm直径圆形滤纸片蘸上清液贴于酪蛋白平板中,于37 ℃恒温培养24 h后,用量尺测量透明圈的直径与菌落的直径,根据平板上透明圈直径和菌落直径比值(H/C)的大小,筛选出产生较大水解圈的菌株。
1.2.3 产蛋白酶菌株发酵试验 将筛选菌株接种至5 mL的牛肉膏蛋白胨液体培养基中,37 ℃下220 r/min摇床培养12~16 h,按5%接种量接种至50 mL的液体发酵培养基中,37 ℃下220 r/min摇床培养48 h,10 000 r/min离心10 min,取上清液测蛋白酶活力。
酶活力测定按GB/T 23527—2009《蛋白酶制剂》的福林法执行。
1.2.4 牛肉TPA质构特性的测定 将酶活力较大的菌株活化,以5%的量接种于50 mL灭菌发酵培养基中,37 ℃下220 r/min摇床培养48 h,5 000 r/min离心3 min,则上清液为粗酶液。取牛肩胛肉,切成2 cm的正方体,分装到蒸煮袋中,在25 ℃的水浴锅中将酶液倒入蒸煮袋对牛肉进行浸渍,50 min后将样品置于80 ℃水浴锅中加热,待中心温度达到70 ℃后取出,冷却样品至4 ℃后,采用物性测试仪测定酶液浸渍后牛肉的质构特性[7],测定样品的硬度、弹性、凝聚性、胶着性、咀嚼性和回复性,测试完成后,采用spss18.0分析结果。参数[8]设定有一定调整,如下:探头P/36R;测前2.00 mm/s,测中1.00 mm/s,测后2.00 mm/s,压缩比50%,每组6个平行。
1.2.5 菌株的鉴定
(1) 形态学观察:观察菌株在平板和斜面上的培养特征,同时进行革兰氏染色[9],光学显微镜放大1 000倍观察个体形态,进行初步鉴定。
(2) 总DNA的提取:采用溶菌酶破壁[10]和细菌DNA提取试剂盒结合的方法提取目的菌株总DNA。具体如下:取菌液0.6~3.0 mL,12 000 r/min离心1 min弃上清,加入1~2 mL的浓度为5 mg/mL的溶菌酶溶液,37 ℃的水浴锅酶解破壁,酶解2 h左右,离心弃上清;加入600 μL Lysis Buffer A,漩涡重悬,加入20 μL Proteinase K 60 ℃水浴45~60 min,其间颠倒混匀数次;加入400 μL Lysis Buffer B 充分混匀;10 000 r/min离心10 min,将上清液倒入离心柱中,12 000 r/min离心1 min,弃废液;加入700 μL Wash buffer A(使用前检查是否已加入无水乙醇),12 000 r/min离心1 min,弃废液;加入700 μL Wash buffer B,12 000 r/min离心1 min,弃废液;加入500 μL Wash buffer B,12 000 r/min离心1 min,弃废液;再次12 000 r/min离心2 min,将离心柱置于新的离心管中,并打开离心柱盖,于室温或37 ℃恒温箱放置5~10 min,直至无明显乙醇味;在硅基质膜中加入50~200 μL TE buffer(事先预热在55~65 ℃水浴锅中),置于室温2 min,12 000 r/min离心2 min,管底即为基因组。
(3) PCR扩增及序列测定:反应体系(25 μL):10×PCR buffer(含25 mmol/L Mg2+)2.5 μL,dNTPs(10 μmol/L)0.5 μL,引物(20 μmol/L)各1 μL,Taq(2 U/μL)0.5 μL,DNA模板0.5 μL,ddH2O 19 μL。反应参数:95 ℃预变性3 min;94 ℃变性50 s;53.5 ℃退火1 min;72 ℃延伸90 s;体系运行30个循环后72 ℃延伸5 min 30 s。将PCR产物用1.0%琼脂糖凝胶电泳检测后送至上海生工生物技术有限公司测序。
(4) 序列分析:将测序获得的序列于NCBI中利用Blast软件进行比对分析后,利用Lasergene软件构建目的菌株的系统发育树。
2 结果与分析
2.1 菌种的分离、纯化与筛选
挑取出能产生水解圈的菌株,经分离和纯化共得到豆豉12株、甜酒曲10株,将这22株菌接种于酪蛋白平板中,其水解圈的比值见表1。将水解圈直径和菌落直径比值大于3的菌株进行蛋白酶活力的测定,由表1可知,分别选出豆豉(D5、D7、D9、D11、D12)和甜酒曲(J1、J3、J5、J6、J9)进行下一级筛选。
2.2 蛋白酶活力的测定
2.2.1 酪氨酸标准曲线图(图1) 根据标准曲线的各点,添加趋势线后得出回归方程y=0.010 8x-0.076 8,利用回归方程,计算出当吸光度为1时的酪氨酸的量(μg),即吸光常数K值为99.7,利用K值,计算出酶活力值。

表1 透明圈与菌落直径比值(H/C)表Table 1 The ratio of hydrolytic zone and colony area(H/C)

图1 酪氨酸标准曲线图Figure 1 The standard curve of L-tyrosine
2.2.2 蛋白酶活力值 由表2可知,10株菌中,通过纵向比较,发现蛋白酶活力较大的菌分别是豆豉中的D7、D11和甜酒曲中的J5、J9,分别达到71.68,66.75,71.39,54.56 U/g。因此选取这4株菌对牛肉进行浸渍,并测定其质构特性。

表2 菌的蛋白酶活力值Table 2 The protease activity value of strain
2.3 不同菌株产蛋白酶对牛肉的质构特性
经试验得出,4种菌均能使牛肉的质构特性得以改善,见表3。其中菌D11处理组的硬度、胶着性和咀嚼性相对于空白组分别降低了8.5%,12.5%,13.8%;菌J9处理组硬度、胶着性和咀嚼性分别降低了19.3%,20.44%,29.4%;菌J5处理组硬度、胶着性和咀嚼性分别降低了23.4%,24.5%,25.12%;菌D7处理组硬度、胶着性和咀嚼性分别降低了31.37%,31.8%,38.2%;通过这4株菌处理后的牛肉在硬度、胶着性和咀嚼性中相对于空白组K显著下降,变化均差异显著(P<0.05),这就表明酶液对牛肉的质构特性有一定的影响,但是在弹性、凝聚性和回复性中无明显变化。通过4株菌处理后的牛肉硬度值从大到小的顺序是D7、J5、J9、D11,胶着性从大到小的顺序是D7、J5、J9、D11,咀嚼性从大到小的顺序是D7、J9、J5、D11。综合以上分析,菌D7对牛肉的嫩化效果最为突出,则确定D7为最佳的对牛肉嫩化的菌株,并进行分子学鉴定。
2.4 D7的鉴定结果与分析
2.4.1 形态学观察结果与分析 观察D7在平板和斜面上的培养特征,菌株在分离培养基平板上37 ℃培养(24±2) h呈白色,光滑湿润菌落,稍隆起,菌落中间有褶皱,在分离培养基斜面上呈薄膜状,表面白色,见图2。同时对D7进行革兰氏染色,光学显微镜放大1 000倍观察个体形态,为革兰氏阳性、有芽孢的杆状菌,见图3。但是并不能得出D7的种属信息,因此需进一步做分子生物学鉴定。
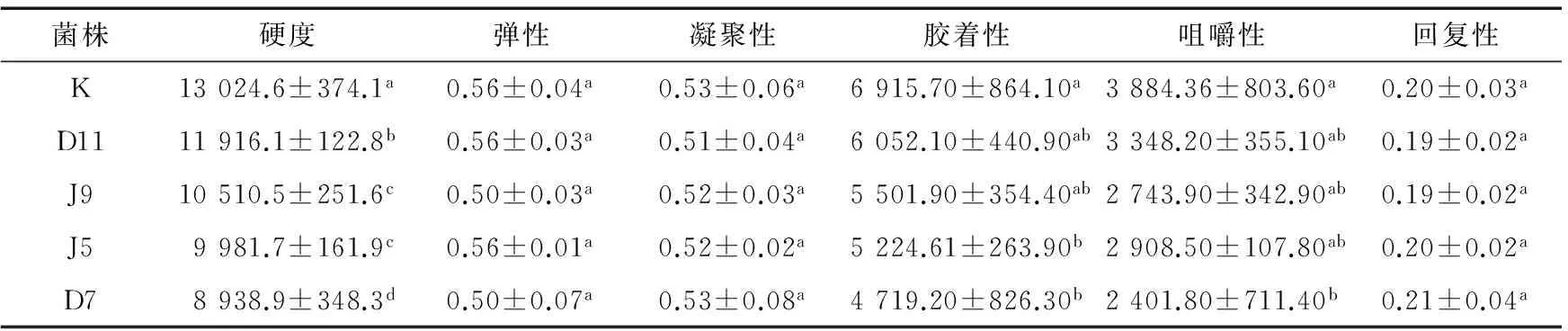
表3 不同菌株处理后质构特性的变化†Table 3 The different strains after processing quality and structure features of change
† 同列不同字母表示差异显著(P<0.05)。
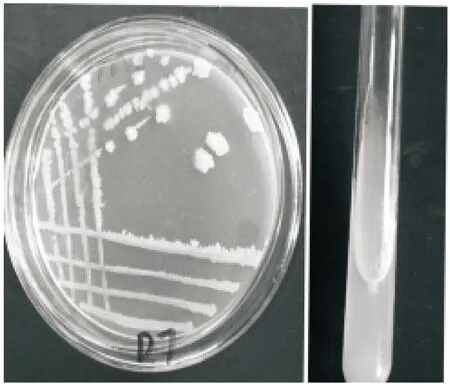
图2 细菌D7平板和斜面培养特征Figure 2 Bacterial characteristics in plate and slant culture
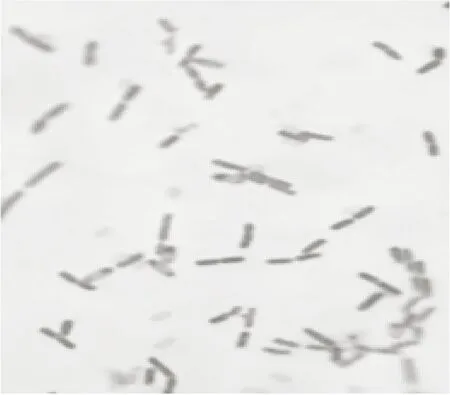
图3 D7革兰氏染色图Figure 3 Gram stain picture of D7
2.4.2 分子生物学鉴定结果与分析 以溶菌酶破壁和细菌提取试剂盒相结合的方法提取细菌D7基因组DNA,27F/1492R为引物扩增细菌D7的ID区,扩增产物用琼脂糖电泳检测,条带清晰(见图4),扩增的片段长度在1 500 bp左右。
将回收好的细菌PCR产物送至上海生工生物技术有限责任公司检测基因序列,得到细菌准确的序列在NCBI上进行BLAST比对,得出细菌D7与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)序列相似性达99%,最后采用Lasergene软件构建目的菌株D7的系统发育树,见图5。
3 结论
本试验对产蛋白酶菌株的来源进行了一个比较全面、细致的筛选,分离鉴定出能嫩化牛肉的优势菌株D7。该菌的酶活力值、对牛肉嫩化的效果相对于空白组都较好。经16S rDNA测序及系统发育树分析,鉴定菌株D7为解淀粉芽孢杆菌(Bacillusamyloliquefaciens),但有关该菌的安全性及发酵工艺特性,还需要进一步的研究,随着研究的深入,该产品将具有广泛的应用前景。
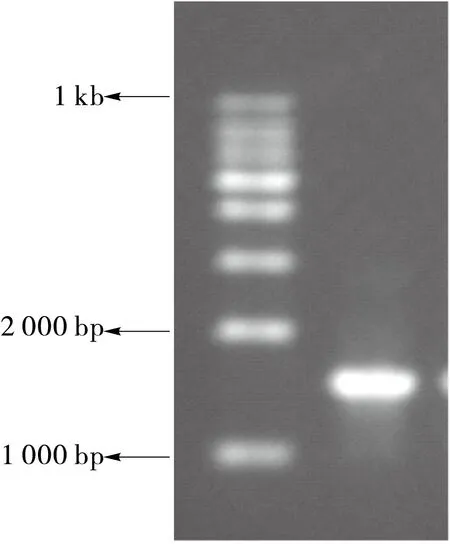
图4 细菌D7 16s rDNA电泳图Figure 4 16s rDNA electrophoretogram of bacteria D7

图5 D7解淀粉芽孢杆菌的16S rDNA系统发育进化树Figure 5 Phylogentic tree of Bacillus amyloliquefaciensD7 based on 16S rDNA 参考文献
[1] 张秋会, 李苗云, 黄现青, 等. 肉制品的质构特性及其评价[J]. 食品与机械, 2012, 28(3): 36-39.
[2] HWANG I H, DEVINE C E, HOPKINS D L. The biochemical and physical effects of electrical stimulation on beef and sheep meat tenderness[J]. Meat Science, 2003, 65: 677-691.
[3] HAYWARD L H, HUNT M C, KASTNER C L, et al. Blade tenderization effects on beef longissimus sensory and instron textural measurements[J]. Journal of Food Science, 1980, 45(4): 925-930, 935.
[4] 高海燕, 潘润淑, 马汉军. 超高压技术对鹅肉嫩度的影响[J]. 食品科学, 2011, 32(8): 107-110.
[6] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-43.
[7] 郝红涛, 赵改名, 柳艳霞, 等. 肉类制品的质构特性及其研究进展[J]. 食品与机械, 2009, 25(3): 125-128.
[8] 常海军, 唐翠, 牛晓影, 等. 超高压处理对牛肉肌内结缔组织胶原蛋白热力特性的影响[J]. 食品科学, 2013, 34(23): 28-31.
[9] 徐德峰, 李彩虹, 王雅玲, 等. 细菌革兰氏染色探究式实验教学的设计和实施效果分析[J]. 微生物学通报, 2013, 40(5): 871-876.
[10] 李琦, 张兰威, 韩雪, 等. 破壁方法对嗜热链球菌SP1.1胞内乳糖代谢关键酶活性的影响及其条件优化[J]. 食品科学, 2011, 32(9): 183-187.
Separation, screening and identification of special microbial strain for beef meat tenderizer
TAN Ya
LIZong-jun
LIKe
WUGen-liang
(HunanAgriculturalUniversity,Changsha,Hunan410128,China)
In order to obtain microbial strain suitable for the tenderization of beef, a total of 22 bacteria of producing proteinase were isolated from traditional lobster sauce and wine song in Guizhou. With the screening by using microscopy, analyses of enzyme activities, and TPA value of beef with in treatment of fermented broth, a bacteria defined as D7 was found the optimal strain, and its enzyme activity was 71.68 U/g. The molecular biological identification results showed that it was very similar toBacillusamyloliquefaciens(JN700123.1), and the similarity was 99%, on the basis of molecular biology identification, using 16S rDNA sequences identification and phylogenetic analyses. Thus this strain was identified asBacillusamyloliquefaciens.
protease; enzyme activity;Bacillusamyloliquefaciens; texture profile analysis(TPA); 16S rDNA
公益性行业(农业)科研专项(编号:201303082);湖南省科技厅重点项目(编号:2015NK2096);湖南省科技项目(编号:2015WK3015);湖南省科技厅科技计划重点研发项目(编号:2016NK2038)
谭雅,女,湖南农业大学在读硕士研究生。
李宗军(1967-),男,湖南农业大学食品科技学院教授,博导。E-mail:hnlizongjun@163.om
2016—08—23
10.13652/j.issn.1003-5788.2016.11.004
