对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶的抑制效果
2016-12-29易晶晶
易晶晶
欧仕益
董颖妍
陈秋明
(暨南大学食品科学与工程系,广东 广州 510632)
对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶的抑制效果
易晶晶
欧仕益
董颖妍
陈秋明
(暨南大学食品科学与工程系,广东 广州 510632)
通过测定酶的稳态活力、迟滞时间和动力学参数,研究对香豆酸、阿魏酸及低聚糖阿魏酸酯对酪氨酸酶的抑制效果。结果表明,3种物质对酪氨酸酶单酚酶活性均有抑制作用,其中对香豆酸的抑制作用最强,其次为低聚糖阿魏酸酯和阿魏酸。对香豆酸、低聚糖阿魏酸酯和阿魏酸对单酚酶的IC50值分别为0.75,3.20,9.30 mmol/L。对香豆酸和阿魏酸抑制二酚酶活性,IC50值分别为4.3,12.7 mmol/L;但低聚糖阿魏酸酯对二酚酶活力没有影响。对香豆酸能明显延长单酚酶反应的迟滞时间,阿魏酸影响很小,而低聚糖阿魏酸酯则缩短迟滞时间。动力学研究结果显示,阿魏酸和低聚糖阿魏酸酯对单酚酶的抑制作用表现为混合性抑制,而对香豆酸为竞争性抑制。
对香豆酸;阿魏酸;低聚糖阿魏酸酯;酪氨酸酶
酪氨酸酶(EC 1.14.18.1)是一种多酚氧化酶,其活性中心有两个铜离子,可催化单酚类物质(单酚酶活性)和二酚类物质氧化为醌类(二酚酶活性)[1],在黑色素形成的反应前期起着非常重要的作用,是人体黑色素合成的限速酶。由于黑色素的过度沉淀会导致雀斑、黄褐斑、老年斑等皮肤疾病[2],因此人们对酪氨酸酶抑制作用的研究日益重视。酪氨酸酶抑制剂主要分为五大类:某些酚类物质、苯甲醛类、苯甲酸衍生物、长链脂类或类固醇、还有其他的一些天然或者合成的抑制剂[3]。
对香豆酸以游离态或结合态广泛存在于水果、蔬菜、谷物及蕈类中,如苹果、梨、大豆、土豆、玉米和燕麦等[4];阿魏酸存在于一些水果、蔬菜、饮料和中药,如当归、升麻属类和川芎中[5]。玉米皮天然提取物低聚糖阿魏酸酯是阿魏酸与低聚糖酯化形成的物质,因其结构既含有阿魏酰基,又含有亲水性的低聚糖基团,因此具有阿魏酸和低聚糖的双重活性,能促进双歧杆菌的增殖、清除自由基、抑制红细胞氧化性溶血,水溶性好,热稳定性高[6]。因为酶抑制剂主要应用于食品和化妆品行业,其安全稳定和高效性是极其重要的因素,因此,低聚糖阿魏酸酯具有很高的实践应用价值。
近年来,对安全高效型酪氨酸酶抑制剂的探寻一直是一个研究热点。有前人发现对香豆酸和阿魏酸对单酚酶显示出一定的抑制效果,本试验则从单酚酶和二酚酶两个方面更系统地探讨了这两种物质对酪氨酸酶的抑制作用。玉米低聚糖阿魏酸酯作为一种新型功能性谷物提取物,对酪氨酸酶的抑制作用未见报道。本试验拟采用紫外分光光度法研究酪氨酸酶的活力,利用Lineweaver-Burk 双倒数法求出3种物质对酪氨酸单酚酶的抑制动力学参数从而探讨其抑制机理,旨在为天然安全的美白剂开发和食品保鲜技术如延缓果蔬、饮料类褐变提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
蘑菇酪氨酸酶:505 U/mg,超纯级,合肥博美生物科技有限责任公司;
酪氨酸、左旋多巴:99%,北京百灵威科技有限公司;
阿魏酸、对香豆酸:98%,广州市齐云生物技术有限公司;
低聚糖阿魏酸酯:本实验室参考文献[6]从玉米麸皮中提取,其阿魏酸质量分数为13%,还原糖主要有木糖、阿拉伯糖、半乳糖和葡萄糖;
玉米麸皮:山东西王集团有限公司;
二甲基亚砜(DMSO):99.8%,北京百灵威科技有限公司;
磷酸氢二钠、磷酸二氢钠:分析纯,天津市大茂化学试剂厂。
1.1.2 主要仪器设备
精密电子天平:HR-200型,广州市艾安得仪器有限公司;
紫外分光光度计:UV-900型,北京瑞利分析仪器公司;
水浴锅:HH-4型,江苏金坛市宏华仪器厂;
微型涡旋混合仪:XW-80A型,上海沪西分析仪器厂。
1.2 方法
1.2.1 3种物质对酪氨酸酶抑制作用(IC50)及迟滞时间的测定 根据文献[7~8],修改如下:将对香豆酸、阿魏酸、低聚糖阿魏酸酯溶于DMSO中配成不同浓度的溶液;将酪氨酸、多巴和酪氨酸酶分别用0.1 mmol/L磷酸缓冲液(pH 6.8)配成一定浓度的溶液。向离心管中加入由3.4 mL的酪氨酸(或多巴)和0.1 mL抑制剂(对照组用DMSO代替抑制剂)组成的混合液,将混合液和酶液分别置于37 ℃水中温浴5 min,取0.1 mL酶液加入混合液中,用涡旋混合仪混匀后立即倒入比色皿中,置于紫外分光光度计内,记录475 nm波长下吸光度的变化(以酪氨酸为底物,阿魏酸或低聚糖阿魏酸酯为抑制剂时,测量10 min内吸光度的变化,而添加对香豆酸为抑制剂则需测量30 min内的吸光度变化,以避免迟滞作用的干扰[9];以多巴为底物,3种物质分别为抑制剂时,均测量2 min内的吸光度变化)。在此体系中,酶的最终浓度为50 U/mL(多巴为底物时,酶浓度为20 U/mL),酪氨酸的最终浓度为1.5 mmol/L(多巴浓度为10 mmol/L)。
反应曲线的直线部分斜率即为速率,由于单酚酶反应具有迟滞效应,速率的计算应先获得反应曲线上4个连续点呈线性关系的回归方程,其斜率为速率;同时,将直线部分反向延长,交于横轴的值即为迟滞时间[10]。
1.2.2 3种物质对酪氨酸酶的抑制动力学 固定酶浓度50 U/mL,测量不同抑制剂浓度(对香豆酸:0.0,0.1,0.2 mmol/L;阿魏酸:0,3,7 mmol/L;低聚糖阿魏酸酯:0,1,2 mmol/L)和不同酪氨酸浓度(0.3~1.5 mmol/L)下酶的催化反应速度,用Lineweaver-Burk双倒数法做出酶动力学曲线得到动力学参数以判断其抑制类型。
1.2.3 相对抑制率的计算 计算公式:

(1)
式中:
I——相对抑制率,%;
Vi——有抑制剂存在时的反应速率,ΔOD475 nm/min;
V0——无抑制剂存在时的反应速率,ΔOD475 nm/min。
2 结果与分析
2.1 3种物质对单酚酶迟滞时间的影响
迟滞效应是酪氨酸酶单酚酶催化反应的典型特征[3]。表现为单酚底物与酶接触后,反应速度随时间的延长而逐渐增加,并最终达到稳定的最大速度。迟滞时间的延长,说明抑制剂增加了酶达到最大催化速度的时间,延缓了酶的反应。
酪氨酸酶在自然状态下主要以Emet形式存在[4],该状态下的酪氨酸酶不能与单酚底物结合,但具有二酚酶活性,能氧化邻二酚类化合物成邻二醌,同时酶转化成Edoxy态(脱氧态),而Edoxy状态下的酶能和氧分子结合转变成Eoxy状态[11]。Eoxy状态下的酶能使单酚底物和二酚底物通过不同途径氧化成醌类。酶从Emet状态转变为Eoxy状态需要一定的时间,因此产生了单酚酶氧化的迟滞效应。单酚底物反应的迟滞时间主要取决于反应溶液中酶和单酚底物的浓度,单酚底物浓度越大迟滞时间越长,酶浓度越大迟滞时间则越短[10]。
以酪氨酸为底物,酪氨酸酶催化反应的初始阶段速度较小,随着反应时间的延长而逐渐上升到稳定速度。加入不同浓度的对香豆酸后,迟滞时间随抑制剂浓度的升高而明显延长,当对香豆酸浓度达到1.5 mmol/L时,迟滞时间为对照组的7.5倍,见图1(a);以阿魏酸为抑制剂时,迟滞时间也随抑制剂浓度的增加而增加,但增加幅度比对香豆酸小,当阿魏酸浓度提高到10 mmol/L,迟滞时间仅增大到对照组的1.4倍,见图1(b);而低聚糖阿魏酸酯则缩短单酚酶的迟滞时间,当低聚糖阿魏酸酯为2.5 mmol/L时,迟滞时间变为对照组的50%,见图1(c)。
二酚类物质能使酶从Emet状态转化成Eoxy状态,因此二酚类物质的积累速度和单酚酶反应的迟滞时间有关。二酚类物质主要由Eoxy状态的酶氧化单酚底物产生的邻二醌还原而来[11]。本试验中,对香豆酸和阿魏酸能延长迟滞时间,可能是它们与底物竞争结合Eoxy状态的酶,而其氧化形成的邻二醌无法被还原成二酚类物质,因此减慢了二酚类物质的积累速度;低聚糖阿魏酸酯由于具有还原性的糖配基,会加速邻醌类还原成二酚类物质,从而缩短迟滞时间。

低聚糖阿魏酸酯的浓度用其总阿魏酸的浓度代替;迟滞时间是反应曲线直线部分反向延长并交于横轴的值,如图中虚线所示
图1 对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶抑制作用的进程曲线
Figure 1 Time course for the inhibition of monophenolase byp-coumaric acid, ferulic acid, and feruloylated oligosaccharides
2.2 3种物质对单酚酶的抑制效果(IC50)
酪氨酸酶能催化单酚化合物和二酚化合物氧化成黑色素,其中测定单酚酶活性时通常用酪氨酸作为底物,而测定二酚酶活性时则用多巴为反应底物。
由图2可知,3种物质的浓度与抑制效果都成正相关,对香豆酸、阿魏酸和低聚糖阿魏酸酯的半抑制浓度(IC50)分别为0.75,9.30,3.20 mmol/L。由此可见,以酪氨酸为底物时,对酪氨酸酶抑制效果最好的为对香豆酸,其次为低聚糖阿魏酸酯和阿魏酸。
阿魏酸在分子结构上比对香豆酸多了一个甲氧基,而阿魏酸对酪氨酸酶催化反应的抑制效果不如对香豆酸,说明酚酸苯环上甲氧基的增加会减弱酚酸对酪氨酸酶的抑制效果。因是甲氧基为供电子基团,使酚羟基上的电子云密度增加,电子不易离去,使得抑制剂较难与酪氨酸酶结合。低聚糖阿魏酸酯和游离的阿魏酸相比,具有更强的金属离子螯合力[12],从而将酶中的铜离子螯合,使酶的活力下降。同时,低聚糖阿魏酸酯中的醛基可与酶活性中心周围的氨基酸残基结合而形成空间位阻,因此具有更强的酪氨酸酶抑制力[13]。

低聚糖阿魏酸酯的浓度用其总阿魏酸的浓度替代图2 不同浓度的对香豆酸、阿魏酸和低聚糖阿魏酸酯 单酚酶抑制率的影响
Figure 2 Inhibitory effect of different concentration ofp-coumaric acid, ferulic acid and feruloylated oligosaccharides on monophenolase
2.3 3种物质对单酚酶的抑制动力学
对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶单酚酶抑制作用的机理,可以以酪氨酸为底物,通过研究抑制剂对酶催化反应动力学参数的影响来推断。通过做Lineweaver-burk双倒数图,可推算出酶抑制动力学的两个重要参数:表观米氏常数(Km)和最大反应速度(Vm)。
图3为本试验研究的3种物质的Lineweaver-burk双倒数图。当加入不同浓度的低聚糖阿魏酸酯和阿魏酸时,随着抑制剂浓度增大,Km值增大而Vm值下降,可以推断低聚糖阿魏酸酯和阿魏酸对酪氨酸酶的抑制机理都为混合型抑制,且得到的两组Lineweaver-burk直线相都交于第二象限说明为竞争—非竞争性混合抑制[14]。对于对香豆酸,直线斜率随对香豆酸浓度增加而增大,纵截距不变,说明米氏常数Km值增大而Vm值恒定,表现为竞争性抑制。
酪氨酸酶反应活性中心有两个金属铜离子,CuA和CuB,酪氨酸会和其中的CuA结合从而进一步被催化氧化成醌类[15]。由于供试的3种物质都具有与酪氨酸相似的结构,由试验结果可推测,对香豆酸与游离的酪氨酸竞争性结合CuA位点;低聚糖阿魏酸酯和阿魏酸与酪氨酸竞争酶的CuA位点或与酶—酪氨酸络合物结合从而抑制产物的形成,另外,低聚糖阿魏酸酯中的糖苷配基的醛基能与酶活性中心周围的氨基酸残基结合,形成席夫碱结构,从而在活性中心周围形成空间位阻,也阻碍酶和底物结合[13]。
2.4 3种物质对二酚酶的抑制效果(IC50)
图4显示了不同浓度的3种物质与二酚酶抑制率的关系。以多巴为底物时,对香豆酸和阿魏酸对二酚酶的抑制率随抑制剂浓度的增加而增加。对香豆酸和阿魏酸对二酚酶的IC50值分别为4.3,12.7 mmol/L,可见对香豆酸对二酚酶的抑制效率高于阿魏酸。低聚糖阿魏酸酯在DMSO的可溶解范围内对二酚酶基本没有影响(如图4中低聚糖阿魏酸酯曲线所示)。
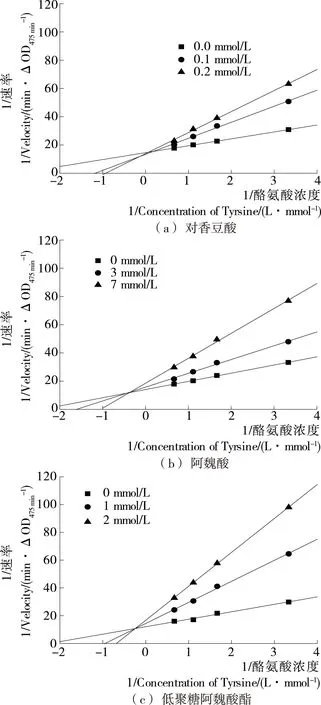
图3 加入对香豆酸、阿魏酸和低聚糖阿魏酸酯后单酚酶的 Lineweaver-Burk曲线
Figure 3 Lineweaver-Burk plots of monophenolase after the addition ofp-coumaric acid, ferulic acid, feruloylated oligosaccharides

低聚糖阿魏酸酯的浓度用其总阿魏酸的浓度替代,小图为低聚糖阿魏酸酯曲线的放大图
图4 不同浓度的对香豆酸、阿魏酸和低聚糖阿魏酸酯二酚酶抑制率的影响
Figure 4 Effect of different concentration ofp-coumaric acid, ferulic acid and feruloylated oligosaccharides on the inhibitory rate of diphenolase
3 结论
对香豆酸对单酚酶和二酚酶都有抑制作用,主要表现在延长单酚酶作用的迟滞时间,降低单酚酶和二酚酶反应稳态时的速度;阿魏酸对单酚酶和二酚酶都有抑制作用,但抑制效果不如对香豆酸,说明酚酸苯环上甲氧基的增加会减弱酚酸对酪氨酸酶的抑制效果;低聚糖阿魏酸酯会缩短单酚酶的迟滞时间,阿魏酸总浓度相同时,低聚糖阿魏酸酯对单酚酶稳态速度的抑制效果高于游离态的阿魏酸,但低聚糖阿魏酸酯对二酚酶的活力没有影响。对香豆酸对单酚酶的抑制机理为竞争性抑制,阿魏酸和低聚糖阿魏酸酯属于混合型抑制。
考虑到低聚糖阿魏酸酯是从玉米皮中提取的天然化合物,成本低,具有抗氧化、抗糖基化等其他功效[16],可以添加于美容或保健产品中,提升其保健价值。
[1] KANTEEV M, GOLDFEDER M, FISHMAN A. Tyrosinase: Structure-function correlations in tyrosinases[J]. The Prorein Society, 2015, 24(9): 1 360-1 369.
[2] LEE S Y, BAEK N, NAM T G. Natural, semisynthetic and synthetic tyrosinase inhibitors[J]. Journal of Enzyme Inhibtion and Medicinal Chemistey, 2016, 31(1): 1-13.
[3] CHANG Te-sheng. An updated review of tyrosinase[J]. International Journal of Molecular Sciences, 2009, 10(6): 2 440-2 475.
[4] PEI Ke-han, OU Juan-ying, HUANG Jun-qing, et al.p-Coumaric acid and its conjugates: dietarysources, pharmacokinetic propertiesand biological activities[J]. Journal of the Science of Food and Agriculture, 2016, 96(9): 2 952-2 962.
[5] PEI Ke-han, OU Juan-ying, HUANG Cai-huan, et al. Derivatives of ferulic acid: Structure, preparation and biological activities[J]. Annual Research & Review in Biology, 2015, 5(6): 512-528.[6] YAO Sheng-wen, WEN Xiao-xiao, HUANG Ru-qing, et al. Protection of feruloylated oligosaccharides from corn bran against oxidative stress in PC 12 cells[J]. Journal of Agriculture and Food Chemistry, 2014, 62(3): 668-674.
[7] 刘晓丹, 黄璜, 陈清西. 苯甲酸对蘑菇酪氨酸酶抑制作用机理的研究[J]. 厦门大学学报, 2003, 42(1): 102-106
[8] CUI Yi, LIANG Ge, HU Yong-hua, et al. Alpha-Substituted derivatives of cinnamaldehyde as tyrosinase inhibitors: Inhibitory mechanism and molecular analysis[J]. Journal of Agriculture and Food Chemistry, 2015, 63(2): 716-722.
[9] AN S M, KOH J S, BOO Y C.p-Coumaricacid not only inhibits human tyrosinase activity in vitro but also melanogenesis in cells exposed to UVB [J]. Phytotherapy Research, 2010, 24(8): 1 175-1 180.
[10] SANCHEZ F A, RODRIGUEZ J N, GARCIA C F. Tyrosinase: A comprehensive review of its mechanism[J]. Biechem Biophys Aeta, 1995, 1 247(1): 1-11.
[11] RAMSDEN C A, RILEY P A. Tyrosinase: The four oxidation states of the active site and theirrelevance to enzymatic activation, oxidation and inactivationitors[J]. Bioorganic & Medicinal Chemistry, 2014, 22(8): 2 388-2 395.
[12] LIN Qi-ling, OU Shi-yi, WEN Qi-biao. In vitro antioxidant activity of feruloyl arabinose isolated from maize bran by acid hydrolysis[J]. Journal of Food Science and Technology, 2014, 51(7): 1 356-1 362.
[13] 陈清西, 林建峰, 宋康康. 酪氨酸酶抑制剂的研究[J]. 厦门大学学报, 2007, 46(2): 274-282.
[14] 郑穗平, 郭勇, 潘力. 酶学[M]. 北京: 科学出版社, 2009: 106-117.
[15] DECKER H, SCHWEIKARDT T, TUCZEK F. Therst crystal structure of tyrosinase: all questions answered?[J]. Angewandte Chemie International Edition, 2006, 45(28): 4 546-4 550. [16] OU Juan-ying, SUN Zheng. Feruloylated oligosaccharides:Stucture, metabolism and function[J]. Journal of Functional Foods, 2014, 7: 90-100.
The inhibitory effect on tyrosinase from p-coumaric acid, ferulic acid and feruloylated oligosaccharides
YI Jing-jing
OUShi-yi
DONGYing-yan
CHENQiu-ming
(DepartmentofFoodScienceandEngineering,JinanUniversity,Guangzhou,Guangdong510632,China)
This study investigated the inhibitory effects ofp-coumaric acid, ferulic acid and feruloylated oligosaccharides on catalytic activities of tyrosinase by analysising tyrosinase steady state activity and enzyme kinetics. The results showed that the three compounds were found to efficiently inhibit tyrosinase monophenolase activities. Thep-Coumaric acid was the strongest inhibitor followed by feruloylated oligosaccharides and ferulic acid, with theIC50value of 0.75, 3.20, 9.30 mmol/L respectively. Moreover,p-coumaric acid and ferulic acid were found to inhibit the activities of diphenolase withIC50value of 4.3, 12.7 mmol/L respectively; however, feruloylated oligosaccharides showed no inhibitory effect on diphenolase activity.p-Coumaric acid increased the lag time of monophenolase activity, but ferulic acid showed little effect; while feruloylated oligosaccharides reduced the lag time of monophenolase activity. Enzyme kinetics analysis indicated thatp-coumaric acid is a competitive inhibitor of the monophenolase, while ferulic acid and feruloylated oligosaccharides showed a mixed inhibitory effect.
p-coumaric acid; ferulic acid; feruloylated oligosaccharides; tyrosinase
国家自然科学基金(编号:31371745)
易晶晶,女,暨南大学在读硕士研究生。
欧仕益(1963-),男,暨南大学教授,博士。 E-mail: tosy@jnu.edu.cn
2016-08-10
10.13652/j.issn.1003-5788.2016.11.002
