一种从小卷蛾斯氏线虫怀卵成虫制备感染期幼虫的简易方法
2016-12-27韩日畴
颜 珣,韩日畴
(广东省生物资源应用研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260)
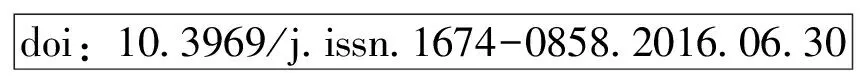
一种从小卷蛾斯氏线虫怀卵成虫制备感染期幼虫的简易方法
颜 珣,韩日畴*
(广东省生物资源应用研究所,广东省动物保护与资源利用重点实验室,广东省野生动物保护与利用公共实验室,广州 510260)
昆虫病原线虫是新型的生物杀虫剂,其感染期幼虫是昆虫病原线虫产业化生产和应用的唯一虫态,对昆虫病原线虫基因功能的研究及转基因改造有助于推进昆虫病原线虫的产业化。本研究基于昆虫病原线虫“噬母现象”的原理,以不同的孵育液孵育小卷蛾斯氏线虫Steinernemacarpocapsae的怀卵成虫,找到可以简单快速从怀卵成虫直接获得整齐龄期的感染期幼虫的方法,为该线虫卵或性腺的RNA干扰后感染期幼虫的收集及生物测定提供基础,为昆虫病原线虫的转基因改造以提高其环境耐受力提供技术支持。
小卷蛾斯氏线虫;感染期幼虫;噬母现象;体外诱导;生物防治
昆虫病原斯氏属Steinernema与异小杆属Heterorhabditis线虫是国际上新型的生物杀虫剂,具有广泛的寄主范围;对寄主特别是对土栖性及钻蛀性害虫具主动搜寻能力;对人畜、环境安全,易于大量培养,使用方便,在环境中可循环利用,已经商业化应用于各种重要害虫的安全防治(Grewaletal.,2005;Georgisetal.,2006;Kayaetal.,2006;Laceyetal.,2015)。在我国,昆虫病原线虫也已经商业化生产和销售,并应用于防治多种农林、草地、花卉以及卫生等害虫,结果令人鼓舞(Grewaletal.,2005;韩日畴等,2008;颜珣等,2014)。
昆虫病原线虫是与其体内专化性携带的共生菌一起致死寄主昆虫的。昆虫病原线虫以感染期幼虫(Infective juvenile,IJ)随寄主食物或从昆虫的自然开口(如肛门、气孔)、节间膜进入昆虫体内,随后释放肠腔中携带的共生菌。线虫及其共生菌分泌毒素(毒性因子)导致昆虫死亡,然后利用寄主体内的营养物质繁殖后代。昆虫病原线虫的生活史包括卵、一至四龄幼虫和成虫阶段。感染期幼虫是昆虫病原线虫生活史中唯一具有杀虫能力的虫态,此龄期幼虫可自由生活于寄主体外,一般滞育不取食,对外界不良环境的耐受能力强,是昆虫病原线虫产业化生产和应用的目标虫态(Poinar,1990;Adams and Nguyen,2002)。
昆虫病原线虫卵缠在母体内并在母体内孵化,在感染期幼虫形成之前,幼虫取食母体组织,该过程称为“噬母过程”(endotokia matricida),母体组织的利用有利于将昆虫营养转化为感染期幼虫的生物能量(Steiner,1929;Baliadietal.,2001)。在外界营养供给不足或者环境恶劣时,噬母现象可以保证感染期幼虫的形成以确保昆虫病原线虫的存活。在昆虫病原线虫感染寄主昆虫体内或在体外进行培养时,由于有充足的营养,感染期幼虫恢复后经历多代才形成新的感染期幼虫。
本研究以不同的孵育液孵育小卷蛾斯氏线虫Steinernemacarpocapsae的怀卵成虫,以寻找最快获得由卵直接诱导形成感染期幼虫的方法,为小卷蛾斯氏线虫卵或性腺的RNA干扰后感染期幼虫的收集及生物测定提供基础和依据。
1 材料与方法
1.1 昆虫病原线虫
小卷蛾斯氏线虫S.carpocapsaeAll的感染期幼虫由广东省昆虫研究所以人工固体培养基培养获得(韩日畴等,1997),以浅水层方法贮存于10℃±1℃条件下,贮存期不超过15 d。
1.2 孵育液
用于怀卵成虫孵育的溶液包括纯水,0.9%氯化钠溶液(NaCl),PBS(0.85% NaCl,0.22% NaH2PO4,0.04% NaH2PO4,pH7.0),Ringer’s液1(0.9% NaCl,0.04% KCl,0.05% CaCl2,0.02% NaHCO3),Ringer’s液2(0.58% NaCl,0.01% KCl,0.02% CaCl2,0.02% MgCl2·6H2O,0.12% HEPES),P溶液(1%蛋白胨,1% NaCl),LB培养液(1%蛋白胨,0.5%酵母粉,1% NaCl),NB培养液(1.8%营养肉汤)。配制好各孵育液,于121℃,1.05 kPa灭菌30 min,室温保存备用。
1.3 感染期幼虫的诱导
将感染期幼虫接种到长好XenorhabdusnematophilaAll共生细菌的NBO培养基上(营养肉汤,1.5%琼脂粉,1%玉米油),每日观察感染期幼虫发育情况,约3 d后线虫发育成成虫且怀有成熟的卵。在超净工作台内用无菌Ringer’s液1将怀卵成虫洗出,清洗怀卵成虫3次。于96孔板内每孔加入50 μL的孵育液,每种孵育液12个孔,每孔挑入1条怀卵成虫,每个处理重复3次。封口膜封口,26℃孵育。每24 h观察卵孵化及幼虫发育情况,观察两周。实验用不同批次的共生细菌和昆虫病原线虫重复2次。
1.4 感染期幼虫对大蜡螟的感染力
在培养皿中测定线虫对大蜡螟的感染力(Yanetal.,2012)。收集形成的感染期幼虫,无菌水重悬,在垫有2层中速定性滤纸(新华牌)的灭菌培养皿(6 cm)中挑入5头大蜡螟末龄幼虫,然后均匀滴入1 mL含有100条在纯水中形成的感染期幼虫,封口膜封好后置于25℃黑暗条件下,对照为无菌水处理的大蜡螟。3 d后检查大蜡螟的死亡情况,5 d后解剖大蜡螟,检查线虫侵染及发育情况。
1.5 数据统计
计算怀卵成虫的存活率,卵孵化的比例,感染期幼虫形成最短时间,全部幼虫形成感染期幼虫的时间,单条怀卵成虫最终形成感染期幼虫的数量,以及感染期幼虫对大蜡螟的致死率。统计分析使用SPSS 16.0软件进行。百分数值均经反正弦转换后进行方差分析,采用Duncan检验各处理之间的差异显著性,显著水平P<0.05。
2 结果与分析
2.1 怀卵成虫存活及卵孵化情况
怀卵成虫在P,LB和NB溶液中的存活时间及比例见表1,在这3种孵育液中,由于细菌的大量生长,孵育液变混浊,怀卵成虫最短仅存活1 d,最长3 d即死亡。成虫体内卵不孵化,会释放部分卵到体外,LB溶液中释放的卵不孵化,P和NB溶液中有部分卵可孵化至1龄幼虫后死亡(比例分别为58.3%及37.5%)。怀卵成虫在其他5种孵育液中均可以存活至体内卵孵化后耗尽成虫营养,体外卵均可孵化并发育至2龄幼虫。
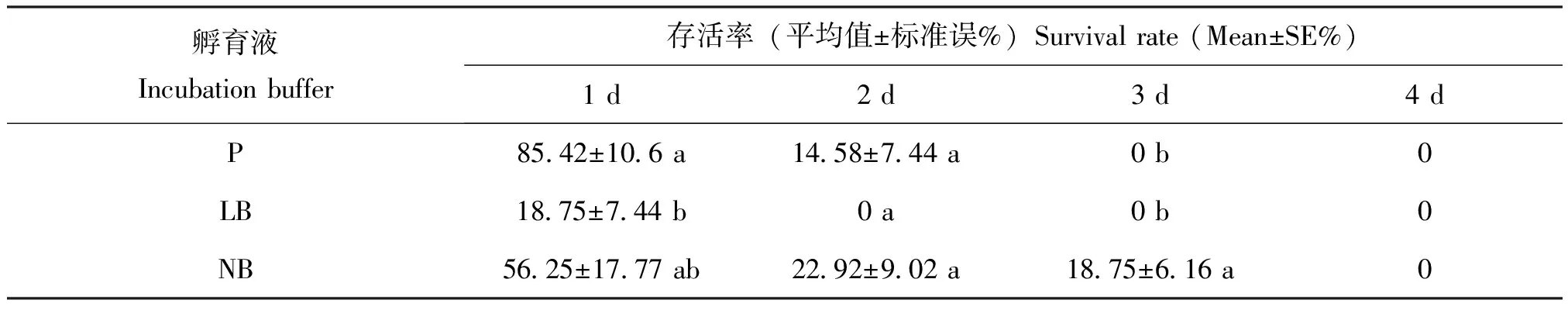
表1 怀卵成虫在不同孵育液中的存活时间及存活率
注:不同字母表示相同处理时间下不同孵育液中怀卵成虫的存活率之间存在显著性差异(Duncan检验,P<0.05)。Note: Different letters show significant differences among survival rates of the gravid female adults in different incubation buffers at the same treated time (Duncan’s test,P<0.05).
2.2 感染期幼虫的形成
不同孵育液中开始形成感染期幼虫的时间见图1。感染期幼虫在纯水中最快形成,最快仅需要2.5 d的时间即可观察到感染期幼虫的形成;感染期幼虫在PBS溶液中形成所需要的时间最长,最长需要6 d才能观察到感染期幼虫的形成。
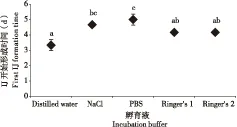
图1 感染期幼虫(Infective juveniles,IJ)在不同孵育液中开始形成时间Fig.1 Time for the first infective juvenile(IJ) formation in different incubation buffers注:不同字母表示感染期幼虫形成的时间之间存在显著性差异(Duncan检验,P<0.05)。Note: Different letters show significant difference among IJ formation time in different incubation buffers (Duncan’s test, P<0.05).
在观察的2周时期内,孵育单条怀卵成虫的8种孵育液中,仅在纯水及两种Ringer’s液中可观察到2龄幼虫全部转化成感染期幼虫,所需的时间见图2。2周内,其他孵育液中的幼虫或全部死亡,或者仍未完全转变成感染期幼虫。
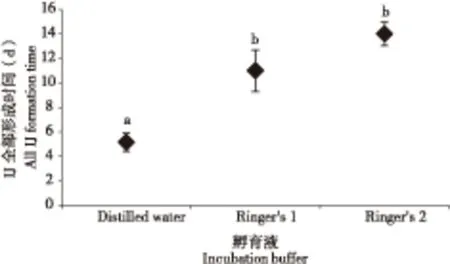
图2 孵育孔内全部形成感染期幼虫(Infective juveniles,IJ)时间Fig. 2 Times for all the infective juveniles (IJ) formation in different incubation buffers注:不同字母表示感染期幼虫全部形成的时间之间存在显著性差异(Duncan检验,P<0.05)。Note: Different letter shows significant difference among IJ formation time in different incubation buffers (Duncan’s test, P<0.05).
2.3 单条怀卵成虫形成感染期幼虫的数量及感染力
单条怀卵成虫产生的感染期幼虫的数量见图3。单条怀卵成虫产生的感染期幼虫数量差异较大,实验中观察到在纯水中最多能形成66条感染期幼虫,单条怀卵成虫平均能形成21±5条感染期幼虫。两种Ringer’s溶液中由于感染期幼虫形成耗时较长,线虫在孵育过程中死亡,因此全部幼虫形成感染期幼虫的最终数量显著下降,在Ringer’s 1和Ringer’s 2溶液中最高仅为21和13条。形成的感染期幼虫感染大蜡螟3 d后大蜡螟死亡率为100%(对照大蜡螟全部存活);5 d后解剖大蜡螟,体内由感染期幼虫发育而成的母虫已死亡,幼虫已发育至2-3龄。10 d后可观察到有感染期幼虫爬出大蜡螟尸体。
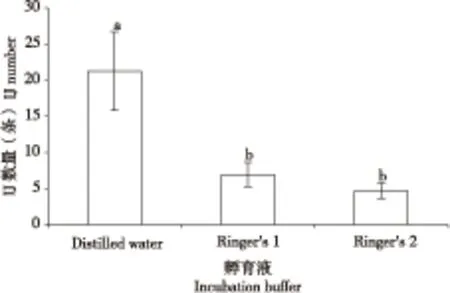
图3 孵育孔内全部形成感染期幼虫(Infective juveniles,IJ)时感染期幼虫数量Fig.3 Numbers of infective juveniles (IJ) produced from one gravid female adult in each incubation buffer注:不同字母表示不同孵育液中感染期幼虫数量之间存在显著性差异(Duncan检验,P<0.05)。Note: Different letter shows significant difference among IJ numbers in different incubation buffers (Duncan’s test, P<0.05).
3 结论与讨论
本研究选用了8种孵育液来孵育小卷蛾斯氏线虫的怀卵成虫,观察怀卵成虫在不同孵育液中的存活及卵的孵育情况,以及感染期幼虫诱导形成的情况。结果表明在含有营养物质的孵育液中(P,LB和NB溶液),由于共生细菌的大量生长,怀卵成虫体内卵无法孵化,怀卵成虫3 d即全部死亡;虽然有从母体排出的卵在孵育液P和NB溶液中能够孵化并发育,但生长至1龄幼虫末期即死亡。而在另外5种孵育液中,共生细菌不能大量生长,怀卵成虫均能存活。怀卵成虫会将部分卵排出体外,卵可在体外孵化并发育;怀卵成虫体内部分卵会在母体内孵化,出现噬母现象,母体营养耗尽后以2龄幼虫,或由2龄幼虫向感染期幼虫转变的虫态出母体,在孵育液中继续以2龄幼虫存活或形成感染期幼虫。在选择的5种孵育液中,纯水中是最先诱导出感染期幼虫的,也是所有幼虫都转变成感染期幼虫所需时间最短的。
Johnigk & Ehlers(1999)研究了H.bacteriophora和H.megidis线虫噬母现象发生的过程及其功能,发现在营养成分不如LCM培养液的Ringer’s液中,噬母现象发生更早;Baliadi等(2001)研究了H.bacteriophora,S.glaseri和S.carpocapsae等3种线虫在Ringer’s液1,营养琼脂及加了共生细菌的营养琼脂上发生噬母现象的情况,结果发现在Ringer’s液1中,噬母现象发生的比例最高,发生噬母现象的成虫数量几乎是在另外两种孵育液中数量的两倍。这与本研究的结果一致,在低水平食物供应的情况下会显著刺激噬母现象的发生,共生细菌的存在会延长成虫产卵的周期,从而推迟噬母现象的发生(Johnigk and Ehlers,1999)。本研究发现,在纯水中发生噬母现象的成虫,其后代能在少于1周的时间内全部形成IJ,全部形成IJ的时间显著短于在两种Ringer’s液中所需的时间,而营养成分介于纯水和Ringer’s液中的生理盐水及PBS中,则无法诱导获得全部的感染期幼虫,这其中的原因有待进一步研究。
在怀卵成虫出现噬母现象时,分泌到母体外的卵孵化后,在饥饿的情况下会提高其直接形成感染期幼虫的比例(Strauchetal.,1994)。本研究中,虽可观察到怀卵成虫在发生噬母现象之前,会将一部分卵排出体外,这些排出体外的卵在不同的孵育液中均可孵化并发育,但存活时间不长,且不能最终发育成感染期幼虫。
Baliadi等(2001)在研究3种昆虫病原线虫感染大蜡螟后产生的怀卵成虫在Ringer’s液1中孵育后的感染期幼虫产量时发现,在连续3代的S.carpocapsae怀卵成虫中,噬母现象发生后能产生的感染期幼虫的比例最高仅为40%,得不到全部为感染期幼虫的情况,第3代成虫的IJ产量每条怀卵成虫仅约为20条,而H.bacteriophora,S.glaseri则在第3代时可以最终获得整齐龄期的感染期幼虫。本研究在纯水中孵育怀卵成虫时,随着1龄,2龄幼虫的逐渐死亡,在5 d左右可获得整齐龄期的感染期幼虫,存活感染期幼虫的最终产量最高可达66条。这与营养成分对噬母现象的影响至关重要相关,噬母现象形成的过程并不受营养缺乏的影响,但营养缺乏可促使噬母现象提前发生(Johnigk and Ehlers,1999)。
从纯水中孵育怀卵成虫所获得的感染期幼虫,保持了对大蜡螟幼虫的感染力,并且能在大蜡螟体内繁殖,说明以这种方法诱导获得的感染期幼虫保持了对寄主昆虫的毒力,因为从母体中孵育出的感染期幼虫既储存了足够多的能量,又携带有共生细菌(Johnigk and Ehlers,1999),与从活体或离体培养获得的感染期幼虫的感染力一致。
本研究通过使用不同的孵育液孵育S.carpocapsae线虫的怀卵成虫,筛选到一种简便快速从怀卵成虫母体诱导获得整齐龄期且保持感染力的感染期幼虫的方法,为该线虫卵或性腺的RNA干扰后感染期幼虫的收集及生物测定提供基础,为昆虫病原线虫的转基因改造以提高其环境耐受力提供技术支持。
References)
Adams BJ, Nguyen KB. Taxonomy and systematics. In: Gaugler R, ed. Entomopathogenic Nematology[C]. New York: CABI, 2002:1-34.
Baliadi Y, Yoshiga Y, Kondo E. Development ofEndotokiamatricidaand emergence of originating infective juveniles of Steinernematid and Heterorhabditid nematodes[J].JapaneseJournalofNematology, 2001, 31:26-35.
Georgis R, Koppenhöfer AM, Lacey LA,etal. Successes and failures in the use of parasitic nematodes for pest control[J].BiologicalControl, 2006, 38:103-123.
Grewal PS, Ehlers RU, Shapiro-Ilan DI. Nematodes as Biocontrol Agents[M]. Wallingford, UK: CABI, 2005:1-505.
Han RC, Li LY, Pang XF. Modelling of the culture parameters for production ofSteinernemacarpocapsaeandHeterorhabditisbacteriophorain solid cultures[J].NaturalEnemiesofInsects, 1997, 19(2):75-83. [韩日畴,李丽英,庞雄飞. 昆虫病原线虫固体培养系统中主要培养参数的优化[J]. 昆虫天敌, 1997, 19(2):75-83]
Han RC, Tian CJ, Zhang PB,etal. Research and commercialization of the bio-insecticide: Entomopathogenic nematodes. In: Cheng Z, ed. Technical Innovation and Development in Plant Protection[C]. China: Chinese Agricultural Science and Technology Press, 2008: 250-255. [韩日畴, 田彩娟, 张鹏波,等. 生物杀虫剂-昆虫病原线虫的研究及其产业化. 见:成卓敏主编. 植物保护科技创新与发展[C]. 中国: 中国农业科学技术出版社, 2008, 250-255]
Johnigk SA, Ehlers RU.Endotokiamatricidain hermaphrodites ofHeterorhabditisspp. and the effect of the food supply[J].Nematology, 1999, 1:717-726.
Kaya HK, Aguillera MM, Alumai A,etal. Status of entomopathogenic nematodes and their symbiotic bacteria from selected countries or regions of the world[J].BiologicalControl, 2006, 38:134-155.
Lacey LA, Grzywacz D, Shapiro-Ilan DI,etal. Insect pathogens as biological control agents: Back to the future[J].JournalofInvertebratePathology, 2015, 132: 1-41.Poinar GOJr. Taxonomy and biology of Steinernematidae and Heterorhabditidae. In: Gaugler R, Kaya HK, eds. Entomopathogenic Nematodes in Biological Control[C]. Boca Raton FL: CRC, 1990: 23-61.
Steiner G.Neoaplectanaglaseri, n.g., n. sp. (Oxyuridae), a new nemic parasite of the Japanese beetle (PopilliajaponicaNewm.)[J].JournaloftheWashingtonAcademyofScience, 1929, 19: 436-440.
Strauch O, Stoessel S, Ehlers RU. Culture conditions define automictic or amphimictic reproduction in entomopathogenic rhabditid nematodes of the genusHeterorhabditis[J].FundamentalandAppliedNematology, 1994, 17:575-582.
Yan X, Guo WX, Zhao GY,etal. Research advances in subterranean pest control by entomopathogenic nematodes[J].JournalofEnvironmentalEntomology, 2014, 36(6):1018-1024. [颜珣, 郭文秀, 赵国玉,等. 昆虫病原线虫防治地下害虫的研究进展[J]. 环境昆虫学报, 2014, 36(6):1018-1024]
Yan X, Moens M, Han R,etal. Effects of selected insecticides on osmotically treated entomopathogenic nematodes[J].JournalofPlantDiseasesandProtection, 2012, 119(4):152-158.
A simple method for induction of infective juveniles from gravid female adults ofSteinernemacarpocapsae
YAN Xun, HAN Ri-Chou*
(Guangdong Key Laboratory of Animal Conservation and Resource Utilization, Guangdong Public Laboratory of Wild Animal Conservation and Utilization,Guangdong Institute of Applied Biological Resources,Guangzhou 510260,China)
Entomopathogenic nematodes (EPN) are obligate parasites of many insect pests and have been used as biological pest control agents. The infective juveniles are the only stage that is used for commercial production and application. The study on the gene functions and transgenic modification of EPN may help to promote the industrialization of EPN. The gravid female adults ofSteinernemacarpocapsaewere incubated in different incubation buffers in this study and a method for simple and fast induction of accordant stage of infective juveniles was founded. This method is the basis for collection of infective juveniles for bioassay after RNA interference in eggs or gonad. The method also provides technical support for transgenic EPN modification to improve environmental resistance.
Steinernemacarpocapsae; infective juveniles; endotokia matricida;invitroinduction; biological control
广东省省级科技计划项目(2016A020210076,2014A020208075);广东省科学院科研平台环境与能力建设专项资金项目(2016GDASPT-0305);广东省科学院人才基金(rcjj201201);国家自然科学基金(31101494)
颜珣,女,1980年生,广东汕头人,博士,副研究员,研究方向为生物农药-昆虫病原线虫及其应用,E-mail:yanxun@gdabr.gd.cn
*通讯作者Author for correspondence,E-mail:hanrc@gdabr.gd.cn
Received:2016-06-12;接受日期Accepted:2016-07-01
Q968.1;S476
A
1674-0858(2016)06-1288-05
