绿僵菌及其与dsRNA混合使用对褐飞虱的防治效果
2016-12-27潘春艳蔡尤俊李腾超张文庆
潘春艳,蔡尤俊,李腾超,张文庆*
(1. 中山大学深圳研究院,深圳 518057;2. 有害生物控制与资源利用国家重点实验室,中山大学生命科学学院,广州 510275)
绿僵菌及其与dsRNA混合使用对褐飞虱的防治效果
潘春艳1,2,蔡尤俊2,李腾超2,张文庆2*
(1. 中山大学深圳研究院,深圳 518057;2. 有害生物控制与资源利用国家重点实验室,中山大学生命科学学院,广州 510275)
褐飞虱NilaparvatalugensStål是我国重要的迁飞性水稻害虫,本文研究了金龟子绿僵菌Metarhiziumanisopliae及其与dsRNA混合使用对褐飞虱的防治效果。绿僵菌悬浮液1.6×108孢子/mL至8×106孢子/mL对褐飞虱2龄、4龄和成虫进行喷药,发现1.6×107孢子/mL对各个虫态虫龄均有良好致死效果,并且成虫和4龄若虫均好于2龄若虫。在交配行为上来看,绿僵菌处理过的褐飞虱成虫活跃度非常低,从配对开始一直到交配结束的各个阶段都受到明显影响,处理组3 h的交配率只有3.70%,而对照组的交配率为24.44%。还把褐飞虱几丁质合成酶基因A的dsRNA与绿僵菌混合使用防治褐飞虱2龄和4龄若虫,结果表明0.5 μg/μL dsCHSA与绿僵菌混合使用的防治效果最好,2龄若虫的死亡率为89.63%,4龄若虫的死亡率达到93.94%。而0.2 μg/μL dsCHSA与绿僵菌的混合,对2龄和4龄若虫的致死率为65.56%-76.52%。研究结果为褐飞虱的生物防治提供了新的思路。
绿僵菌;褐飞虱;防治效果;dsRNA
绿僵菌Metarhizium是广谱的昆虫病原真菌,寄主范围包括直翅目、鞘翅目、半翅目、双翅目、鳞翅目等7目42科的200多种昆虫,还能寄生螨类及线虫等。利用绿僵菌M.flavoviride在田间防治东亚飞蝗Locustmigratoriamanilensis取得良好效果(陆庆光等, 1996)。绿僵菌对青杨天牛Saperdapopulnea、稻水象甲Lissorhoptrusoryzophilus、蛴螬Anomalacorpulenta、红缘天牛Asiashalodendri、日本双棘长蠹Sinoxylonjaponicum等害虫的防治效果也很好 (童树森等, 1991;Lomeretal., 2001;农向群等, 2007;于凤泉等, 2008;汪敏捷和刘强, 2014;刘晨等, 2015)。
RNAi技术是近年发展的基因功能研究方法,在害虫控制中也有广阔应用前景(Gordon & Waterhouse, 2007)。目前,主要的应用途径包括直接喷施dsRNA、在植物或微生物中表达dsRNA等。例如,利用壳聚糖与dsRNA形成纳米颗粒饲喂冈比亚按蚊Anophelesgambiae幼虫,增加了幼虫感染伏虫脲的几率(Zhangetal., 2010)。转昆虫基因V-ATPase A的dsRNA的玉米可显著减轻害虫的危害(Baumetal., 2007),饲喂转褐飞虱Nilaparvatalugens蜕皮激素受体基因水稻后,褐飞虱的繁殖力减少了22.78%-77.83%,而且出现致死表型(Yuetal., 2014)。在玫烟色棒束孢Isariafumosorosea中表达烟粉虱BemisiatabaciToll-like 受体7的dsRNA,提高了对烟粉虱的死亡率(Chenetal., 2015)。
本文研究了金龟子绿僵菌M.anisopliae不同浓度对褐飞虱不同虫态的防治效果,以及对褐飞虱交配行为的影响。还测定了绿僵菌与dsRNA混合使用对褐飞虱的防治效果,期望为绿僵菌的田间应用提供更多基础数据。
1 材料与方法
1.1 实验材料
8×109孢子/mL金龟子绿僵菌油悬浮剂由重庆大学夏玉先教授提供。褐飞虱在温室(26℃±2℃)中的水稻植株上饲养,所用水稻品种为黄华占。
1.2 绿僵菌不同浓度对褐飞虱成虫和若虫的校正死亡率测定
在金龟子绿僵菌油悬浮剂中按体积比加入10%分散液混匀,兑水1.6×108孢子/mL-8×106孢子/mL后备用。取6盆(直径20 cm)用塑料罩罩好(透气好)的长势相近的拔节期水稻,每盆水稻上接入30头褐飞虱成虫(或2龄若虫或4龄若虫),置于温室中,待褐飞虱适应1 d后分别喷施5 mL不同浓度的绿僵菌(3盆)或水(作为对照)。喷施时,均匀喷施于养虫笼中的水稻茎和叶部,并尽量直接喷施于供试褐飞虱体表。每天观察和记录褐飞虱的存活数量,连续观察7 d,计算校正死亡率(刘晨等, 2015)。重复3次。
1.3 绿僵菌对褐飞虱交配行为和产卵量的影响
取若干盆拔节期的水稻置入养虫笼(60 cm×60 cm×60 cm)中,喷施1.6×107孢子/mL绿僵菌悬浮液或水于水稻茎部及褐飞虱若虫体表。取若干玻璃试管(直径3 cm),内有1株水稻(含根和茎),根部用海绵包裹并加水保湿,棉塞封口。每管接入1头喷施绿僵菌或水后第6天存活的雌成虫(1日龄)以及1头未经过任何处理的健康雄成虫。接入褐飞虱成虫后第4天,观察试管中雌褐飞虱的存活情况。若雌虫死亡,则认为该管试验无效。若雌虫存活,则用1株全新的水稻根茎替换试管中的水稻根茎,让褐飞虱继续产卵。接入褐飞虱成虫后第8天,再次观察试管中褐飞虱雌成虫的存活情况。若雌虫已死亡,则取出试管中的水稻根茎。若雌虫存活,则用1株全新的水稻根茎替换试管中的水稻根茎,让褐飞虱继续产卵。接入褐飞虱成虫后第16天,取出试管中的水稻根茎,放在解剖镜下解剖、观察统计褐飞虱8-16 d的产卵量,并结束实验。第4天和第8天取出的水稻根茎中的褐飞虱产卵量也在解剖镜下解剖统计。重复30次。
1.4 绿僵菌与dsRNA混合使用对褐飞虱的校正死亡率测定
取1.6×107孢子/mL的绿僵菌油悬浮剂与褐飞虱几丁质合成酶基因A(CHSA)的dsRNA(称为dsCHSA,合成方法见陈洁(2012))混合使用,称为混合使用组,该组先喷施绿僵菌于褐飞虱 2龄或4龄若虫体表,然后接入玻璃试管(15头若虫/管),饲喂添加了dsCHSA的人工饲料。饲喂方法基于Chenetal(2010)的方法,但略有改进,一天添加2次饲料,每次30 μL。dsCHSA设置两个浓度:0.2 μg/μL和0.5 μg/μL。同时设置单独使用绿僵菌组(喷施绿僵菌于褐飞虱体表,然后饲喂普通人工饲料)、单独使用dsCHSA组(饲喂添加了dsCHSA的人工饲料)、以及对照组(饲喂普通人工饲料)。每天观察和记录褐飞虱的存活数量,连续观察7 d,计算校正死亡率(刘晨等, 2015)。重复3次。
1.5 统计分析
校正死亡率数据经过反正弦平方根转换后,利用单因素方差分析和q检验分析各平均数之间的差异显著性。利用t检验分析两个平均数之间的差异显著性。
2 结果与分析
2.1 绿僵菌不同浓度对褐飞虱成虫和若虫的致死效果
施用不同浓度的绿僵菌后1-4 d,褐飞虱成虫的校正死亡率均低于20%;4龄若虫的校正死亡率除高浓度(稀释50倍)外也低于20%,稀释50倍时第4天的校正死亡率为40.77%;2龄若虫的校正死亡率在低浓度(8×106孢子/mL)时几乎为0,其它浓度的绿僵菌引起的褐飞虱校正死亡率在29.07%-58.15%,高于褐飞虱成虫和4龄若虫的死亡率。
不同浓度的绿僵菌施用5 d后,对褐飞虱成虫和若虫的防治效果有点波动(表1)。总的来说,1.6×107孢子/mL的绿僵菌对成虫和若虫的防治效果均较好。绿僵菌施用7 d后,对褐飞虱成虫和若虫的防治效果也较好(8×106孢子/mL除外)(表2)。总的来说,1.6×108孢子/mL-1.6×107孢子/mL的绿僵菌对4龄若虫的校正死亡率接近或超过90%,对成虫的校正死亡率接近或超过80%,对2龄若虫的致死率相对低一些(表2)。
综合分析褐飞虱成虫和若虫的致死率和防治成本,1.6×107孢子/mL为值得推荐的使用浓度。
2.2 绿僵菌对褐飞虱交配行为和产卵量的影响
在褐飞虱交配行为的各个阶段,无论是前期的开始求偶行为还是最后成功的交配数量,对照组的比率均显著高于绿僵菌处理组(表3)。从表中可以看出,处理组的雌虫在第一阶段2 min找到水稻的比率低于对照组的1/3;而在30 min时两者的比率都达到100.00%;但处理组雄虫在30 min内找到水稻的比率也只有对照组的一半左右。在比较找到水稻的时间时发现,雌虫找到水稻的时间要远远短于雄虫,这可能与雌虫需要繁衍后代产卵等行为相关。接入成虫后3 h观察到的交配率分别3.70%(处理组)和24.44%(对照组),两者差异极显著。接入成虫24 h后,通过解剖观察交配囊获得的成功交配率同样有显著差别,处理组为51.11%,对照组为78.78%。
表1 绿僵菌使用5 d后对褐飞虱成虫和若虫的校正死亡率
Table 1 The corrected mortality of BPH adults and nymphs caused byMetarhiziumanisopliaein different concentrations in the 5thday

浓度单位(10n孢子/mL)Concentration成虫Adults4龄若虫4thinstarnymphs2龄若虫2ndinstarnymphs160×1084150±132c8663±42a6405±213b800×1076797±283a4875±386b5686±581a257×1075861±249a5187±1572a3765±644b160×1077549±137b8871±207a5765±192c800×1075643±464a3075±393b-196±160c
注:数据为平均数±标准误(n=3),同行数据后的不同字母表示差异显著(P<0.05,q检验)。表2、4、5同。Note:Data are mean ± standard error (n=3). Different letters on the same row after data shows significant difference (P< 0.05, q-test). The same to table 2,4,5.
表2 绿僵菌使用7 d后对褐飞虱成虫和若虫的校正死亡率
Table 2 The corrected mortality of BPH adults and nymphs caused byMetarhiziumanisopliaein different concentrations in the 7thday

浓度单位(10n孢子/mL)Concentration成虫Adults4龄若虫4thinstarnymphs2龄若虫2ndinstarnymphs160×1087688±491a8857±195a7575±596a800×1078721±332a9556±181a7374±393bc257×1078759±271a9095±175a6861±470c160×1078943±192a9778±181a6126±652bc800×1067716±121a5495±086b1896±490c
表3 绿僵菌处理后对褐飞虱交配行为的影响(%)
Table 3 Effects ofMetarhiziumanisopliaeon the mating behavior of the brown planthopper

项目Items对照组TreatedwithMetarhizium处理组Control雌虫2min找到水稻9037±217b2741±260a雌虫30min找到水稻10000a10000a雄虫2min找到水稻4815±336b1852±271a雄虫30min找到水稻6741±260b3407±168a雄虫找到水稻1min内找到雌虫3407±261b1185±053a找到雌虫后1min雄虫展开求偶行为3111±277b741±059a3h交配率2444±118b370±167a24h交配率7878±403b5111±331a
注:数据为平均数±标准误(n=3),同行数据后的不同字母表示差异显著(P<0.05,t-检验)。Note:Data are mean±standard error (n=3). Different letters on the same row after data shows significant difference (P<0.05, t-test).
取喷施金龟子绿僵菌后第6天存活的雌成虫(1日龄),测定其产卵量。结果表明,褐飞虱产卵量也相应下降(图1)。一般情况下褐飞虱交配后前4 天产卵量少,若受绿僵菌侵染则更少,处理组褐飞虱的产卵量为对照组的60.35%;交配后4-8 d是雌褐飞虱产卵高峰期,处理组褐飞虱该段时间的产卵量比对照组少71.35粒/雌,为对照组褐飞虱产卵量的60.73%;交配后8-16 d为产卵末期,同样处理组褐飞虱的产卵量较少,为对照组的63.26%。在所观测的16 d内,处理组褐飞虱共产卵208.52粒/雌,对照组共产卵 338.33粒/雌,产卵量下降了38.37%。
2.3 绿僵菌与dsRNA混合使用对褐飞虱的防治效果
绿僵菌与dsRNA混合使用对褐飞虱的防治效果通常好于单独使用绿僵菌或dsRNA,特别是0.5 μg/μL dsCHSA 与绿僵菌混合时(表4、表5)。对2龄褐飞虱若虫,0.5 μg/μL dsCHSA与绿僵菌的混合使用的效果最好,第7天校正死亡率达到89.63%,显著高于其它处理的致死率。dsCHSA的浓度也影响其防治效果,浓度高的效果更好(表4)。对4龄褐飞虱若虫,校正死亡率最高的同样是0.5 μg/μL dsCHSA与绿僵菌的混合处理组,第7天达到93.94%。同样,dsCHSA浓度高的防治效果更好(表5)。

图1 绿僵菌对褐飞虱产卵量的影响Fig.1 Effect of Metarhizium anisopliae on the No. of eggs of the brown planthopper注:数据为平均数±标准误(n=30),不同字母表示各试验组间存在显著差异(P﹤0.01, t检验)。Note:Data are mean±SEM(n=30),different letters means a significant difference between groups(P﹤0.01, t-test).
表4 褐飞虱2龄若虫喷施绿僵菌与dsRNA后的校正死亡率
Table 4 The corrected mortality of BPH 2ndinstar nymphs after treated withMetarhiziumand dsRNA

处理方式Treatment处理后天数Daysaftertreatment1d3d5d7d05dsRNA+绿僵菌3397±005a3904±004a7313±003a8963±005a02dsRNA+绿僵菌1581±0003ab3020±001ab4633±004b6556±002b05dsRNA1560±003ab3020±001ab4633±004b6185±003b02dsRNA1303±004ab2106±002bc2916±007b5148±004b绿僵菌1282±006b1106±009c3923±007b6852±006b
表5 褐飞虱4龄若虫喷施绿僵菌与dsRNA后的校正死亡率
Table 5 The corrected mortality of BPH 4thinstar nymphs after treated withMetarhiziumand dsRNA
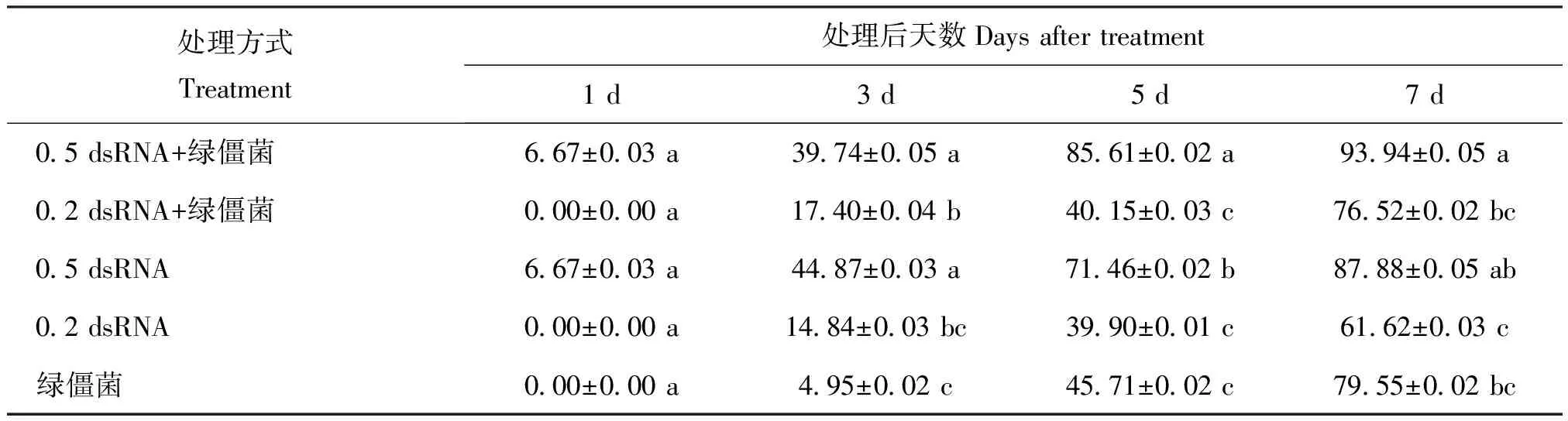
处理方式Treatment处理后天数Daysaftertreatment1d3d5d7d05dsRNA+绿僵菌667±003a3974±005a8561±002a9394±005a02dsRNA+绿僵菌000±000a1740±004b4015±003c7652±002bc05dsRNA667±003a4487±003a7146±002b8788±005ab02dsRNA000±000a1484±003bc3990±001c6162±003c绿僵菌000±000a495±002c4571±002c7955±002bc
3 结论与讨论
3.1 利用真菌杀虫剂防治害虫的适宜虫龄
真菌杀虫剂对不同发育阶段害虫的防治效果可能不同。菜青虫Pierisrapae不同虫龄对绿僵菌VM07菌株的敏感程度明显不同,表现为高龄幼虫敏感度低,低龄幼虫敏感度高(刘树峰,2007);但用球孢白僵菌防治桃蚜Myzuspersicae时,龄期越高死亡率越高,4龄若虫的死亡率只有40.20%,而成虫的死亡率为98.00%(刘银泉等,2003)。应用玫烟色棒束孢在果园防治柑橘木虱若虫,第8天后,被处理的枝芽上柑橘木虱若虫的数目减少,但在此之后死亡率变化不大(Lezamaetal. 2012)。本文的研究结果表明,施用绿僵菌后1-4 d,褐飞虱2龄若虫的校正死亡率常高于成虫和4龄若虫的死亡率。但以推荐浓度(1.6×107孢子/mL)的绿僵菌防治褐飞虱时,对成虫和4龄若虫的效果均好于2龄若虫(表1、表2)。研究表明昆虫病原真菌主要通过接触从体壁侵入,低龄幼虫的体壁较薄,真菌孢子更易穿透侵染,而高龄幼虫体壁蜡质层增厚,表皮硬化加强,血细胞数量增多,防卫机制发育健全而增强了抗病性,真菌孢子难以穿透侵染(Meyeretal. 2008);也有研究者认为温室白粉虱或银叶粉虱1龄幼虫对真菌侵染有抗拒行为(Halletal. 1994)。然而,亦有人发现上述两种粉虱的1龄幼虫受侵染的明显症状(Laceyetal. 1999)。可见,导致真菌杀虫剂对不同发育阶段害虫的防治效果不同的机制是多样的。
3.2 微生物杀虫剂对害虫交配行为的影响
褐飞虱的交配行为会受到绿僵菌的影响(表3)。雄性褐飞虱羽化两天后可以发出求偶的信号进行交配,求偶信号包括胸背板的震动频率、震动翅膀等行为(张志涛等,1991)。绿僵菌从褐飞虱胸背板开始侵染,影响到了震动频率,发射求偶信号不顺,导致雌雄互相识别及交配率均降低。除了绿僵菌,有研究者发现雄性棉红铃虫Pectinophoragossypiella被喂食转苏云金杆菌基因棉花(Bt棉花),会降低雄性交配频率,并且与之交配的雌性后代数降低(Higginsonetal. 2005)。另有研究也表明喂食Bt棉花给雌性棉铃虫,会降低雌性的鸣叫比例和时间,从而降低了交配频率(Zhaoetal. 2009)。这些研究结果与本文结果一致。
3.3 绿僵菌与其它防控因子的混合使用
绿僵菌在实际使用中也有见效慢等不足。因此希望通过绿僵菌与其他防治方式结合起来使用来提高防治效果。例如,低剂量的杀虫剂与绿僵菌混配可提高绿僵菌防治椰心叶甲Brontispalongissima的效果(秦长生等,2008) 。苏云金芽胞杆菌与绿僵菌对椰心叶甲也有协同控制作用 (边强等,2009)。表达几丁质酶的绿僵菌的LT50为125 h,而野生型绿僵菌的LT50为209 h (Boldoetal., 2009)。还有研究表明,无论是注射还是饲喂dsCHSA,均导致褐飞虱存活率与几丁质含量显著下降,并且出现蜕皮与变态相关的畸形表型(Wangetal., 2012;李腾超,2016)。本文结果表明dsCHSA与绿僵菌悬浮液的混合使用的防治效果均优于单独使用绿僵菌或dsCHSA(表4、表5)。由于褐飞虱饲喂dsCHSA后可导致蜕皮障碍,从而有利于绿僵菌侵染,因此推测两者可能存在协同作用。这些研究结果可为褐飞虱的防治提供新的思路。
References)
Baum JA, Thierry B, William C,etal. Control of coleopteran insect pests through RNA interference[J].NatureBiotechnology, 2007, 25(11): 1322-1326.
Bian Q, Wang GJ, Zhang ZH,etal. Synergism betweenBacillusthuringiensisandMetarhiziumanisopliaeagainstBrontispalongissima[J].PlantProtection, 2009, 35(3):130-132. [边强,王广君,张泽华等. 苏云金芽胞杆菌与绿僵菌对椰心叶甲的协同控制作用[J]. 植物保护, 2009, 35(3):130-132]
Boldo JT,Junges A, do Amaral KB,etal. Endochitinase CHI2 of the biocontrol fungusMetarhiziumanisopliaeaffects its virulence toward the cotton stainer bugDysdercusperuvianu[J].CurrentGenetics, 2009, 55:551-56.
Chen J. Preliminary Studies on Regulatory Mechanism of Chitin Biosynthesis Pathway in Insects [D]. Doctoral Dissertation. Sun Yat-sen University, 2012. [陈洁. 昆虫几丁质合成通路调控机制的初步研究[D]. 博士论文. 中山大学, 2012]
Chen J, Zhang DW, Yao Q,etal. Feeding-based RNA interference of a trehalose phosphate synthase gene in the brown planthopper,Nilaparvatalugens[J].InsectMolecularBiology, 2010, 19(6):777-786.
Chen X, Li L, Hu Q,etal. Expression of dsRNA in recombinantIsariafumosoroseastrain targets the TLR7 gene inBemisiatabaci[J].BMCBiotechnology, 2015, 15(1):1-8.
Gordon KH, Waterhouse PM. RNAi for insect-proof plants[J].NatureBiotechnology, 2007, 25(11): 1231-1232.
Hall RA, Peterkin D, Ali B. Fungal control of whitefly,Thripspalmiand sugarcane froghopper in Trinidad and Tobago. In: Proceedings of the VI International Colloquium on Invertebrate Pathology and Microbial Control[C]. Montpellier, 1994: 277-282.
Higginson DM, Morin S, Nyboer ME,etal. Evolutionary trade-offs of insect resistance toBacillusthuringiensiscrops: Fitness cost affecting paternity[J].Evolution, 2005, 59(4): 915-20.
Lacey LA, Kirk AA, Millar L,etal. Ovicidal and larvicidal activity of conidia and blastospores ofPaecilomycesfumosoroseus(Deuteromycotina: Hyphomycetes) againstBemisiaargentifolii(Homoptera: Aleyrodidae) with a description of a bioassay system allowing prolonged survival of control insects[J].BiocontrolScience&Technology, 1999, 9(1): 9-18.
Lezama-Gutiérrez R, Molina-Ochoa J, Chávez-Flores O,etal. Use of the entomopathogenic fungiMetarhiziumanisopliae,CordycepsbassianaandIsariafumosoroseato controlDiaphorinacitri(Hemiptera: Psyllidae) in Persian lime under field conditions[J].InternationalJournalofTropicalInsectScience, 2012, 32(1): 39-44.
Li TC. Functional Analysis of Two MicroRNAs Related to Chitin Biosynthesis inNilaparvatalugens[D]. Master Thesis. Sun Yat-sen University, 2016. [李腾超. 两个褐飞虱几丁质合成相关microRNA的功能研究[D]. 硕士论文. 中山大学, 2016]
Liu C, Zhu GP, Chen YT,etal. Study on the field management ofSinoxylonjaponicumusingBeauveriabassiana andMetarhiziumanisopliae[J].JournalofEnvironmentalEntomology, 2015,37 (2): 343-347. [刘晨,朱耿平,陈易彤等. 球孢白僵菌和绿僵菌对日本双棘长蠹林间防治效果的研究[J]. 环境昆虫学报,2015,37 (2): 343-347]
Liu SF. Studies on Control ofPierisrisrapaewithMetarhizium[D]. Master Thesis. Sichuan Agricultural University, 2007. [刘树峰. 绿僵菌VM07菌株防治甘蓝菜青虫(Pierisrapae)的研究[D]. 硕士学位论文. 四川农业大学, 2007]
Liu YQ, Zhang FC, Liu SS. Effects of moulting inMyzuspersicaeon the virulence of the entomopathogenic fungusBeauveriabassiana[J].ActaEntomologicaSinica, 2003, 46 (4):441-446. [刘银泉, 张发成, 刘树生. 桃蚜脱皮对球抱白僵菌毒力的影响[J]. 昆虫学报, 2003, 46(4): 441-446]
Lomer CJ, Bateman RP, Johnson DL,etal. Biological control of locusts and grasshoppers[J].AnnualReviewofEntomology, 2001, 46(1): 667-702.
Lu QG, Deng CG, Chen CF. Field experiment on locust control byMetarhiziumflavoviridein China[J].NaturalEnemiesofInsects, 1996, 18(4): 147-150. [陆庆光, 邓春光, 陈长风. 应用绿僵菌防治东亚飞蝗田间试验[J]. 昆虫天敌, 1996, 18(4): 147-150]Meyer JM, Hoy DG, Boucias MA. Isolation and characterization of anIsariafumosoroseaisolate infecting the Asian citrus psyllid in Florida[J].JournalofInvertebratePathology, 2008, 99(99): 96-102.
Nong XQ, Li CH, Zhang ZH,etal. Control effect ofMetarhiziumanisopliaeonAnomalacupripesin golf course [J].PlantProtection, 2007, 33(2): 118-121. [农向群, 李存焕, 张泽华等. 绿僵菌防治高尔夫草坪蛴螬效果[J]. 植物保护, 2007, 33(2): 118-121]
Qin CS, Xu JZ, Xie PH,etal. Screening of chemical pesticides compatible withMetarhiziumanisopliaefor control ofBrontispalongissima[J].JournalofSouthChinaAgriculturalUniversity, 2008, 29(2): 44-46. [秦长生,徐金柱,谢鹏辉等. 绿僵菌相容性杀虫剂筛选及混用防治椰心叶甲[J]. 华南农业大学学报, 2008, 29(2): 44-46]
Tong SL, Gong J, Gou YJ, Application ofMetarhiziumanisopliaeagainst SmallPoplarborer[M]. Beijing: China Agriculture Press, 1991: 155-157. [童树森, 宫建, 苟英杰. 利用绿僵菌防治青杨天牛试验研究[M]. 中国虫生真菌研究与应用. 北京: 中国农业出版社, 1991: 155-157]
Wang MJ. Liu Q. Pathogenicity of theMetarhiziumanisopliaetoAsiashalodendrilarvae at different temperature and humidity conditions [J].JournalofEnvironmentalEntomology, 2014,36 (2): 151-156. [汪敏捷, 刘强. 不同温湿度下绿僵菌对红缘天牛幼虫致病力的影响[J]. 环境昆虫学报,2014,36 (2): 151-156]
Wang Y, Fan HW, Huang HJ,etal. Chitin synthase 1 gene and its two alternative splicing variants from two sap-sucking insects,Nilaparvatalugens andLaodelphaxstriatellus(Hemiptera: Delphacidae)[J].InsectBiochemistryandMolecularBiology, 2012, 42, 637-646.
Yu FQ, Tian CH, Li ZQ,etal. Evaluation ofMetarhiziumanisopliaefor control ofLissorhoptrusoryzophilusin the field[J].LiaoningAgriculturalSciences, 2008(6): 5-8. [于凤泉, 田春晖, 李志强等. 绿僵菌对稻水象甲的田间防治效果研究[J]. 辽宁农业科学, 2008(6): 5-8]
Yu R, Xu XX, Liang YK,etal. The insect ecdysone receptor is a good potential target for RNAi-based pest control[J].InternationalJournalofBiologicalSciences, 2014, 10(10): 1171-80.
Zhang ZT, Yin BT, Chen LY,etal. The model of signal production and the simulation of female signals in rice brown planthopper,Nilaparvatalugens(Stål) (Homoptera: Delphaeidae) [J].ChineseJournalofRiceSciences, 1991, 5(1): 29-36. [张志涛, 殷柏涛, 陈伦裕等. 褐稻虱发生机理模型和雌虫鸣声的人工模拟[J]. 中国水稻科学, 1991, 5(1): 29-36.]
Zhang X, Zhang J, Zhu KY. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anophelesgambiae)[J].InsectMolecularBiology, 2010, 19(5): 683-693.
Zhao XC, Wu KM, Liang GM,etal. Modified female calling behaviour in Cry1Ac-resistantHelicoverpaarmigera(Lepidoptera: Noctuidae)[J].PestManagementScience, 2009, 65(4):353-357.
Control effect ofMetarhiziumanisopliaeand its mixture with dsRNA on the brown planthopper
PAN Chun-Yan1,2, CAI You-Jun2, LI Teng-Chao2, ZHANG Wen-Qing2*
(1. Shenzhen Institute, Sun Yat-sen University, Shenzhen 518057, China; 2. State Key Laboratory of Biocontrol and School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China)
The brown planthopper (BPH)NilaparvatalugensStål is an important migratory insect pest of rice. This paper studied the control effect ofMetarhiziumanisopliaeon the brown planthopper and its application mixed with dsRNA of chitin synthase gene A (CHSA).M.anisopliaesuspension was 1.6×108spores/mL to 8×106spores/mL and then sprayed onto BPH nymphs (second instars and fourth instars) and adults, the results showed that 1.6×107spores/mLM.anisopliaeresulted in good mortality rates for both nymphs and adults, and that control effect for adults and the fourth instar nymphs was better than that for the second instar nymphs. In the mating behavior experiments, activity of the BPH adults treated withM.anisopliae(1.6×107spores/mL) was very low, all stages from pairing to success of mating were affected significantly by the spraying. During 3 h period, the mating rate in the treated group was only 3.70% whereas it was 24.44% in the control group. When mixedM.anisopliaewith dsRNA of BPH chitin synthase gene A, better control effects were achieved. When the concentration of dsRNA was 0.5 μg/μL dsCHSA, the mortality rate of the second and fourth instars was 89.63% and 93.94%, respectively; when the concentration of dsRNA was 0.2 μg/μL dsCHSA, the mortality rate of the second and fourth instars was 65.56%-76.52%. The results gained may provide novel clue for better control of the brown planthopper.
Metarhiziumanisopliae; brown planthopper; control effect; dsRNA
深圳市科技计划项目(JCYJ20140419130210750) ; 国家科技支撑计划项目课题(2012BAD19B03)
潘春艳,女,1991年生, 硕士,研究方向为害虫生物防治, E-mail: 1272685410@qq.com
* 通讯作者Author for correspondence,E- mail: lsszwq@mail.sysu.edu.cn
Received:2016-11-07;接受日期 Accepted:2016-11-15
Q963;S433
A
1674-0858(2016)01-1071-07
