淋巴细胞胞浆蛋白1在免疫系统和肿瘤中的研究进展①
2016-12-26滕永生
滕永生 庄 园
(第三军医大学药学系微生物与生化药学教研室,重庆400038)
淋巴细胞胞浆蛋白1在免疫系统和肿瘤中的研究进展①
滕永生 庄 园
(第三军医大学药学系微生物与生化药学教研室,重庆400038)
细胞通过细胞骨架来运动、极化、分化和维持多细胞组织形态。而肌动蛋白是构成细胞骨架的基石,它可以被超过100种的肌动蛋白结合蛋白(Actin binding proteins,ABPs)所不断地重构。淋巴细胞胞浆蛋白1(Lymphocyte cytosolic protein 1,Lcp1)作为一种肌动蛋白结合蛋白,主要通过与肌动蛋白互相作用来调控细胞运动,是直接控制细胞运动的主要细胞骨架结合蛋白之一;此外,其还参与宿主防御、免疫突触的形成、 T细胞的激活等。正常情况下,淋巴细胞胞浆蛋白1主要在造血来源的细胞中表达,而其却在多种恶性肿瘤细胞内存在异位高表达。淋巴细胞胞浆蛋白1在肿瘤细胞内的异位高表达同肿瘤的侵袭、转移密切相关,并且其表达高低等指标还可协助评估肿瘤患者的预后。本文主要对造血系细胞以及肿瘤细胞内淋巴细胞胞浆蛋白1的研究进展做一综述。
1 淋巴细胞胞浆蛋白的基本概况
1.1 淋巴细胞胞浆蛋白的表达 Plastin也称丝束蛋白(Fimbrin),是细胞骨架蛋白α-actinin家族的成员。Plastin作为一类肌动蛋白结合蛋白,其通过与肌动蛋白互相作用调控细胞运动,在细胞移行过程中起关键作用,是直接调控细胞运动的主要细胞骨架结合蛋白。在哺乳动物中,Plastin按氨基酸排列顺序的不同分为三个亚型(I型、T型和L型),即I-、T-、L-plastin。这三种亚型具有70%的氨基酸同源序列,但是他们却是由不同染色体上的独立基因编码。L-plastin即淋巴细胞胞浆蛋白1,人类L-plastin基因位于13q14.3,编码的蛋白分子量为67 kD,其编码的蛋白包含有627个氨基酸残基。L-plastin首先于肿瘤转化的人纤维母细胞中发现,而后发现其可在正常人造血来源的细胞中表达,是plastin中表达于免疫细胞内的唯一亚型[1]。随后人们发现,在一些淋巴结基质细胞内也会有L-plastin的低水平表达。之后,人们研究发现,在多种肿瘤细胞(如卵巢癌、结直肠癌、恶性黑色素瘤等)内都会有L-plastin异位高表达[2,3]。
1.2 淋巴细胞胞浆蛋白的结构和功能 L-plastin的蛋白形式结构域包含头端,2个EF-臂结构域(钙离子结合区域),1个钙调蛋白结构域以及2个串联的肌动蛋白结合域(Actin binding domain,ABD),每个肌动蛋白结构域包含2个钙调蛋白同源(Calponin homology,CH)结构域[1];L-plastin是三种plastin亚型中唯一可以在多种刺激下发生磷酸化的蛋白;L-plastin的N末端有两个可磷酸化位点,即丝氨酸5和丝氨酸7(Ser5和Ser7),前者的磷酸化和去磷酸化则构成调节L-plastin功能的特殊机制(见图1)。研究发现,L-plastin中Ser5的磷酸化可以增加其对肌动蛋白的绑定活性,并且会促进肌动蛋白在特定位点的组装,比如细胞膜的褶边和微突[4]。在细胞启动迁移信号的应答中也会发生L-plastin的磷酸化,而通过磷酸化作用调节L-plastin被认为是免疫应答的结果[5]。另外,在L-plastin N末端还具有2个钙离子结合结构域,即EF-臂结构域。L-plastin的EF-臂结构域的本质是钙结合基序,它属于钙传感器多样超家族,是一种钙信号调节器。EF-臂结构域与钙离子的结合可导致钙结合基序的构象改变,使目的蛋白激活或失活,也就表明L-plastin与肌动蛋白结合的特性与细胞内钙离子的调节相关[6]。CH是肌钙蛋白同源结构域,其存在于多种细胞骨架和信号转导蛋白中,包括肌动蛋白结合蛋白如α-肌动蛋白、肌营养不良蛋白等[7]。在L-plastin蛋白中,2个钙调蛋白同源结构域构成一个肌动蛋白结合结构域。CH对于细胞形态及信号蛋白的调节起到重要作用。
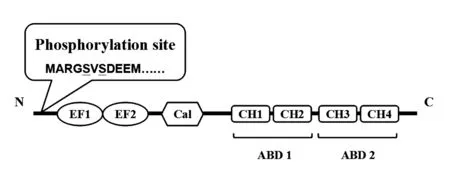
图1 L-plastin的蛋白形式结构域Fig.1 Protein domains of L-plastin
2 L-plastin在免疫细胞中的表达和意义
2.1 L-plastin在固有免疫细胞中的表达和意义 固有免疫细胞是机体固有免疫的重要组成部分,是生物体在长期种系进化过程中形成的一系列免疫效应细胞,主要参与宿主防御。目前对于固有免疫细胞中L-plastin的研究,多集中于巨噬细胞以及中性粒细胞和嗜酸性粒细胞等粒细胞[8]。
L-plastin在固有免疫细胞内的表达对其抗菌效应的发挥至关重要。Deady等[9]研究发现,在气管内灌注肺炎链球菌的感染模型中,相对于正常小鼠,L-plastin基因敲除(L-plastin-/-)小鼠更容易获得肺炎链球菌感染,同固有免疫正常而适应性免疫缺陷的Rag I-/-小鼠相比,L-plastin-/-小鼠肺泡内肺炎链球菌的清除能力显著下降,提示L-plastin-/-小鼠的固有免疫存在缺陷。 随后通过比较感染小鼠肺部炎症细胞的聚集以及细胞因子的分泌情况,发现L-plastin-/-小鼠对肺炎链球菌感染的易感性增加与小鼠肺泡巨噬细胞的减少相关;并且在破坏造血功能的辐照小鼠体内发现,其巨噬细胞的再生则需要L-plastin的参与;上述结果表明,L-plastin对巨噬细胞的产生及其抗菌效应的发挥至关重要。Chen等[10]发现不管是在体内还是在体外,L-plastin缺陷的中性粒细胞对金黄色葡萄球菌的吞噬能力没有差别,但是杀伤能力均存在缺陷。
然而,对于L-plastin在固有免疫细胞内发挥作用机制的研究却进展缓慢。首先,固有免疫细胞内的某些蛋白可以直接结合L-plastin,并且可能调节其活性。有研究发现[11]:在巨噬细胞内,L-plastin可以直接绑定离子钙接头蛋白分子1(Ionized calcium binding adaptor molecule 1,Iba1),并协同Iba1调节肌动蛋白骨架的重构,调节巨噬细胞吞噬作用的发挥。Iba1是小胶质细胞/巨噬细胞特异的钙离子结合蛋白,具有肌动蛋白绑定活性,主要定位于巨噬细胞的褶边并且参与巨噬细胞的吞噬活动。通过免疫组化、免疫共沉淀、蛋白质体外结合实验以及配体叠加分析,表明了在小胶质细胞/巨噬细胞内L-plastin和Iba1可以结合并形成复合物,协同调节细胞肌动蛋白骨架的重构,从而调控细胞的迁移和吞噬细菌等生物学活动。L-plastin不仅仅可以和Iba1形成复合物,在黏附的巨噬细胞中也可以同波形蛋白(Vimentin,VIM)形成复合物,并且可能同颗粒钙蛋白结合(主要表达在具有吞噬作用的细胞上,比如中性粒细胞和巨噬细胞)[12]。然而,关于Iba1、VIM以及颗粒钙蛋白与L-plastin结合是否能够调节L-plastin的活性以及发挥的生物学意义仍有待进一步研究。
L-plastin除了通过与细胞内蛋白的结合影响固有免疫细胞功能,其蛋白磷酸化形式的改变也参与固有免疫细胞的功能调控。大量研究显示,固有免疫细胞内的L-plastin可以在多种刺激下发生磷酸化。革兰阴性菌成分脂多糖(LPS)可以诱导激活巨噬细胞内的L-plastin的特定位点Ser5发生磷酸化;而Ser5位点磷酸化的L-plastin可以通过介导整合素来调节中性粒细胞的黏附功能;Ser5位点的磷酸化还能增加L-plastin对F-actin的绑定活性,从而促进actin在细胞内目标位点的组装。Pazdrak等[13]研究通过对GM-CSF刺激的嗜酸性粒细胞的磷酸化蛋白组分析发现,磷酸化形式的L-plastin受刺激后显著上调;免疫共沉淀实验则显示磷酸化的L-plastin可与PKCβⅡ形成沉淀复合物;若使用特异性阻断剂或siRNA阻断或干扰PKCβⅡ表达,则会导致GM-CSF诱导的L-plastin磷酸化程度下调,嗜酸性粒细胞活化相关的刺激脱颗粒效应和嗜酸性阳离子蛋白、嗜酸性过氧化物以及趋化因子释放下调;而使用外源性合成的Ser5磷酸化的L-plastin刺激嗜酸性粒细胞则会导致αMβ2整合素的表达上调,并且会增加嗜酸性粒细胞对嗜酸性粒细胞活化相关趋化因子的迁移。因此,PKCβⅡ磷酸化的L-plastin在介导GM-CSF启动的嗜酸性粒细胞功能中有重要作用。这些特征表明,当需要对细胞外多种刺激做出快速应答时,L-plastin可以帮助固有免疫细胞快速重组肌动蛋白细胞骨架,发挥细胞固有免疫效应[2]。
总之,L-plastin参与了固有免疫细胞的宿主防御功能,其在除巨噬细胞和粒细胞之外的固有免疫细胞中的作用以及参与调控固有免疫与适应性免疫间相互作用的证据尚待进一步研究。
2.2 L-plastin在适应性免疫细胞中的表达和意义 目前关于L-plastin在适应性免疫细胞的研究则主要集中在淋巴细胞(包括T细胞和B细胞)。从亚细胞角度,淋巴细胞的形态、运动以及激活均需要依赖于肌动蛋白骨架,而这些又与淋巴细胞的迁移、归巢以及效应应答等生物学活动相关。L-plastin可以交联平行的肌动蛋白丝,稳定大数量级的肌动蛋白结构(比如板状伪足)。研究表明,T、B细胞的运动和T细胞的激活均需要L-plastin。最近,L-plastin已经被确认为常用的免疫抑制剂地塞米松的作用靶点[14]。因此,阐明L-plastin在T、B细胞内的功能,不仅对于理解L-plastin在调节机体适应性免疫功能的生物学过程中具有的重要基础研究意义,而且对发现基于L-plastin的新的免疫调节或治疗药物的相关靶点也具有重要临床意义。细胞形态是细胞行使功能的前提,而肌动蛋白骨架是维持细胞形态的主要物质。T细胞的激活以及后续的细胞运动均需要肌动蛋白骨架。肌动蛋白的动态变化对于T细胞的激活和功能至关重要。最近的研究表明,人和小鼠的T细胞的运动和激活需要L-plastin蛋白[1,8]。T细胞缺乏L-plastin则不会形成完整的成熟的免疫突触,从而会影响细胞因子的产生和细胞增殖。T细胞内降低或缺乏L-plastin的表达会降低T细胞的运动速率,同时会损害T细胞迁移出胸腺的运动。尽管需要邻近的T细胞受体和趋化因子受体信号,但是L-plastin对于晚期免疫突触的成熟和细胞的极化至关重要。目前所知的丝氨酸的磷酸化、钙离子浓度、钙调蛋白的结合等因素,均会调节L-plastin的结合活性和细胞内定位,但是上述结构域所导致的L-plastin对肌动蛋白骨架调节的具体分子机制并没有很好的阐释。
除了影响T细胞的激活,L-plastin最重要的参与T细胞的生物学活动就是调节T细胞的运动迁移。L-plastin在形成和维持整合素介导的黏附结构中具有重要作用,并可以调节趋化因子刺激所诱导的T细胞的极化和迁移。对趋化因子信号应答时,T细胞会发生极化,通过提供定向运动和提供必要的力量来推动细胞向前,因此,T细胞极化被认为是细胞有效迁移的先决必备条件。Freeley等[15]发现,T细胞在受到趋化因子CXCL12刺激后,细胞内L-plastin会和F-actin共存于细胞定向迁移的前沿,并且L-plastin会在Ser5位点发生磷酸化。L-plastin的磷酸化对PKC抑制剂敏感,而CXCL12刺激的T细胞内,L-plastin会和PKC的几种亚型共存在。目前为止,PKCζ是已经确认的可以调节T细胞极性的激酶。使用siRNA等技术证明,L-plastin可以调节受到趋化因子刺激的T细胞内F-actin在细胞前沿的定位,后者是T细胞极化、板层形成和后续趋化运动所必需的。干扰L-plastin的表达也会损害对CXCL12刺激应答时Rac1激活的细胞周期和Akt的磷酸化。而且,L-plastin也可以调节CXCL12介导的与淋巴细胞迁移作用相关的整合素配体ICAM-1,这种机制则主要通过影响运动速率和持续力来调节适应性免疫细胞迁移活动。
L-plastin对另一种重要适应性免疫细胞—B细胞的调节则表现在B细胞成熟发育的迁移上。研究发现,L-plastin对边缘区B细胞的发育至关重要。B细胞的发育对位置相对比较敏感,通常在骨髓和脾的特殊的“巢”内,而不同发育阶段的B细胞定位在这些“巢”内是受到趋化因子和黏附分子的调控。B细胞定位依赖趋化因子CXCL12和CXCL13以及化学引诱物鞘氨醇-1-磷酸盐,而B细胞向这些物质的定向运动则需要肌动蛋白结合蛋白—L-plastin,后者参与引导正常的B细胞发育。在L-plastin-/-小鼠中,B细胞的运动被破坏,损害了脾中B细胞的成熟,大约会造成40%的滤泡状B细胞和80%的边缘区B细胞的发育缺失;且L-plastin-/-小鼠体内L-plastin缺失的B细胞,其迁移到淋巴结和骨髓的运动效应亦会受损。这些结果均表明,L-plastin参与了B细胞的成熟和迁移运动。众所周知,边缘区B细胞的一个重要的生物学特征是对多糖抗原产生快速的体液应答,而L-plastin-/-小鼠表现出对肺炎链球菌的抗体应答缺陷,进一步证明L-plastin与边缘区B细胞发育及其功能维持密切相关[16]。
除了激活、迁移等,L-plastin还与适应性免疫细胞的功能发挥和维持相关。Todd等[17]发现,在L-plastin-/-小鼠体内,固有的T、B细胞的缺陷会损害T细胞依赖的抗体应答,这种小鼠生发中心的形成迟缓,并且其T细胞依赖的抗体产生也会下降。采用骨髓移植实验提示,L-plastin-/-小鼠体内的T和B细胞,其细胞固有的缺陷会损害生发中心的形成。在有抗原刺激时,相对于正常供体小鼠,移植受体小鼠体内所获得的总的L-plastin-/-供体小鼠的T细胞数量会降低。但是,总的供体L-plastin-/-小鼠T细胞数量的降低并不是由于增殖降低或者死亡增加引起的,而是在接受抗原刺激后,脾内的T细胞聚集降低。上述结果表明,早期淋巴细胞募集至抗原提成部位对于形成免疫应答是至关重要的,而L-plastin则参与调控这一重要免疫行为。同时,研究者发现,将L-plastin-/-供体小鼠B细胞移植到正常小鼠体内,其并不会分化为生发中心中的B细胞,且不会像正常的B细胞一样进行有效的扩增。另外,L-plastin-/-小鼠中的T、B细胞还表现出缺乏发展成为滤泡状辅助T细胞的亚群,这也可以解释L-plastin-/-小鼠体内的B细胞发育和分化缺陷,以及在生发中心应答和产生T细胞依赖的抗体应答的功能缺陷。综上所述,L-plastin对维持包括T细胞和B细胞在内的完整适应性免疫应答功能至关重要。
3 L-plastin在肿瘤细胞中的异位表达和临床意义
肿瘤细胞的侵袭转移同细胞移行黏附的能力密切相关,而细胞内肌动蛋白骨架对细胞的移行黏附起着至关重要的作用。肌动蛋白骨架结构可被多种肌动蛋白结合蛋白所调节,因此,肌动蛋白结合蛋白成为近年研究阻止肿瘤浸润和转移的热点[18]。L-plastin作为一种肌动蛋白结合蛋白,其在多种恶性肿瘤(卵巢癌、结直肠癌、恶性黑色素瘤等)细胞中具有组成性高表达。在68%的上皮性肿瘤和53%的非上皮性间质瘤中检测出L-plastin的表达,而正常组织细胞中则无表达。随后使用RT-PCR技术检测发现,在大部分肿瘤细胞内都有L-plastin基因的激活。因此,L-plastin被认为是多种肿瘤的共同标志[3]。然而,临床研究发现,L-plastin的表达高低同乳腺癌、黑色素瘤的分期无关,而同结直肠癌、前列腺癌的分期相关[3,19]。因此,虽然在多种肿瘤中,肿瘤细胞L-plastin的表达都有不同程度的增高,但在不同类型肿瘤中,L-plastin的增高表达与肿瘤分期可能存在不一致性。虽然L-plastin在某些肿瘤进程中的临床意义仍有待进一步验证,但是,越来越多的肿瘤生物学研究证明,L-plastin的高表达同肿瘤细胞的侵袭转移密切相关。
首先,L-plastin在肿瘤细胞内的表达量增高可以影响肿瘤细胞的生物学活性。研究发现,L-plastin可以诱导结直肠癌细胞的增殖和侵袭以及E-cadherin的表达缺失;在结直肠癌细胞系SW480细胞内过表达L-plastin蛋白会增加肿瘤细胞的增殖和侵袭转移能力;此外,在高表达L-plastin的SW480细胞中,E-cadherin的表达会下调,而使用细胞松弛素B则会减小E-cadherin的下调,从而揭示L-plastin诱导E-cadherin的表达下调是通过内吞途径起作用的[20]。
其次,L-plastin在肿瘤细胞内的表达形式改变也能够影响肿瘤细胞的生物学特性。实验证明,异位表达的磷酸化的L-plastin可以增加黑色素瘤的侵袭性;Klemke等[19]使用siRNA技术沉默掉黑色素瘤细胞系IF6内源性的L-plastin的表达,发现黑色素瘤细胞的转移能力降低;但随后的研究发现L-plastin的表达同黑色素瘤的分期无关,这提示一些其他因素比如L-plastin的磷酸化可能参与并影响了肿瘤细胞的功能;基底膜侵袭的体外实验发现,只有磷酸化而非去磷酸化形式的L-plastin蛋白才能增加黑色素瘤细胞对基底膜的侵袭;同时,在小鼠黑色素细胞瘤细胞系B16的荷瘤体内实验中,B16细胞的转移能力同细胞L-plastin的表达量增高和其磷酸化程度增强密切相关;Riplinger等[21]使用黑色素瘤细胞系MV3和前列腺癌细胞系PC3M进行动物实验亦证明了,在体内L-plastin的表达可以促进肿瘤细胞的转移,并且其功能的发挥需要蛋白的磷酸化形式。上述系统性的研究说明,黑色素瘤细胞侵袭能力的增强不仅需要其细胞内L-plastin蛋白量的表达增高,而且还需要增高表达的L-plastin蛋白的磷酸化程度增强。
再次,L-plastin参与肿瘤细胞侵袭迁移能力增强的细胞内机制也在逐渐被揭示:Janji等[22]在对乳腺癌的研究中发现,L-plastin可以作为肿瘤细胞的“保护蛋白”来“抵抗”抗肿瘤细胞因子—肿瘤坏死因子(TNF)的抗肿瘤细胞毒性,表现为在对TNF敏感的乳腺癌细胞系MCF-7内过表达L-plastin,则可以保护其免受TNF介导的细胞死亡;通过基于DNA微阵列的表达谱分析,则揭示了肿瘤细胞形态的改变同肌动蛋白骨架的重构相关,并且肿瘤细胞内肌动蛋白骨架相关基因的表达以及参与肿瘤细胞上皮间质转化的标志性分子的基因表达均发生了改变;其可能的机制是,作为F-actin的交叉联系和稳定蛋白,L-plastin很可能参与了上调与TNF抵抗相关的分子的表达。研究还发现这种“抵抗”TNF的“保护”作用依赖于L-plastin蛋白的Ser5位点的磷酸化,并且这种磷酸化状态很可能被非传统蛋白激酶C(PKC)和神经酰胺通路所调节;然而与之不同的是,Lommel等[23]提出了新的Ser5磷酸化机制。Lommel等对4种不同侵袭转移能力的乳腺癌细胞系研究发现:具有不同侵袭能力的乳腺癌细胞系中,L-plastin的Ser5磷酸化水平亦具有差异,而全基因组芯片分析揭示了不同细胞系中ERK/MAPK通路的相关基因具有不同的表达水平,从而也就暗示了ERK/MAPK通路可能参与了L-plastin的Ser5磷酸化的调节;在体外激酶试验中,作者发现ERK/MAPK通路的下游分子—核糖体S6激酶α-1(Ribosomal protein S6 kinasesα-1,RSK1)和核糖体S6激酶α-3(Ribosomal protein S6 kinasesα-3,RSK3)可以直接使L-plastin的Ser5发生磷酸化。同时,迁移和侵袭实验分析发现RSK沉默后,乳腺癌细胞系MDA-MB-435S的迁移和侵袭会降低30%。但这些均是体外细胞系实验,仍需有效的体内实验来验证。而介于L-plastin在女性生殖系统组织来源的肿瘤(卵巢癌、子宫内膜癌等)细胞内大量表达,因此,提示在肿瘤细胞内L-plastin的表达可能具有一定的类固醇激素的相关依赖性调控。而关于L-plastin的基因表达调控,林天歆等[24-26]研究发现,证实了甾体类激素受体AR、ER对激素依赖型前列腺癌中L-plastin启动子转录活性起调节作用,并且寻找出了非甾体激素类顺式作用元件序列,同时阐明了在非激素依赖型前列腺癌中转录因子AP-4、SP-1可以上调L-plastin基因的转录活性,由此,介导L-plastin表达进而影响前列腺癌的演进。这些研究为丰富和深入阐明L-plastin在肿瘤细胞内的表达调控机制提供了新证据。
总之,肌动蛋白结合蛋白L-plastin在肿瘤中的调控及其功能正在被逐渐揭示,但是其在不同类型肿瘤中的具体作用及其机制仍有待进一步的阐明,而研究肿瘤细胞异位高表达L-plastin的调控机制和功能作用以及与临床的相关性,对于发现以L-plastin为核心的肿瘤治疗药物的新靶点具有重要的临床意义。
4 结语与展望
肌动蛋白骨架的动态变化是真核细胞的基本特征之一,它对细胞的分裂、形态以及能动性等基本生物学功能至关重要。肌动蛋白骨架结构可以被多种肌动蛋白结合蛋白所调节,L-plastin作为一种重要的肌动蛋白结合蛋白,其参与调节肌动蛋白的聚合和解离,在细胞的移行运动等相关生物学活动中发挥了重要作用。此外,L-plastin还参与免疫突触的形成、整合素的介导、T细胞的激活等一系列重要的免疫学活动。在分布上,L-plastin具有很强的组织特异性,是plastin肌动蛋白结合蛋白在免疫细胞内表达的唯一亚型;而其在大部分肿瘤细胞内存在异位高表达,并参与肿瘤的侵袭和转移等肿瘤生物学功能,临床上还可以作为指标协助评估肿瘤患者的预后。目前研究所知,L-plastin在不同类型的细胞中发挥的功能不尽相同。因此,全面深入研究L-plastin的表达调控和功能作用及其机制将对于与L-plastin相关的疾病研究和治疗具有重要基础和临床意义。
[1] Morley SC.The actin-bundling protein L-plastin supports T-cell motility and activation[J].Immunol Rev,2013,256(1):48-62.
[2] Shinomiya H.Plastin family of actin-bundling proteins:its functions in leukocytes,neurons, intestines,and cancer[J].Int J Cell Biol,2012,2012:213492.
[3] Samstag Y,Klemke M.Ectopic expression of L-plastin in human tumor cells:diagnostic and therapeutic implications[J].Adv Enzyme Regul,2007,47:118-126.
[4] Janji B,Giganti A,De Corte V,etal.Phosphorylation on Ser5 increases the F-actin-binding activity of L-plastin and promotes its targeting to sites of actin assembly in cells[J].J Cell Sci,2006,119(Pt 9):1947-1960.
[5] De Clercq S,Zwaenepoel O,Martens E,etal.Nanobody-induced perturbation of LFA-1/L-plastin phosphorylation impairs MTOC docking,immune synapse formation and T cell activation[J].Cell Mol Life Sci,2013,70(5):909-922.
[6] Miyakawa T,Shinomiya H,Yumoto F,etal.Different Ca(2)(+)-sensitivities between the EF-hands of T- and L-plastins[J].Biochem Biophys Res Commun,2012,429(3-4):137-141.
[7] Singh SM,Bandi S,Mallela KM.The N- and C-terminal domains differentially contribute to the structure and function of dystrophin and utrophin tandem calponin-homology domains[J].Biochemistry,2015,54(46):6942-6950.
[8] Morley SC.The actin-bundling protein L-plastin:a critical regulator of immune cell function[J].Int J Cell Biol,2012,2012:935173.
[9] Deady LE,Todd EM,Davis CG,etal.L-plastin is essential for alveolar macrophage production and control of pulmonary pneumococcal infection[J].Infect Immun,2014,82(5):1982-1993.
[10] Chen H,Mocsai A,Zhang H,etal.Role for plastin in host defense distinguishes integrin signaling from cell adhesion and spreading[J].Immunity,2003,19(1):95-104.
[11] Ohsawa K,Imai Y,Sasaki Y,etal.Microglia/macrophage-specific protein Iba1 binds to fimbrin and enhances its actin-bundling activity[J].J Neurochem,2004,88(4):844-856.
[12] Liu F,Shinomiya H,Kirikae T,etal.Characterization of murine grancalcin specifically expressed in leukocytes and its possible role in host defense against bacterial infection[J].Biosci Biotechnol Biochem,2004,68(4):894-902.
[13] Pazdrak K,Young TW,Straub C,etal.Priming of eosinophils by GM-CSF is mediated by protein kinase CbetaII-phosphorylated L-plastin[J].J Immunol,2011,186(11):6485-6496.
[14] Wabnitz GH,Michalke F,Stober C,etal.L-plastin phosphorylation:a novel target for the immunosuppressive drug dexamethasone in primary human T cells[J].Eur J Immunol,2011,41(11):3157-3169.
[15] Freeley M,O′Dowd F,Paul T,etal.L-plastin regulates polarization and migration in chemokine-stimulated human T lymphocytes[J].J Immunol,2012,188(12):6357-6370.
[16] Todd EM,Deady LE,Morley SC.The actin-bundling protein L-plastin is essential for marginal zone B cell development[J].J Immunol,2011,187(6):3015-3025.
[17] Todd EM,Deady LE,Morley SC.Intrinsic T- and B-cell defects impair T-cell-dependent antibody responses in mice lacking the actin-bundling protein L-plastin[J].Eur J Immunol,2013,43(7):1735-1744.
[18] Stevenson RP,Veltman D,Machesky LM.Actin-bundling proteins in cancer progression at a glance[J].J Cell Sci,2012,125(Pt 5):1073-1079.
[19] Klemke M,Rafael MT,Wabnitz GH,etal.Phosphorylation of ectopically expressed L-plastin enhances invasiveness of human melanoma cells[J].Int J Cancer,2007,120(12):2590-2599.
[20] Foran E,Mcwilliam P,Kelleher D,etal.The leukocyte protein L-plastin induces proliferation,invasion and loss of E-cadherin expression in colon cancer cells[J].Int J Cancer,2006,118(8):2098-2104.
[21] Riplinger SM,Wabnitz GH,Kirchgessner H,etal.Metastasis of prostate cancer and melanoma cells in a preclinical in vivo mouse model is enhanced by L-plastin expression and phosphorylation[J].Mol Cancer,2014,13:10.
[22] Janji B,Vallar L,Al TZ,etal.The actin filament cross-linker L-plastin confers resistance to TNF-alpha in MCF-7 breast cancer cells in a phosphorylation-dependent manner[J].J Cell Mol Med,2010,14(6A):1264-1275.
[23] Lommel MJ,Trairatphisan P,Gabler K,etal.L-plastin Ser5 phosphorylation in breast cancer cells and in vitro is mediated by RSK downstream of the ERK/MAPK pathway[J].FASEB J,2016,30(3):1218-1233.
[24] 林天歆,黄 健,黄 海,等.甾体类激素受体AR、ER对前列腺癌中L-plastin表达的调控[J].中华泌尿外科杂志,2005,26(9):611-614.
[25] 林天歆,黄 建,许可慰,等.鉴定AP-4是在非激素依赖型前列腺癌中上调L-plastin表达的转录因子[J].中山大学学报(医学科学版),2006,27(1):19-23.
[26] 林天歆,黄 建,尹心宝,等.鉴定调控L-plastin在非激素依赖型前列腺癌中表达的转录因子SP-1[J].中国病理生理杂志,2006,22(7):1330-1334.
[收稿2015-12-01 修回2016-01-11]
(编辑 张晓舟)
10.3969/j.issn.1000-484X.2016.11.029
①本文受国家自然科学基金(81402355,8167510)资助。
滕永生(1990年-),男,在读博士,主要从事肿瘤免疫与感染免疫研究,E-mail:tengys2014@163.com。
及指导教师:庄 园(1983年-),男,博士,副研究员,主要从事肿瘤免疫与感染免疫研究,E-mail:yuanzhuang1983@yahoo.com。
R392.11
A
1000-484X(2016)11-1703-06