神经干细胞移植对颈上交感神经节损毁兔MAP-2、GFAP表达的影响
2016-12-24,,,,,,
,, , ,, ,
(1.南华大学外科学总论教研室,湖南 衡阳 421001;2.南华大学附属第二医院神经内科;3.南华大学诊断学教研室;4.南华大学附属南华医院神经内科;5.南华大学解剖学教研室;6.南华大学医学院人体中心)
·基础医学·
神经干细胞移植对颈上交感神经节损毁兔MAP-2、GFAP表达的影响
王芳1,汤永红2*,杨科3,王灿4,朱梦霞1,李彩5,郭东铭6
(1.南华大学外科学总论教研室,湖南 衡阳 421001;2.南华大学附属第二医院神经内科;3.南华大学诊断学教研室;4.南华大学附属南华医院神经内科;5.南华大学解剖学教研室;6.南华大学医学院人体中心)
目的研究神经干细胞(NSCs)移植对颈上交感神经节(SCSG)损毁兔胶质纤维酸性蛋白(GFAP)以及微管相关蛋白2(MAP2)表达的影响。方法32只新西兰兔中8只为正常组不予处理,24只通过持针钳持续压榨兔SCSG 10 s的方法构建SCSG损毁模型,均分成模型组、培养液组和干细胞组,造模后第7天分别给予等量的生理盐水、培养液及2×106个神经干细胞,移植后第1、7、10、14、21天分别记录各组兔损伤侧瞳孔直径变化,第21天取损伤侧SCSG进行HE染色,并进行免疫组化检测MAP-2和GFAP的表达。结果瞳孔直径变化情况,第10天、14天、21天干细胞组瞳孔直径均大于模型组和培养液组,差异有显著性(P<0.05);HE染色,干细胞组较模型组和培养液组细胞排列整齐,大小形态较一致,细胞间质增生少;免疫组化结果显示,干细胞可增加MAP-2的表达,降低GFAP的表达。结论神经干细胞通过促进兔损毁侧SCSG内MAP-2的表达,同时抑制GFAP的表达来发挥神经功能的修复作用。
骨髓间充质干细胞; 胶质纤维酸性蛋白; 微管相关蛋白2; 颈上交感神经节
神经损伤分为中枢性和周围性损伤,疾病预后较差,常留下程度不等的后遗症,不仅对个人和家庭,甚至对社会都造成了巨大的压力,严重的危害着人类健康。众所周知,传统观念认为神经损伤后不可再生,这就导致治疗相当困难,而近年来提出神经干细胞的概念后,对传统观念造成了巨大的冲击,也为神经损伤的治疗带来了新的曙光。骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)因其易获取,免疫原性低等多项优点被广泛应用[1],但目前的研究报道多涉及干细胞移植干预相关模型,再采用形态学或者行为学评分来评估疗效[2-5],并未探讨干细胞是否成功迁移至损伤部位,随后能否存活并进行分化。因此本研究旨在神经细胞标志物微管相关蛋白(MAP-2)和胶质纤维酸性蛋白(GFAP)方面着手,通过骨髓源神经干细胞移植治疗SCSG损毁兔,不同时间点观察兔瞳孔直径恢复情况,观察受损部位MAP-2和GFAP含量的变化,来探讨NSCs修复神经功能的可能作用及机制。
1 材料与方法
1.1动物与试剂健康成年的新西兰雄性白兔32只,2 000~2 500 g,由南华大学实验动物部提供;bFGF 、CNTF 购自美国Peprotech公司; CD34、CD44和CD54单克隆抗体购自北京博奥森生物技术有限公司;MAP-2、GFAP抗体购于武汉博士德生物工程有限公司。
1.2动物模型制备暴露颈部皮肤后逐层分离出颈上交感神经节,用直持针钳压榨交感神经节约10 s,压下一个齿,并且保持持针钳长轴方向与交感神经节长轴方向一致,神经节与钳头完全咬合,从而保证颈上交感神经节变形超过50%。
1.3模型成功标准模型兔出现Horner三联征,瞳孔缩小、眼球凹陷、睑裂变小。瞳孔直径:可通过数码相机拍摄,然后Image J软件处理测得瞳孔直径数据,随后进行统计分析。对于模型判定睑裂及眼球凹陷则采用直接图片比较分析。
1.4动物分组将32只实验兔均分为4组,每组8只。正常组:不予任何处理。模型组:造模成功后第7天注射1 mL生理盐水;培养液组:造模成功后第7天注射1 mL培养液;干细胞组:造模成功后第7天注射1 mL含2×106个神经干细胞的培养液。
1.5细胞培养、诱导分化及鉴定提取的兔骨髓细胞,经全骨髓培养法和密度梯度离心法培养3~5代后,进行细胞表型鉴定,CD34阴性,CD44及CD54阳性提示细胞为BMSCs。采用Nestin单克隆抗体鉴定,经bFGF预诱导,CNTF诱导后BMSCs分化为神经干细胞。
1.6 HE染色移植后第21天处死兔,取颈上交感神经节置入甲醛中固定24 h后石蜡包埋,4 μm切片,切片常规用二甲苯脱蜡;经各级乙醇脱水;蒸馏水水洗2 min;苏木素染色5 min;自来水冲洗;盐酸乙醇分化30 s;自来水浸泡15 min;置伊红液2 min;常规脱水,透明,树胶封片,镜检。
1.7 MAP-2及GFAP免疫组化染色具体操作按照免疫组化试剂盒说明书进行,石蜡切片70 ℃烤片10 min;二甲苯ⅠⅡ各30 min;再按无水乙醇到75%乙醇中逐级脱水;去离子水5 min;柠檬酸盐缓冲液抗原热修复15 min;PBS每次5 min,洗3次;过氧化氢15 min;再次PBS洗3次;血清封闭1 h;去除血清,加一抗4 ℃孵育过夜;PBS洗3次每次5 min; 二抗37 ℃孵育30 min;PBS洗3次每次5 min;DAB显色,苏木素复染,树胶封片,镜检。
1.8图像分析和统计学处理统计分析和绘制采用Graphpad Prism软件,运用单因素方差分析以及LSD组间比较法,数据使用均数±标准差表示,P<0.05为差异有显著性。
2 结 果
2.1兔瞳孔测量结果模型组与培养液组比较,各个时间点瞳孔直径差异均无显著性(P>0.05);干细胞组分别与模型组和培养液组对比,移植后第1天、7天差异不明显(P>0.05),第10天、14天、21天干细胞组瞳孔直径均大于模型组和培养液组(P<0.05);干细胞组与正常组比较,细胞移植后第1天、7天、10天干细胞组瞳孔直径均小于正常组(P<0.05),第14天、21天差异不明显(P>0.05)(表1)。
2.2 HE染色结果切片制成后,进行HE染色,观察神经节内病理组织学改变,正常组与干细胞组可见细胞大小形态基本一致,分布均匀,排列整齐、紧密,少量间质增生,新生血管丰富,未见明显核固缩。模型组与培养液组可见细胞大小各异,分布不均,排列紊乱,可见炎性细胞浸润,细胞间质增生明显,可见核固缩(图1)。
2.3 MAP-2、GFAP免疫组化结果MAP-2和GFAP主要存在于胞浆中,若阳性表达则胞浆着棕黄色,着蓝紫色表示阴性表达。MAP-2、GFAP免疫组化结果表明(见图2、图3),干细胞组和正常组MAP-2呈阳性表达,GFAP呈阴性表达;模型组和培养液组MAP-2呈阴性表达,GFAP呈阳性表达,差异有显著性(P<0.05)。
表1不同时间点各组瞳孔测量数据(mm)

组别n第1天第7天第10天第14天第21天正常组87.92+0.388.02+0.308.13+0.377.96+0.368.12+0.25模型组85.82+0.42a5.84+0.34a5.68+0.29a5.91+0.31a5.80+0.36a培养液组85.85+0.32a5.75+0.32a5.64+0.37a5.84+0.27a5.59+0.23a干细胞组85.64+0.33a5.72+0.35a6.79+0.33abc7.98+0.28bc8.06+0.21bc
与正常组比较,a:P<0.05;与模型组比较,b:P<0.05;与培养液组比较,c:P<0.05
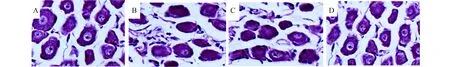
图1 HE染色观察各组神经节内病理学变化(400×) A:正常组;B:模型组;C:培养液组;D:干细胞组
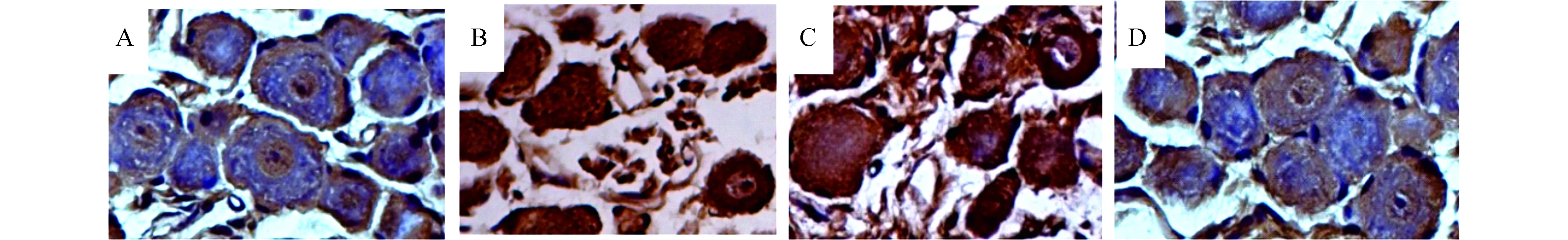
图3 GFAP免疫组化结果(400×) A:正常组;B:模型组;C:培养液组;D:干细胞
3 讨 论
MAP-2作为神经元细胞骨架的重要组成部分,在神经系统形成、发育以及再生过程中扮演着重要角色,参与神经纤维的信号传导和物质转运等过程,所以MAP-2既是一种结构蛋白又是一种功能蛋白,可以作为神经元特有标志物来反应神经细胞的损害程度,MAP-2含量的多少可以作为一个判定标准判断神经细胞是否死亡。相关神经生物学研究证实病人脊髓发生损伤后其损伤区MAP-2含量是显著下降的[6]。MAP-2作为一种功能蛋白有助于神经细胞缺血急性期耐受缺氧环境,但随着时间推移,缺血缺氧的持续导致神经元大量死亡,MAP-2的含量也随之下降[7-8],并且从缺血中心区逐渐向缺血半暗带延续[9],所以MAP-2被认定是神经元缺血的敏感指标。同样GFAP参与胶质细胞的骨架构成并维持其张力强度[10],为星型胶质细胞的标志性蛋白,仅在成熟的胶质细胞表达。GFAP可以调节细胞的代谢,分泌相关营养因子参与信号传导等[11-12]。在正常脑组织中,GFAP免疫组化检测多为阴性,当神经系统损伤后,星形胶质细胞快速反应,其标志之一就是GFAP的表达[13],所以可将GFAP的表达作为星形胶质细胞活动的标志之一,判断急性期神经的损伤。神经损伤后,星型胶质细胞最开始反应性增生,早期的增生具有保护作用,但是胶质细胞过度的增生则容易形成胶质瘢痕,阻碍神经元纤维活动联结[14]。
本实验中模型组和培养液组兔SCSG在细胞移植后第21天MAP-2表达呈阴性,GFAP表达呈阳性,且两组MAP-2表达明显低于正常组,而GFAP表达高于正常组,由此可知兔颈上交感神经节损毁后神经元标志性蛋白MAP-2表达量是下调的,星型胶质细胞的标志性蛋白GFAP表达是增加的。而干细胞组移植后第21天MAP-2表达呈阳性,与正常组无明显统计学差异,但明显高于模型组与培养液组,由此可认为干细胞移植能促进神经节内MAP-2的分泌。而干细胞组GFAP表达呈阴性,明显低于模型组与培养液组,可推测神经干细胞抑制了胶原纤维的过度增生,下调了GFAP的表达。综上所述,本研究认为兔SCSG损毁导致神经元损伤,神经功能障碍,进而导致MAP-2下降,GFAP表达上调,从而引起神经功能障碍,阻碍了神经功能的恢复。而神经干细胞移植后,MAP-2表达增加,GFAP表达下降,抑制了胶质细胞的增生,促进了神经功能的恢复,说明MAP-2在神经功能修复过程中发挥着重要作用,但在本实验中,MAP-2作为神经元的敏感指标,细胞干预组兔瞳孔直径在细胞移植后10~14天即有明显恢复,由于只研究了细胞移植后21天MAP-2的值,MAP-2的增高与神经功能的恢复的先后顺序未知,本课题组将继续深入探讨在这一修复过程中MAP-2的变化情况。另外神经细胞损伤后伴随着胶质增生,且GFAP表达上调,早期适度增生是有利于神经功能恢复的,但是后期过度增生导致胶质瘢痕形成阻碍了神经元的再生,由此可知需要评估最佳移植时间点以便达到最好的移植效果,这也将是本课题组以后研究的重点。
[1] Klinker MW,Wei CH.Mesenchymal stem cells in the treatment of inflammatory and autoimmune diseases in experimental animal models[J].World J Stem Cells,2015,7(3):556-567.
[2] Hao L,Zou Z,Tian H,et al.Stem cell-based therapies for ischemic stroke[J].Biomed Res Int.2014,2014(2014):468748-468748.
[3] Eckert MA,Vu Q,Xie K,et al.Evidence for high translational potential of mesenchymal stromal cell therapy to improve recovery from ischemic stroke[J].J Cereb Blood Flow Metab,2013,33(9):1322-1334.
[4] Lin YC,Ko TL,Shih YH,et al.Human umbilical mesenchymal stem cells promote recovery after ischemic stroke[J].Stroke,2011,42(7):2045-2053.
[5] 王芳.BMSCs移植对缺血性脑卒中鼠IL-l0、TGF-β1表达的影响[D].衡阳:南华大学,2014:1-53.
[6] Gotohda T,Tokunaga I,Kitamura O,et al.Toluene inhalation induced neuronal damage in the spinal cord and changes of neurotrophic factors in rat[J].Leg Med,2007,9(3):123-127.
[7] Rota Nodari L,Ferrari D,Giani F,et al.Long-term survival of human neural stem cells in the ischemic rat brain upon transient immunosuppression[J].PLoS One,2010,5(11):e14035.
[8] Zhou Q,Zhang Q,Zhao X,et al.Cortical electrical stimulation alone enhances functional recovery and dendritic structures after focal cerebral ischemia in rats[J].Brain Res,2010,1311 (2):148-157.
[9] Xiao-Hua X,Ling L,Mei Y,et al.Dynamic changes of microtubule-associated proteins,heat shock proteins and glial fibrillary acidic proteins after experimental cerebral infarction and reperfusion[J].Chin J Clin Reh,2005,9(9):73-75.
[10] Hergenroeder GW,Redell JB,Moore AN,et al.Biomarkers in the clinical diagnosis and management of traumatic brain injury[J].Mol Diagn Ther,2008,12( 6):345-358.
[11] Zoltewicz JS,Scharf D,Yang B,et al.Characterization of antibodies that detect human GFAP after traumatic brain injury[J].Biomark Insights,2012,7:71-79.
[12] Gwak YS,Kang J,Unabia GC,et al.Spatial and temporal activation of spinal glial cells:role of gliopathy in central neuropathic pain following spinal cord injury in rats[J].Exp Neurol,2012,234( 2):362-372.
[13] Middeldorp J,Hol EM.GFAP in health and disease[J].Prog Neurobiol,2011,93(93):421-443.
[14] Otani N,Nawashiro H,Fukui S,et al.Enhanced hippocampal neurodegeneration after traumatic or kainate excitotoxicity in GFAP-null mice [J].J Clin Neurosci,2006,13( 9 ):934-938.
TheEffectofNSCsTransplantationontheExpressionofMAP-2andGFAPinRabbitswithLesionofSuperiorCervicalSympatheticGanglion
WANG Fang,TANG Yonghong,YANG Ke,et al
(DepartmentofOperativeSurgery,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveThis study was to investigate the effects of Neural stem cells transplantation on the expression of MAP2 and GFAP for treatment in superior cervical sympathetic ganglion injury in rabbits.Methods8 of the 32 New Zealand rabbits were recruited in normal group and no intervention was made,24 SCSG damage models were constructed by the method of continuous pressing of rabbit’s SCSG for 10 seconds,which were divided into model group,culture-medium group and stem cells group,the same amount of normal saline,culture media and 2*106neural stem cells were given seven days after modeling.The changes of pupil diameter in four groups were observed and recorded 1,7,10,14,21 days after transplantation.HE staining was performed and the expression of MAP-2 and GFAP were detected by immunohistochemistry on the twenty-first day.ResultsThe changes of pupil diameter in injured side of rabbits in stem cells group,compared with model group and culture-medium group,were statistically significant on days of 10,14,and 21 (P<0.05).Compared with model group and culture-medium group,cells in the stem cells group were arranged in order,size and shape were uniform,and have a small amount of interstitial cell hyperplasia.Immunohistochemistry results showed that stem cells could increase the expression of MAP-2 and decrease the expression of GFAP.ConclusionNeural stem cells transplantation is able to repair the nerve function of the damaged SCSG in rabbits,and its mechanism may be related to promoting the expression of MAP-2 and inhibiting the expression of GFAP.
bone marrow mesenchymal stem cells; GFAP ; MAP-2; SCSG
10.15972/j.cnki.43-1509/r.2016.04.010
2016-03-03;
2016-06-28
湖南省研究生科研创新项目(2013SCX17) 及衡阳市科学技术发展计划项目(2015KJ21).
*通讯作者,E-mail:tang6246@tom.com.
R741
A
蒋湘莲)
