原子力显微镜检测α-突触核蛋白转基因鼠线粒体微观结构的变化
2016-12-23汪志鹏段春礼鲁玲玲
高 歌 汪志鹏 段春礼 鲁玲玲 杨 慧
(首都医科大学神经生物系 北京脑重大疾病研究院帕金森病研究所 北京市神经再生修复重点实验室 神经变性病教育部重点实验室, 北京 100069)
· 基础研究 ·
原子力显微镜检测α-突触核蛋白转基因鼠线粒体微观结构的变化
高 歌 汪志鹏 段春礼 鲁玲玲 杨 慧*
(首都医科大学神经生物系 北京脑重大疾病研究院帕金森病研究所 北京市神经再生修复重点实验室 神经变性病教育部重点实验室, 北京 100069)
目的 使用原子力显微镜检测α-突触核蛋白(α-synuclein, α-syn)转基因小鼠模型中,皮质线粒体表面微观结构的变化。方法 提取野生型和转基因小鼠皮质细胞线粒体,使用共聚焦显微镜检测其膜电势变化,使用原子力显微镜的敲击模式检测线粒体膜表面的微观结构。结果 JC-1染色法检测线粒体膜电势结果显示,转基因小鼠线粒体膜电势与野生组相比降低20.4%,差异有统计学意义 (P<0.01);原子力显微镜观察结果显示,转基因小鼠线粒体长度与野生组相比增加,表面光滑度减低,线粒体膜孔增多(P<0.05)。结论 α-Syn的转基因小鼠线粒体膜电势减低,线粒体膜完整性受到破坏。在原子力显微镜敲击模式下检测离体线粒体,能反映出转基因小鼠线粒体膜表面微观结构的变化。
原子力显微镜;线粒体;α-突触核蛋白;线粒体膜电势
帕金森病(Parkinson’s disease,PD)是第二大神经退行性疾病,PD的发病因素涉及基因、环境、神经内毒素和老化等多种因素,这些致病因素中线粒体功能障碍是PD发病的中心环节。线粒体受损后,由于ATP合成的丢失、水解增加,离子稳态的失平衡活性氧(reactive oxygen species,ROS)的产生增多,以及凋亡前体蛋白的释放等结果,对细胞产生不可逆转的损伤[1]。线粒体形态的改变如肿胀、固缩、膜损伤、空洞样形成是与这种生理及病理的功能紧密相关的。然而,在PD动物模型中使用原力力显微镜(atomic force microscopy,AFM)检测过表达α-syn后线粒体结构变化的相关研究报道很少。因此本研究使用过表达α-突触核蛋白(α-synuclein,α-syn)转基因小鼠进行线粒体微观形态的研究。Thy1-α-synuclein转基因小鼠能模拟PD症状的发生、发展过程,本实验对PD模型小鼠脑组织的线粒体进行提取后,检测过表达α-syn 对线粒体功能的影响及使用AFM对线粒体的三维微观形态及线粒体膜孔深度进行直观检测,以期建立一种检测PD模型小鼠中线粒体微观结构形态学的技术,对研究α-synuclein损伤线粒体的机制提供实验基础。
1 材料和方法
1.1 材料及分组
Thy1-α-syn转基因小鼠(购于Jackson laboratory,美国),雄性,25~30 g,实验动物许可证号:3377883。小鼠分为2组:转基因小鼠组(transgenic mice, TG)及同窝对照野生小鼠组(wild type mice, WT),每组3只,即从3窝同代小鼠中随机取出TG及WT各一只。MinuteTM线粒体分离试剂盒(Invent公司,美国),JC-1(5,5′,6,6′-四氯-1,1′,3,3′-甲基苯并咪唑氢碘化物)(Sigma公司,美国),原子力显微镜为美国VECCO公司,云母片为71856-01-10(EMS公司,美国),OTR8-10型号AFM探头(Bruker 公司,美国),Triethoxysilane(Sigma公司,美国)。
1.2 方法
1)线粒体提取:使用Minute TM线粒体分离试剂盒,快速从各组小鼠脑皮质中分离出完整线粒体。步骤如下:(1)将新鲜皮质组织60 mg放置于离心管柱上。加入250 μL Buffer A,用塑料棒反复扭转研磨组织1 min, 14 000 r/min离心30 s,弃去离心管柱,涡旋震荡重悬沉。(2)3 000 r/min离心1 min(沉淀为细胞核),小心地将上清液转移到新的2.0 mL离心管中,加入400 μL 缓冲液B,涡旋震荡10 s混合,溶液。(3) 随后14 000 r/min离心10 min,弃去上清液(上清液包含胞质蛋白)。(4)沉淀加入200 μL缓冲液B涡旋震荡10 s重悬沉淀,10 000 r/min离心5 min。(5)将上清液转移到新的2.0 mL离心管中。加入1.6 mL预冷的mito Buffer A (145 mmol/L KCl, 50 mmol/L sucrose, 1 mmol/L EGTA,1 mmol/L MgCl2, 10 mmol/L PB, pH值为7.4),14 000 r/min离心15 min,沉淀即为分离出的线粒体(约140 μg)。
2)JC-1染色检测线粒体膜电势:准备好WT组及TG组皮质的新鲜线粒体悬液后,在mito Buffer A中加入终浓度为10 mmol/L 丙酮酸钠,10 mmol/L 琥珀酸钠,1 mmol/L的二磷酸腺苷(adenosine diphosphate,ADP)的缓冲液中,加入5 μmol/L的 JC-1染液,37 ℃孵育30 min后,14 000 r/min离心15 min洗去染液,使用mito Buffer A重悬,即刻吸取2 μL制片,在荧光显微镜下进行观察:观察红色荧光,滤波器激发波长529 nm,散发波长590 nm,观察绿色荧光:滤波器激发波长488 nm,散发波长530 nm。使用红色与红绿荧光比值反映线粒体膜电势的变化情况。
3)云母片处理:荧光显微镜观察确认活性高的线粒体后,取2 μL线粒体悬液,事先用Triethoxysilane处理的新鲜的云母片,使之带上正电荷,与带负电荷的线粒体结合,晾干后用2%(质量分数)多聚甲醛固定10 min,用超纯水轻冲洗云母片,冲走盐粒,随着线粒体基质液体的蒸发,多聚甲醛的固定,会使线粒体的体积变小,样品干燥箱晾干后行原子力显微镜检测(图1)。
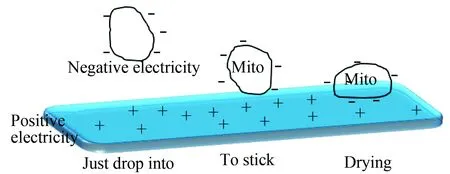
图1 线粒体与云母片的黏附过程
Fig.1 Process of mitochondria attaching to triethoxysilane coatedmica
4) 原子力显微镜观察线粒体膜表面结构:使用OTR8-10型号探针检测线粒体,其纵向分辨率为0.1 nm,横向分辨率为2 nm。采取敲击模式进行检测,使用的扫描范围为:2 μm×2 μm,扫描分辨率为512×512 像素, 扫描速度为每秒0.8 line。图像采用Nanoscope 1.40r3软件分析,进行了线粒体的三维构建。测量线粒体的形态参数,包括长度、宽度、长宽比、高度、表面粗糙度、膜孔的深度和个数。共检测90个线粒体 (n=3)。
1.3 统计学方法

2 结果
2.1 JC-1染色检测线粒体膜电势
线粒体电势情况如图2所示,左列(图2A、B)是2组皮质组织提取的线粒体经JC-1 染色后,发射波长为590 nm 时,显示红色,反映聚合态的JC-1,表征线粒体膜电势良好,右列(图2C、D)是发射波长为530 nm时,显示绿色,反映单体的JC-1,表征线粒体膜电势降低。使用Image J软件分析荧光个数,结果显示TG组线粒体膜电势比WT组平均下降20.4% (P<0.01,n=3,图2E)。
2.2 原子力显微镜检测小鼠皮质线粒体
图3左侧列分别是不同组的线粒体二维结构图(图3C、E),右侧列为左侧的三维形貌图(3D、F)。图3A、B为云母片本底图,因为有盐粒存在,所以也呈现非光滑的颗粒状。可以观察到,WT组的线粒体呈圆棒状,表面较为光滑,TG组的线粒体形状不规则,表面可见较多膜孔样凹陷(3F图红色箭头指示)。图G代表云母片本底光滑度,图3H,3I分别显示了2组线粒体的长宽测量值,蓝线代表长度测量值,红线代表宽度测量值。
2.3 WT及TG组线粒体长度,宽度,长宽比,高度,表面粗糙度,膜孔个数及膜孔深度比较
图像使用Nanoscope 1.40r3软件分析线粒体的形貌参数,结果显示,WT组线粒体平均长度为(371.40 ± 40.78)nm,表面粗糙度为(13.980±0.984)nm,线粒体的膜孔个数为1.400±0.510,而TG组线粒体长度明显增加到(643.20±95.35)nm,平均表面粗糙度增加为(22.870±1.732)nm,线粒体的膜孔个数为4.200±0.663,差异均有统计学意义(P<0.05),而线粒体的宽度、高度、长宽比及膜孔深度在TG组虽有增加,但差异无统计学意义(P>0.05)。共检测90个线粒体,其中转基因组45个,野生组45个,详见表1。
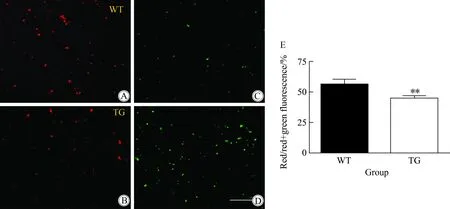
图2 WT及TG组线粒体膜电势变化情况
Fig.2 Mitochondrial Δψm isolated from WT and TG mice
Δψm of purified mitochondria was visualized by the probe JC-1. Confocal image showed the Δψm. Normal Δψm was red fluorescence for the aggregation of the JC-1 monomers (A, B), while green fluorescence was associated with reduced Δψm (C, D). The same intensity was used to acquire the images. Quantitative and statistical analysis showed the decreased Δψm in mitochondria isolated from TG mice (E). Thirty visual fields were detected by Image J. (**P<0.01,n=3). Scale bar=50 μm;WT:wild type mice;TG:transgenic mice.
表1 WT及TG组线粒体形貌参数比较
Tab.1 Quantitative analysis of nanostructural changes in isolated mitochondria from WT and TG (n=3)

*P<0.05,**P<0.01vsWT group;WT:wild type mice; TG:transgenic mice.

图3 线粒体的平面(2D)及立体结构图(3D)
Fig.3 Representative atomic force microscopy (AFM) topographic images and line profiles of mitochondria isolated from WT (wild type) (C, D, H), TG (transgenic type) (E, F, I) mice
A: mica surface 2D image as the background; B: mica surface 3D image; C: 2D mitochondrial image of WT; D: 3D image of WT; E:2D mitochondrial image of TG; F: 3D image of TG. The lines profiles were showed in Fig(G,H,I).G:Mica surface was showed;H: size of mitochondria in WT; I: size of mitochondria in TG. Blue line represented the length of mitochondria.Red line representedthe width of mitochondria;WT: wild type mice; TG:transgenic mice; Red arrow showed the pore-like changes (F).
3 讨论
大量的研究[2-5]结果提示,过表达α-syn能引起线粒体肿胀,线粒体渗透性转运孔(mitochondrial permeability transition pore, mPTP)开放,线粒体膜电势降低,钙稳态失衡,ROS产生增加,进而引起细胞坏死或凋亡,另外,也有文献[4]报道,过表达α-syn能在生物膜上引起孔道样改变。
自从Binnig等[2]1986年发明AFM以来,AFM成为了一项非常重要的检测各种细胞及生物材料表面特性的技术方法。在医学和生物学领域,AFM作为一种成像技术能提供样品的三维成像和样品的细微结构,包括微生物、细胞膜、生物大分子及细胞外膜结构等[3-5]。相比电镜及其他显微镜,AFM最主要的优势是不需要特殊处理样品,并且在各种环境下如大气中,真空,甚至溶液介质中都能进行测试,样品制备方法简单,分辨率达到nm级别,并且AFM能提供样品的二维,三维结构图像。Wilson等[6]的研究中,离体评估线粒体形态的是通过测量线粒体悬液的吸光度等数值进行的,使用荧光显微镜观测在体的线粒体肿胀程度也没有特别量化的指标[7],虽然使用高分辨率的电镜能进行观测线粒体的轮廓及内部结构,但是它不能像AFM一样给出微观的三维形貌图,也不能观察到线粒体的膜表面的改变。
α-Syn作为路易小体(Lewy bodies,LBs)的主要成分,在PD发生发展过程中起着非常重要的作用。α-Syn的N端有6个氨基酸(KTKEGV)高度保守序列,可与脂质膜可逆结合,它对心磷脂具有高度亲和性,而心磷脂在线粒体内外膜中含量丰富[8]。线粒体作为细胞的能量工厂,它在离体的环境下存活的时间短,功能损伤大,本实验室使用试剂盒快速提取线粒体后,在体外进行JC-1检测时加入丙酮酸盐、琥珀酸盐及ADP,以维持在体的微环境,保证线粒体在固定之前保持其完整的形态及功能。JC-1染色结果显示,TG组离体线粒体膜电势与WT组相比下降20.2%(P<0.05)。本实验室的前期结果显示在MN9D和原代神经元中过表达α-syn后,能对线粒体功能造成损伤[9]。在PC12细胞培养基中外加α-syn也能引起线粒体功能损伤,cytochrome c释放增加,进而引起细胞凋亡[10]。α-Syn转基因小鼠皮层的线粒体膜电势减低,ROS增加。那么这种线粒体功能的降低是不是有其形态改变的基础呢?随后本研究AFM检测线粒体微观结构的变化。
AFM利用样品和探针之间的原子力检测样品的形貌结构,其分辨率达到纳米级别,AFM有3种扫描模式,接触模式(contact mode)、非接触模式(non-contact mode),敲击模式(tapping mode)。鉴于线粒体属于软质样品,为了增加纵向分辨率,本研究采用了敲击模式进行线粒体的检测。敲击模式很好的消除了横向力的影响,降低了由吸附液层引起的力,图像分辨率高,适于观测软、易碎、或胶黏性样品,并且不会损伤线粒体的膜结构。AFM在Z方向的分辨率为0.1 nm,那么,就要求样品下的基底的粗糙度为0.1 nm或更小,云母片因为其表面平滑,并呈现片层结构。因此本研究也选用广泛使用的云母片作为基底介质。在AFM扫描过程中,即使扫描到了云母的层状边界,云母单层的高度分辨率<1 nm,也能减少误差。云母片的片层结构使它易于替换,取走云母表层后剩余的云母就是一个新鲜干净的表面。本研究结果提示,过表达α-syn小鼠皮质(TG组)线粒体长度增加,可能是α-syn过表达引起线粒体肿胀,但是由于多聚甲醛后固定的原因,线粒体出现了固缩,因此长宽比与WT组相比差异无统计学意义(P>0.05)。WT及TG两组线粒体在云母片上的高度差异无统计学意义(P>0.05),可能是因为样品与云母片结合的原因,随着接触面积增大,所以高度基本保持一致。2 μm×2 μm的扫描面积时,TG组线粒体表面出现明显孔道样改变,膜孔的个数与同窝野生组相比也显著增加,孔道深度约9 nm,笔者推测,此孔道能造成线粒体通透性增加,线粒体膜电势减低,cyto c的释放增加,进而引起细胞损伤,结果也显示与同窝对照组相比,转基因组小鼠线粒体表面粗糙度增加(P<0.05),这与Biasutto等[11]的研究结果一致。作为PD模型的α-syn转基因小鼠,能模拟PD的发病机制,包括早期的嗅觉功能减低、晚期的运动功能障碍等[12-15],这些表型都是与线粒体的结构功能改变密切相关,本研究结果提示,过表达α-syn能引起线粒体膜电势的减低,这与其结构的改变有关。AFM结果也证实了过表达α-syn能引起线粒体变大,孔道样结构增加。因此,使用AFM能观察到离体线粒体微观结构的变化,是一种直观准确的应用于PD研究中线粒体结构的观察手段。但是,这种在线粒体上观察到的孔道样变化的原因可能是α-syn与mPTP的蛋白发生相互作用造成的,也可能是增多的α-syn由于其亲膜的结构进而在膜上直接形成孔道。下一步将寻找α-syn与线粒体膜发生直接相互作用的关键蛋白,并对其进行保护性干预后,线粒体微观形态的变化,以期为线粒体功能变化找到直观的佐证,为PD的研究提供新的实验依据。
[1] Halestrap A P, Clarke S J, Khaliulin I. The role of mitochondria in protection of the heart by preconditioning[J]. Biochimi biophys acta, 2007,1767(8):1007-1031.
[2] Binnig G Q, Gerber C. Atomic force microscope [J]. Phys Rev Lett, 1986, 56(9): 930-933.
[3] Lee G J, Jeong J H, Lee S, et al. Quantitative and qualitative analysis of heart mitochondria for evaluating the degree of myocardial injury utilizing atomic force microscopy [J]. Micron, 2013,44:167-173.
[4] Lee G J, Park E J, Choi S, et al. Observation of angiotensin Ⅱ-induced changes in fixed and live mesangial cells by atomic force microscopy [J]. Micron, 2010, 41(3):220-226.
[5] Lee G J, Chae S J, Jeong J H, et al. Characterization of mitochondria isolated from normal and ischemic hearts in rats utilizing atomic force microscopy [J]. Micron, 2011,42(3):299-304.
[6] Wilson J D, Bigelow C E, Calkins D J, Foster TH. Light scattering from intact cells reports oxidative-stress-induced mitochondrial swelling [J]. Biophys J, 2005,88(4):2929-2938.
[7] Shalbuyeva N, Brustovetsky T, Bolshakov A,et al. Calcium-dependent spontaneously reversible remodeling of brain mitochondria [J]. J Biol Chem,2006,281(49):37547-37558.
[8] Nakamura K, Nemani V M, Azarbal F, et al. Direct membrane association drives mitochondrial fission by the Parkinson disease-associated protein alpha-synuclein [J]. J Biol Chem, 2011, 286(23):20710-20726.
[9] Shen J, Du T, Wang X, et al. alpha-Synuclein amino terminus regulates mitochondrial membrane permeability [J]. Brain Res, 2014, 1591:14-26.
[10]Seo J H, Rah J C, Choi S H, et al. Alpha-synuclein regulates neuronal survival via Bcl-2 family expression and PI3/Akt kinase pathway [J]. FASEB J, 2002, 16(13):1826-1828.
[11]Biasutto L, Azzolini M, Szabo I, Zoratti M. The mitochondrial permeability transition pore in AD 2016: An update[J]. Biochim biophys acta, 2016, 1863(10):2515-2530.
[12]Gerstenberger J, Bauer A, Helmschrodt C, et al. The novel adaptive rotating beam test unmasks sensorimotor impairments in a transgenic mouse model of Parkinson’s disease [J]. Behav Brain Res, 2016, 304:102-110.
[13]尹娜,陈予东,李昕,等. 帕金森病患者血浆增强α-突触核蛋白寡聚体形成[J]. 首都医科大学学报, 2013,34(6) :840-843.
[14]李昕,杨巍巍,李旭冉,等. 寡聚化α-突触核蛋白在不同年龄段食蟹猴消化道中的表达[J]. 首都医科大学学报,2014,35(5) :830-834.
[15]张如意,张丽,李林. 线粒体功能障碍、α-突触核蛋白与帕金森病[J]. 首都医科大学学报,2015,36(6) :861-864.
编辑 慕 萌
Topographic images analysis of mitochondria from α-synuclein transgenic mice utilizing atomic force microscopy
Gao Ge, Wang Zhipeng, Duan Chunli, Lu Lingling, Yang Hui*
(DepartmentofNeurobiology,CapitalMedicalUniversity,CenterforParkinson’sDisease,BeijingInstituteforBrainDisorders,BeijingCenterofNeuralDegenerationandRepairing,KeyLaboratoryforNeurodegenerativeDiseases,MinistryofEducation,Beijing100069,China)
Objective To investigate the mitochondrial topographic images and nanostructural changes in isolated cortex mitochondria from mice overexpressing human wild-type α-synuclein (Thy1-α-synuclein mice, Tg/α-syn) via atomic force microscopy (AFM). Methods Via JC-1 staining to exam the mitochondrial membrane potential of mitochondria isolated from wild type mice(WT) and transgenic mice(TG). The topographic images and nanostructural changes of mitochondria were detected by AFM between the two groups. Results The mitochondrial membrane potential of mitochondria isolated from transgenic mice was decreased by 20.4% compared with the wild type mice (P< 0.01). And the topographic images and nanostructure results showed that the length, roughness and number of pore-like structure were increased in mitochondria isolated from TG group (P<0.05). Conclusion Overexpressing α-syn could attenuate mitochondrial membrane potential (Δψm) and the mitochondrial membrane was destroyed. The AFM could show the topographic images and nanostructural changes in the isolated mitochondria using tapping mode.
atomic force microscopy (AFM); mitochondria; α-synuclein (α-syn); mitochondrial membrane potential(Δψm)
国家自然科学基金(81371398),北京市自然科学基金(7131001),北京市创新团队建设提升计划 (IDHT20140514),首都医科大学校基金(2015JS21),北京脑重大疾病研究院项目(BIBD-PXM2013 014226 07 000084)。This study was supported by National Natural Science Foundation of China (81371398), Natural Science Foundation of Beijing (7131001),Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20140514),Principal Fund of Capital Medical University(2015JS21),Beijing Institute for Brain Disorder-PXM(BIBD-PXM2013 014226 07 000084).
时间:2016-12-14 20∶23
http://www.cnki.net/kcms/detail/11.3662.r.20161214.2023.046.html
10.3969/j.issn.1006-7795.2016.06.017]
R 742.5
2016-06-22)
*Corresponding author, E-mail:huiyang@ccmu.edu.cn
