浅析化学检测实验室的方法确认和方法验证
2016-12-20郑卫东杨定清
侯 雪, 郑卫东, 胡 莉, 杨定清
(1.四川省农业科学院 分析测试中心,四川 成都 610066;2.中国科学院 成都有机化学研究所,四川 成都 610041;3.农业部农产品质量安全风险评估实验室(成都),四川 成都 610066;4.四川省食品药品检验检测院,四川 成都 610000; 5.中国科学院 研究生院,北京 100049)
浅析化学检测实验室的方法确认和方法验证
侯 雪1,2,3,5, 郑卫东4, 胡 莉1,2,3, 杨定清1,2,3
(1.四川省农业科学院 分析测试中心,四川 成都 610066;2.中国科学院 成都有机化学研究所,四川 成都 610041;3.农业部农产品质量安全风险评估实验室(成都),四川 成都 610066;4.四川省食品药品检验检测院,四川 成都 610000; 5.中国科学院 研究生院,北京 100049)

根据EN ISO/IEC 17025,为了证明方法是符合目的的,化学检测实验室应对所使用的方法进行验证和确认。由此,可提供客观证据证明方法的预期用途是否得以满足。本文以方法确认和验证的定义、范围、要求为基础,比较了两者的差异;讨论了何时应进行方法验证,何时应开展方法确认,以及开展方法确认和验证的具体程序。此外,本文还讨论了方法确认和验证过程中涉及到的性能参数,包括准确度、正确度、精密度、线性度、检出限、定量限、选择性/特异性和测量不确定度,为方法确认和验证的实施提供了参考,也为实验室依照EN ISO/IEC 17025要求,制定方法确认和验证程序文件和作业指导书提供了指导。
方法确认; 方法验证; 化学检测实验室
0 引 言
根据ISO/ IEC 17025:2005《检测和校准实验室能力通用要求》[1],实验室应使用合适的方法和程序进行检测和/或校准,这意味着实验室应对所采用的方法,包括标准方法和非标方法,开展适当的方法确认和验证工作。国际上许多机构和组织,如:国际标准化组织(International Organization for Standardization, ISO),美国分析化学家协会 (Association of Official Analytical Chemists, AOAC),美国食品药品监督管理局(Food and Drug Administration, FDA),国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry, IUPAC)都对“方法验证”和“方法确认”给出了相关定义,并对其具体执行方法做出了规定。然而,在实际工作中,“方法验证”和“方法确认”却常常被混淆。本文从“方法验证”和“方法确认”的定义入手,详细诠释了两者的差异,以及在日常工作中,应该如何开展方法确认和方法验证工作。
1 方法验证和确认的定义
“方法验证”对应于英文单词“Verification”,ISO对其定义为“通过检查并提供客观证据,验证规定要求得以满足”[2]。通过方法验证可证实方法适用于其预期目的的过程。确认包括研究性能特征,如:准确度、特异性、检出限、定量限、线性度、范围、耐用性和稳健性。“方法确认”对应于英文单词“Validation”,根据ISO,其定义为:“通过考察和提供客观证据,确认是否能满足某个特定预期用途的特殊要求”[2],即:方法确认需要“确认某个特定的分析方法能满足分析目的。”换句话说就是“表明一个规定的方法协议,适用于某个特定类型的测试物料,以及待测物特定的浓度水平”[3]。通过方法确认可证实一个实验室有能力重复已确认的方法,同时方法能够达到可接受的性能水平。
从方法确认和方法验证两者的定义可知,如果一个实验室希望使用某一标准方法(已通过协作研究被全面确认),则应开展方法验证。而某一实验室需要研发一个新方法或使用非标方法时,则应进行方法确认。方法验证研究范围通常比方法确认的要小。方法验证侧重于提供客观证据,证明该实验室具有合理运用该方法的能力,即:在实验室自有测试条件下,所获得的方法性能参数能满足要求。
2 方法验证和确认的实施程序
2.1 方法验证的实施程序
一般来说,进行方法验证有以下几种情况:①采用标准方法前;②对已确认方法进行了细微改变时(例如:使用了不同厂家的相同类型的色谱柱、改变了样品稀释倍数等)。
FDA实验室手册规定[4]:对标准方法的性能验证可分为两种情况:①批量分析情况下的性能验证,②实验室首次使用标准方法前的验证。而前者更多意义上是属于内部质量控制的范畴。
在方法验证过程中,需要考虑哪些关键参数,取决于方法的性质和可能遇到的样品类型。首先,应考察偏倚和精密度是否满足定量方法的最低要求。痕量分析则需要验证检出限(Limit of Detection, LOD)和定量限(Limit of Quantification, LOQ)是否满足要求。对于定性方法,必须通过方法比对,考察与现有已确认方法的相关性。理想情况下,实验室应证明所获得的方法性能数据满足方法要求。如果不能满足,则应判断该实验室是否可以应用此方法,产生真正符合预期目的的结果。
2.2 方法确认的实施程序
当需要确定一个方法的性能参数,是否满足解决特定分析问题的要求时,则需要对方法进行确认,具体情况有:①研发新方法;②修改已有方法,以满足新的分析要求;③实验室、使用的仪器或分析员与已有方法的规定不同;④比较两种方法是否等效,例如:新方法和标准方法[5]。
方法确认总是和一个特定的“分析系统”有关,因此,只要分析系统里的任一构件发生变化,或者当已建立的方法体系不能充分地满足需求时,都需要对方进行“再确认”[5-7]。
方法确认的程度取决于两个方面:①分析方法的状态和使用经验;②分析需求决定,即:客户需求或法规要求。方法确认中,需要考察的性能特征至少应包括精密度、偏倚、线性度和耐用性。不需要开展深入确认研究的情况有:①将已确认的方法用于新基质;②未开展协同研究的已有方法;③提供了性能参数、通过文献报道的方法。而需要进行深入确认的情况有:①文献报道的方法,但未给出性能参数;②实验室内部开发的方法[8]。
方法确认(至少)的内容至少应包括:①分析客户对测试的特殊要求;②针对不同的需求,明确方法性能特征的定义;③考察分析方法(性能特征)是否能满足相关要求;④对分析方法有效性的声明[8]。化学实验室在实际工作中,什么时候应开展方法验证,什么时候应进行方法确认,具体该怎么做,常常难以界定。本文引用了INAB出版的《化学测试实验室定量方法确认指南》中的相关信息(表1),通过实例的形式,对此类工作做了解释。
3 方法验证和方法确认中的性能参数
3.1 准确度(Accuracy)
准确度是指测量结果与接受参考值的一致程度[9]。事实上,准确度涵盖正确度和精密度,即:包含系统误差(偏倚)和随机误差(精密度)。一个测量结果既要正确,测量的精密度也要符合要求。

表1 方法验证和确认范围实例*
*该表摘自《Guide to Method Validation for Quantitative Analysis in Chemical Testing Laboratories》,INAB。
3.1.1 正确度(Trueness)
正确度是指由大量测试结果得到的平均数与接受参照值间的一致程度[9],常用偏倚来度量。在方法验证和确认过程中,常常通过测量(有证)参考物质来获取正确度的信息。此外,也可通过加标回收试验,利用回收率来考察方法的正确度。回收率越低,偏倚对方法的影响越大,正确度就越低。《AOAC单一实验室方法验收准则(化学方法)》规定:空白样和样品的加标浓度应至少包括检测区间内的3个浓度水平,对每个浓度水平需进行至少7次独立的重复分析[10]。
考察方法正确度的第三种方式是方法比对,即通过将方法与另一已表征的参考方进行比对。具体做法为,采用两个方法分析同一个/组样品,比较测试结果,被测样品可以是(有证)参考物质、内部标准物质或典型样品。如果没有相关规定可参考,则可以通过t-检验或观察值的置信区间,评估偏倚[8]。
3.1.2 精密度(Precision)
精密度是指在规定条件下,独立测试结果间的一致程度[9]。精密度仅依赖于随机误差的分布,与真值、统一真值或接受参考值无关。“独立测量结果”意味着结果不受先前相同或相似待测物的测量结果的影响。测定精密度取决于规定的测量条件,重复性和再现性条件是测量条件的两个极端情况,因此精密度通常可分为重现性精密度和再现性精密度,而再现性精密度又包括实验室内再现性(中间精密度)和实验室间再现性。精密度通常可用标准偏差和变异系数来表征。此外,也可考察重复性/再现性或重复性限/再现性限。另一种表示精密度的参数为置信区间,即:所有测量结果都以一定概率或置信水平1-α(α通常是0.05,概率为95%)分布于该区间内[12]。
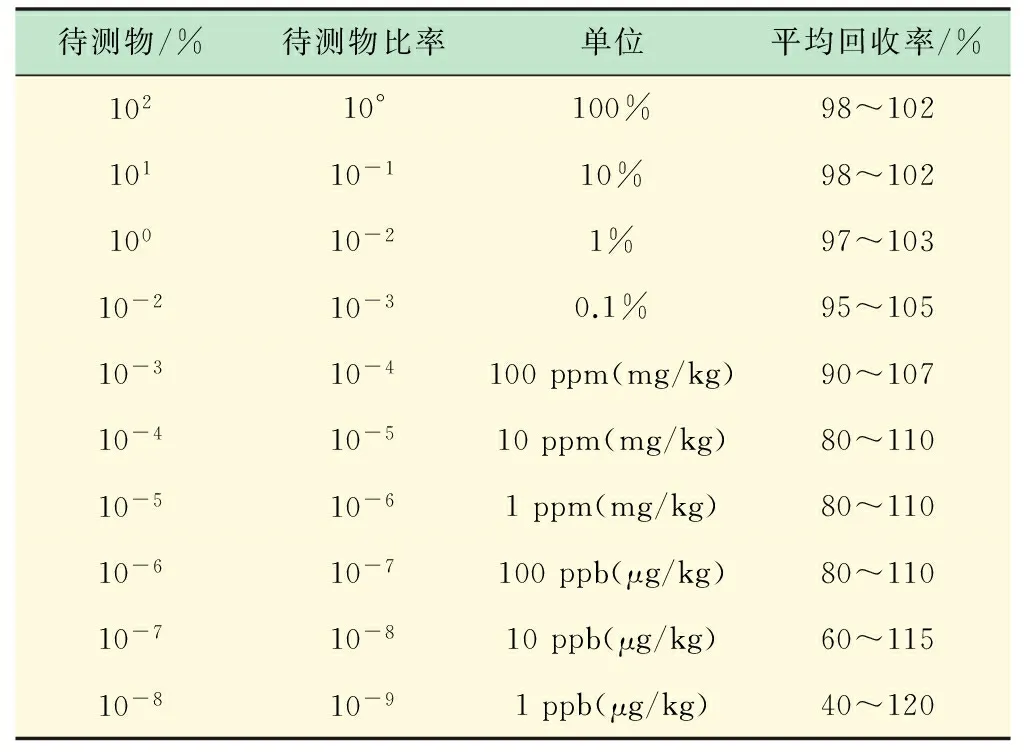
表2 回收率(作为待测物浓度的函数)的期望值*
此外,还可以通过方法比对,来考察精密度,即将重复性、中间精密度和再现性的数值与现有的方法进行比较。如果没有可比较的方法,则可以与相对重复性标准偏差和再现性标准偏差的理论Horwitz和Horrat值进行比较。

表3 精密度(作为待测物浓度的函数)的期望值*
3.2 线性度
对于一个分析程序,校准曲线的线性度反应了待测物浓度与对应信号(响应)之间的比例关系。对于仪器分析来说,推荐以下方案,以确定校准模型的有效性[13-15]:①6个或以上的校准点(包括一个空白点或一个浓度近似于零的点);②理论上,校准点要均匀分布于目标浓度范围内,不同浓度要单独配制,而不能通过稀释同一母液而制备;③校准溶液的浓度范围应覆盖到待测物浓度的0%~150%或50%~150%,可根据情况确定浓度范围;④标准溶液每个浓度点至少要重复测定2次,建议3次或更多次,同时,应随机测定。
3.3 检出限(LOD)
通常情况下,“检出限”的定义可分为两种[9]:
(1) 为避免假阳性或假阴性的情况发生,在某个置信水平下(例如95%、99%或99.7%),能检测到的待测物的最低含量。
(2) 检出限的定义是基于结果具有最大不确定度的期望时,为具有合理统计学不确定度的,能检测到的最低含量。
确定检出限的方法有多种,常见的方法有[16]:
(1) 基于目测来确定LOD。通过在空白样中添加已知浓度的待测物,可确定能够被可靠检测出的最低浓度值。
(2) 基于空白标准偏差来确定LOD。可通过分析大量的空白样(推荐20个以上),以此计算出LOD。样品空白样的独立测试次数应≥10,加入最低可接受浓度的样品测试次数应≥10。LOD为空白样平均值加上3倍标准偏差(+3 s)。
(3) 基于校准公式的使用范围来确定LOD。如果无法得到LOD或与LOD相近的数据,则可利用校准方程的参数来确定LOD。例如:从校准方程:
yLOD=a+3sy/x=a+bxLOD,xLOD=3sy/x/b
获得LOD的近似数据。
(4) 基于信噪比来确定LOD。应尽量选取浓度较低的样品,此时,检出限可以用3倍信噪比来表示。
3.4 定量限(LQD)
定量限是指可检测到的、具有可接受的实验室再现性及正确度的最低浓度[9]。定量限的传统计算方式为空白值加上10倍的重复性标准偏差,或3倍检出限(这两种方式的计算结果基本一致)。如何计算定量限,实验室应视具体情况而定。
3.5 选择性和特异性(干扰情况)
在样品分析过程中,常常会受到来自样品内部或外界环境的干扰,导致测量结果发生偏离。因此,在方法确认过程中,确定所选择的测试方法仅测量待测物是非常重要的,即:方法应不受可能导致错误结果产生的干扰物的影响。选择性是指:在测试条件下,在样品基质同时含有其他干扰组分时,方法能准确和特定地测定待测物的能力[16]。
“选择性”和“特异性”经常被交替使用。事实上,“特异性”一般用于能对单一待测物产生独立响应的方法,而“选择性”则用于对可能或不能区分的一定数量的物质产生响应的方法。如果某个物质的响应能与其他物质区分,则可以说:该方法具有选择性。由于极少有方法仅对单一待测物有响应,因此使用“选择性”这一术语更加恰当。考察选择性和特异性时至少应考察可能存在哪些干扰情况,具体做法有:①分析(相对)纯基质或已知含量最小的天然样本;②在简单基质中,分析和待测参数有关的溶剂;③分析加入待测参数的基质加标样[8]。
3.6 测量不确定度(Measurement Uncertainty, MU)
测量不确定度的定义为与测量结果相关,表征待测量的合理分布值的参数[9]。从某种意义上说,MU不只是一个方法性能参数。这是因为:方法确认是通过对一系列的方法性能特性进行评估而完成的,如:精确度、正确度、选择性/特异性、线性度等;而MU是一个包括了所有误差来源的综合参数,且从方法确认和协同研究获得的数据并不能完全满足MU的评估。事实上,通过考察测量不确定度来进行方法确认或验证已获得广泛认同。
MU是与测试结果相关的参数,用于表征合理赋予被测量值的分散性。如果需对比测量之间,以及测量与特定要求时,则应评估MU。在适用的情况下,《ISO/IEC 17025 》和《ISO 15189》均要求机构所报出的结果需附带不确定度;因此,不确定评估是方法确认中的基本要求。
4 结 语
在实验室检测工作中,方法确认和方法验证是开展检测工作的前提条件和基本要求,应纳入实验室质量体系范畴,即制定相应的程序文件和作业指导书。目前,关于该类工作的要求规范众多,在实际工作中,各家实验室应根据自身的特点,分析检测目的,客户的要求等,确定方法确认和验证的具体做法。本文基于定义、实施条件、具体实施过程等,详细说明了方法验证和确认的区别,以及方法验证和确认过程中,需要考察的基本方法性能参数。
[1] ISO/IEC 17025, General Requirements for the competence of testing and calibration laboratories[S]. International Organization for Standardization, Geneva, Switzerland, 2005.
[2] ISO 9000, Quality management systems-Fundamentals and vocabulary[S]. International Organization for Standardization, Geneva, Switzerland, 2005.
[3] Thompson M., Ellison S., Wood R. IUPAC Technical Report, Harmonized Guidelines for Single-Laboratory Validation of Method of Analysis [J]. Pure Appl Chem, 2002, 74(5):835.
[4] ORA-LAB.5.4.5 Methods, method verification and validation[S]. Food and Drug Administration, USA, 2001.
[5] Eurachem Guide:The fitness for purpose of analytical methods[S]. LGC, UK,1998.
[6] Huber L. Validation and Qualification in Analytical Laboratories[M]. New York, USA: Interpharm, Informa Healthcare, 1998.
[7] Wells R. J. Validation requirements for chemical methods in quantitative analysis-horses for courses[J]. Accred. Qual. Assur., 1998 (3): 189.
[8] Guide to Method Validation for Quantitative Analysis in Chemical Testing Laboratories[S]. The Irish National Accreditation Board, Dublin, Ireland, 2012.
[9] GB/T 6379.1—2004: 测量方法与结果的准确度(正确度与精密度)第1部分: 总则与 定 义[S]. 北京:中国标准出版社, 2004.
[10] Single Laboratory Validation Acceptance Criteria[S]. AOAC Inter., 2005.
[11] Method Validation Programs (OMA/PVM Department), including Appendix D: Guidelines for collaborative study procedures to validate characteristics of a method of analysis[S]. AOAC Inter., 2000.
[12] Currie L. Nomenclature in evaluation of analytical methods,including quantification and detection capabilities [J]. Pure Appl Chem,1995,67(8):1699.
[13] Thompson M., Wood R. Harmonized guidelines for the use of recovery information in alaytical measurement [J]. Pure Appl Chem,1999,71(2):337.
[14] Harmonised guidelines for single-laboratory validation of methods of analysis (IUPAC Technical Report) [J]. Pure Appl. Chem., 2002, 74(2):835.
[15] In-house method validation-A guide for chemical laboratories, Laboratory of the Government Chemist[S]. LGC, UK, 2003.
[16] Guidelines for the validation and verification of quantitative and qualitative test methods[S]. NATA, 2012.
Method Validation and Verification in Chemical Testing Laboratory
HOUXue1,2,3,5,ZHENGWei-dong4,HULi1,2,3,YANGDing-qing1,2,3
(1. Analysis and Testing Centre, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China;2. Chengdu Institute of Organic Chemistry Chinese Academy of Sciences, Chengdu 610041, China;3. Laboratory of Quality and Safety Risk Assessment for Agro-products (Chengdu), Ministry of Agriculture, Chengdu 610066, China; 4. Sichuan Institute for Food and Drug Control. Chengdu 610000,China; 5. Graduate School of Chinese Academy of Sciences, Beijing 100049, China)
According to EN ISO/IEC 17025, methods used in chemical testing laboratories should be validated and verified, in order to prove that the selected methods are fit the purpose. Method validation and verification provides objective evidence that the particular requirements for a specific intended use of the method are fulfilled. In this study, method validation and verification is compared based on definition, scope and requirement. Meanwhile, method validation and verification procedures are specified and discussed. Moreover, the performance characteristics of a method are defined and discussed, including: accuracy, trueness, precision, linearity, LOD, LOQ, selectivity/ specificity and MU. The information provided in this study is useful in drafting and approving the program document and standard operation procedure based on EN ISO/IEC 17025.
method validation; method verification; chemical testing laboratory
2015-03-22
农业部农产品产供安全过程管控技术研究与示范(201303088-6);农业部食用农产品环境因子风险评估项目(GJFP2014012)
侯 雪(1984-),女,四川雅安人,在读博士生,助理研究员。Tel.:028-84504141;E-mail:houxue127@163.com
G 482.0
A
1006-7167(2016)02-0255-04
