丛枝菌根真菌对黄檗耐盐能力的影响1)
2016-12-19赵匠徐佳晶李霞
赵匠 徐佳晶 李霞
(吉林师范大学,四平,136000)
丛枝菌根真菌对黄檗耐盐能力的影响1)
赵匠 徐佳晶 李霞
(吉林师范大学,四平,136000)
采用温室盆栽试验,研究盐胁迫下,接种摩西球囊霉(Glomusmosseaw)和根内球囊霉(Glomusuntraradices)对黄檗耐盐能力的影响。结果表明:盐胁迫下,丛枝菌根(AM)真菌对黄檗侵染率影响不显著(p>0.05),黄檗叶片丙二醛(MDA)质量分数显著高于对照处理,接种AM真菌处理的黄檗叶片MDA质量摩尔浓度均显著低于不接种处理(p<0.05);脯氨酸质量分数均较未接种植株升高,AM真菌有效地减轻黄檗受胁迫的程度。接种AM真菌显著增加了可溶性蛋白质量分数,AM真菌增强了黄檗非酶促防御系统能力。盐胁迫下,过氧化物酶(CAT)和过氧化氢酶(POD)活性在菌根和非菌根处理间差异不显著(p>0.05),超氧岐化酶(SOD)活性在菌根和非菌根植株处理间差异显著(p<0.05)。接种AM真菌后,菌根化黄檗植株可通过渗透调节物质积累和抗氧化酶活性的提高,降低体内膜脂过氧化产物的水平,缓解胁迫对黄檗植株的伤害,增强了黄檗对盐胁迫的耐受力。
丛枝菌根真菌;黄檗;盐胁迫
The experiment was conducted to study the effect of inoculated withGlomusmosseawandG.untraradiceson salt tolerance ability under salt stress by a pot experiment under greenhouse conditions. The effect of infection rate ofArbuscularmycorrhizal(AM) fungi under salt stress onPhellodendronamurensehas no significance (p>0.05). MDA content in leaves ofP.amurenseunder salt stress was significantly higher than that of the control treatment, and the MDA content in leaves ofP.amurenseinoculated with two species fungi treatment was significantly lower than that of non-inoculation treatment (p<0.05). The proline content was higher than that of non inoculation treatment, AM fungi can effectively reduce the degree of stress ofP.amurense. Inoculated treatment with two species fungi significantly enhanced soluble protein, and AM fungi can enhance non-enzymatic defensive System ability ofP.amurense. There were not significantly difference mycorrhizal and non-mycorrhizal treatments of CAT and POD activities under salt stress (p>0.05), in addition, there was significantly different between the mycorrhizal and non-mycorrhizal plants of the SOD activity (p<0.05). After inoculated with AM fungi, mycorrhizal plants ofP.amurensecan be, through osmoregulation substance accumulation and antioxidant enzyme activity, raised to reduce the level of lipid peroxidation productions, to relieve the stress on the plant damage ofP.amurense, and to enhance the salt tolerance ofP.amurense.
丛枝菌根(Arbuscularmycorrhizal,AM)真菌能与80%的植物建立共生关系,加强宿主植物对土壤养分和水分吸收,促进植物生长。通过提高抗逆相关酶活性,减缓逆境胁迫影响,对植物的抗逆境胁迫能力具有一定的影响[1-3]。土壤盐害是限制植物生长发育的重要因素,全世界有超过7%的盐碱土地,而在干旱和半干旱地区这一比例可达15%[4]。研究发现,逆境胁迫下,AM真菌增加叶片可溶性蛋白、脯氨酸质量分数[5-6],提高宿主植物质膜ATPase和液泡膜ATPase的活性[3];调节细胞对K+和Na+的运输与吸收,并通过提高抗逆相关酶活性及植株N和P质量分数,调节植物渗透势,保持细胞内外离子平衡,以减缓逆境胁迫对宿主植物的影响[7]。国内外有关AM真菌与植物的互惠共生关系的研究,发现AM真菌在提高植物抗逆境胁迫能力(如耐旱、耐盐和盐碱地改良)有着非常重要的作用[8-11]。
黄檗(PhellodendronamurenseRupr.)是芸香科黄檗属植物,主要分布在黑龙江、吉林、辽宁等地区。黄檗是重要的用材树种,也是珍贵的中药材,具有重要的经济价值。关于黄檗丛枝菌根真菌及黄檗次生代谢产物等研究有少量报道[12-16],也有研究报道了环境胁迫(如光照、土壤水分、氮素)对黄檗主要次生代谢产物及逆境胁迫生理的影响[17-20]。目前对于AM真菌及环境胁迫交互作用对黄檗影响还未见报道。本文以盆栽黄檗为试验对象,接种摩西球囊霉(Glomusmosseaw)和根内球囊霉(Glomusuntraradices),测定盐胁迫下,接种AM真菌后,黄檗抗氧化物质组成的变化,探讨AM真菌对黄檗抗逆性的影响,为AM真菌应用于黄檗生产以及盐碱地生态恢复提供基础资料。
1 材料和方法
1.1 试验设计
将土壤过2 mm筛,采用高压蒸汽灭菌,风干后待用。供试AM真菌采用摩西球囊霉和根内球囊霉。试验容器为塑料花盆,每盆装土1.2 kg,加入AM真菌接种剂50 g,对照处理每盆加等量灭菌菌剂,每盆3株,重复4次。待黄檗生长3个月后,进行盐胁迫处理。盐胁迫处理(S)采用100 mmol/L的NaCl,对照处理(C)加等量水,每一胁迫处理下,再设不接种AM真菌(A0)、接种摩西球囊霉(Gm)和接种根内球囊霉(Gi)3个处理。处理30 d后,测定根侵染率和抗氧化物质。
1.2 测定指标
采用Trouvelot et al.[21]描述的方法测定菌根侵染状况;丙二醛(MDA)质量摩尔浓度采用硫代巴比妥酸比色法测定;脯氨酸质量分数的测定为磺基水杨酸法;可溶性蛋白用考马斯亮蓝G-250染色法测定;超氧岐化酶(SOD)活性测定采用氮蓝四唑(NBT)法,以单位时间内抑制光化还原50%的氮蓝四唑为一个酶活性单位(U)[22];过氧化物酶(CAT)活性采用高锰酸钾滴定法测定,以每毫克蛋白每分钟作用的H2O2表示;过氧化氢酶(POD)活性采用愈创木酚法测定,以每分钟内A470变化0.01为1个过氧化物酶活性单位(U),各指标测定方法主要参照李合生的方法[23]。
1.3 数据处理
用Excel软件录人原始数据并进行初步统计,用SPSS13.0软件进行数据分析。平均值间的比较采用单因素方差分析;不同处理间的差异采用LSD多重比较检验;采用多因素方差分析AM真菌和盐胁迫的交互作用,显著性水平设定为a=0.05。
2 结果与分析
2.1 盐胁迫下,AM真菌对黄檗侵染率的影响
根据实验结果可知,盐胁迫的情况下,接种Gm处理黄檗根系侵染率比对照降低6.95%;接种Gi处理侵染率比对照降低6.08%,差异均不显著(p>0.05)。
2.2 盐胁迫下,AM真菌对黄檗叶片MDA、脯氨酸和可溶性蛋白的影响
由表1可知,盐胁迫处理黄檗幼苗,接种Gm、Gi和不接种的A0处理黄檗叶片的MDA质量摩尔浓度显著升高,分别比正常供水处理升高37.29%、40.10%和37.39%,接种Gm、Gi后,黄檗的MDA质量摩尔浓度分别低于不接种的(A0)处理18.42%和13.62%,差异显著(p<0.05)。AM真菌和盐胁迫均显著影响黄檗叶片MDA质量摩尔浓度(p<0.001),而两者交互作用不显著(p>0.05)。
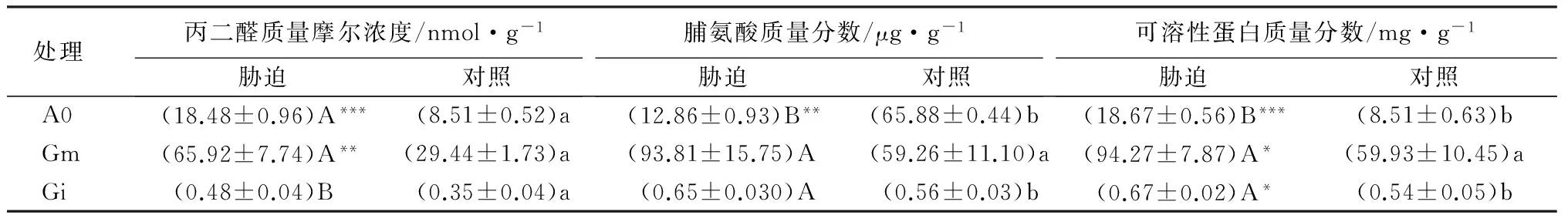
表1 盐胁迫下,AM真菌对黄檗叶片中丙二醛、脯氨酸和可溶性蛋白的影响
注:表中数值为平均值±标准差;*、** 、*** 分别代表p<0.05、p<0.01、p<0.001水平T检验的结果差异显著;同列不同小写字母代表对照处理差异显著(p<0.05);同列不同大写字母代表相同盐胁迫差异显著性(p<0.05)。
盐胁迫处理下接种Gm、Gi和不接种的A0处理黄檗幼苗叶片中脯氨酸质量分数分别比正常供水升高22.57%、22.67%和38.25%,Gm和A0处理差异不显著(p>0.05),Gi和A0处理差异显著(p<0.05和p<0.01)。接种Gm、Gi后,在盐胁迫下,黄檗的脯氨酸质量分数分别高于不接种的A0处理17.46%和34.11%,差异不显著(p>0.05);AM真菌和盐胁迫均显著影响黄檗叶片脯氨酸质量分数(分别为p<0.05和p<0.001),而两者交互作用不显著(p>0.05)。
盐胁迫处理下黄檗叶片的可溶性蛋白质量分数均高于正常供水,接种Gm、Gi和不接种的A0处理分别比正常供水升高6.72%、11.14%和15.93%,接种Gi和不接种的A0处理处理达到显著水平(p<0.05),接种Gm和不接种的A0处理差异不显著(p>0.05)。接种Gm、Gi后,在盐胁迫下,黄檗的可溶性蛋白质量分数分别显著高于不接种的A0处理14.74%和16.31%;AM真菌和盐胁迫均显著影响黄檗叶片可溶性蛋白质量分数(分别为p<0.001和p<0.01),而两者交互作用不显著(p>0.05)。
2.3 盐胁迫下AM真菌对黄檗叶片SOD、POD和CAT活性的影响
由表2可知,盐胁迫处理下黄檗叶片的SOD活性均高于正常供水,接种Gm、Gi和不接种的A0处理分别比正常供水升高8.94%、11.13%和17.84%,接种Gm、Gi的盐胁迫处理与对照差异不显著(p>0.05),不接种的A0处理盐胁迫和对照差异显著(p<0.001)。接种Gm、Gi后,在盐胁迫下,黄檗的SOD活性分别高于不接种的A0处理17.82%和17.40%,接种Gm、Gi处理显著高于A0处理(p<0.05)。AM真菌和盐胁迫均显著影响黄檗叶片SOD活性(p<0.001),而两者交互作用不显著(p>0.05)。
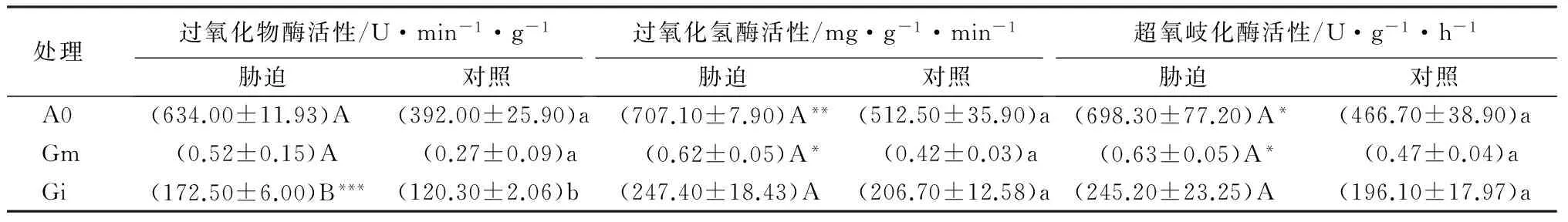
表2 盐胁迫下AM真菌对黄檗叶片中SOD、POT、CAT活性的影响
注:表中数值为平均值±标准差;*、** 、*** 分别代表p<0.05、p<0.01、p<0.001水平T检验的结果差异显著;同列不同小写字母代表对照处理差异显著(p<0.05);同列不同大写字母代表相同盐胁迫差异显著性(p<0.05)。
盐胁迫处理下,黄檗的POT活性显著高于正常供水,接种Gm、Gi和不接种的A0处理分别比正常供水升高15.56%、19.88%和23.59%,接种Gm、Gi的盐胁迫处理与对照差异显著(p<0.01,p<0.05),不接种的A0处理盐胁迫和对照差异不显著(p>0.05)。接种Gm、Gi后,在盐胁迫下,黄檗的POT活性分别显著高于不接种的A0处理5.45%和4.82%。AM真菌对黄檗POT活性影响不显著(p>0.05),盐胁迫对黄檗叶片SOD活性影响显著(p<0.001),而两者交互作用不显著(p>0.05)。
盐胁迫处理下黄檗的CAT活性显著高于正常供水(p<0.05),接种Gm、Gi和不接种的A0处理分别比正常供水升高19.02%、14.89%和30.61%,接种Gm、Gi的盐胁迫处理与对照差异显著(p<0.01,),不接种的A0处理盐胁迫和对照差异不显著(p>0.05)。接种Gm、Gi后,在盐胁迫下,黄檗的CAT活性分别高于不接种的A0处理9.17%和10.28%,但差异均不显著(p>0.05)。AM真菌对黄檗CAT活性影响不显著(p>0.05),盐胁迫对黄檗叶片SOD活性影响显著(p<0.01),而两者交互作用不显著(p>0.05)。
3 结论与讨论
通过接种AM真菌,促进菌根化黄檗植株渗透调节物质的积累和抗氧化酶活性的提高,降低黄檗膜脂过氧化产物的水平,在一定程度上缓解了胁迫对黄檗植株的伤害,增强了黄檗对盐胁迫的耐受力。
AM真菌可促进植物生长、缓解逆境胁迫的影响[10-11,24-26];而逆境胁迫条件下也可影响AM真菌对宿主植物的侵染能力,Al-karaki[28]等试验证明,随着土壤盐度的提高,菌根侵染率越来越低,当土壤盐质量浓度提高至710mg/L时,菌根的侵染率降低到27.0%。本试验结果表明,在盐胁迫的条件下,降低了Gm和Gi对黄檗的侵染率,影响均未达到显著水平(p>0.05)。
逆境胁迫会扰乱植物体产生和清除活性氧的平衡,植物体内活性氧自由基累积,使膜中的酶蛋白发生交联并失活,损伤细胞膜的结构和功能。MDA质量摩尔浓度的变化是质膜损伤程度的重要标志之一[28-29]。贺学礼等[31]研究发现,接种摩西球囊霉或苏格兰球囊霉可降低棉花(Gossypiumherbaceum)体内的MDA质量摩尔浓度。盐胁迫下玉米菌根植株叶片MAD质量分数低于非菌根植株[32]。本研究结果表明,盐胁迫下MDA质量摩尔浓度显著高于对照处理,而接种AM真菌处理后,黄檗MDA质量摩尔浓度均显著低于不接种的处理(p<0.05)。
植物为缓解胁迫会诱导渗透调节物质(如可溶性蛋白和脯氨酸等)调节细胞内渗透压平衡[32]。脯氨酸可增强植株的渗透调节作用,保护抗氧化酶的活性,其含量可以反映植物遭受逆境胁迫的程度[33]。而AM真菌对宿主植物的脯氨酸质量分数影响的研究存在不同结果[30,34],水分胁迫下,接种AM真菌显著增加沙打旺(AstragalusadsurgensPall.)脯氨酸的质量分数[35],而对民勤绢蒿(Seriphidiumminchünense)研究发现接种株叶片脯氨酸质量分数低于未接种株[30]。本试验中,接种AM真菌的黄檗叶片脯氨酸质量分数均较未接种植株升高,可见菌根植株比非菌根植株通过增加叶片渗透调节物质的质量分数提高了盐胁迫的能力,AM真菌有效地减轻黄檗受胁迫的程度。可溶性蛋白可增强植物细胞的保水能力,提高植物抗旱性[36],接种AM真菌增加了可溶性蛋白质量分数,可见AM真菌增强了黄檗非酶促防御系统能力。
逆境胁迫使植物的光合作用和CO2同化受到抑制,增加植物体的活性氧和自由基数量。根据自由基伤害学说,SOD、CAT和POD是防御系统的主要保护酶,三者协调一致,使生物体内自由基维持在一个较低水平,以缓解自由基伤害[29]。从试验结果看,盐胁迫处理使SOD、CAT和POD活性升高。接种菌根黄檗植株的SOD、CAT和POD活性均高于未接种菌根的黄檗植株,可见AM真菌可调节宿主保护酶活性清除自由基的能力,以缓解胁迫对黄檗造成的伤害。盐胁迫下,CAT、POD活性在菌根和非菌根处理间差异不显著(p>0.05)。接种AM真菌后,菌根化黄檗植株可通过渗透调节物质积累和抗氧化酶活性的提高,降低体内膜脂过氧化产物的水平,缓解胁迫对黄檗植株的伤害,增强了黄檗对盐胁迫的耐受力。
[1] STRACK D, FESTER T, HAUSE B, et al. Arbuscular mycorrhiza: biological, chemical, and molecular aspects[J]. Journal Chemical Ecology,2003,29(9):1955-1979.
[2] SMITH S E, READ D J. Mycorrhizal Symbiosis[M]. 2nd edn. San Diego: Academic Press Inc,1997,164:233-289.
[3] RAMOS A C, MARTINS M A, OKOROKOVA-FAÇANHA A L, et al. Arbuscular mycorrhizal fungi induce differential activation of the plasma membrane and vacuolar H+ pumps in maize root[J]. Mycorrhiza,2009,19(2):69-80.
[4] ALLAKHVERDIEV S I, SAKAMOTO A, NISHIYAMA Y, et al. Ionic and osmotic effects of NaCL-induced inactivation of photosystems I and II inSynechococcussp[J]. Plant Physiol,2000,123(3):1047-1056.
[5] BRUNDRETT M C. Mycorrhizal associations and other means of nutrition of vascular plants: Understanding the global diversity of host plants by resolving conflicting information and developing reliable means of diagnosis[J]. Plant and Soi1,2009,320(1):37-77.
[6] DUNCAN D C. Arbuscular mycorrhizal fungi as (agro) ecosystem engineer[J]. Plant and Soi1,2010,333(1/2):1-5.
[7] 贺忠群,贺超兴,张志斌,等.丛枝菌根真菌提高植物耐盐性的作用机制[J].西北植物学报,2007,27(2):414-420.
[8] 冯固,白灯莎,杨茂秋,等.盐胁迫菌根形成及接种VAM真菌对植物耐盐性的效应[J].应用生态学报,1999,10(1):79-82.
[9] GUPTA R, KRISHNAMURTHY K V. Response of mycorrhizal and nonmycor rhizal arachis hypogaea to NaC’1 and acid stress[J]. Mycorrhiza,1996,6(2):145-149.
[10] DAEI G, ARDEKANI M, REJALI F, et al. Alleviation of salinity stress on wheat yield, yield components, and nutrient uptake using arbuscular mycorrhizal fungi under field conditions[J]. Plant Physio1,2009,166(6):617-625.
[11] 郭绍霞,陈丹明,刘润进.盐水胁追下接种AM真菌对牡丹幼苗抗氧化酶活性的影响[J].园艺学报,2010,37(11):1796-1802.
[12] 范继红,邹原东,郭秋生,等.AM真菌对黄檗幼苗的侵染特性比较[J].中国农学通报,2012,28(7):21-26.
[13] 接伟光,蔡柏岩.葛菁萍,等.黄檗丛枝菌根真菌鉴定[J].生物技术,2007,17(6):32-35.
[14] 蔡柏岩,葛菁萍,接伟光,等.黄檗根围丛枝菌根真菌菌群组成[J].菌物学报,2009,28(4):512-520.
[15] 范继红,邹原东,高琼.丛枝菌根对黄檗生长及NPK吸收的影响[J].安徽农业大学学报,2013,40(5):815-818.
[16] 范继红,杨国亭,穆立蔷,等.接种丛枝菌根菌对黄檗苗木主要3种生物碱含量的影响[J].防护林科技,2006(5):24-26.
[17] 李霞,阎秀峰,于涛.水分胁迫对黄檗幼苗保护酶活性及脂质过氧化作用的影响[J].应用生态学报,2005,16(12):2352-2356.
[18] 李霞,阎秀峰,于涛.滤光膜对黄檗幼苗生物量及初级氮同化酶活性的影响[J].应用生态学报,2006,17(11):2020-2023.
[19] 李霞,阎秀峰,刘剑锋.氮素形态对黄檗幼苗生长、氮代谢相关酶类的影响[J].植物学通报,2006,23(3):255-261.
[20] 李霞,于涛,阎秀峰.光强对黄檗幼苗生长及抗氧化酶活性的影响[J].东北林大学报学报,2007,35(1):25-27.
[21] TROUVELOT A, KOUGH J L, GIANINAZZI-PEARSON. Mesure du taux de mycorhization va d’un systeme radiculaire. Recherche de methodes d’estimation ayant une signification functionnelle. In: Physiological and genetic aspects of mycorrhizae. Gianinazzi-pearson v. And s. Gianinazzi[M]. Paris: Eds INRA Press,1986:217-221.
[22] GIANNOPOLITIS C N, RIES S K. Superoxide dismutases II. Purification and quantitative relationship with water-soluble protein in seedlings[J]. Plant Physiol,1977,59(2):315-318.
[23] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[24] EVCLIN H, KAPOOR R, UIRI B. Arbuscular mycorrhizal fungi in alleviation of salt stress: A review[J]. Annals of Botany,2009,104(7):1263-1280.
[25] PFEIFFER C M, BLOSS H E. Growth and nutrition of guayule (Purthvniw, argvntutum) in a saline soil as influenced by resicular-arbuscular mycorrhiza and phosphorus fertilization[J]. New Phytologist,1988,108:315-321.
[26] 姚艳玲,冯固,白灯沙,等.NaCI胁追下VA菌根对玉米耐盐能力的影响[J].新疆农业科学,1999(1):20-22.
[27] AL-KARAKI G N, HAMMAD R, RUSAN M. Response of two tomato cultivars differing in salt tolerance to inoculation with mycorrhizal fungi under salt stress[J]. Mycorrhiza,2001,11(1):43-47.
[28] 方允中,李文杰.自由基与酶[M].北京:科学出版社,1989:126-146.
[29] 陈少裕.膜脂过氧化与植物逆境胁迫[J].植物学通报,1989,6(4):211-217.
[30] 贺学礼,高露,赵丽莉.水分胁迫下丛枝菌根AM真菌对民勤绢篙生长与抗旱性的影响[J].生态学报,2011,31(4):1029-1037.
[31] 盛敏,唐明,张峰峰,等.盐胁迫下接种AM真菌对玉米耐盐性的影响[J].西北植物学报,2011,31(2):332-337.
[32] QU T, NAN Z B. Research progress on responses and mechanisms of crop and brass under drought stress[J]. Acta Prataculturae,2008,17(2):126-135.
[33] 陈敏,侯新村,范希峰,等.细叶芒苗期耐旱性分析[J].草业学报,2013,22(3):184-189.
[34] NISHI M, ANIL V. lnfluence of arbuscular mvcorrhizae on biomass production, nutrient uptake and physiological changes in Ziziphus mauritiarra Lam. under water stress[J]. Journal of Arid Environments,2000,45(3):191-195.
[35] 郭辉娟,贺学礼.水分胁迫下AM真菌对沙打旺生长和抗旱性的影响[J].生态学报,2010,30(21):5933-5 940.
[36] 赵金莉,贺学礼.AM真菌对油篙生长和抗旱性的影响[J].华北农学报,2007, 22(5):184-188.
Effects ofArbuscularmycorrhizalFungi on Salt Tolerance Ability ofPhellodendronamurense//
Zhao Jiang, Xu Jiajing, Li Xia
(Jilin Normal University, Siping 136000, P. R. China)//Journal of Northeast Forestry University,2016,44(11):74-77.
Arbuscularmycorrhizal;Phellodendronamurense; Salt stress
1)国家自然科学基金项目(30271045)。
赵匠,男,1959年3月生,吉林师范大学生命科学学院,教授。E-mail:zhaojiang0059@163.com。
2016年4月8日。
Q945.79
责任编辑:王广建。
