霍山石斛组培苗移栽驯化过程中叶抗氧化酶活性、超微结构及4种有效成分的变化1)
2016-12-19杨静方炎明周则刚王纪
杨静 方炎明 周则刚 王纪
(南方现代林业创新中心(南京林业大学),南京,210037) (南京审计大学) (南京晓庄学院)
霍山石斛组培苗移栽驯化过程中叶抗氧化酶活性、超微结构及4种有效成分的变化1)
杨静 方炎明 周则刚 王纪
(南方现代林业创新中心(南京林业大学),南京,210037) (南京审计大学) (南京晓庄学院)
通过对霍山石斛(Dendrobiumhuoshanense)组培苗在移栽驯化过程中(0、10、30、60 d)叶的抗氧化酶活性、细胞超微结构及有效成分积累等特征指标的变化研究,阐明了其移栽驯化过程中的适应性调节。结果表明:霍山石斛苗叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性在移栽前期均先降后升,移栽后60 d,POD的活性继续微升,SOD、CAT活性则微降;移栽前,叶细胞内含物不丰富,叶绿体长椭圆形,片层结构发育不完善,移栽后10 d,细胞结构显示有所损坏,叶绿体多变为短椭圆形,线粒体增多,后期,叶绿体形状趋于丰满且结构更加完善,基质片层和基粒片层逐渐完整清晰,淀粉粒、嗜锇颗粒增多,线粒体增多;叶片总蛋白、总氨基酸、多糖以及总生物碱质量分数在前期均累积不多,后期涨幅增大,总体呈上升趋势,移栽后60 d以上各质量分数分别比移栽前增长20.69%、25.93%、11.51%、44.44%。移栽后各项指标发生适应性变化,并且后期良性发展,从而也表明了移栽条件的合适设置。
霍山石斛;组培苗;移栽;抗氧化酶;有效成分;超微结构
To explore the adaptation ofDendrobiumhuoshanensetissue culture seedlings to field environment, we studied the changes in antioxidant enzymes activity, ultrastructure and some active components of leaves fromD.huoshanensetissue culture seedlings in the course of transplant acclimation, including 0, 10, 30 and 60 d after transplantation. The activities of SOD, POD and CAT were decreased in early stage then increased, and decreased gently after 60 d except for POD. Features for leaves cells of tissue culture seedlings were less containing, long oval chloroplasts with imperfect lamellar structure. Then after transplantation for 10 d, some cells became bad with more mitochondria and short oval chloroplasts. After 30 d, better chloroplasts together with more starch grains and osmiophilic granules were found. While leaves cells were characterized by richer contents, perfect chloroplasts with good lamellar structure and more mitochondria. Contents of protein, total amino acids, polysaccharide and total alkaloids all showed an upward trend generally, and after 60 d their growth rates were 20.69%, 25.93%, 11.51% and 44.44%, respectively, comparing with tube seedlings. Antioxidant enzymes activity, active components and ultrastructure of leaves changed adaptively and developed well, and the new environment were suitable.
霍山石斛(Dendrobiumhuoshanense),主产于安徽霍山,兰科(Orchidaceae)石斛属(Dendrobium),是药用石斛中的珍品,主要活性成分为多糖和生物碱等,具有滋阴、益胃、润肺止咳、增强免疫活性的优良品质[1]。而因其种子繁殖能力低,生长周期长,加之历史上的过度采挖利用以及原生境的破坏,野生资源濒临枯竭[2]。供需关系的严重失衡,推动霍山石斛人工培养技术的发展,而当前栽培主要采用组培苗脱瓶移栽的方式。
国内外专家学者在霍山石斛快繁、遗传育种等方面做了大量研究[3-10],但组培苗移栽成活率极低,规模化栽培依然是瓶颈问题,组培苗对移栽条件能否适应是关键[6,8-10]。本试验主要研究霍山石斛组培苗移栽过程中叶抗氧化酶活性、超微结构及所含多糖、生物碱等有效成分的变化,一方面通过叶的生长发育进一步在一定程度上反映植株对移栽环境的适应状况,以深入探讨组培苗移栽的生理基础;同时通过几种主要有效成分的质量分数变化,了解霍山石斛移栽苗叶的药用价值,探索石斛除茎以外的可入药部位,为充分开发、利用石斛药用资源提供可行的理论支撑。
1 材料与方法
霍山石斛组培苗取自南京林业大学植物组培室,先将完整植株与容器一起转移到半遮阴的自然环境中锻炼5 d,打开容器口喷洒少量自来水,保持2 d,之后进行移栽,移栽驯化基质主要为m(腐树皮)∶m(兰花石)=2∶1,湿度控制在65%左右,每隔1周喷1次600倍的多菌灵溶液。分别在移栽0(即移栽前)、10、30、60 d对植株叶片进行抗氧化酶活性、超微结构及4种有效成分的质量分数测定。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性测定:采集不同移栽时间植株顶端前两片叶,冰盒保存备用。称取叶片1.0 g,用pH值7.0的0.1 mol·L-1的磷酸缓冲液冰浴研磨,提取液经冷冻离心,上清液用于SOD、POD、CAT活性的测定,3个重复,参照张志良等[11]的方法。
叶片超微结构观察:选择植株顶端前3片叶,各切取中部长×宽约1 mm×3 mm的材料3片,去主脉,迅速放入4%戊二醛进行前固定,10 h后用pH值7.2的0.1 mol·L-1的磷酸缓冲液清洗3次,再用1%锇酸后固定,至样品黑透,pH值7.2的0.1 mol·L-1的磷酸缓冲液清洗3次,丙酮梯度脱水,Epon812包埋剂与纯丙酮按比例逐级渗透,然后进行包埋,聚合设置为35 ℃12 h—45 ℃12 h—60 ℃12 h,固化后的包埋块在美国RMC超薄切片机上进行切片(50 nm厚度),经醋酸双氧铀和柠檬酸铅染液双染色,使用日本电子JEM1400型透射电子显微镜观察并拍照保存。
蛋白质、氨基酸、多糖、总生物碱质量分数测定:取植株顶端前3片叶。蛋白质质量分数测定参照国标《食品中蛋白质的测定》(GB 5009.5-2010)[12],氨基酸质量分数测定参照国标《食品中氨基酸的测定》(GB/T 5009.124-2003)[13],多糖质量分数测定借鉴黄晓君等[14]的方法,总生物碱质量分数测定采用陈乃东等[15]的方法。
数据处理:利用Excel 2007和SPSS Statistics 18.0软件进行数据处理和方差分析。
2 结果与分析
2.1 移栽驯化过程中叶片抗氧化酶活性的变化
SOD、POD、CAT等构成生物体内重要的保护酶系统,是生物防御体系的关键酶,通常作为生物逆境反应机理研究的重要指标。霍山石斛试管苗随着移栽时间的延长叶片保护酶(SOD、POD、CAT)活性的变化趋势见表1。由表1中数据可知,叶片SOD、POD、CAT活性的变化较为一致,移栽后10d,均显示下降,表明移栽初期试管苗对环境的极度不适应,致使抗氧化酶系统受到破坏,细胞代谢受到影响,而在30d酶活性显著提高,防御系统启动,清除有害物质对细胞造成的伤害并及时修复受损细胞,到60d,SOD、CAT活性分别降低0.04%和12.94%,但仍高于移栽前水平,而POD活性则稍微上升,由18.80 U·g-1·min-1增至18.85 U·g-1·min-1。结合移栽苗的生长状况以及其他指标的变化来看,后期SOD、POD活性略微下降并非由叶抗氧化系统的损坏造成,反而表明移栽苗抗逆能力在增强,酶活性趋于稳定,已逐步适应了新的生活环境。
2.2 移栽驯化过程中叶片超微结构的变化
取样的植株生长状况如表2,整体显示出移栽前期,植株生长受到影响,叶面积变化不明显,叶出现失绿,但30 d后,叶生长得到改善,60 d后已基本适应并且生长受到促进,叶面积显著增大,叶色浓绿。叶细胞结构的变化在一定程度上能够体现植物生长发育的状况。移栽前的霍山石斛组培苗,叶色翠绿(表2),但叶肉细胞内容并不丰富,叶绿体、细胞核紧贴细胞壁排列,核仁清晰,叶绿体呈细长椭圆形,分布有少许淀粉粒和嗜锇颗粒,片层结构不明显(图1 A、B)。移栽10 d,由于对新环境的不适应,叶绿体多变为短椭圆形(图1 C、D),片层可见但数量很少,部分叶绿体受到破坏,结构变得不完整(图1 C,箭头所指),细胞内还出现一些黑色物质沉积,推测可能是叶绿体或者其他细胞器的降解物质(图1 D,箭头所指),叶绿体旁边开始明显出现线粒体(图1 D)。移栽30 d,叶绿体数目增多,形状趋于丰满,可见片层结构但不清晰,少数叶绿体膨胀成近圆形(图1 E、F),出现淀粉粒(图1 E),嗜锇颗粒明显增加(图1 F)。移栽60 d以后,叶肉细胞内容物明显丰富(图1 G、H),叶绿体结构更加完善,形态饱满,面向中央液泡的一面较为凸起,此变化利于细胞的气体交换,基质片层和基粒片层增多、排列趋向紧密(图1 G、H),线粒体结构清晰,数量增多,体积略微增大。叶肉细胞超微结构显示出细胞物质和能量代谢基础的逐渐增强。
2.3 移栽驯化过程中叶片4种有效成分质量分数的变化
中草药含有的具有一定生物活性、能代表其功效的化学成分通常称为有效成分。本试验对霍山石斛试管苗移栽过程中叶片有效成分如总蛋白、总氨基酸、多糖和总生物碱质量分数进行了测定,结果如表1。随着移栽时间的延长,叶片的总蛋白质量分数在逐渐增多,移栽10 d仅增加0.08 mg·g-1,后期增幅不断加大,移栽60 d的质量分数达到3.15 mg·g-1,比移栽前(0 d)增长20.69%;总氨基酸质量分数在移栽10 d时略微上涨,在30 d涨幅增大,比10d时增长8.51%,60 d显著增多,比移栽前增长25.93%,每个移栽阶段,叶片中均含较多的天冬氨酸(Asp),谷氨酸(Glu)、甘氨酸(Gly)、亮氨酸(Leu)和缬氨酸(Val),并且由表3可见,随着移栽时间的延长,5种主要氨基酸都总体呈现上升趋势,其中Asp、Glu增幅较大;多糖质量分数一直在平缓上涨,移栽60 d的质量分数是移栽前的1.12倍,增长11.51%;总生物碱前30 d缓慢增加,移栽60 d质量分数急剧上升, 是移栽30 d的1.30倍,比移栽驯化前增长44.44%。4种有效成分的质量分数均整体呈现上升趋势,前期由于对新环境的不适应而增长缓慢,后期普遍涨幅较大,首先说明了移栽苗顺利成活,其次表明对新环境的逐步适应,并已具备生产物质并有效积累的能力。
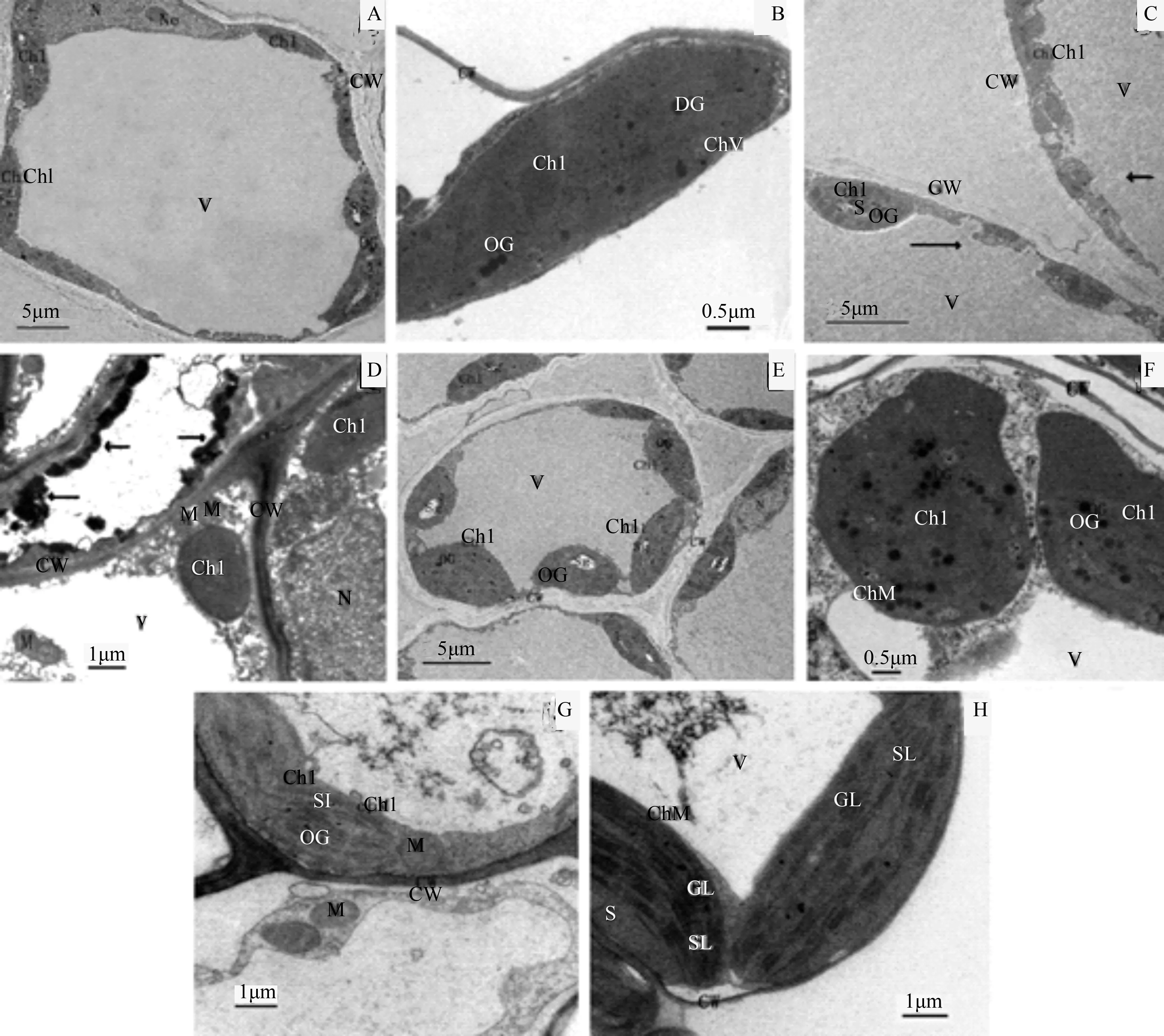
A、B.移栽0 d;C、D.移栽10 d;E、F.移栽30 d;G、H.移栽60 d;Chl.叶绿体;ChM.叶绿体质膜;CW.细胞壁;GL.基粒片层;M.线粒体;N.细胞核;Ne.核仁;OG嗜锇颗粒;Sg.淀粉粒;SL.基质片层;V.液泡。
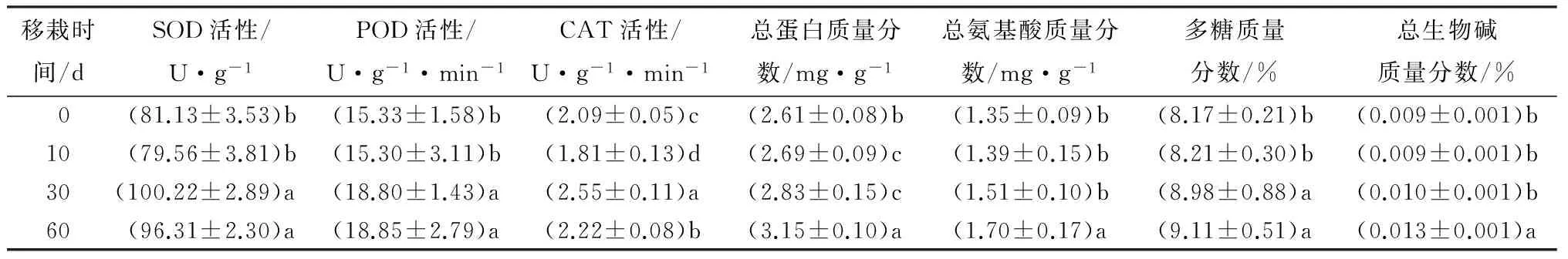
图1 霍山石斛组培苗移栽驯化过程中叶片超微结构的变化
注:表中数据均为平均值±标准误;同列不同字母表示差异显著(p<0.05)。

表2 霍山石斛移栽苗叶的生长状况
注:表中数据均为平均值±标准误;同列不同字母表示差异显著(p<0.05)。
3 结论与讨论
本试验将霍山石斛组培苗移栽后,叶片抗氧化酶活性呈现动态变化,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性先下降后显著提高,而移栽60 d时,SOD、CAT活性又略微降低。SOD、POD、CAT等抗氧化酶类具有维持活性氧自由基产生与清除系统的平衡,保护生物机体免受伤害,延缓细胞衰老等重要作用,其活性的变化能够反映出生物体对不良条件的适应与否。裴斌等[16]研究认为,水分胁迫程度相对较轻时,沙棘(Hippophaerhamnoides)叶片的SOD、POD 和CAT活性显著升高,自由基清除能力增强,从而起到保护光合机构的作用,但当严重胁迫时,抗氧化酶活性发生明显下降。何洁等[17]研究重金属对翅碱蓬(Salineseepweed)抗氧化酶系统的影响时也发现Zn质量分数<100 mg·kg-1时,植物体内SOD、POD、CAT 活性均升高,Zn质量分数≥200 mg·kg-1时,SOD、POD和CAT活性减弱。本试验中移栽前期,苗从养分、水分以及温、湿度均适宜的环境突然转入自然环境,体内活性氧产生与清除的平衡被打破,自由基在体内大量积累,造成膜脂过氧化作用加剧,抗氧化系统暂时遭到损坏。自由基积累过多,导致生物膜结构和功能破坏,损害细胞代谢,进而降低植物叶片的光合能力[18],所以移栽前期,叶相应表现出发育不良,随着植株对新环境的逐步适应,抗氧化系统活性提高,在抵抗氧化胁迫和消除自由基损伤时开始有效地发挥作用,保证了细胞代谢的正常进行,长势渐好。移栽60 d,叶SOD、CAT活性出现少许下降,结合植株当时以及后续的生长状况,推测是移栽苗对新环境的适应性应答,而并非由于抗氧化系统遭到破坏所致。

表3 移栽过程中叶中5种主要氨基酸的质量分数变化
注:表中数据均为平均值±标准误;同列不同字母表示差异显著(p<0.05)。
叶是植物生长发育和产量形成的基础。本试验发现,随着霍山石斛组培苗移栽驯化时间的延长,叶的生长发育状况日趋理想,叶细胞结构由破坏严重至逐步恢复,并且叶绿体逐渐发育完善,面向液泡排列,形态丰满,嗜锇颗粒增多。文献报道植株对周围环境因子的变化响应也会明显体现在细胞超微结构上[19],叶绿体是植物进行光合的重要场所,其结构的变化会直接影响叶的光合功能[20],当叶绿体具备了完整的片层结构,能够保证最大的光合作用面积,使光反应及有关光合作用电子传递高效进行[21-22],并且叶绿体由紧靠细胞壁、一面凸起的狭长型变为面向中央液泡、一面凸起的丰满型,这种变化有利于与外界进行有效的气体交换[23],濮晓珍等[24]在研究铁皮石斛移栽驯化时也有类似的发现。同时报道认为嗜锇小体的产生可提高细胞质浓度、降低渗透势、保证水分和无机盐类营养的吸收[25]。所以移栽后期叶面积明显增大,叶色浓绿,长势较好。叶细胞超微结构的系列变化与叶的表观生长相呼应,由此可见,二者相结合一定程度上可反映植株对新环境的响应情况。
中草药的有效成分主要包括蛋白质、氨基酸、多糖、生物碱、微量元素、菲类化合物等。本试验对霍山石斛移栽苗叶中一些有效成分,如总蛋白、总氨基酸、多糖、总生物碱质量分数进行跟踪测定,结果表明,移栽后期由于植株对新环境的适应,各种代谢恢复正常甚至受到促进,叶片逐渐积累较多物质,并且发现含有的氨基酸主要为天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、亮氨酸(Leu)和缬氨酸(Val),而铁皮石斛也主要含有这5种氨基酸[26],因此,它们与石斛药效价值的关系值得深入探讨。植物多糖和生物碱因在抗肿瘤、提高机体免疫、抗衰老、抗辐射等方面的显著疗效而日益受到关注[27-29],研究认为,多糖和生物碱是石斛主要的活性成分,这两大功能化合物关系着石斛的品质和药效[28,30-32],并且含有生物碱种类丰富,如石斛碱、石斛次碱、石斛胺等,其各部位分布规律由大到小的顺序为叶、成熟茎≈根[33]。结合本试验对霍山石斛叶内4种有效成分的测得数据,推测叶的药用价值或许值得开发,如若得到利用将能缓解霍山石斛供需严重不平衡的局面。
通过对霍山石斛叶的抗氧化酶活性、超微结构以及4种有效成分积累的变化研究,发现设置的移栽条件不仅能够保证组培苗的顺利成活并且对其生长发育有着良好的促进作用。希望结合笔者系列研究的其他成果,能为霍山石斛组培苗的规模化栽培及全株药用价值研究提供有效的科学参考。
[1] NG T B, LIU J, WONG J H, et al. Review of research onDendrobium, a prized folk medicine[J]. Applied Microbiology and Biotechnology,2012,93(5):1795-1803.
[2] 李玲,贾书华,金青,等.光对霍山石斛试管苗光合特性、生长及有效成分积累的影响[J].植物生理学报,2014,50(7):989-994.
[3] WEI M, JIANG S T, LUO J P. Enhancement of growth and polysaccharide production in suspension cultures of protocorm-like bodies fromDendrobiumhuoshanenseby the addition of putrescine[J]. Biotechnology Letters,2007,29(3):495-499.
[4] 任杰,王军,丁增成,等.霍山石斛生产质量管理规范研究[J].农学学报,2014,4(6):72-76.
[5] WANG Y, LUO J P, WEI Z J, et al. Molecular cloning and expression analysis of a cytokinin oxidase (DhCKX) gene inDendrobiumhuoshanense[J]. Molecular Biology Reports,2009,36(6):1331-1338.
[6] 童晨曦,齐蕾.霍山石斛的研究进展及可持续发展[J].医学综述,2015,21(24):4512-4514.
[7] 陈存武,戴军,姚厚军,等.霍山石斛资源与鉴定研究进展[J].现代中药研究与实践,2013,27(3):84-87.
[8] FAN H H, LI T C, GUAN L, et al. Effects of exogenous nitric oxide on antioxidation and DNA methylation ofDendrobiumhuoshanensegrown under drought stress[J]. Plant Cell, Tissue and Organ Culture,2012,109(2):307-314.
[9] LEE P L, CHEN J T. Plant regeneration via callus culture and subsequent in vitro flowering ofDendrobiumhuoshanense[J]. Acta Physiologiae Plantarum,2014,36(10):2619-2625.
[10] 杨静,方炎明,陈乃富.霍山石斛组培苗移栽后微观结构与微区元素的变化研究[J].西北植物学报,2015,35(2):486-492.
[11] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003.
[12] 中华人民共和国卫生部.食品中蛋白质的测定:GB 5009.5-2010.[S].北京:中国标准出版社,2010.
[13] 中华人民共和国卫生部.食品中氨基酸的测定:GB/T 5009.124-2003.[J].北京:中国标准出版社,2004.
[14] 黄晓君,聂少平,王玉婷,等.铁皮石斛多糖提取工艺优化及其成分分析[J].食品科学,2013,34(22):21-26.
[15] 陈乃东,高峰,林欣,等.不同种源霍山石斛生物碱比较研究[J].中药材,2014,37(6):953-956.
[16] 裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396.
[17] 何洁,高钰婷,贺鑫,等.重金属Zn和Cd对翅碱蓬生长及抗氧化酶系统的影响[J].环境科学学报,2013,33(1):312-320.
[18] SOHRABI Y, HEIDARI G, WEISANY W, et al. Changes of antioxidative enzymes, lipid peroxidation and chlorophyll content in chickpea types colonized by different Glomus species under drought stress[J]. Symbiosis,2012,56(1):5-18.
[19] 孟力力,张俊,闻婧.干旱胁迫对彩叶草光合特性及叶片超微结构的影响[J].江苏农业学报,2015,31(1):180-185.
[20] JIANG H M, YANG J C, ZHANG J F. Effects of external phosphorus on the cell ultrastructure and the chlorophyll content of maize under cadmium and zinc stress[J]. Environmental Pollution,2007,147(3):750-756.
[21] 陈明辉,谢晓娜,王盛,等.宿根矮化病菌对甘蔗品质及茎、叶超微结构的影响[J].植物病理学报,2014,44(4):379-386.
[22] SIMOVA-STOILOVA L, VASEVA I, GRIGOROVA B, et al. Proteolytic activity and cysteine protease expression in wheat leaves under severe soil drought and recovery[J]. Plant Physiology and Biochemistry,2010,48(2):200-206.
[23] DU K B, XU L, TU B K, et al. Influences of soil flooding on ultrastructure and photosynthetic capacity of leaves of one-year old seedlings of two poplar clones[J]. Scientia Silvae Sinicae,2010,46(6):58-64.
[24] 濮晓珍,尹春英,周晓波,等.铁皮石斛组培苗移栽驯化过程中叶片光合特性、超微结构及根系活力的变化[J].生态学报,2012,32(13):4114-4122.
[25] 韦存虚,王建军,王建波,等.Na2CO3胁迫对星星草叶肉细胞超微结构的影响[J].生态学报,2006,26(1):108-114.
[26] 黄民权,阮金月.铁皮石斛氨基酸组分分析[J].中药材,1997,20(1):32-33.
[27] 吴胡琦,罗建平.霍山石斛的研究进展[J].时珍国医国药,2010,21(1):208-211.
[28] 查学强,王军辉,潘利华,等.石斛多糖体外抗氧化活性的研究[J].食品科学,2007,28(10):90-92.
[29] 陈乃东,李俊,金晖,等.HPLC-UV-CL联用研究霍山石斛生物碱清除自由基活性[J].食品工业科技,2015,36(7):276-280.
[30] 陈晓梅,郭顺星.石斛属植物的化学成分与药理作用的研究进展[J].天然产物研究与开发,2001,13(1):70-75.
[31] 张丹丹,黄森,查学强,等.霍山石斛多糖对人胃癌细胞生长的抑制作用[J].食品与生物技术学报,2014,33(5):542-547.
[32] 田长城,罗建平.霍山石斛不同多糖组分的保肝活性[J].食品科学,2015,36(7):162-166.
[33] 丁亚平,杨道麒,吴庆生,等.安徽霍山三种石斛总生物碱的测定及其分布规律研究[J].安徽农业大学学报,1994,21(4):503-506.
Changes in Antioxidant Enzymes Activity, Ultrastructure and Four Kinds of Active Components of Leaves fromDendrobiumhuoshanenseTissue Culture Seedlings during Transplantation//
Yang Jing, Fang Yanming; Zhou Zegang
(Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, P. R. China)(Nanjing Audit University); Wang Ji(Nanjing Xiaozhuang University)//Journal of Northeast Forestry University,2016,44(11):69-73.
Dendrobiumhuoshanense; Transplantation; Tissue culture seedlings; Antioxidant enzymes; Active components; Ultrastructure
1)江苏省林业三新工程项目(lysx[2013]07)、国家自然科学基金(31200233)。
杨静,女,1980年8月生,南方现代林业创新中心(南京林业大学)、南京林业大学生物与环境学院、南京林业大学现代分析测试中心,博士研究生。E-mail:yjnjfu@126.com。
方炎明,南方现代林业创新中心(南京林业大学)、南京林业大学生物与环境学院,教授 。E-mail:jwu4@njfu.com.cn。
2016年3月2日。
Q945.51
责任编辑:任 俐。
