miR-31在结直肠癌患者血清中的表达及对结肠癌HCT116细胞增殖及凋亡的影响
2016-12-15王园园张丽静韩晓东翟丛劼杜志坚赵增仁
王园园,张丽静,韩晓东,翟丛劼,杜志坚,张 军,赵增仁
河北医科大学第一医院普外科,河北 石家庄 050031
miR-31在结直肠癌患者血清中的表达及对结肠癌HCT116细胞增殖及凋亡的影响
王园园,张丽静,韩晓东,翟丛劼,杜志坚,张军,赵增仁
河北医科大学第一医院普外科,河北 石家庄 050031
背景与目的:microRNA与肿瘤关系密切,血清miRNAs可以作为筛选和监测结直肠癌的有效指标。该研究旨在检测结直肠癌患者血清中miR-31的表达水平,并分析miR-31对结肠癌细胞增殖、凋亡及细胞周期的影响。方法:收集40例结直肠癌患者和35例健康人群作为对照,采用实时荧光定量聚合酶链反应(realtime fluorescent quantitative polymerase chain reaction,RTFQ-PCR),检测其血清miR-31的表达水平,并分析结直肠癌患者血清miR-31的表达水平与临床病理特征之间的关系。采用脂质体转染将miR-31模拟物(miR-31 mimics)和抑制剂(miR-31 inhibitor)转染到HCT116细胞,采用CCK-8法检测细胞增殖,流式细胞术检测细胞凋亡及周期改变。结果:结直肠癌患者血清中miR-31的表达显著高于健康对照组,miR-31表达与结直肠癌分化程度有关。转染miR-31mimics组HCT116细胞生长增快,而转染miR-31抑制剂后细胞增殖能力明显降低(P<0.01);同时miR-31mimics组细胞凋亡所占比例较miR-31抑制剂组和阴性对照组(miR-control,NC)明显减少,尤其是晚期凋亡细胞减少为著;转染miR-31抑制剂组,G1期细胞较miR-31 mimics组和NC组明显增多。结论:miR-31在结直肠癌患者血清中表达显著上调,miR-31可能通过促进结肠癌细胞增殖、抑制细胞凋亡而参与了结直肠癌的发展进程,有望成为结直肠癌诊断的标志物。
大肠癌;microRNA-31(miR-31);血清;细胞增殖;凋亡
结直肠癌是消化道最常见的恶性肿瘤之一,早期可以通过手术取得很好的疗效。由于大多数患者早期缺乏特异性症状和体征,患者就诊时多数已处于中晚期。因此,临床迫切需要寻找有效的方法在早期发现肿瘤。血浆miRNA作为一种非侵入性的肿瘤诊断和预后评价的标志物正显示出良好的应用前景。本研究的前期研究结果显示,通过miRNA芯片技术能发现在结直肠癌组织中miR-31的表达明显上调。本研究旨在探讨血清 miR-31的表达并分析miR-31对结肠癌细胞增殖及凋亡的影响。
1 资料和方法
1.1研究对象
收集河北医科大学附属第一医院普外科2011年1月—2012年6月原发性结直肠癌手术患者40例(经术后病理切片证实)的临床资料,术前均未接受过放化疗和生物治疗。其中男性25例,女性15例,平均年龄64.2岁。同时收集35例同期年龄匹配的健康体检人群的外周血,且证实无肿瘤病史,其中男性19例,女性16例;年龄37~78岁,平均年龄63.4岁。结直肠癌患者和健康查体人群的年龄和性别匹配(P>0.05)。所有样本的采集均获得参与者本人的知情同意,本研究获得河北医科大学第一医院伦理委员会的批准。
1.2主要试剂
McCoys 5A培养液、胎牛血清购自美国Gibco公司。TRIzol LS、脂质体转染试剂LipofectamineTM2000购自美国Invitrogen公司,miRNeasy迷你试剂盒购自美国Qiagen公司,Allin-One™miRNA qRT-PCR检测试剂盒、miR-31及内参U6的引物均购自广州复能基因有限公司。miR-31mimics、抑制剂及miR-对照购自广州市锐博生物技术有限公司。细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂购自同仁化学研究所;细胞凋亡检测试剂盒(AnnexinⅤ-FITC)购自深圳欣博盛生物科技有限公司。
1.3实验方法
1.3.1RNA 的提取
200 μL低温冷藏的血清,置于冰上融化,且充分混匀。加入3倍体积的TRIzol LS到样本中,在震荡器上充分混匀,室温放置5~15 min进行变性处理(为了控制提取过程中样本间的差异,在变性处理之后加入内参)。按等体积加入氯仿,震荡器上充分混匀,室温放置15 min,在4 ℃条件下,12 000×g离心15 min 抽提RNA。将上层水相迅速转移到新管中,加入1.5倍体积的无水乙醇,两者充分混匀。按照miRNeasy迷你试剂盒的操作手册用吸附柱进行RNA的富集。
1.3.2实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测血清miR-31的表达水平
取总RNA 0.5 μg进行逆转录反应,反应条件:37 ℃×60 min,85 ℃×5 min。取反转录产物cDNA 2 μL进行RTFQ-PCR反应。RTFQ-PCR按照All-in-One™miRNA qRT-PCR检测试剂盒说明书操作,反应条件:95 ℃预变性10 min,然后按95 ℃×10 s,60 ℃×30 s,72 ℃×10 s,进行40个循环。反应体系及试剂用量均严格按照说明书进行。记录每个标本的Ct值,miR-31的相对表达量用2-△CT法计算。其中ΔCt=CtmiR-31-CtU6。
1.3.3细胞培养及转染
细胞培养:人结肠癌HCT116细胞用含10%胎牛血清的McCoys 5A培养液于37 ℃、CO2体积分数为5%的细胞培养箱中培养。根据细胞生长状况每2~3 d更换新鲜培养液1次。当细胞融合率为70%~80%时,用胰蛋白酶消化并进行细胞传代或收集细胞。
细胞转染:收集处于对数生长期的HCT116细胞,重悬后接种于24孔板。然后采用LipofectamineTM2000将miR-31 mimics、抑制剂及miR-control转染到HCT116细胞中。转染后6 h,更换无血清培养液为新鲜完全培养液,继续培养并进行后续实验。
1.3.4CCK-8法检测不同转染组细胞的增殖能力
将不同转染组(miR-31mimics组、抑制剂组及miR-对照组)HCT116细胞于转染后24 h消化细胞,接种于96孔板,按照CCK-8说明书分别于接种96孔板后第1、2、3和4 天向每孔加入10 μL CCK-8溶液,在培养箱中继续培养1 h,用酶标仪测定在450 nm处的吸光度(D450nm)。以时间为横坐标,D450nm为纵坐标绘制细胞生长曲线。每组设4个复孔,实验重复3次。
1.3.5流式细胞术检测不同转染组细胞的凋亡
收集转染48 h后各转染组细胞,用预冷PBS液充分洗涤细胞2次。按照Annexin Ⅴ-FITC试剂盒提供的说明书进行溶液的配制,以250 μL结合缓冲液重悬细胞并使其浓度至2×105个/mL~5×105个/mL,取195 μL的细胞悬液加入5 μL Annexin Ⅴ-FITC,轻轻混匀,间隔3 min后再加入10 μL浓度为20 μg/mL的碘化丙啶溶液,混匀后于室温下避光温育10 min,加入300 μL结合缓冲液,轻轻混匀后上流式细胞仪(BD Calibur,BD biosciences)进行检测分析。
1.4统计学处理
采用SPSS 17.0 统计软件进行统计学分析。计量数据以x±s 表示,组间比较采用t检验,多组数据之间的差异采用单因素方差分析;大肠癌临床病理特征与miR-31表达水平(-ΔCt)之间的关系分析采用独立样本t检验或方差分析。P<0.05为差异有统计学意义。
2 结果
2.1结直肠癌患者血清miR-31的表达
本研究收集了40例结直肠癌患者术前血清标本,同时收集了35例健康人群(其性别、年龄构成与结直肠癌患者差异无统计学意义)的血清标本进行miR-31检测。结果发现,结直肠癌患者血清miR-31的表达显著增加,结直肠癌患者血清miR-31的相对表达量中位数为0.005 87,健康人群miR-31相对表达量中位数为0.000 37,结直肠癌患者血清miR-31表达明显高于正常健康人群,差异有统计学意义(P<0. 001,图1)。

图1 结直肠癌和健康对照组血清miR-31的表达Fig. 1 Expression of serum miR-31 in colorectal cancer and the healthy control
2.2血清miR-31表达水平与结直肠癌患者临床病理特征之间的关系
血清miR-31表达和结直肠癌临床病理特征间的关系见表1。miR-31在不同临床分期,其表达水平不同。随着病情进展,血清miR-31有增高趋势,Ⅲ期miR-31的表达较Ⅰ期和Ⅱ期增高,但是差异无统计学意义(P>0.05)。在低分化结直肠癌中血清miR-31表达水平较高分化腺癌增高约2倍,差异有统计学意义(P<0.05,表1)。
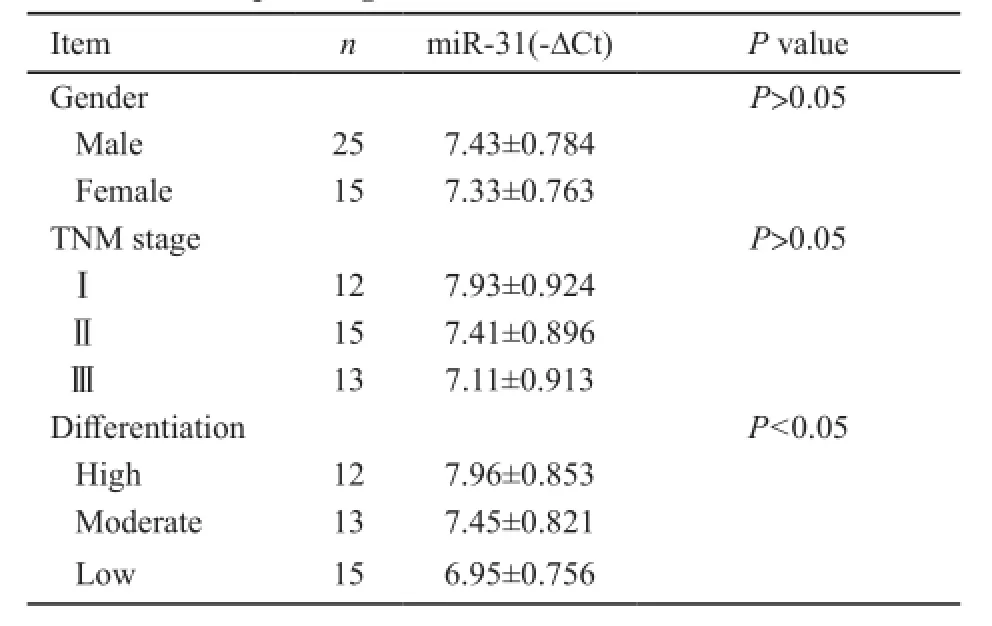
表1 结直肠癌患者血清miR-31与临床病理指标关系Tab. 1 Relationship between the expression of serum miR-31 and clinicopathological features of colorectal carcinoma
2.3miR-31对结肠癌HCT116细胞增殖活性的影响
使用CCK-8检测不同组别HCT116细胞在不同时间点的细胞生长情况。结果发现,转染miR-31mimics组与miR对照组相比,细胞生长活力增加,而转染miR-31抑制剂组细胞生长活力显著降低(P<0.01,图2)。
2.4miR-31对结肠癌HCT116细胞凋亡的影响
本研究采用流式细胞术检测不同组别HCT116细胞凋亡情况。结果显示,miR-31mimics组HCT116细胞的早期凋亡细胞所占比例为(1.80±0.73)%,晚期凋亡细胞为(6.01±0.61)%,活细胞数为(91.72±1.26)%;miR-31抑制剂组早期凋亡细胞为(3.31±0.38)%,晚期凋亡细胞所占比例为(14.19±2.72)%,活细胞数为(77.92±1.94)%;miR对照组早期凋亡细胞为(3.69±0.12)%,晚期凋亡细胞所占比例为(15.25±2.62)%,活细胞数为(75.06±1.88)%。3组之间早期凋亡细胞差异无统计学意义(P>0.05),而晚期凋亡细胞差异无统计学意义(P>0.05)。miR-31mimics组晚期凋亡细胞较miR-31抑制剂组及miR对照组明显减少,而miR-31抑制剂组和miR对照组相比差异无统计学意义(P>0.05,图3)。
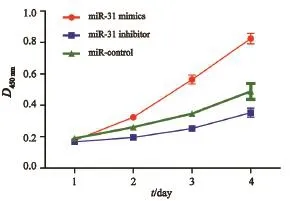
图2 miR-31 对细胞增殖的影响Fig. 2 Effects of miR-31 on cell proliferation
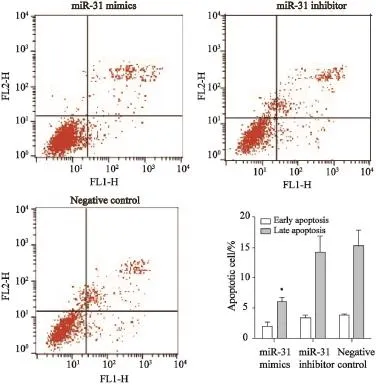
图3 miR-31对细胞凋亡的影响Fig. 3 Effects of miR-31 on cell apoptosis The miR-31 mimics compared with miR-31 inhibitor, P<0.05; The miR-31 mimics compared with negative control, P<0.05
2.5miR-31对结肠癌HCT116细胞周期的影响
采用流式细胞术检测不同组别HCT116细胞周期分布情况。结果显示,miR-31抑制剂组G1期细胞较miR-31 mimics和miR对照组细胞明显增多,S期细胞明显减少(P<0.05,图4)。
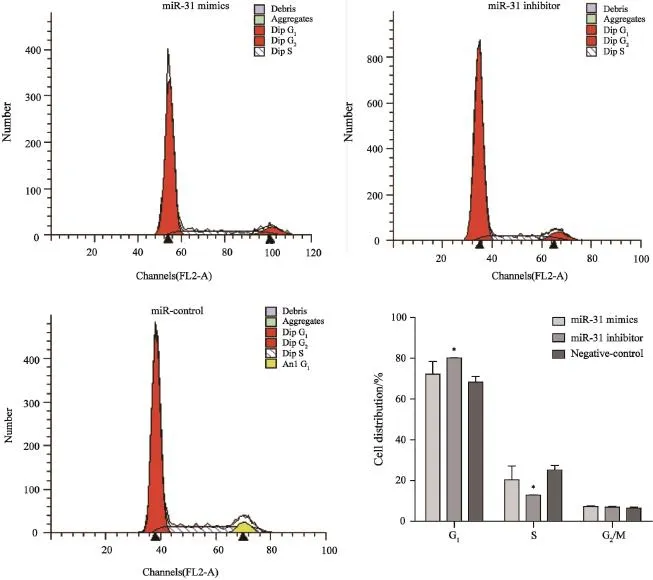
图 4 miR-31对细胞周期的影响Fig. 4 Effects of miR-31 on cell cycle distribution The miR-31 mimics compared with miR-31 inhibitor, P<0.05; miR-31 inhibitor compared with negative control, P<0.05
3 讨论
microRNA(miRNA)是一类长18~22 nt的单链非编码RNA,通过特异性识别并结合靶mRNA的3’-UTR区,促进靶mRNA降解和(或)阻碍翻译过程而发挥作用[1]。越来越多的证据表明,miRNA参与多种肿瘤发生、发展的多个环节,如结直肠癌中miR-139-5p低表达,且与肿瘤细胞增殖、浸润与转移有关[2]。本课题组前期采用miRNA芯片筛选发现,miR-31在结直肠癌组织中表达增加[3],提示miR-31可能与结直肠癌的发生、发展有关。
人miR-31首先在HeLa细胞中被发现,研究证实,miR-31在多种恶性肿瘤中表达异常且存在组织差异性。有研究表明,其可以作为癌基因(oncomiR),如miR-31通过调控LATS2和PPP2R2A导致肺癌细胞生长加快[4];miR-31可以通过阻抗或抑制缺氧诱导因子增加头颈鳞癌细胞的进展[5];在结直肠癌,miR-31通过激活RAS信号通路,通过抑制RASA1翻译,增加结肠癌细胞生长,促进肿瘤生成[6]。相反,miR-31也可作为肿瘤抑制因子,如miR-31表达和乳腺癌的转移呈负相关,miR-31通过介导的ITGA5、RDX和RhoA抑制乳腺癌转移[7]。miR-31通过调控细胞周期关键蛋白如E2F1、E2F2、FOXM1和MCM2等破坏细胞稳态,导致前列腺癌的发生、发展[8]。另外有学者研究发现,miR-31作为一个肿瘤抑制因子,通过直接调控HDAC2和CDK2表达抑制肝癌细胞生长和转移[9]。
miR-31在结直肠癌中高表达,且能促进肿瘤生长提示miR-31可能是一种肿瘤标志物。许多研究表明,肿瘤患者血液中可检测到miRNA异常表达[10-11]。食管鳞癌患者血清miR-31的表达较正常对照组明显增高,且高表达miR-31者,无瘤生存期和总生存期均缩短[12]。另有学者检测了结直肠癌患者血清中包括miR-31在内的6个miRNA(包括miR-21、let-7g、miR-31、miR-92a、miR-181b和miR-203)的表达,证实在结直肠患者和正常对照组有显著差异,且其表达和结直肠癌的进展有关,而且同时检测这6种miRNA可以很好的区分结直肠癌患者和非患者,其灵敏度和特异度分别高达90%和92.3%[13]。
本实验结果发现,结直肠癌患者血清miR-31表达明显高于正常健康人群,并且在低分化腺癌中的表达水平高于高分化腺癌,提示miR-31可能参与了结直肠癌的进展过程。另外本研究发现,随着肿瘤分期升级,血清miR-31的表达有增高的趋势,差异无统计学意义,分析其原因可能与我们纳入研究的样本量太少有关。
同时,本研究将人工合成的miR-31mimics和抑制剂转染人结肠癌HCT116细胞,体外细胞实验初步研究了miR-31的功能。结果证实,miR-31过表达组细胞生长明显增快,且细胞凋亡减少;抑制miR-31表达可以降低细胞活力,同时可以诱导细胞凋亡增加,导致细胞周期阻滞。细胞生长和侵袭是肿瘤细胞的重要特征,抑制细胞生长可以有效阻止肿瘤进展。
本实验不足之处是需要加大研究的样本量,同时可以联合其他miRNA检测,分析其联合表达与结直肠癌临床病理资料间的关系,同时分析其用于结直肠癌诊断的灵敏性和特异性,以将其用于临床,对结直肠癌患者的早期、无创诊断提供更好的参考价值。
[1] ROSENFELD N, AHARONOV R, MEIRI E, et al. MicroRNAs accurately identify cancer tissue origin[J]. Nat Biotechnol, 2008, 26(4): 462-469.
[2] ZHANG L, DONG Y, ZHU N, et al. microRNA-139-5p exerts tumor suppressor function by targeting NOTCH1 in colorectal cancer[J]. Mol Cancer, 2014, 13 (5): 124-135.
[3] 张丽静, 赵增仁, 张志勇, 等. 直肠腺癌组织中microRNA差异表达谱分析[J]. 肿瘤防治研究, 2014, 41(6): 602-605.
[4] LIU X, SEMPERE L F, OUYANG H, et al. MicroRNA-31 functions as an oncogenic microRNA in mouse and human lung cancer cells by repressing specific tumor suppressors[J]. J Clin Invest, 2010, 120(4): 1298-1309.
[5] LIU C J, TSAI M M, HUNG P S, et al. miR-31 ablates expression of the HIF regulatory factor FIH to activate the HIF pathway in head and neck carcinoma[J]. Cancer Res, 2010, 70(4): 1635-1644.
[6] SUN D, YU F, MA Y, et al. MicroRNA-31 activates the RAS pathway and functions as an oncogenic MicroRNA in human colorectal cancer by repressing RAS p21 GTPase activating protein 1 (RASA1) [J]. J Biol Chem, 2013, 288(13): 9508-9518.
[7] VALASTYAN S, REINHARDT F, BENAICH N, et al. A pleiotropically acting microRNA, miR-31, inhibits breast cancer metastasis[J]. Cell, 2009, 137(6): 1032-1046.
[8] LIN P C, CHIU Y L, BANERJEE S, et al. Epigenetic repression of miR-31 disrupts androgen receptor homeostasis and contributes to prostate cancer progression[J]. Cancer Res, 2013, 73(3): 1232-1244.
[9] KIM H S, LEE K S, BAE H J, et al. MicroRNA-31 functions as a tumor suppressor by regulating cell cycle and epithelialmesenchymal transition regulatory proteins in liver cancer[J]. Oncotarget, 2015, 6(10): 8089-8102.
[10] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10): 997-1006.
[11] ZENG R C, ZHANG W, YAN X Q, et al. Down-regulation of miRNA-30a in human plasma is a novel marker for breast cancer[J]. Med Oncol, 2013, 30(1): 477-484.
[12] ZHANG T, WANG Q, ZHAO D, et al. The oncogenetic role of microRNA-31 as a potential biomarker in oesophageal squamous cell carcinoma[J]. Clin Sci (Lond), 2011, 121(10): 437-447.
[13] WANG J, HUANG S K, ZHAO M, et al. Identification of a circulating microRNA signature for colorectal cancer detection[J]. PLoS One, 2014, 9(4): 87451-87459.
Expression of serum miR-31 in colorectal cancer patients and its effect on cell proliferation and apoptosis
WANG Yuanyuan, ZHANG Lijing, HAN Xiaodong, ZHAI Congjie, DU Zhijian, ZHANG Jun,ZHAO Zengren
(Department of General Surgery, First Hospital of Hebei Medical University, Shijiazhuang 050031, Hebei Province, China)
Correspondence to: ZHAO Zengren E-mail: zzr-doctor@163.com
Background and purpose: miRNA plays important roles in tumorigenesis. It has been reported that many kinds of serum miRNA serve as markers for tumor diagnosis and screening. This study aimed to detect the expression of serum miRNA-31 (miR-31) in colorectal cancer patients and to explore the effect of miR-31 on cell proliferation, apoptosis and cell cycle distribution. Methods: The expressions of miR-31 in 40 cases of colorectal cancer serum and 35 cases of the healthy control were examined by real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR). The correlation between miR-31 expression and clinicopathological features of colorectal cancer (including age, gender, depth of infiltration, lymph node metastasis, clinical stage) were further analyzed. The miR-31 mimics, inhibitor and miR-control (negative control) were transfected into HCT116 cells. The effect of miR-31 on cell proliferation was evaluated by CCK-8 method. Flow cytometry was used to examine the change of cell apoptosis and cell cycle. Results: Relative expression of serum miR-31 was significantly increased in cancer patients compared with healthy controls (P<0.01). Expression of serum miR-31 was higher in poorly differentiated carcinoma than that in well or moderately differentiated carcinoma (P<0.05). No correlation was found between serum miR-31 expression and otherclinicopathological variables. CCK-8 assay showed that after transfection with miR-31 mimics, the cell proliferation was increased, compared with miR-31 inhibitor and negative control group. Meantime, the apoptotic cell number was significantly decreased, particularly in late apoptosis. The cell number of G1stage was remarkably increased in miR-31 inhibitor group, compared with miR-31mimics and negative control group. Conclusion: The expression of serum miR-31 is higher in colorectal cancer. miR-31 can promote cell proliferation and inhibit the apoptosis of HCT116 cells. It might be a potential biomarker for colorectal cancer.
Colorectal cancer; miRNA-31(miR-31); Serum; Cell proliferation; Apoptosis
10.19401/j.cnki.1007-3639.2016.11.002
R735.3
A
1007-3639(2016)11-0888-06
国家自然科学基金项目(81072034);河北省卫生厅项目(20110284)。
赵增仁E-mail:zzr-doctor@163.com
(2015-07-30
2016-01-15)
