人胃癌SGC-7901/TCF7L2细胞株的建立及其生物学特性观察
2016-12-14付翠群沈国栋胡世莲
付翠群,沈国栋,沈 干,胡世莲
人胃癌SGC-7901/TCF7L2细胞株的建立及其生物学特性观察
付翠群1,2,沈国栋1,2,沈 干1,2,胡世莲1,2
目的 建立人胃癌SGC-7901/TCF7L2细胞株,观察其生物学特性。方法 使用质粒稳定转染技术,获得高表达TCF7L2蛋白的胃癌细胞株SGC-7901/TCF7L2及其空转对照组SGC-7901细胞株(SGC-7901/CON)。采用qRT-PCR和Western blot法分别检测SGC-7901/TCF7L2和SGC-7901/CON两细胞株中的TCF7L2 mRNA和蛋白表达水平;光学显微镜下观察并比较两种细胞株的细胞形态;划痕实验比较两者的迁移能力;用细胞计数法分别检测两者对顺铂和卡铂的耐药情况;裸鼠体内荷瘤实验比较两者在体内成瘤的能力。结果 经稳定转染技术成功建立稳定的SGC-7901/TCF7L2细胞株,其TCF7L2的mRNA和蛋白表达量均较SGC-7901/CON细胞株明显升高;光镜下SGC-7901/TCF7L2细胞形态较对照细胞形态多样,伪足增多,体积增大,胞质内颗粒物质增多;迁移能力和对铂类的耐受性较对照细胞明显增强;SGC-7901/TCF7L2细胞在小鼠体内的成瘤能力也明显增强。结论 TCF7L2可以增强人胃癌细胞株SGC-7901的恶性生物学特性,SGC-7901/TCF7L2细胞株的建立为胃癌发生发展机制研究及其靶向药物开发提供基础。
胃癌;SGC-7901/CON细胞株;SGC-7901/TCF7L2细胞株;TCF7L2
胃癌是全世界最常见的恶性肿瘤之一,我国胃癌发病率与致死率在恶性肿瘤中均居前列,严重危害人类健康[1]。早期胃癌经外科手术和药物化疗容易治愈,但目前胃癌缺乏特异有效的标志物分子,内窥镜技术接受率较低,使得我国大多数胃癌患者确诊时已经是晚期,失去了治疗的最佳时期。因此,寻找与胃癌发生发展密切相关的分子标志物,对胃癌的早期诊断和药物治疗有很重要的临床意义。已有研究[2]显示Wnt通路在结肠癌与乳腺癌等多种肿瘤细胞中呈活化状态,其中TCF7L2是该通路中的关键分子之一。该研究利用基因稳定转染技术建立高表达TCF7L2的胃癌细胞株SGC-7901/ TCF7L2,观察其生物学特性变化,为研究胃癌发生发展机制和开发靶向药物提供基础。
1 材料与方法
1.1 药物及试剂 RPMI-1640培养基和胎牛血清(美国Gibco公司);TCF7L2 兔抗 mAb、β-actin兔mAb、抗兔IgG(美国CST公司);RIPA裂解液(上海碧云天生物技术有限公司);蛋白磷酸酶抑制剂、蛋白酶抑制剂混合物(瑞士Roche公司);显影液(上海天能科技有限公司);BCA试剂盒(上海碧云天生物技术有限公司);RNeasy mini Kit(德国Qiagen GmbH公司);High Capacity cDNA Reverse Transcription Kit(美国Life Technologies公司);Lipofectamine 2000(美国Invitrogen公司);引物TCF7L2、β-actin(日本TaKaRa公司)。
1.2 实验动物 SPF级裸鼠(BALB/c-nu)10只,雌性,6~8周龄,25 g左右,购于北京维通利华实验动物技术有限公司,饲养于安徽医科大学附属省立医院SPF级动物房。
1.3 实验方法
1.3.1 细胞培养 人胃癌SGC-7901/CON和SGC-7901/TCF7L2细胞株由安徽医科大学附属省立医院分子实验室保存, 分别在含10 %小牛血清RPMI-1640完全培养基、37 ℃、5% CO2及饱和湿度条件下进行常规培养。
1.3.2 质粒稳定转染技术 转染24 h前,在30 mm培养皿中接种适量密度的SGC7901细胞(约2×105/ml),待细胞生长面积达50%~80%时即可用于转染。配制溶液1 ∶240 μl无血清培养基+10 μl Lipofectamine 2000,室温孵育5 min;溶液2 ∶250 μl无血清培养基+2 μg TCF7L2表达质粒,室温孵育5 min;将溶液1与溶液2混合,室温下放置20 min;将6孔板中的细胞用无血清培养基冲洗细胞2遍后,加入2 ml无血清培养基;将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀;置于37 ℃、5% CO2细胞培养箱中保温4~6 h;更换含有血清的全培养基,置于37 ℃、5% CO2细胞培养箱中培养24 h,将6孔板中转染的细胞用0.25%的胰酶消化成单细胞悬液,按照每孔1个细胞比例稀释后加入96孔板,并加入适量purocymin进行筛选[3],最终获得TCF7L2高表达的SGC-7901/TCF7L2细胞株和空转对照组SGC-7901/CON细胞株。
1.3.3 细胞形态学观察 应用倒置显微镜,对比观察SGC-7901/CON和SGC-7901/TCF7L2细胞株的活体细胞形态。
1.3.4 Western blot法检测 应用RIPA裂解液、蛋白磷酸酶抑制剂和蛋白酶抑制剂制成的混合物裂解细胞提取蛋白,具体实验步骤见说明书;应用BCA试剂盒测蛋白浓度,加蛋白上样缓冲液,于100 ℃水中煮沸5~10 min,冰上冷却上样;取出凝胶常规转膜后在5%的脱脂奶粉中封闭2 h,加1 ∶1 000稀释的β-actin兔mAb,摇床摇荡孵育4 ℃过夜,PBST漂洗过后将膜与HRP结合的二抗(抗兔 IgG)1 ∶1 000稀释室温摇荡孵育2 h[4]。然后用PBST充分洗膜后将显影液加于PVDF膜上,在显影仪上显影。
1.3.5 实时定量PCR(RT-PCR) 应用RNeasy mini Kit提取RNA,具体步骤见试剂盒说明书;核酸蛋白测定仪测定抽提RNA的浓度,根据High Capacity cDNA Reverse Transcription Kit说明书操作步骤进行逆转录得到cDNA;以cDNA为模板,扩增TCF7L2片段,选β-actin作为内参[5-6]。TCF7L2上游引物:5′-AAACAGGAATCGTCCCAGAGTG-3′,下游引物:5′-CTCAGCTACGACCTTTGCTCTCA-3′;β-actin上游引物:5′-TTGCCGACAGGATGCAGAA-3′,下游引物:5′-GCCGATCCACACGGAGTACTT-3′。
1.3.6 划痕实验 将SGC-7901/CON和SGC-7901/TCF7L2细胞株分别接种到6孔板中,待细胞贴壁生长至融合度约为80%时,用无菌移液器枪沿孔中轴线轻轻划过,然后用37 ℃预热的PBS洗涤细胞3次,以去除漂浮细胞,加入培养基;置37 ℃、5% CO2培养箱分别培养0、14 h后拍照,观察划痕愈合情况并测量。
1.3.7 耐药实验 收集SGC-7901/CON及SGC-7901/TCF7L2细胞株,分别制成浓度为10×104个/ml的单细胞悬液,接种于6孔板,每孔2 ml。分别加入5种不同浓度的化疗药物,即顺铂0.01、0.1、1、10、100 μmol/L,卡铂0.01、0.1、1、10、100 μmol/L,每个药物浓度设2个复孔,另设2个复孔不加药物作为空白对照。37 ℃、5% CO2饱和湿度培养箱中培养48 h。用PBS洗2次,用500 μl的0.25%胰酶消化10 min,再加入500 ml PBS,用1 ml移液枪吹打均匀,在显微镜下计数,计算各组的平均值。
1.3.8 裸鼠成瘤实验 裸鼠经适应性饲养1周后进行试验。将SGC-7901/CON和SGC-7901/TCF7L2细胞株用胰酶消化后,分别制成浓度为5×106个/ml的单细胞悬液,在每一只裸鼠的左侧肋部皮下注入200 μl SGC-7901/CON的单细胞悬液,在上述裸鼠的右侧肋部皮下注入200 μl SGC-7901/TCF7L2的单细胞悬液,共接种6只裸鼠,比较SGC-7901/CON和SGC-7901/TCF7L2的肿瘤生长情况[7-8]。
1.4 统计学处理 采用SPSS 22.0软件对数据进行分析,多组样本均数的比较采用单因素方差分析,方差齐者采用LSDt检验,方差不齐者采用Games Howell检验。两组独立样本的比较,数据服从正态分布者采用独立样本t检验,若不服从正态分布者采用秩和检验,检验水准P=0.05。
2 结果
2.1 SGC-7901/CON和SGC-7901/TCF7L2细胞株显微镜下形态差异 在光学显微镜下观察SGC-7901/TCF7L2细胞株和SGC-7901/CON细胞株形态差异。光镜下SGC-7901/CON细胞形态一致,呈圆形,胞质内颗粒物质较少,而SGC-7901/TCF7L2细胞形态多样,伪足增多,体积增大,胞质内颗粒物质增多,见图1。
2.2 TCF7L2在SGC-7901/TCF7L2细胞株中高表达 Western blot结果显示,TCF7L2蛋白在SGC-7901/TCF7L2细胞中的表达量较SGC-7901/CON细胞中明显升高,见图2,RT-PCR结果表明TCF7L2 mRNA在SGC-7901/TCF7L2细胞株中明显较SGC-7901/CON细胞株高表达(P=0.02),见图3。
2.3 TCF7L2的高表达促进肿瘤细胞迁移 光学显微镜下观察显示SGC-7901/TCF7L2细胞14 h后爬行的距离明显大于SGC-7901/CON细胞株,对两者的结果进行量化,结果显示在14 h内SGC-7901/TCF7L2细胞爬行的距离明显大于SGC-7901/CON细胞株,差异有统计学意义(P=0.00),见图4。
2.4 SGC-7901/TCF7L2细胞株对铂类化疗药物的耐受性明显强于SGC-7901/CON细胞株 耐药性实验结果表明当药物浓度<100 μmol/L时,SGC-7901/TCF7L2细胞株对顺铂和卡铂的耐药性明显强于SGC-7901/CON细胞株(P值均为0.03),当药物浓度≥100 μmol/L时,SGC-7901/TCF7L2细胞株和SGC-7901/CON细胞株对顺铂和卡铂的耐药性无明显差异(P=0.12,P=0.16),见图5。

图1 显微镜下观察SGC-7901/CON和SGC-7901/TCF7L2细胞形态学差异 ×200
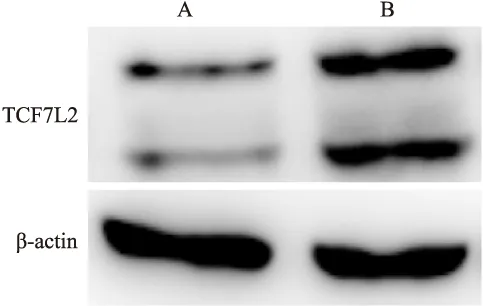
图2 Western blot检测TCF7L2在SGC-7901/CON和SGC-7901/TCF7L2细胞株中的表达
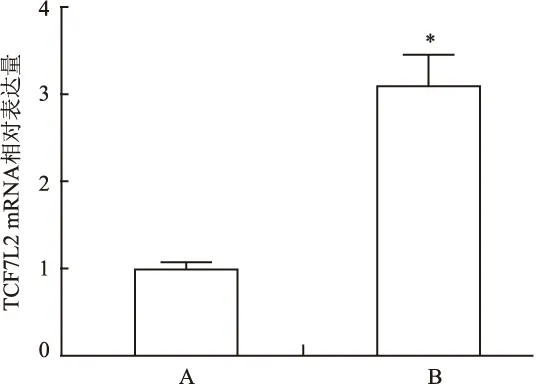
图3 RT-PCR检测TCF7L2 mRNA在SGC-7901/CON和SGC-7901/TCF7L2细胞中的表达
A:SGC-7901/CON细胞株;B: SGC-7901/TCF7L2细胞株;与SGC-7901/CON细胞株比较:*P<0.05

图4 划痕实验检测SGC-7901/CON和SGC-7901/TCF7L2的转移性 ×100
A:SGC-7901/CON细胞株;B:SGC-7901/TCF7L2细胞株;1:0 h;2:14 h;与SGC-7901/CON细胞株比较:**P<0.01
2.5 SGC-7901/TCF7L2细胞株在裸鼠体内较SGC-7901/CON细胞株更易成瘤 按1.2.8项建立小鼠模型,7 d后所有接种点均成瘤,生长20 d后测量移植瘤的体积和质量,结果显示SGC-7901/TCF7L2细胞移植瘤体积较SGC-7901/CON细胞的移植瘤大(P=0.02),质量也明显较SGC-7901/CON细胞的移植瘤重(P=0.04),差异有统计学意义,见图6。
3 讨论
研究[9]显示在胃癌的发展过程中Wnt信号异常激活,包括Wnt表达的频率上调[10],以及β-catenin/TCF4的核异位现象,初步确认了Wnt通路参与了胃癌的发生发展。 TCF7L2是TCF家族的一员,是Wnt通路中最为重要的下游转录因子[11]。当Wnt信号通路异常激活时,未被降解的β-catenin进入核内,与 TCF7L2的相关结构域结合形成转录复合物,并与其他转录因子相结合使下游靶基因过度表达,促进了肿瘤的发生发展[12]。 因此,TCF7L2基因的转录活性是维持细胞恶性表型所必需的,是开启下游靶基因转录的先决条件,成为了Wnt信号通路的分子开关。
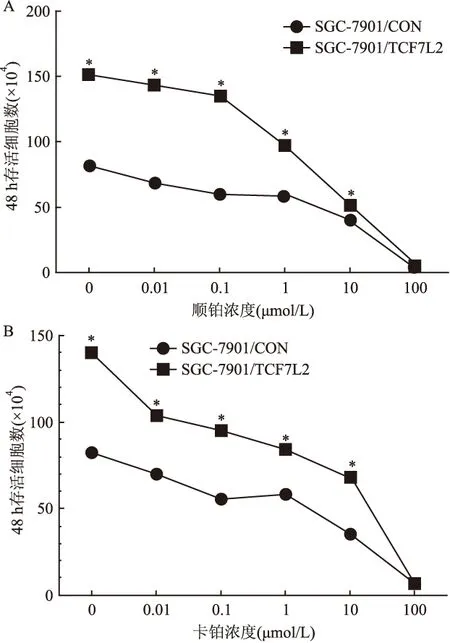
图5 SGC-7901/CON和SGC-7901/TCF7L2细胞株对铂类化疗药物的耐药性差异
A:细胞株对顺铂耐药实验;B:细胞株对卡铂耐药实验;与SGC-7901/CON比较:*P<0.05,**P<0.01
本研究通过质粒稳定转染技术获得稳定的SGC-7901/TCF7L2细胞株,SGC-7901/TCF7L2细胞株在形态学上较对照细胞形态多样,伪足增多,体积增大,胞质内颗粒物质增多。经RT-PCR和Western blot证实该细胞株的TCF7L2基因和蛋白表达明显增高。划痕实验证实SGC-7901/TCF7L2细胞株的迁移能力明显强于对照组细胞株。耐药试验结果显示SGC-7901/TCF7L2细胞株对铂类的耐药性明显强于SGC7901/CON细胞株,小鼠荷瘤实验表明SGC-7901/TCF7L2细胞株在小鼠体内成瘤能力较SGC-7901/CON细胞株明显增强。SGC-7901/TCF7L2和SGC-7901/CON细胞株唯一的不同就是TCF7L2基因的表达量不同,由此可以说明上述的现象是由TCF7L2基因过表达引起的。因此该研究证明TCF7L2基因可以增强人胃癌细胞株SGC-7901的恶性生物学特性。
SGC-7901/TCF7L2细胞株的建立为胃癌发生发展机制研究提供基础,也为体外研究TCF7L2在胃癌的转移、耐药以及胃癌的不良预后方面中的作用提供模型。TCF7L2可能成为胃癌患者对化疗的敏感性及不良预后的良好预测指标[13]。

图6 SGC-7901/CON和SGC-7901/TCF7L2细胞株在裸鼠体内成瘤能力的差异
A:移植瘤的最终质量;B:移植瘤的最终体积;1:SGC-7901/CON细胞株;2:SGC-7901/TCF7L2细胞株;与SGC-7901/CON细胞株比较:*P<0.05
[1] Vogelstein B, Papadopoulos N, Velculescu V E, et al. Cancer genome landscapes[J]. Science,2013,339(6127): 1546-58.
[2] Wang F, Jiang L, Li J, et al. Association between TCF7L2 polymorphisms and breast cancer susceptibility: a meta-analysis.[J]. Inter J Clin Exp Med, 2015, 8(6):9355-61.
[3] Chen C,Cao F,Bai L, et al. IKKβ enforces a LIN28B/TCF7L2 positive feedback loop that promotes cancer cell stemness and metastasis[J]. Cancer Res, 2015, 75(8):1725-35.
[4] Shin H W, Choi H, So D, et al. ITF2 prevents activation of the β-catenin-TCF4 complex in colon cancer cells and levels decrease with tumor progression[J]. Gastroenterology, 2014, 147(2):430-42.e8.
[5] Wang S, Sun Z, Zhang X,et al. Wnt1 positively regulates CD36 expressionviaTCF4 and PPAR-γ in macrophages[J]. Cell Physiol Biochem, 2015, 35(4):1289-302.
[6] Yuan G, Regel I, Lian F,et al. WNT6 is a novel target gene of caveolin-1 promoting chemoresistance to epirubicin in human gastric cancer cells[J]. Oncogene, 2012, 32(3):375-87.
[7] 唐杨琛, 沈 干, 胡世莲,等. 两种方法建立人胃癌裸鼠移植瘤模型的比较[J]. 中国临床保健杂志, 2013, 16(2):180-2.
[8] Grumolato L,Liu G,Haremaki T, et al. β-catenin-independent activation of TCF1/LEF1 in human hematopoietic tumor cells through interaction with ATF2 transcription factors[J]. PLoS Genet, 2013, 9(8):e1003603.
[9] Ye Q,Yao G,Zhang M, et al. A novel ent-kaurane diterpenoid executes antitumor function in colorectal cancer cells by inhibiting Wnt/β-catenin signaling[J]. Carcinogenesis, 2015, 36(3):318-26.
[10]Konsavage W M Jr,Kyler S L,Rennoll S A, et al. Wnt/β-catenin signaling regulates Yes-associated protein (YAP) gene expression in colorectal carcinoma cells[J]. J Biol Chem, 2012, 287(15):11730-9.
[11]Zhao C,Deng Y,Liu L,et al. Dual regulatory switch through interactions of TCF7l2/TCF4 with stage-specific partners propels oligodendroglial maturation[J]. Nat Commun, 2016, 7:10883.
[12]Srivastava R, Zhang J, Go G W, et al. Impaired LRP6-TCF7L2 activity enhances smooth muscle cell plasticity and causes coronary artery disease[J]. Cell Reports, 2015, 13(4):746-59.
[13]Dou X,Wang R,Meng X, et al. The prognostic role of TCF4 expression in locally advanced rectal cancer patients treated with neoadjuvant chemoradiotherapy[J]. Cancer Biomark, 2015, 15(2):181-8.
Establishment of the human gastric cancer SGC-7901/TCF7L2 cell line and observing its biological characteristics
Fu Cuiqun1,2, Shen Guodong1,2, Shen Gan1,2,et al
(1DeptofGeriatrics,AffiliatedProvincialHospitalofAnhuiMedicalUniversity,Hefei230001;2AnhuiProvincialKeyLaboratoryofTumorImmuneandNutritionalTherapy,Hefei230001)
ObjectiveToestablishhumangastriccancerSGC-7901/TCF7L2celllineandobserveitsbiologicalcharacteristics. MethodsStableplasmidtransfectiontechniquewasusedtoobtainhighTCF7L2proteinexpressionofgastriccancercelllineSGC-7901/TCF7L2andidlingcontrolSGC-7901celllines(SGC-7901/CON).RT-PCRandWesternblotwereusedtodetectSGC-7901/TCF7L2andSGC-7901/CONtwocelllinesofTCF7L2genemRNAandproteinexpressionlevels;undertheopticalmicroscope,toobserveandcomparethemorphologicaloftwocelllines.Woundhealingexperimentswereusedtocomparetheabilityofmigrationbetweenthetwocelllines.Cellcountsweredetectedbothcisplatinandcarboplatindrugresistance.Tumor-burdenedexperimentsinnudemicewereusedtocomparetheabilityoftumorigenicitybetweentwocelllines.ResultsStablytransfectedtechnologysuccessfullyestablishedstableSGC-7901/TCF7L2cellline,whichcomparedwithSGC-7901/CONcellline,mRNAandproteinexpressionofTCF7L2amountweresignificantlyincreased;undertheopticalmicroscope,SGC-7901/TCF7L2celllinehadmorphologicaldiversity,increasedpseudopodiaandvolume,moreparticulatematterinthecytoplasmofparticulatemattercomparedwithSGC-7901/CONcellline.Migrationandtoleranceofplatinumcomparedwithcontrolcelllinewassignificantlyenhanced.ThetumorigenicityofSGC-7901/TCF7L2celllineinmicealsosignificantlyenhanced. ConclusionTCF7L2genecanenhancethebiologicalcharacteristicsofmalignantgastriccancercelllineSGC-7901.TheestablishmentofSGC-7901/TCF7L2celllineprovidesthebasisfortheresearchondevelopmentandmechanismofgastriccancer,anditisalsohelpfulforthedevelopmentoftargeteddrugs.
gastriccancer;SGC-7901/CONcellline;SGC-7901/TCF7L2cellline;TCF7L2
安徽省自然科学基金面上项目(编号:1408085MH167);安徽省科技攻关计划项目(编号:1301042094)
1安徽医科大学附属省立医院老年病科,合肥 2300012肿瘤免疫与营养治疗安徽省重点实验室,合肥 230001
付翠群,女, 硕士研究生; 胡世莲,女,教授,主任医师,博士生导师,责任作者,E-mail: hushilian@126.com
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.006.html
R 735.2
A
1000-1492(2016)11-1579-05
10.19405/j.cnki.issn1000-1492.2016.11.006
2016-07-04接收
