2型糖尿病合并高血压脑损害代谢物改变研究
2016-12-14林小荣肖叶玉
林小荣,曹 震,何 戎,张 颖,肖叶玉
·论著·
2型糖尿病合并高血压脑损害代谢物改变研究
林小荣,曹 震,何 戎,张 颖,肖叶玉
目的 探讨2型糖尿病合并高血压脑损害代谢物改变情况。方法 选取2013年4月—2014年11月汕头大学医学院第二附属医院门诊或住院的2型糖尿病合并高血压患者33例为病例组,及同期与病例组性别、年龄、受教育年限相匹配的健康志愿者30例为对照组。采用美国GE signa HDX-Speed 1.5T超导型磁共振成像仪。二维磁共振频谱(2D-1HMRS)扫描:体素置于半卵圆中心层面,感兴趣区体积为7 cm×10 cm×2 cm,TR 1 500 ms,TE 35 ms。使用SAGE软件分别测定双侧额叶灰质和顶叶白质代谢物比值,包括N-乙酰天冬氨酸(NAA)/肌酸(Cr)、胆碱(Cho)/Cr。统计学分析采用SPSS 17.0统计软件。结果 两组左额叶NAA/Cr、Cho/Cr和右额叶NAA/Cr、Cho/Cr及左顶叶NAA/Cr间差异有统计学意义(P<0.05),而左顶叶Cho/Cr和右顶叶NAA/Cr、Cho/Cr间差异无统计学意义(P>0.05)。其中对照组左额叶与左顶叶(t=0.77,P=0.45)、右额叶与右顶叶(t=-0.81,P=0.43)、左额叶与右额叶(t=-0.66,P=0.51)、左顶叶与右顶叶(t=-0.45,P=0.65)NAA/Cr间差异均无统计学意义;左额叶与左顶叶(t=0.49,P=0.63)、右额叶与右顶叶(t=0.53,P=0.59)、左额叶与右额叶(t=-0.96,P=0.35)、左顶叶与右顶叶(t=-0.79,P=0.93)Cho/Cr间差异亦均无统计学意义。病例组左额叶与左顶叶(t=5.40,P<0.01)、右额叶与右顶叶(t=-5.86,P<0.01)、左额叶与右额叶(t=3.14,P=0.01)、左顶叶与右顶叶(t=2.74,P=0.01)NAA/Cr间差异均有统计学意义;左额叶与左顶叶(t=-0.78,P=0.94)、左额叶与右额叶(t=-0.46,P=0.65)、左顶叶与右顶叶Cho/Cr(t=-0.90,P=0.38)Cho/Cr间差异无统计学意义,而右额叶与右顶叶(t=-2.93,P=0.04)Cho/Cr间差异有统计学意义。结论 2型糖尿病合并高血压导致的脑损害呈进展性,双侧额叶灰质及左侧顶叶白质均发生代谢功能紊乱,代谢物改变以 NAA/Cr降低、Cho/Cr升高为主,额叶灰质较顶叶白质明显,左侧较右侧明显。
糖尿病,2型;高血压;脑损害;代谢物
林小荣,曹震,何戎,等.2型糖尿病合并高血压脑损害代谢物改变研究[J].中国全科医学,2016,19(34):4183-4186,4195.[www.chinagp.net]
LIN X R,CAO Z,HE R,et al.Metabolites alterations of brain damage in type 2 diabetic patients combined with hypertension[J].Chinese General Practice,2016,19(34):4183-4186,4195.
2型糖尿病与高血压互为危险因素、常常相互伴发,约75%的2型糖尿病患者同时伴有高血压[1]。脑损害是造成致残致死的重要慢性并发症之一,传统的CT、MRI检查可检出脑梗死、脑白质病变等影像学改变,是目前用于脑损害检查的最重要评估手段,但仅可提供脑组织损害形态学的信息,在许多疾病中,由于代谢变化通常早于组织结构病理形态的变化,因而早期了解疾病累及器官的代谢物变化情况对于疾病的诊断及治疗起到重要的作用[2]。目前磁共振频谱(MRS)检测代谢物有N-乙酰天冬氨酸(N-acetylaspartare,NAA)、胆碱(choline,Cho)、肌酸(creatine,Cr)、乳酸(lactate,Lac)、脂质(lipid,Lip)、丙氨酸(alanine,Ala)、谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)、肌醇(myo-inositol,MI)等。Cr较稳定,常被用作与其他代谢物比较的标准。以Cr为参照的NAA/Cr、Cho/Cr和MI/Cr比值在一定程度上反映了NAA、Cho、MI的水平变化[3]。本研究采用多体素频谱将感兴趣区置于半卵圆中心层面,研究早期即有脑血流量改变的双侧额叶灰质和顶叶白质脑代谢物改变,为糖尿病合并高血压脑损害的早期诊断与防治提供依据。
1 对象与方法
1.1 研究对象 选取2013年4月—2014年11月汕头大学医学院第二附属医院门诊或住院的2型糖尿病合并高血压患者33例为病例组,及同期与病例组性别、年龄、受教育年限相匹配的健康志愿者30例为对照组。病例组纳入标准:(1)空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L或口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)2 h血糖≥11.1 mmol/L;(2)未服用抗高血压药物情况下,收缩压≥140 mm Hg(1 mm Hg=0.133 kPa)和/或舒张压≥90 mm Hg。对照组纳入标准:(1)空腹血糖<6.1 mmol/L和OGTT 2 h血糖<7.8 mmol/L;(2)未服用抗高血压药物情况下,收缩压<140 mm Hg和舒张压<90 mm Hg;(3)无脂代谢异常等病史。两组排除标准:(1)有明确的其他引起中枢神经损伤的疾病与病史;(2)酒精或药物依赖史以及其他精神活动物质滥用病史;(3)有精神疾病史;(4)合并严重内科疾病史。两组均为右利手。本研究经汕头大学医学院伦理委员会批准,检查前受试者均知情并签署知情同意书。
1.2 研究方法 采用美国GE signa HDX-Speed 1.5T超导型磁共振成像系统、配套的8通道头线圈、GE advantage workstation ADW4.3工作站及SAGE软件(美国通用电气公司)。所有受检者扫描时使用8通道头线圈并用海绵垫固定头部,扫描时头部须保持静止不动。二维磁共振频谱(2D-1HMRS)扫描:采用点分解频谱分析法(point resolved selective spectroscopy,PRESS)序列,扫描参数:TR 1 500 ms,TE 35 ms,矩阵521×512,相位×频率:18×18,FOV:16 cm×16 cm,NEX:1.0。在行2D-1HMRS扫描前,先进行T2WI三平面(轴位、矢状位、冠状位)体素定位,感兴趣区置于半卵圆中心层面,体积为7 cm×10 cm×2 cm,每个体素的大小为1.58 ml。为了满足代谢物分析需求,先由计算机自动预扫描匀场,若自动匀场效果不好,再通过手动调整射频增益、体素内匀场和水抑制,使半高宽度(FWHM)控制在10 Hz之内,水抑制效果98%,采集次数1次,采集时间为8 min 12 s。2D-1HMRS扫描结束后导入UNIX系统,使用LCModel软件和SAGE软件完成信号平均、基线校正、相位循环、代谢物识别、每个体素内代谢物比值计算。本研究选取的感兴趣区体素为双侧额叶灰质和顶叶白质(见图1),着重了解NAA/Cr和Cho/Cr比值的变化情况。

注:2D-1HMRS采集置于半卵圆中心层面,F为双侧额叶灰质小体素感兴趣区,P为双侧顶叶白质小体素感兴趣区;2D-1HMRS=二维磁共振频谱

2 结果
2.1 两组基本情况比较 两组性别、年龄、受教育年限间差异均无统计学意义(P>0.05,见表1),具有可比性。
2.2 两组2D-1HMRS检测结果比较 两组左额叶NAA/Cr、Cho/Cr和右额叶NAA/Cr、Cho/Cr及左顶叶NAA/Cr间差异有统计学意义(P<0.05),而左顶叶Cho/Cr和右顶叶NAA/Cr、Cho/Cr间差异无统计学意义(P>0.05)。其中对照组左额叶与左顶叶(t=0.77,P=0.45)、右额叶与右顶叶(t=-0.81,P=0.43)、左额叶与右额叶(t=-0.66,P=0.51)、左顶叶与右顶叶(t=-0.45,P=0.65)NAA/Cr间差异均无统计学意义;左额叶与左顶叶(t=0.49,P=0.63)、右额叶与右顶叶(t=0.53,P=0.59)、左额叶与右额叶(t=-0.96,P=0.35)、左顶叶与右顶叶(t=-0.79,P=0.93)Cho/Cr间差异亦均无统计学意义。病例组左额叶与左顶叶(t=5.40,P<0.01)、右额叶与右顶叶(t=-5.86,P<0.01)、左额叶与右额叶(t=3.14,P=0.01)、左顶叶与右顶叶(t=2.74,P=0.01)NAA/Cr间差异均有统计学意义;左额叶与左顶叶(t=-0.78,P=0.94)、左额叶与右额叶(t=-0.46,P=0.65)、左顶叶与右顶叶(t=-0.90,P=0.38)Cho/Cr间差异无统计学意义,而右额叶与右顶叶(t=-2.93,P=0.04)Cho/Cr间差异有统计学意义(见表2)。
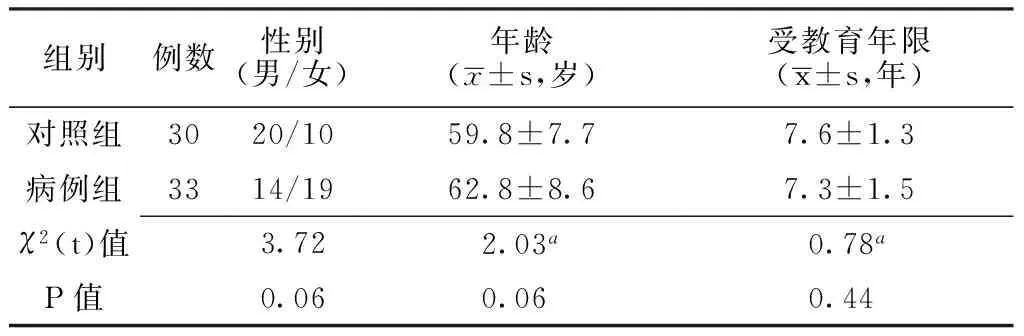
表1 两组基本情况比较
注:a为t值

表2 两组2D-1HMRS检测结果比较±s)
注:a为t值; 2D-1HMRS=二维磁共振频谱,NAA=N-乙酰天冬氨酸,Cr=肌酸,Cho=胆碱
3 讨论
3.1 单体素与多体素MRS MRS是目前常用于检测包括脑组织在内不同部位代谢物的一种方法,具有非侵入性和重复性良好的特点[4-5]。分为单体素频谱和多体素频谱。单体素频谱可以选择性采集一个感兴趣区体素的谱线,操作简便,采集时间短,减少了患者的运动伪影,但一次采集只能获得一个频谱数据,不能同时与病变的对侧组织进行比较,同时单体素频谱的准确性依赖兴趣区的定位。多体素频谱又称化学位移成像(chemica1 shift imaging,CSI),其优点是多体素频谱获得的是覆盖较大范围的无数个小体素的频谱,当病灶内为不匀质时,小体素可减少平均容积效应,同时其视野较大,可以一次采集多个感兴趣信号,得到多个体素的代谢物谱,便于病变组织与正常组织的比较[6]。本研究中采用2D-1HMRS分析糖尿病合并高血压患者脑代谢物改变,采用了MRS无创检测的优点,且能达到一次采集、对多个感兴趣区分别研究、左右侧对比研究的优点。
3.2 健康人不同解剖结构MRS NAA主要存在于神经元胞体和轴突中,而不存在于神经胶质细胞,因此NAA被认为是神经元的标志物,通常认为NAA减少反映了神经元的缺失、活性下降,也反映了白质内轴突损伤[7]。Cho是组成细胞膜的主要成分之一,也是乙酰胆碱和甘油磷酸胆碱的前体之一,Cho在胶质细胞中含量高于其他细胞[8]。灰质解剖结构主要是神经元,白质解剖结构主要是神经轴突与胶质细胞,按理论推测灰质部分的NAA水平应较高,但本研究并未发现此现象,而是发现对照组同侧额叶灰质与顶叶白质NAA/Cr、Cho/Cr间均无差异,左右侧额叶灰质和顶叶白质NAA/Cr、Cho/Cr间亦无差异,可能与NAA存在于神经元胞体与轴突的水平分布有关。同一部位脑左右侧NAA/Cr、Cho/Cr间无差异,这一研究结果表明可应用于频谱试验中自身对照。
3.3 糖尿病合并高血压患者MRS 本研究结果显示,与对照组相比,病例组双侧额叶灰质及左侧顶叶白质NAA/Cr均降低,双侧额叶灰质Cho/Cr均升高。(1)有研究显示,糖尿病可引起海马神经元DNA 断裂,导致神经元退行性改变,进而影响海马突触可塑性[9]。KARIO等[10]通过对顶叶分水岭区白质血流与代谢的研究表明,NAA下降与血流改变无明显相关关系,而与2型糖尿病具有独立相关关系。但也有研究指出,NAA/Cr在皮质下动脉硬化性脑病病灶中明显降低,其认为持续的高血压及其他危险因素导致慢性脑循环障碍,造成缺血、低氧性改变,神经元缺失,致NAA降低[11]。本研究中2型糖尿病合并高血压患者双侧额叶灰质NAA/Cr均较对照组降低,可能与额叶灰质对缺血敏感有关,高血压、糖尿病均可致造成血管内膜损伤、血管壁增厚、管腔狭窄,脑组织灌注减少,造成缺血、低氧性改变,在持续的缺血状态下,神经元缺失、轴索与细胞膜代谢紊乱导致细胞成分改变,继发了细胞形态结构的改变,髓鞘的破坏,轴突大量丢失,从而导致NAA降低。本研究中2型糖尿病合并高血压患者左侧顶叶白质NAA/Cr较对照组降低,这可能因右利手被试的优势半球为左半球,对于缺血耐受性比右侧差,损伤后更容易出现神经元代谢的障碍。以往学者对非胰岛素依赖性糖尿病组患者海马代谢物的研究也发现,2型糖尿病患者双侧海马NAA/Cr较对照组明显降低,表明2型糖尿病患者可致海马神经元损伤,并以左侧海马神经元退变尤为明显[12]。(2)Cho是组成细胞膜的主要成分之一,也是乙酰胆碱和甘油磷酸胆碱的前体之一。Cho升高主要见于代谢旺盛的细胞膜和细胞膜的解体;还与炎症有关,反映了炎症加重。Cho/Cr降低可能与细胞膜磷脂更新增加、MI更新加快、细胞密度改变、内分泌状态及局部代谢率变化等过程有关。本研究中2型糖尿病合并高血压患者双侧额叶灰质Cho/Cr均较对照组升高,可能糖尿病与高血压同时存在使血管损害进一步加重,致细胞膜溶解有关;其次,与炎性递质形成增多有关,有研究认为2型糖尿病也是一种炎性疾病,炎性反应加重,故Cho/Cr升高[13-14]。
总之,2型糖尿病与高血压有许多共同的危险因素,因此2型糖尿病患者合并高血压的发生率很高[15]。当高血压与糖尿病同时存在时,会使脑损害程度加重,致病机制未完全明确,但与脑血管损伤、氧化应激、非酶性蛋白糖基化等关系密切。这些病理生理变化可以通过观察相关代谢物变化反映出来,代谢物的改变以NAA/Cr降低、Cho/Cr升高为主,灰质较白质明显,右利手患者左侧较重。
作者贡献:林小荣进行试验设计与实施、撰写论文;曹震、何戎、张颖进行试验实施、评估、资料收集;肖叶玉进行试验设计、质量控制与审校,并对文章负责。
本文无利益冲突。
[1]CHOBANIAN A V,BAKRIS G L,BLACK H R,et al.Seventh report of the joint national committee on prevention,detection,evaluation,and treatment of high blood pressure[J].JAMA,2003,289(19):2560-2572.
[2]VAN ELDEREN S G,BRANDTS A,VAN DER GROND J,et al.Cerebral perfusion and aortic stiffness are independent predictors of white matter brain atrophy in type 1 diabetic patients assessed with magnetic resonance imaging[J].Diabetes Care,2011,34(2):459-463.
[3]THEBERGE J,ALSEMAAN Y,WILLIAMSON P C,et al.Glutamate and glutamine in the anterior and thalamus of medieated patients with chronic schizo phrenia and healthy comparison subjects measured with 4.0T proton MRS[J].Am J Psychiatry,2003,160(12):2231-2233.
[4]GOLDBERG M P,RANSOM B R.New light on white matter[J].Stroke,2003,34(2):330-332.
[5]ISOBE T,MATSUMURA A,ANNO I,et al.Quantification of cerebral metabolites in glioma patients with proton MR spectroscopy using T2 relaxation time correction[J].Magn Reson Imaging,2002,20(4):343-349.
[6]VICENTE J,FUSTER-GARCIA E,TORTAJADA S,et al.Accurate classification of childhood brain tumours by in vivo1H MRS-a mult- centre study[J].Eur J Cancer,2013,49(3):658-667.
[7]MOFFETT J R,ROSS B,ARUN P,et al.N-Acetylaspartate in the CNS:from neurodiagnostics to neurobiology[J].Prog Neurobiol,2007,81(2):89-131.
[8]CHANG L,FRIEDMAN J,ERNST T,et al.Brain metabolite abnormalities in the white matter of elderly schizophrenic subjects:implication for glial dysfunction[J].Biol Psychiatry,2007,62(12):1396-1404.
[9]高原,肖谦.海马突触可塑性与糖尿病脑病[J].国外医学(老年医学分册),2006,27(1):19-22. GAO Y,XIAO Q.Hippocampal synaptic plasticity and diabetic encephalopathy[J].Foreign Medical Sciences (Geriatrics),2006,27(1):19-22.DOI:10.3969/j.issn.1674-7593.2006.01.006.
[10]KARIO K,ISHIKAWA J,HOSHIDE S,et al.Diabetic brain damage in hypertension:role of rennin-angiotensin system[J].Hypertension,2005,45(5):887-893.
[11]KREIS R,ROSS B D.Cerebral metabolic disturbances in patients with subacute and chronic diabetes mellitus:detection with proton MR spectroscopy[J].Radiology,1992,184(1):123-130.
[12]周红,卢万俊,滕皋军,等.2型糖尿病患者认知功能及海马氢质子磁共振波谱研究[J].中国医学影像技术,2009,25(8):1367-1370. ZHOU H,LU W J,TENG G J,et al.The study of cognitive function and proton magnetic resonance spectroscopy on hippocampus inpatients with type 2 diabetes mellitus[J].China Joural Medical Imaging Technology,2009,25(8):1367-1370.
[13]TAKENAKA S,SHINODA J,ASANO Y,et al.Metabolic assessment of monofocal acute inflammatory demyelination using MR spectroscopy and 11C-methionine-,11C-choline-,and 18F-fluorodeoxyglucose-PET[J].Brain Tumor Pathol,2011,28(3):229-238.
[14]MELLERGÅRD J,TISELL A,DAHLQVIST LEINHARD O,et al.Association between change in normal appearing white matter metabolites and intrathecal inflammation in natalizumab-treated multiple sclerosis[J].PLoS One,2012,7(9):e44739.DOI:10.1371/journal.pone.0044739.
[15]VAN BILSEN M,DANIELS A,BROUWERS O,et al.Hypertension is a conditional factor for the development of cardiac hypertrophy in type 2 diabetic mice[J].PLoS One,2014,9(1):e85078.DOI:10.1371/journal.pone.0085078.
(本文编辑:崔沙沙)
Metabolites Alterations of Brain Damage in Type 2 Diabetic Patients Combined with Hypertension
LINXiao-rong,CAOZhen,HERong,ZHANGYing,XIAOYe-yu.
DepartmentofEmergencyInternalMedicine,theSecondAffiliatedHospitalofShantouUniversityMedicalCollege,Shantou515041,China
Correspondingauthor:XIAOYe-yu,DepartmentofMedicalImaging,theSecondAffiliatedHospitalofShantouUniversityMedicalCollege,Shantou515041,China;E-mail:xyyu73@163.com
Objective To investigate the metabolites alterations of brain damage in type 2 diabetic patients combined with hypertension.Methods Thirty-three type 2 diabetic patients combined with hypertension,who received treatment in the outpatient of or hospitalized in the Second Affiliated Hospital of Shantou University Medical College from April 2013 to November 2014,were selected as the patients group,and 30 healthy volunteers whose gender,age,and educational years were matched with those of the patients group were enrolled as the control group at the same period.The US GE signa HDXT-Speed (1.5T superconducting magnetic resonance imager) was used in the study.The scanning results of two-dimensional H magnetic resonance spectrum was shown as follow,the voxel was located in the semiovale center,the volume of interest was 7 cm×10 cm×2 cm,TR 1 500 ms,and TE 35 ms.The SAGE software was used to measure the specific value of bilateral frontal lobe gray matter and left parietal lobe white matter,including N-acetylaspartate (NAA)/creatine (Cr) and Choline (Cho)/Cr.Statistical analysis were performed with SPSS 17.0.Results There were significant differences in NAA/Cr and Cho/Cr in left frontal lobe and NAA/Cr and Cho/Cr in right frontal lobe and NAA/Cr in the left parietal lobe between the two groups (P<0.05),while there were no significant differences in Cho/Cr in left parietal lobe and NAA/Cr and Cho/Cr in right parietal lobe (P>0.05).The NAA/Cr between left frontal lobe and left parietal lobe (t=0.77,P=0.45);between right frontal lobe and right parietal lobe (t=-0.81,P=0.43);between left frontal lobe and right frontal lobe (t=-0.66,P=0.51);between left parietal lobe and right parietal lobe (t=-0.45,P=0.65) in the control group was not significantly different;and Cho/Cr between left frontal lobe and left parietal lobe (t=0.49,P=0.63);between right frontal lobe and right parietal lobe (t=0.53,P=0.59);between left frontal lobe and right frontal lobe (t=-0.96,P=0.35);and between left parietal lobe and right parietal lobe (t=-0.79,P=0.93) was also not significantly different.The NAA/Cr between left frontal lobe and left parietal lobe (t=5.40,P<0.01);between right frontal lobe and right parietal lobe (t=-5.86,P<0.01);between left frontal lobe and right frontal lobe (t=3.14,P=0.01);and between left parietal lobe and right parietal lobe (t=2.74,P=0.01) in the patients group was significantly different;there were no significant differences in Cho/Cr between left frontal lobe and left parietal lobe (t=-0.78,P=0.94),between left frontal lobe and right frontal lobe (t=-0.46,P=0.65),and between left parietal lobe and right parietal lobe (t=-0.90,P=0.38),while there were significant differences in Cho/Cr between right frontal lobe and right parietal lobe (t=-2.93,P=0.04).Conclusion Brain damage caused by type 2 diabetic hypertension presents progressivity,and the metabolic dysfunction has occurred both in bilateral frontal lobe gray matter and left parietal lobe white matter.Metabolic alterations are mainly manifested by decreasing NAA/Cr and increasing Cho/Cr,clearer frontal lobe gray matter compared with parietal lobe white matter and the left side is clearer than the right side.
Diabetes mellitus,type 2;Hypertension;Brain damage;Metabolites
国家自然科学基金资助项目(81371612);广东省自然科学基金资助项目(S2013010013867);广东省医学科研项目(A2014446)
515041广东省汕头市,汕头大学医学院第二附属医院急诊内科(林小荣),医学影像科(曹震,何戎,张颖,肖叶玉)
肖叶玉,515041广东省汕头市,汕头大学医学院第二附属医院医学影像科;E-mail:xyyu73@163.com
R 587.1 R 544.1
A
10.3969/j.issn.1007-9572.2016.34.007
2016-07-21;
2016-10-25)
