利培酮所致的体质量、瘦素、瘦素基因变化与精神症状的相关性
2016-12-08郭丽阳亢万虎高成阁马现仓杨小波李雅妹
郭丽阳,亢万虎,高成阁,马现仓,杨小波,陈 策,李雅妹
(西安交通大学第一附属医院精神科,陕西西安 710061)
◇临床研究◇
利培酮所致的体质量、瘦素、瘦素基因变化与精神症状的相关性
郭丽阳,亢万虎,高成阁,马现仓,杨小波,陈 策,李雅妹
(西安交通大学第一附属医院精神科,陕西西安 710061)
目的 探讨抗精神病药利培酮治疗后的体质量增加与血浆瘦素水平及瘦素基因启动子区-2548G/A多态性和精神症状减分率间有无相关性。方法 利培酮单药治疗10周,测定66例患者治疗前后体质量指数(BMI)、腹围及血浆瘦素浓度;PCR-RFLP方法分析66例精神分裂症或分裂样精神病患者瘦素基因启动子区-2548G/A多态性;PANSS量表评定患者治疗前后精神症状;分析体质量指标变化值与血浆瘦素浓度、瘦素基因多态性和PANSS减分率的相关性。结果 治疗后患者体质量指标均有显著性增加(P=0.000,0.002);平均BMI变化为(1.52±1.28)kg/m2,腹围为(4.08±4.32)cm。此外,血浆瘦素水平在治疗期间也有增加,但没有统计学差异(P=0.102)。基础体质量指标显著影响体质量指标变化值,差异有显著性;不同治疗时期的体质量指标显著影响相应时期的血浆瘦素水平和瘦素水平变化值,瘦素基因多态性和PANSS减分率对血浆瘦素水平或瘦素水平变化值的影响的差异均没有显著性(P>0.05)。结论 瘦素基因-2548G/A多态性不是利培酮所致的体质量增加的主要遗传因素;体质量增加不是利培酮临床疗效的指标。
利培酮;体质量增加;瘦素;基因多态性;精神分裂症
精神分裂症患者发生体质量增加的危险性是普通人群的2~3倍[1],但也有相反的报道[2]。抗精神病药物治疗可以影响精神分裂症谱系疾病患者的体质量变化,但具体的机制目前还没有一致性结论[3]。多数研究认为,利培酮治疗发生的体质量变化与血浆瘦素水平升高有关,治疗前基础瘦素越低的患者治疗后体质量增加越明显。瘦素基因启动子区-2548A等位基因是抗精神病药治疗导致体质量增加的危险因素之一[4]。较多文献报道不典型抗精神病药治疗期间,体质量增加和症状改善间有阳性的关联性[5]。体质量增加和抗精神病药较好的疗效可能在治疗的早期阶段有相关性。体质量增加是不典型抗精神病药治疗最突出的副反应。有研究发现对于氯氮平和奥氮平,在有明显疗效的同时,体质量增加也较多,两者间有一定的联系。对于利培酮,这种联系没有统计学意义[6],但也有研究发现是有联系的[7-8],故对上述的结论还有不一致的地方。为了进一步探讨抗精神病药治疗后体质量变化是否与瘦素变化、瘦素基因型和精神症状改善相关,我们观察了利培酮治疗对体质量、瘦素和精神症状的影响情况。
1 对象与方法
1.1 研究对象 2014年3月到2014年10月在西安交通大学第一附属医院精神科门诊和住院治疗的中国北方汉族精神分裂症和分裂样精神病的患者。入组标准:符合《精神障碍诊断统计手册第4版》(DSM-IV)的精神分裂症或分裂样精神病的诊断标准;入组前3月未经任何抗精神病药物治疗;无神经系统和其他精神疾病史;无肥胖、进食障碍、糖尿病、高血压和心脏病史;无药物或酒精依赖史。入组时阳性和阴性症状量表(PANSS)总分值≥60;体质量指数(BMI)在正常范围(18.5~23.9 kg/m2);血糖、血脂和心电图检查均正常;利培酮单药治疗满10周;患者对本研究过程知情同意。符合入组标准者共80例,最终完成为66例,其中男30例,女36例;年龄18~45岁,平均年龄(27±8)岁;发病年龄12~40岁,平均发病年龄(22±5)岁;病程1月至8年,平均病程(0.9±0.5)年,男女患者间上述各指标均匹配。首发患者57例,复发9例;住院患者54例,门诊12例。住院患者的住院时间为2~4周,平均2.6周,患者出院后行门诊随诊治疗,每2周至门诊1次。门诊患者在入组后每2周复诊1次。
1.2 研究方法 所有入组患者使用利培酮单药治疗10周。患者入组后1周内加利培酮至治疗量4~6 mg/d,维持到实验结束。所有患者利培酮平均治疗量(4.12±0.53)mg/d。治疗中出现椎体外系副作用或入睡困难时,酌情使用安坦或苯二氮卓类药物。所有患者在治疗期间未使用其他的抗精神病药或情感稳定剂。
患者饮食主要由家属负责,使其和治疗前尽量保持一致,对于部分用药后进食量显著增加的患者,要求患者家属控制饮食。运动方面要求住院患者尽量和治疗前一致,适当活动。门诊及出院后门诊随诊的患者要求同住院患者。
患者入组时测量其身高、体质量和腹围,计算体质量指数(BMI)。BMI=身高/体质量2(kg/m2);以后每2周测量体质量、腹围1次,到治疗的第10周。患者入组时、治疗4周和10周时分别进行PANSS评分,并计算症状减分率。症状减分率=(4周末评分-入组时评分)/入组时评分。
患者入组时、入组后4周及10周分别抽取肘静脉血5 mL,0.9 mol/L的枸橼酸钠抗凝。所有血样在晨8∶00~8∶30空腹抽取,抽取后在1 h内分离血浆和血细胞并分别放置-80 ℃冰箱冷冻保存。全部患者观察完成后统一用放射免疫法测血浆瘦素浓度。瘦素试剂盒由北京北方生物技术研究所提供,CVw<5%,CVb<10%;灵敏度:0.45 μg/L,回收率平均96.1%。
1.3 DNA抽提和基因分型 天为时代DNA抽提试剂盒抽提患者DNA。PCR-RFLP技术扩增患者目的DNA片断(瘦素基因启动子区-2608~-2367)并行基因分型。上、下游引物分别为5′-TTTCCTGTAATTTCCCGTGAG-3′和5′-AAAGCAAAGACAGGCATAAAAA-3′(北京赛百盛公司)。PCR反应体系为25 μL反应体积,包含1 μg模板基因组DNA,上、下游引物浓度分别分150 μmol/L,2×TaqPCR MasterMix(天为时代公司)12.5 μL。PCR温度循环条件为:95 ℃预变性5 min;94 ℃变性30 s、53 ℃复性30 s、72 ℃延伸1 min,循环反应30次,72 ℃充分延伸7 min。242 bp扩增产物经Hin6Ⅰ限制性内切酶(ISO公司)37 ℃消化1.5 h,消化产物经30 g/L的琼脂糖凝胶电泳及溴化乙啶染色鉴定并进行基因分型。未切片断命名为-2548A(242 bp),已切片段命名为-2548G(181 bp和61 bp)。
1.4 统计学方法 正态性检验检测患者各项指标是否符合正态分布,如不符合作log转换使其符合正态分布。Hardy-Weibberg平衡检验确认样本的群体代表性。重复测量方差分析检验患者治疗前后体质量指标和症状减分率的变化,以年龄、性别、治疗后体质量是否显著增加、瘦素基因型分层检测体质量指标、血浆瘦素水平和精神症状是否有差异,差异的比较使用方差分析的最小显著差异法(LSD)。Pearson相关分析分析体质量、血浆瘦素水平和症状减分率间的关系。逐步多元回归分析检测影响血浆瘦素水平变化的因素。P<0.05为差异有统计学意义。
2 结 果
2.1 瘦素基因的哈-温检验结果 经正态性检验发现瘦素指标不符合正态分布,经log转换后,所有观察指标均符合正态分布,基因型分布符合Hardy-Weinberg遗传平衡法则(P>0.05,表1)。

表1 瘦素基因-2548G/A多态性Hardy-Weinberg遗传平衡检验Tab.1 Hardy Weinberg genetic equilibrium test of leptin gene-2548 G/A polymorphism
2.2 利培酮治疗前后体质量指标的变化 利培酮治疗后BMI和腹围均有显著性升高,4周和10周的上述指标与基础值间有统计学差异(表2)。以年龄分层发现,≥30岁年龄组BMI,腹围均显著高于<30岁年龄组,组间有统计学差异(表3);性别分层发现,女性BMI显著高于男性,但腹围没有统计学差异(表4)。治疗后是否体质量增加及基因型分别分层发现BMI及腹围变化均没有统计学差异。
2.3 利培酮治疗前后瘦素水平的变化 利培酮治疗后血浆瘦素水平增加,4周时显著性增加,但在10周时略有下降,治疗4周时瘦素水平升高有显著性(表2)。年龄(表3)、性别(表4)、基因型及治疗后体质量是否显著增加,分别分层发现组间瘦素指标均没有统计学差异。
2.4 利培酮治疗前后精神症状的变化 利培酮治疗后患者阳性症状、阴性症状、一般状况和PANSS总分均有显著性下降,与基础值比较有统计学差异(表2);性别分层发现,女性患者总分高于男性,组间有统计学差异(表4)。年龄(表3)、基因型和治疗后体质量是否显著增加,分别分层发现各症状减分率变化在组间没有统计学差异。
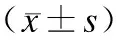
表2 患者治疗前后体质量指标、精神症状和瘦素指标的变化Tab.2 The changes in weight index, leptin and psychiatric symptoms before and after treatment
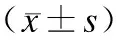
表3 年龄分组,治疗前后体质量指标、症状评分及瘦素水平的变化Tab.3 Changes in weight index, leptin and psychiatric symptoms before and after treatment in different age groups
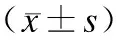
表4 性别分组,治疗前后体质量指标、症状评分及瘦素水平的变化Tab.4 Changes in weight index, leptin and psychiatric symptoms before and after treatment in different sex groups
2.5 利培酮治疗前后体质量变化与症状减分率的相关性 基础体质量指标与4周和10周体质量指标变化值负相关(BMI:r=-0.223,-0.351;腹围:r=-0.405,-0.343)。基础、治疗4周和10周瘦素水平与相应的BMI正相关(r=0.287,0.397,0.358)。患者治疗4周和10周时,各症状减分率、体质量指标变化值与血浆瘦素水平间均不存在相关关系(P>0.05)。
以4周和10周血浆瘦素水平和瘦素变化值为应变量,年龄、性别、基因型、药物剂量、相应的体质量指标和体质量指标变化值、基础精神症状评分及精神症状减分率为自变量,行逐步回归分析发现体质量相关指标显著影响血浆瘦素水平和瘦素变化值,基因型和精神症状评分及其他指标对血浆瘦素水平或瘦素变化值没有显著影响。
3 讨 论
利培酮是目前治疗精神分裂症应用最广泛的药物之一。本研究发现利培酮治疗后,患者体质量均有显著性增加,精神症状评分也有显著性下降[9],血浆瘦素水平在治疗早期显著增加,随后增加幅度下降。女性患者较男性体质量指数高,且PANSS评分总分也显著高于男性。并发现治疗前年龄越大,治疗后体质量增加越明显。基础体质量指标和治疗后体质量指标变化值负相关。
有文献报道利培酮治疗过程中,低的BMI、较小的年龄、较高的药物剂量、疗效均和较显著的体质量增加有关[10-11]。本研究也发现基础体质量越低,利培酮治疗后体质量增加越显著,与上述文献一致,且与大多数研究结果一致[12-13]。但发现年龄大于30岁组,其体质量指数及腹围均明显高于年龄小于30岁组,不论年龄大小,治疗后体质量均显著增加。利培酮治疗的体质量增加与年龄大小没有明显关联性,与上述文献不同。本研究还发现,女性患者体质量增加程度高于男性,与目前研究结果一致[14]。故对于基础体质量较低且是女性的患者,在选择抗精神病药治疗时应该考虑到可能的体质量增加的副作用。
本研究发现,利培酮治疗后血浆瘦素水平升高,瘦素基因型与体质量增加没有关联性,与TEMPLEMAN、张欢等报道一致[15-16],但与张志珺等[4]研究结果不同。不排除研究样本不同的原因。本研究发现,血浆瘦素水平与体质量指标(BMI)正相关,体质量相关指标显著影响血浆瘦素水平和血浆瘦素变化值。POTVIN等[17]做的Meta分析的结果显示血浆瘦素水平与抗精神病药治疗后的体质量增加有关,瘦素在其中起负反馈的作用。这与本研究结果基本一致。说明在抗精神病药导致的体质量增加中,瘦素起了一定的作用。瘦素水平增加,随后发生了瘦素抵抗,从而体质量进一步增加。本研究发现血浆瘦素水平在治疗早期显著增加,随后增加程度有下降,而在治疗期间体质量指标均有显著性增加,考虑利培酮导致的体质量增加不仅与瘦素有关,还有其他内分泌激素参与其中。且不排除与本研究样本不大,不排除存在偏移。故随后还需要大样本研究进一步证实。
CANUSO等[18]发现女性精神分裂症患者的严重程度低于男性。与本研究不同,本研究发现女性患者PANSS总分高于男性,但在阳性、阴性及一般状况方面没有显著性不同。但RUBIN等[19]的研究与本研究一致,女性患者有更高的严重程度。故还需要更多的研究进一步证实上述结论。精神症状减分率与体质量变化值间不存在相关性,治疗不同时期的精神症状评分与相应的体质量指标间也不存在相关性。与CZOBOR等[6]研究结果一致。本研究也发现精神症状评分及其减分率对相应时间的血浆瘦素水平和血浆瘦素变化无影响;不同瘦素基因型间也未发现精神症状减分率的差异。
本研究未设健康对照,为单药治疗前后比较的单臂试验,故本研究结论可能存在一定局限性,需要更大样本及设立对照的双臂研究进一步验证。
[1] DONNA A, WORSHING MD. Schizophrenia and obesity: Impact of antipsychotic medications[J]. Clin Psychiatry, 2004, 65(18):13-27.
[2] SUGAI T, SUZUKI Y, YAMAZAKI M, et al. High prevalence of underweight and undernutrition in Japanese inpatients with schizophrenia: a nationwide survey[J]. BMJ Open, 2015, 5(12):e008720.
[3] LETT TA, WALLACE TJ, CHOWDHURY NI, et al. Pharmacogenetics of antipsychotic-induced weight gain: review and clinical implications[J]. Mol Psychiatry, 2012, 17(3):242-266.
[4] 张志珺,姚志剑,牟晓冬,等. 瘦素基因启动子区22548G/A功能多态性与抗精神病药源性肥胖的相关分析[J]. 中华医学杂志, 2003, 83(24):2119-2123.
[5] TAYLOR DM, MCASKILL R. Atypical antipsychotics and weight gain: a systematic review[J]. Acta Psychiatr Scand, 2000, 101:416-432.
[6] CZOBOR P, VOLAVKA J, SHEITMAN B, et al. Antipsychotic-induced weight gain and therapeutic response: A differential association[J]. J Clin Psychopharmacol, 2002, 22(3):244-251.
[7] BASSON BR, KINON BJ, TAYLOR CC, et al. Factors influencing acute weight change in patients with schizophrenia treated with olanzapine, haloperidol, or risperidone[J]. J Clin Psychiatry, 2001, 62:231-238.
[8] JONES B, BASSON BR, WALKER DJ, et al. Weight change and atypical antipsychotic treatment in patients with schizophrenia[J]. J Clin Psychiatry, 2001, 62[suppl 2]:41-44.
[9] HARVEY RC, JAMES AC, SHIELDS GE. A systematic review and network meta-analysis to assess the relative efficacy of antipsychotics for the treatment of positive and negative symptoms in early-onset schizophrenia[J]. CNS Drugs, 2016, 30(1):27-39.
[10] LANE HY, CHANG YC, CHENG YC, et al. Effects of patient demographics, risperidone dosage, and clinical outcome on body weight in acutely exacerbated schizophrenia[J]. J Clin Psychiatry, 2003, 64:316-320.
[11] 郭丽阳,亢万虎,李强,等. 精神分裂症患者ghrelin基因多态性与利培酮治疗前后患者体重和血脂变化的关系[J].西安交通大学学报(医学版),2007,28(5):530-532.
[12] MUSIL R, OBERMEIER M, RUSS P, et al. Weight gain and antipsychotics: a drug safety review[J]. Expert Opin Drug Saf, 2015, 14(1):73-96.
[13] AMAN M, RETTIGANTI M, NAGARAJA HN, et al. Tolerability, safety and benefits of risperidone in children and adolescents with autism: 21-month follow-up after 8-week placebo-controlled trial[J]. J Child Adolesc Psychopharmacol, 2015, 25(6):482-493.
[14] HUNG GC, KUO CJ, HUANG MC, et al. Sex differences in the association of weight gain and risperidone efficacy among schizophrenic patients[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2010, 34(8):1523-1524.
[15] TEMPLEMAN LA, REYNOLDS GP, ARRANSZ B, et al. Polymorphisms of the 5-HT2C receptor and leptin genes are associated with antipsychotic drug induced weight gain in Caucasian subjects with a first-episode psychosis[J]. Pharmacogenetics Genomics, 2005, 15:195-200.
[16] 张欢,亢万虎,郭丽阳,等. 瘦素和5-HT2C受体基因在利培酮致肥胖中的作用[J]. 西安交通大学学报(医学版),2010, 31(3):332-335.
[17] POTVIN S, ZHORMITSKY S, STIP E. Antipsychotic-induced changes in blood levels of leptin in schizophrenia: a meta-analysis[J]. Can J Psychiatry, 2015, 60(3):26-34.
[18] CANUSO CM, PANDINA G. Gender and schizophrenia[J]. Psychopharmacol Bull, 2007, 40(4):178-190.
[19] RUBIN LH, CARTER CS, DROGOS L, et al. Peripheral oxytocin is associated with reduced symptom severity in schizophrenia[J]. Schizophr Res, 2010, 124, (3):13-21.
(编辑 韩维栋)
Relation of risperidone-induced changes in body weight,serum leptin concentration and leptin gene with psychosis
GUO Li-yang, KANG Wan-hu, GAO Cheng-ge, MA Xian-cang,YANG Xiao-bo, CHEN Ce, LI Ya-mei
(Department of Psychiatry, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To analyze the relation of serum leptin concentration and leptin gene -2548G/A polymorphism with risperidone-induced body weight change and treatment response. Methods We recruited 66 Chinese Han-nationality patients with schizophrenia or schizophrenia-like psychosis. Waistline and body mass index (BMI) were measured on admission and every 2 weeks subsequently for all the patients; plasma leptin level was also measured on admission, at 4-week and 10-week treatment. The polymorphism of leptin gene was determined with PCR-RFLP technique in the patients. The Positive and Negative Symptom Scale (PANSS) was used for the evaluation of the improvement of clinical symptoms. Results After 10 weeks’ risperidone treatment, patients’ waistline and BMI increased significantly (P=0.000, 0.002). There was an average increase of (1.52±1.28)kg/m2in BMI and (4.08±4.32)cm in waistline. In addition, leptin was increased during treatment without significance (P=0.102). The change in index of the body weight was associated with the baseline index of the body weight. The index of the body weight was also associated with the plasma leptin level and the change in plasma leptin level. Plasma leptin level and the changed leptin level were not associated with the genotypes, allele frequencies or the response to risperidone treatment in the patients (P>0.05). Conclusion The -2548G/A polymorphism in promoter region of leptin gene is unlikely to play an important role in risperidone-induced weight gain. Increase in body weight is unlikely to be an indicator of response to risperidone treatment in schizophrenia or schizophrenia-like psychosis.
risperidone; weight gain; leptin; gene polymorphism; schizophrenia
2015-11-24
2016-04-15
陕西省科技攻关项目(No.2013K12-01-12)
Supported by the Scientific and Techological Project of Shaanxi Province (No.2013K12-01-12)
亢万虎. E-mail: kang85323327@126.com
R749.05
A
10.7652/jdyxb201606015
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20161012.1534.010.html(2016-10-12)
