3,4,5-三羟基苯甲酸甲酯防治番茄青枯病的物理作用方式及其对番茄根系次生代谢物质的影响
2016-12-06袁高庆陈媛媛范腕腕黎起秦
袁高庆, 陈媛媛, 范腕腕, 黎起秦, 林 纬
(广西大学农学院, 南宁 530004)
3,4,5-三羟基苯甲酸甲酯防治番茄青枯病的物理作用方式及其对番茄根系次生代谢物质的影响
袁高庆, 陈媛媛, 范腕腕, 黎起秦, 林 纬
(广西大学农学院, 南宁 530004)
通过生物学方法测定3,4,5-三羟基苯甲酸甲酯(MG)防治番茄青枯病的物理作用方式,采用气相色谱-质谱联用方法分析该化合物对番茄根系组织次生代谢物质的影响。结果表明,3,4,5-三羟基苯甲酸甲酯对番茄青枯病有较好的预防作用,持效期较长,施药15 d 后接种青枯病菌,防效仍达52.12%;该化合物可快速扩散到番茄根系组织内,但其向植株顶部和基部的输导作用弱,对番茄青枯病的治疗效果差。番茄根系中共鉴定出36种次生代谢物质,与对照相比,3,4,5-三羟基苯甲酸甲酯处理对番茄根系次生代谢产物的组成和相对含量有明显影响,其中与抑菌活性相关的物质有香叶醇、豆甾醇、β-谷甾醇和木栓醇等4种,前3种物质在3,4,5-三羟基苯甲酸甲酯处理植株体内表现为含量显著升高,木栓醇则为苗期用3,4,5-三羟基苯甲酸甲酯处理后番茄根系新增的化合物。
3,4,5-三羟基苯甲酸甲酯; 番茄青枯病; 物理作用方式; 次生代谢物质
茄青枯拉尔氏菌[Ralstoniasolanacearum(Smith) Yabuuchi et al.]可引起多种植物的青枯病,广泛分布于热带、亚热带及某些温带地区,并有逐渐向高纬度冷凉地区蔓延的趋势[1-2]。防治青枯病必须采取综合措施,其中药剂防治依然是重要的防控措施之一,但目前用于防治青枯病的药剂品种单一,亟待开发出新型药剂。本文作者前期研究发现,木蜡树(Toxicodendronsylvestre)中的3,4,5-三羟基苯甲酸甲酯(methyl gallate,MG)对多种植物病原菌具有较强的离体抑制活性,可显著影响茄青枯拉尔氏菌生长、能量代谢和蛋白质表达等[3-4],且MG 稳定性好,在温室及大田条件下均可有效控制番茄青枯病的发生[3,5]。MG属于酚酸酯类化合物,广泛存在于自然界多种植物中,具有抗氧化、抑菌、抗病毒、对抗血小板聚集等多种生物活性[6]。在农业领域,Ahn等报道MG对稻瘟病、小麦叶锈病和黄瓜灰霉病有较好的防治效果[7];Méndez等将MG施用于菜豆后发现, MG被糖苷化形成3-glucosyl methyl gallate,从而影响菜豆不定根的生长[8-9]。虽然已知的研究报道证实MG有广谱的抑菌活性和较好的病害防治效果,有作为杀菌剂开发利用的潜力,但有关其防治植物病害的作用方式以及对植物生长代谢的研究鲜有报道。本文通过生物学方法测定MG防治番茄青枯病的物理作用方式,采用气相色谱-质谱联用(gas chromatography-mass spectrometry, GC-MS)方法分析MG对番茄根系组织次生代谢物质合成的影响,从而可以进一步揭示MG有效控制番茄青枯病的机制,为合理应用MG防治植物病害提供科学依据。
1 材料与方法
1.1 供试材料
供试番茄品种为‘金卡红’,属于高感青枯病品种,由广州金卡农业科技有限公司提供;培养番茄所用基质为全价育苗基质(有机质+腐殖酸≥50%),由长春市赛世农业开发有限责任公司生产;茄青枯拉尔氏菌菌株Rs-T02由广西大学植物病理学研究室提供,使用时以牛肉膏蛋白胨培养液在28℃130 r/min条件下振荡培养;3,4,5-三羟基苯甲酸甲酯(MG)为人工合成,纯度大于99%,由阿拉丁试剂有限公司提供,使用时用10%甲醇配制成MG母液。
1.2 MG防治番茄青枯病的物理作用方式测定
1.2.1 番茄苗的培育
在玻璃温室中(28±5)℃以育苗基质培育番茄苗至长出真叶,移入塑料盆中以水培法培育,每星期更换1次培养液,至4~5叶期,用于测定MG的作用方式。其中水培营养液成分及用量为:A液,Ca(NO3)2·4H2O 59 g,KNO340.4 g,水1 000 mL;B液,KH2PO413.6 g,MgSO4·7H2O 24.6 g,水1 000 mL;C液,NaFe-EDTA 30 g,MnSO4·4H2O 2.13 g,ZnSO4·7H2O 0.22 g,CuSO4·5H2O 0.08 g,(NH4)6Mo7O24·4H2O 0.02 g,水1 000 mL。取A液8 mL、B液8 mL、C液0.8 mL,加水补足5 L即为每一栽培盆的水培用量。
1.2.2 MG的扩散作用测定
培养液中加入MG母液使其终浓度分别为10 μg/mL和20 μg/mL,番茄植株在其中分别培养24 h和48 h后,用流动清水反复冲掉番茄苗根系及根茎部表面的MG,植株备用。同时,在新鲜的培养液中加入振荡培养24 h的青枯菌Rs-T02,使其浓度为107cfu/mL。将植株移至含菌培养液中,以清水处理为对照,每个处理20株,3次重复。观察番茄植株发病情况,当植株部分枝条或全株出现萎蔫症状并且镜检有喷菌现象时,确定为发病。接种后第30天计算发病率和防治效果,分析前期处理中MG从根系及根茎部组织表面向内的扩散作用。发病率和防治效果按以下公式计算。
发病率(%)=(病株数/总株数)×100;
防治效果(%)= 100×(对照发病率-处理发病率)/对照发病率。
1.2.3 MG向顶输导作用的测定
培养液中加入MG母液使其终浓度分别为20 μg/mL和200 μg/mL,番茄植株在其中培养24 h后,将振荡培养24 h的青枯菌浓度调整为107cfu/mL用剪刀蘸取菌液,从番茄苗最顶端第一张完全展开的叶片的叶尖处剪叶,剪口长度约为0.5 cm,并使剪口处叶肉组织与剪刀蘸取的菌液接触2 s,以清水处理为对照,每个处理20株,3次重复。当接种叶片所在枝条出现萎蔫症状并且镜检有喷菌现象时,确定为发病。以接种后第30天的发病率和防治效果分析MG是否能够向植株顶部输导。
1.2.4 MG向基输导作用的测定
分别将浓度为20 μg/mL和200 μg/mL的MG溶液均匀涂抹在番茄苗所有叶片的正反面,24 h后移至含有107cfu/mL青枯菌的培养液中,以清水处理为对照,每盆20株,每处理3次重复。以接种后第30天的发病率和防治效果分析MG是否能够向植株基部输导。
1.2.5 MG持效期、预防作用及治疗作用的测定
番茄植株在营养液中长至4~5叶期后,移至含20 μg/mL MG的新培养液中,培养24 h后,用清水冲洗根茎部表面,再移至无MG的培养液中,分别将用20 μg/mL MG处理后0、5、15和20 d的番茄植株同时移至含107cfu/mL 青枯菌液的新培养液中。对照植株不用MG处理,与上述MG处理后不同天数的植株同时接种。同时另设一个处理观察MG的治疗作用,取未用MG处理的番茄植株,在其培养液中加入青枯菌液进行接种,5 d后移至含20 μg/mL MG的新培养液中,以同时接种的未加MG的番茄植株作对照,每个处理20株,3次重复。最后以接种后第30天的病株率和防治效果分析MG的持效期、预防作用及治疗作用。
1.3 番茄根系次生代谢物质的GC-MS分析
1.3.1 样品的制备
番茄种子催芽露白后植入营养钵的育苗基质中,每隔7 d灌施20 μg/mL的MG溶液,培育至苗期(4~5叶期),一部分番茄苗用于制备苗期样品,另一部分移栽至大田,每隔10 d灌施500 μg/mL的MG溶液,连施3次,之后按照常规对番茄植株管理至开花结果期,以0.1%甲醇溶剂处理为对照。苗期和开花结果期番茄根系次生代谢物质样品的制备方法如下:取根系组织清水冲洗,将表面水分吸干,加入液氮研碎,称取3.0 g,快速装入离心管中,加入2 mL氯仿,置于涡旋振荡仪上振荡15 min,之后冷冻离心5 min(4℃,5 000 r/min)。移取上清液1 mL,加入一定量无水硫酸钠,0.22 μm 有机滤膜过滤[10-11]。每个处理15株,3次重复。
1.3.2 番茄根系次生代谢物质的GC-MS分析
采用美国Varian 300-MS气相色谱质谱联用仪进行分析。气相色谱条件:VF-5MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm),柱温:50℃保持2 min,之后以5℃/min的速率升温至290℃,保持15 min,载气:He,进样温度:250℃,进样量:1 μL,分流比2;质谱条件:EI(电子轰击):70 eV,倍增器电压1 250 V,扫描质量范围(m/z)45~500。通过谱图库检索鉴定化合物,采用总离子流色谱峰的峰面积归一化法计算各种成分的相对含量。
2 结果与分析
2.1 MG防治番茄青枯病的物理作用方式
表1中MG扩散作用测定结果显示,当MG的浓度分别为10 μg/mL和20 μg/mL时,施用MG 24 h或者48 h的各处理的防治效果均在80%以上,且各处理之间的差异不显著,这说明MG有快速扩散作用。在测定MG向顶输导作用的试验中,MG浓度为20 μg/mL的植株发病率为60%,即使MG浓度提高10倍,植株发病率仍达到56.67%,对照植株的发病率为66.67%,三者之间差异未达到显著水平(表1),这表明MG的向顶输导作用很弱。向基输导作用的测定试验中,20、200 μg/mL的MG处理以及对照植株发病率分别为63.33%、58.33%和65%,施药与不施药处理差异不显著(表1),由此说明MG向基输导作用很弱。
另外从表1可以看出,MG处理番茄后,在间隔不同时间接种的植株,其发病情况有所不同。随着间隔时间的延长,发病植株有所增加。接种30 d后调查植株发病情况,MG处理当天和间隔5 d后接种植株的发病率较低,分别为6.67%和3.33%;MG处理后10 d和15 d后接种的植株发病率基本一致,分别为23.33%和25%;MG处理后20 d接种,植株发病率为40%,CK的发病率为51.67%。由此推测MG在温室条件下的持效期可达到15 d,并且对控制番茄青枯病有较好的预防作用。当番茄先接种青枯病菌5 d后再施用MG,防治效果仅为13.03%,这说明MG对番茄青枯病的治疗作用很差,因此,MG主要是作为预防保护剂对番茄青枯病起作用的。
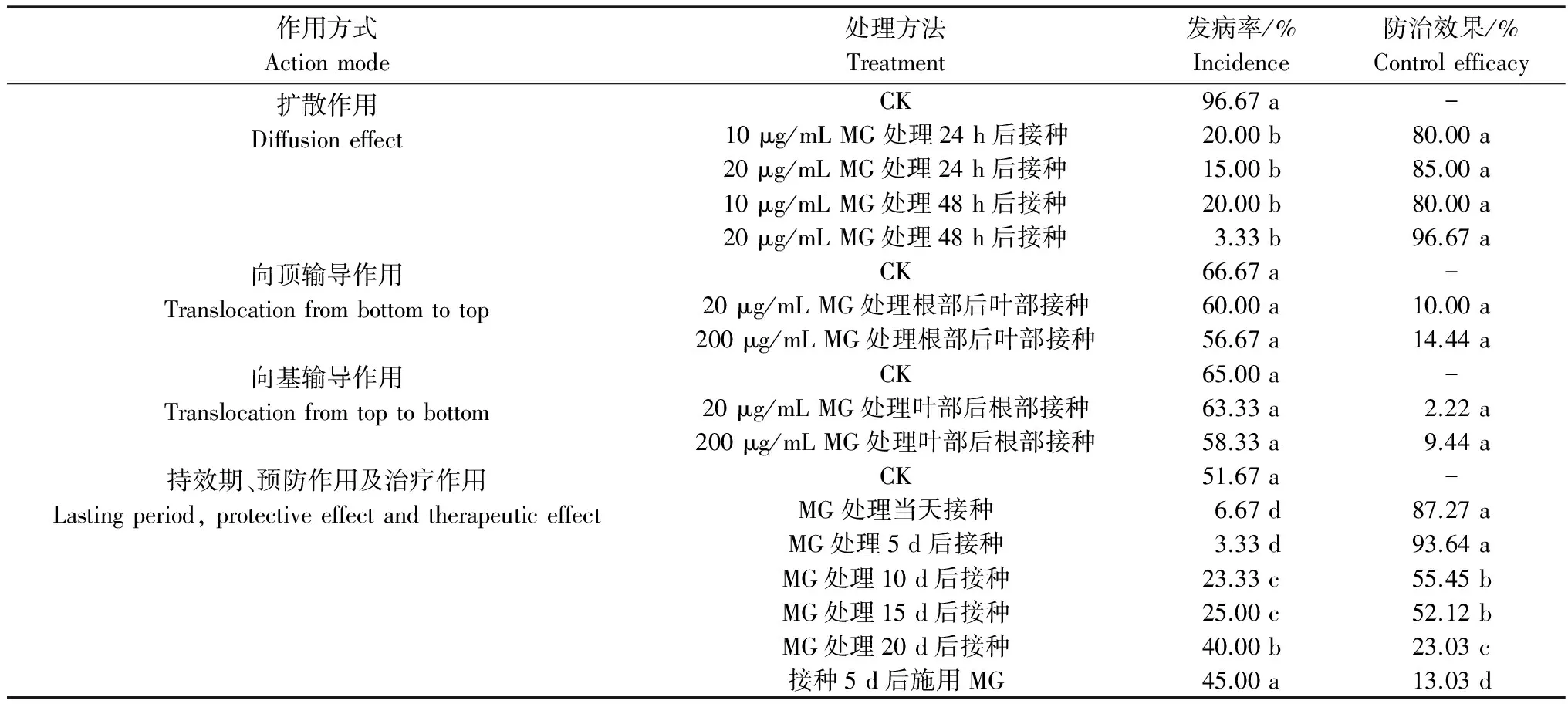
表1 MG防治番茄青枯病的物理作用方式1)
1) 每列数字后不同小写字母表示同一测定项目内不同处理间数据达到显著差异(P<0.05)。
Data in the same column followed by different letters indicate significant difference between the data of the same action mode (P<0.05).
2.2 MG对番茄根系次生代谢的影响
试验结果见表2。在鉴定出的36种化合物中,苯甲醇、水杨酸甲酯、棕榈酸、顺式-11,14-二十碳二烯酸甲酯、硬脂酸、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)、邻苯二甲酸二异辛酯、维生素E、豆甾醇、β-谷甾醇以及Cholest-5-en-3-ol,24-propylidene-,(3beta)等11种化合物在所有处理的番茄根系中均被检测到。番茄根系在不同发育阶段次生代谢产物差异较明显,与苗期相比,成熟期的化合物减少了12种,新增了8种。另外,十五烷和木栓酮只存在于育苗期施用MG的处理中,苄基肼、蔗糖、乙酸环阿屯酯3种化合物仅存在于移栽后施用MG的番茄根系中。
表2所列36种化合物中,目前已知具有抑菌杀菌生物活性的物质有豆甾醇[12-13]、β-谷甾醇[14]、香叶醇[15-16]以及木栓酮[14,17]等4种。4个处理中都含有豆甾醇和β-谷甾醇,均表现为施用MG后的含量明显增多。对于豆甾醇,育苗期和移栽后施用MG的处理组其含量分别为17.09%和8.78%,与对照组相比,分别增加了45.45%和68.85%;对于β-谷甾醇,育苗期和移栽后施用MG的处理组其含量分别为5.3%和6.13%,与对照组相比,分别增加了133.84%和156.78%。番茄育苗期对照组和MG处理组均未检测到香叶醇,移栽后MG处理组香叶醇含量为6.27%,为对照组的162.44%。木栓酮为育苗期MG处理组番茄根系中新增的化合物,但在移栽后的MG处理组及对照组中均未检测到。
对照和MG处理间物质含量差别较大的次生代谢产物还有己内酰胺、顺式-11,14-二十碳二烯酸甲酯、亚麻酸、苯甲醇和水杨酸甲酯。前3种化合物均表现为MG处理后含量明显降低,苯甲醇和水杨酸甲酯则表现为在苗期MG处理中含量降低而在成熟期MG处理中含量升高。
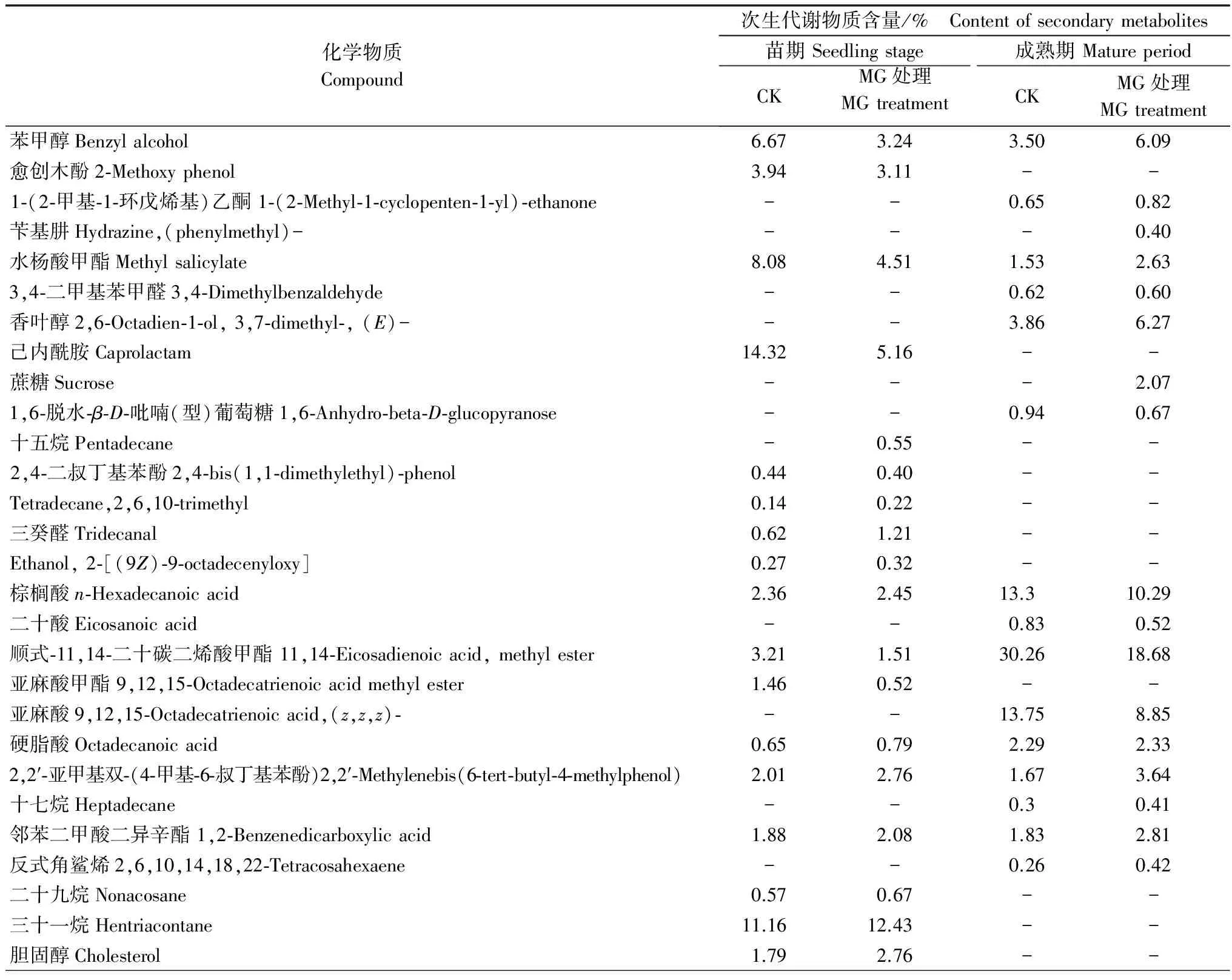
表2 MG处理下番茄根系次生代谢物质的组成及含量
续表2 Table 2(Continued)
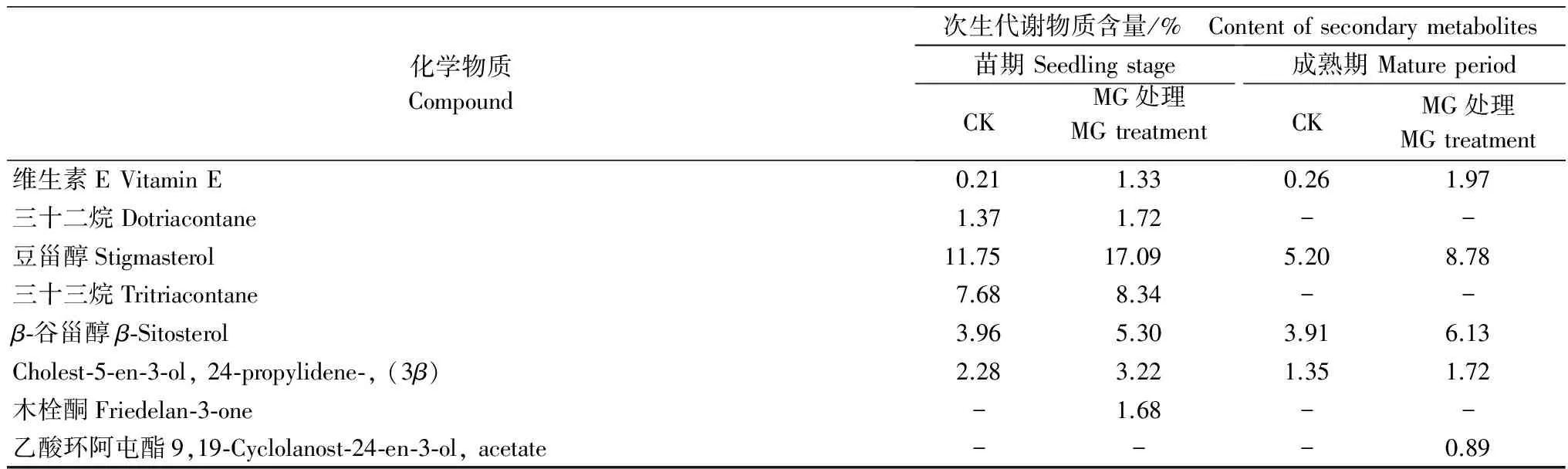
化学物质Compound次生代谢物质含量/% Contentofsecondarymetabolites苗期SeedlingstageCKMG处理MGtreatment成熟期MatureperiodCKMG处理MGtreatment维生素EVitaminE0.211.330.261.97三十二烷Dotriacontane1.371.72--豆甾醇Stigmasterol11.7517.095.208.78三十三烷Tritriacontane7.688.34--β⁃谷甾醇β⁃Sitosterol3.965.303.916.13Cholest⁃5⁃en⁃3⁃ol,24⁃propylidene⁃,(3β)2.283.221.351.72木栓酮Friedelan⁃3⁃one-1.68--乙酸环阿屯酯9,19⁃Cyclolanost⁃24⁃en⁃3⁃ol,acetate---0.89
3 结论与讨论
在病害防治中,明确一种药剂的作用方式能够指导该药剂的科学施用,包括恰当的施用时期、正确的施用部位和使用方式等,对于提高该药剂的防治效果至关重要。根据本研究的结果,3,4,5-三羟基苯甲酸甲酯(MG)对番茄青枯病的预防效果比较理想,但在番茄植株内的向顶和向基的输导作用很差,治疗作用比较弱。另外, MG虽然可被番茄植株根系和根茎部组织快速吸收,但据推测属于短距离的被动扩散,即便MG在番茄植株上有较长的持效期,如果病菌侵入器官距离植株施用药液的部位较远时,药剂也很难达到有效的防治效果。基于此,在用MG控制番茄青枯病时,应当在病菌侵入寄主植物前或刚刚侵入到寄主植物的表皮器官时施用,且药液尽可能分布到病菌易侵染的寄主组织表面。
植物次生代谢并非生物体或细胞生长所必需,是植物在漫长的进化过程中对生态环境适应的结果,目前已发现生物碱、黄酮类、甾体类、醌类、萜类、单宁、苯丙素类和甙类等多种次生代谢产物在植物抗各种病原的过程中起作用[18]。还有些次生代谢产物是在病菌或其他因子的诱导作用下植物体内新合成的物质,属于诱导型次生产物,其中就包括植保素[19]。本研究中,在MG作用下,番茄根系次生代谢物质成分与对照相比有较大变化,体现在代谢物质种类及相对含量上。其中,含量变化明显的苯甲醇、己内酰胺、顺式-11,14-二十碳二烯酸甲酯和亚麻酸等物质在植物体内的作用尚未知晓,而香叶醇、豆甾醇、β-谷甾醇和木栓醇是具有抑菌杀菌生物活性作用或参与植物抗逆抗病的重要物质,香叶醇还可通过目标外排机制恢复一些革兰氏阴性菌株的药物敏感性[12-17],后4种物质在MG作用后的植株体内表现为新增或含量显著升高。推测MG能够诱导番茄根系次生代谢途径发生改变,从而导致根系次生代谢物质成分变化。但是从MG的物理作用方式测定结果来看,本论文中MG的使用浓度或方法所起到的诱导作用有限,使得番茄中具有抑菌活性或诱导抗性的物质含量过低,无法从根本上抵御青枯菌的侵染,需要MG直接作用于病菌才能阻止或减轻青枯病的发生。这些物质在种类和含量上的变化可能与MG的处理方法密切相关。今后将进一步探讨MG是否有诱导番茄植株产生抗病性的作用,而且,含量变化明显的这些物质对番茄植株的生理活性功能以及对茄青枯拉尔氏菌的抑菌活性也值得深入研究,有可能为应用MG防治植物青枯病提供新的思路。另外,水杨酸甲酯是植物体内重要的信号物质,广泛参与植物多种代谢过程,在植物的抗逆反应中具有重要作用,其中包括在植物诱导抗病性以及系统获得抗病性过程中起到信号转导作用[20]。番茄育苗期含有较多水杨酸甲酯(8.08%),但到成熟期含量显著下降,仅为1.53%,MG作用于番茄后在苗期降低了水杨酸甲酯的含量,而在成熟期又有所促进。造成该化合物含量变化的原因和由此产生的功能尚不清晰,均有待后续研究。
[1] Hayward A C.Characteristics ofPseudomonassolanacearum[J]. Journal of Applied Microbiology, 1964, 27(2): 265-277.
[2] Stephane G, Timothy P D.Pathogenomics of theRalstoniasolanacearumspecies complex [J]. Annual Review of Phytopathology, 2012, 50: 67-89.
[3] Yuan Gaoqing, Li Qiqin, Qin Jian, et al. Isolation of methyl gallate fromToxicodendronsylvestreand its effect on tomato bacterial wilt [J]. Plant Disease, 2012, 96: 1143-1147.
[4] Fan Wanwan, Yuan Gaoqing, Li Qiqin, et al. Antibacterial mechanisms of methyl gallate againstRalstoniasolanacearum[J]. Australasian Plant Pathology, 2014, 43(1): 1-7.
[5] 李悦, 范腕腕, 袁高庆, 等. 3,4,5-三羟基苯甲酸甲酯的抑菌特性及其对番茄青枯病的田间防治作用[J]. 农药, 2014, 53(11): 845-848.
[6] Chaubal R, Deshpande V H, Deshpande N R.Methyl gallate, the medicinally important compound:a review[J]. Electron Journal of Environmental, Agricultural and Food Chemistry, 2005, 4:956-962.
[7] Ahn Y J, Lee H S, Oh H S, et al. Antifungal activity and mode of action of Galla rhois-derived phenolics against phytopathogenic fungi [J]. Pesticide Biochemistry and Physiology, 2005, 81(2): 105-112.
[8] Méndez J, Mato M C.Methyl gallate and related polyphenols as auxin protectors [J]. Phytochemistry, 1997, 44:41-43.
[9] Méndez J, Vázquez A, Mato M C.Methyl gallate and its 3-glucoside promote rooting in bean cuttings [J]. Plant Growth Regulation, 2004, 43(3): 275-278.
[10]郭广君, 高建昌, 王孝宣, 等. 不同番茄种质叶表次生代谢物质[J]. 植物学报, 2014, 49(1): 19-29.
[11]Lytovchenko A, Beleggia R, Schauer N, et al. Application of GC-MS for the detection of lipophilic compounds in diverse plant tissues [J]. Plant Methods, 2009, 5(1): 4-11.
[12]Katerere D R, Eloff J N.Anti-bacterial and anti-oxidant activity ofHypoxishemerocallidea(Hypoxidaceae): Can leaves be substituted for corms as a conservation strategy?[J]. South African Journal of Botany, 2008, 74(4): 613-616.
[13]Miraliakbari H, Shahid F.Antioxidant activity of minor components of tree nut oils [J]. Food Chemistry, 2008, 111: 421-427.
[14]刘建群, 吴继梅, 张锐. 扁担杆化学成分体外抑菌活性研究[J]. 江西中医学院学报, 2009, 21(2): 75-76.
[15]Mendon Ade L, da Silva C E, de Mesquita F L, et al. Anti-microbial activities of components of the glandular secretions of leaf cutting ants of the genusAtta[J]. Antonie Van Leeuwenhoek, 2009, 95(4): 295-303.
[16]隋洪楠. 香草精油作为抗菌剂的应用[J]. 发酵科技通讯, 2014, 43(2): 46-49.
[17]Lee I, Lee Y H, Leonard J, et al. Ursolic acid-induced changes in tumor growth, O2consumption and tumor interstitial fluid pressure[J]. Anticancer Research, 2001, 21: 2827-2834.
[18]周立刚.植物抗菌化合物[M].北京:中国农业科学技术出版社,2005:1-293.
[19]Grayer R J, Harborne J B.A survey of antifungal compounds from higher plants [J]. Phytochemistry, 1994, 37: 19-42.
[20]An Y, Shen Y B, Wu L J, et al. A change of phenolic acids content in poplar leaves induced by methyl salicylate and methyl jasmonate[J]. Journal of Forestry Research, 2006, 17(2): 107-110.
(责任编辑:田 喆)
Physical modes of action of methyl gallate for controlling tomato bacterial wilt and its effect on secondary metabolites of tomato roots
Yuan Gaoqing, Chen Yuanyuan, Fan Wanwan, Li Qiqin, Lin Wei
(College of Agriculture, Guangxi University, Nanning 530004, China)
The physical modes of action of methyl gallate (MG) for controlling tomato bacterial wilt were determined by biological method, and its effect on secondary metabolites of tomato roots was determined by gas chromatography-mass spectrometry (GC-MS) method. The results showed that methyl gallate could effectively protect tomato from tomato bacterial wilt with a long lasting period. When methyl gallate was applied 15 d before the pathogen was inoculated, the control efficacy could reach 52.12%. Methyl gallate could diffuse quickly towards tomato root tissues; however, the compound was difficult to translocate from bottom to top or reversed. A total of 36 secondary metabolites produced from tomato roots were identified. Compared with the contrast, the categories and relative contents of root secondary metabolites under the MG treatment were obviously changed. Four of them were relevant to antimicrobial activity, which were geraniol, stigmasterol,β-sitosterol and friedelinol, and the first three were significantly increased and friedelinol was a new compound in seedling roots under the MG treatment.
methyl gallate; tomato bacterial wilt; physical mode of action; secondary metabolite
2015-12-21
2016-02-15
广西自然科学基金(2013GXNSFAA019056)
S 436.412
A
10.3969/j.issn.0529-1542.2016.06.013
联系方式 E-mail: ygqtdc@sina.com
