马铃薯Y病毒属三种病毒通用型单克隆抗体的鉴定
2016-12-06李小宇张春雨张淋淋宋景荣王永志李启云
尤 晴, 李小宇, 张春雨, 张淋淋, 宋景荣, 王永志*, 李启云*
(1.吉林农业大学, 长春 130118; 2. 吉林省农业科学院植物保护研究所, 农业部东北作物有害生物综合治理重点实验室, 吉林省农业微生物重点实验室, 公主岭 136100; 3. 东北农业大学,哈尔滨 150030; 4. 呼伦贝尔市农业科学研究所, 扎兰屯 162652)
马铃薯Y病毒属三种病毒通用型单克隆抗体的鉴定
尤 晴1,2, 李小宇2, 张春雨2, 张淋淋3, 宋景荣4, 王永志2*, 李启云2*
(1.吉林农业大学, 长春 130118; 2. 吉林省农业科学院植物保护研究所, 农业部东北作物有害生物综合治理重点实验室, 吉林省农业微生物重点实验室, 公主岭 136100; 3. 东北农业大学,哈尔滨 150030; 4. 呼伦贝尔市农业科学研究所, 扎兰屯 162652)
构建了马铃薯Y病毒属的大豆花叶病毒(Soybeanmosaicvirus, SMV)、马铃薯Y病毒(PotatovirusY, PVY)、三叶草黄脉病毒(Cloveryellowveinvirus, CLYVV)的原核表达载体pET28-SMV CP、pET28-PVY CP和pET28-CLYVV CP,经IPTG诱导、表达和纯化,获得SMV、PVY和CLYVV的CP蛋白。采用ELISA方法,用9株实验室制备的单克隆抗体对含SMV、PVY、CLYVV的病毒汁液和纯化的重组CP蛋白进行检测分析。结果表明,9株单克隆抗体均识别SMV病毒,2D3、4F9、4G12和6E7单克隆抗体能够识别PVY病毒,4F9和4G12能够识别 CLYVV病毒,但PVY、CLYVV病毒与抗体的亲和力低于SMV病毒;对于重组表达的衣壳蛋白:SMV、CLYVV与抗体2D3、4F9、4G12和6E7反应强烈,PVY与4F9和4G12抗体反应稍强。综上,本研究鉴定出能识别SMV、PVY、CLYVV的通用单克隆抗体4F9和4G12。
大豆花叶病毒; 马铃薯Y病毒; 三叶草黄脉病毒; CP蛋白; 抗体鉴定
马铃薯Y病毒属(Potyvirus)是植物病毒中最大的属,包括 111 个确定种和 86 个暂定种[1],占已知植物病毒的30%。该属病毒引起的病毒病对粮食作物、园艺观赏植物、经济作物、牧草、药材、果树等造成了严重的经济损失[2]。Potyvirus寄主范围最广,可侵染豆科、茄科、菊科、苋科和藜科植物,是大豆、马铃薯、烟草、番茄、玉米等重要农作物的主要病害。病毒粒子呈弯曲的线状,长约 700~750 nm,其基因组为大约10 000个核苷酸组成的单链正义RNA分子。基因组只含有一个开放阅读框,其两端含有非编码区(untranslated region,UTR)。开放阅读框编码一个大的多聚蛋白,多聚蛋白在翻译后自我分解为VPg(virus-encoded genome linked protein)、P1、HC-Pro(aphid transmission helper component-protease)、P3、CI(cylindrical inclusion protein)、6K1、6K2、NIa(nuclear inclusion protein a)、NIb(nuclear inclusion protein b)、CP(coat protein)等蛋白质[3-4]。大多数Potyvirus成员由蚜虫以非持久性方式传播。蚜虫传播病毒需要病毒编码的两种蛋白,一种是衣壳蛋白(CP),另一种是辅助成分-蛋白酶(HC-Pro)[5-6]。1982年Doem等[7]首次成功研制出烟草花叶病毒(Tobaccomosaicvirus, TMV)的单克隆抗体以来,因其具有灵敏度高、特异性强的特点,在多种植物病毒上得到广泛应用。美国Hill等[8]曾研制出两株对SMV有不同抗原决定簇特异性的单克隆抗体;为建立我国的SMV杂交瘤细胞株,国内郭景荣等[9]早在1990年获得3株分泌抗SMV单克隆抗体的杂交瘤细胞株,且与同属的豇豆蚜传花叶病毒(Cowpeaaphid-bornemosaicvirus,CAMV)和西瓜花叶病毒-2(Watermelonmosaicvirus-2,WMV-2)以及不同属的TMV均无交叉反应;王永志等[10]等制备了9株SMV衣壳蛋白的单克隆抗体。同样国内外已筛选并建立了分泌抗PVY的中和抗体[11-14]。Potyvirus成员复杂,且株系分化大、变异频繁,了解各种之间亲缘关系、是否存在相同的抗原表位、分析抗原特异性,对单克隆抗体的制备及今后病毒检测提供了依据。因此,研究PVY、SMV、CLYVV CP蛋白之间抗原表位的关系及其分子变异情况,将有助于了解病毒病的流行和演化趋势,为今后快速检测和抗病育种提供理论依据。
1 材料与方法
1.1 试验材料
本研究采用的SMV(寄主为大豆)是本实验室保存的东北大豆花叶病毒3号株系,PVY(寄主为马铃薯)采自内蒙古扎兰屯,CLYVV(寄主为蚕豆)为本实验室保存毒株,其CP基因已通过前期试验获得。9株抗SMV的单克隆抗体1C2、2A8、2C1、2D3、3B8、4F9、4G12、5D2和6E7[10]由实验室制备和保存。
La-TaqDNA聚合酶、1st strand cDNA Synthesis Kit反转录试剂盒和限制性内切酶购自大连宝生物公司,SanPrep柱式DNA胶回收试剂盒购自生工生物工程股份有限公司,T4 DNA连接酶购自Thermo公司,Ni2+离子亲和层析柱购自美国GE公司,HRP标记的鼠源抗体购自Sigma公司。
1.2 PVY、SMV和CLYVV衣壳蛋白基因的克隆
根据GenBank中登录的PVY、SMV、CLYVV的基因序列设计了扩增CP基因的特异性引物,上游引物的下画线处为NcoⅠ酶切位点,下游引物的下画线处为BamHⅠ酶切位点。上游引物分别为PVY-F:5′-AATAATAATCCATgggAAATgACACAATCgATgCAg-3′、SMV-F:5′-AATAATAAT-CCATgggCAAggAgAAggAAggAgAC-3′、CLYVV-F: 5′-AATAATAATCCATggACAAAgAgAAgTTgA-ATgTTg-3′;下游引物分别为PVY-R:5′-AATAATAATggATCCATgTTCTTCACTCCAAgTAgAg-3′、SMV-R:5′-AATAATAATggATCCTgCTgTgggCCCATgCC-3′、CLYVV-R:5′-AATAATAAT-ggATCCAATCgTgCTCCAgCAATgTg-3′。
以TRIzol法抽提感染病毒的样品叶片总RNA,用1st strand cDNA Synthesis Kit反转录试剂盒合成cDNA体外第一条链,以此为模板用La-TaqDNA 聚合酶扩增CP基因。反应程序为:94℃预变性1 min;98℃变性10 s,53℃退火45 s,72℃延伸1.5 min,进行30个循环;72℃再延伸10 min,反应完成后4℃保存。PCR产物进行凝胶浓度为1%的琼脂糖凝胶电泳,紫外灯下切胶,按SanPrep柱式DNA胶回收试剂盒回收PCR产物,-20℃保存备用。回收后的PCR产物,与pMD18-T 载体16℃作用连接1 h,转化大肠杆菌DH5α感受态细胞,构建重组载体pMD-PVY CP、pMD-SMV CP、pMD-CLYVV CP。
1.3 原核表达载体的构建
利用NcoⅠ和BamHⅠ双酶切重组pMD-PVY CP、pMD-SMV CP、pMD-CLYVV CP和原核表达载体pET-28a(+),凝胶纯化回收目的片段,将PVY CP、SMV CP、CLYVV CP基因与pET-28a(+)连接,构建重组载体pET28a-PVY CP、pET28a-SMV CP、pET28a-CLYVV CP,转化大肠杆菌DH5α感受态细胞,经双酶切和PCR鉴定鉴定后,送往测序公司进行测序。
1.4 重组蛋白的表达与鉴定
重组pET28a-PVY CP、pET28a-SMV CP、pET28a-CLYVV CP转化大肠杆菌Rosetta Ⅱ,经IPTG诱导,SDS-PAGE电泳分析,考马斯亮蓝染色、脱色后观察表达产物[15]。
1.5 重组蛋白的纯化
将诱导表达后的菌液于4℃ 10 000 r/min 离心10 min,收集菌体。超声波400 W,3 s工作时间,3 s间隔时间,重复5 min破碎菌体后收集包涵体表达的重组PVY CP、SMV CP、CLYVV CP,重组蛋白的纯化参照文献[10],包涵体蛋白经高浓度变形剂充分溶解,利用镍离子亲和层析柱纯化,SDS-PAGE电泳分析纯化结果,考马斯亮蓝染色、脱色后观察纯化产物。
1.6 PVY、SMV、CLYVV的抗体特异性鉴定
通过实验室制备的9株单克隆抗体,分别对感染SMV、PVY、CLYVV的病毒叶片制备的病毒汁液以及纯化后的CP蛋白进行ELISA鉴定。ELISA鉴定参照文献[16],并采用优化的最佳参数:包被原按照每孔2 μL/mL浓度包被96孔板,4℃过夜,PBST洗脱3遍;5%脱脂奶300 μL/孔37℃封闭1 h,PBST洗脱3遍;一抗1 000倍稀释于封闭液中,100 μL/孔37℃作用1 h,PBST洗脱3遍;酶标抗体5 000倍稀释于封闭液中,100 μL/孔37℃作用1 h,PBST洗脱6遍,拍干;室温避光条件下单组分TMB显色液显色30 min后,2 mol/L H2SO450 μL/孔终止反应,酶标仪测定A490。记录反应结果,用P/N值即检测A490值与阴性A490值对比,根据数值大小以-、+、++、+++分级记载,+以上均为阳性反应[17]。
2 结果与分析
2.1 PVY CP、SMV CP、CLYVV CP基因的克隆
以反转录合成的cDNA为模板进行PCR扩增,琼脂糖凝胶电泳分析。结果表明,在900 bp左右有1条特异性条带,与PVY CP、SMV CP、CLYVV CP基因大小(900 bp)相吻合,回收后连入pMD-18T载体中,经双酶切鉴定,产生大小约为2 700 bp和900 bp两条带。测序结果表明所克隆基因为PVY CP、SMV CP、CLYVV CP基因。
2.2 衣壳蛋白的表达与纯化
PVY CP、SMV CP、CLYVV CP基因与pET-28a(+)连接,构建重组pET28a-PVY CP、pET28a-SMV CP、pET28a-CLYVV CP,经双酶切鉴定产生大小约为5 300 bp和900 bp两条带,经PCR鉴定产生900 bp一条带,表明所表达基因为PVY CP、SMV CP、CLYVV CP基因。 转化pET28a-PVY CP、pET28a-SMV CP、pET28a-CLYVV CP的RosettaII菌株经IPTG诱导后,SDS-PAGE电泳发现,在相对分子量33 kDa处,沉淀中有1条特异性条带(图1)。 以融合的包涵体形式表达的PVY CP、SMV CP、CLYVV CP重组蛋白经镍离子亲和层析纯化(图1),得到清晰的单一条带,分子量大小与PVY CP、SMV CP、CLYVV CP重组蛋白相符,说明经过纯化后获得了高纯度的PVY CP、SMV CP、CLYVV CP重组蛋白。
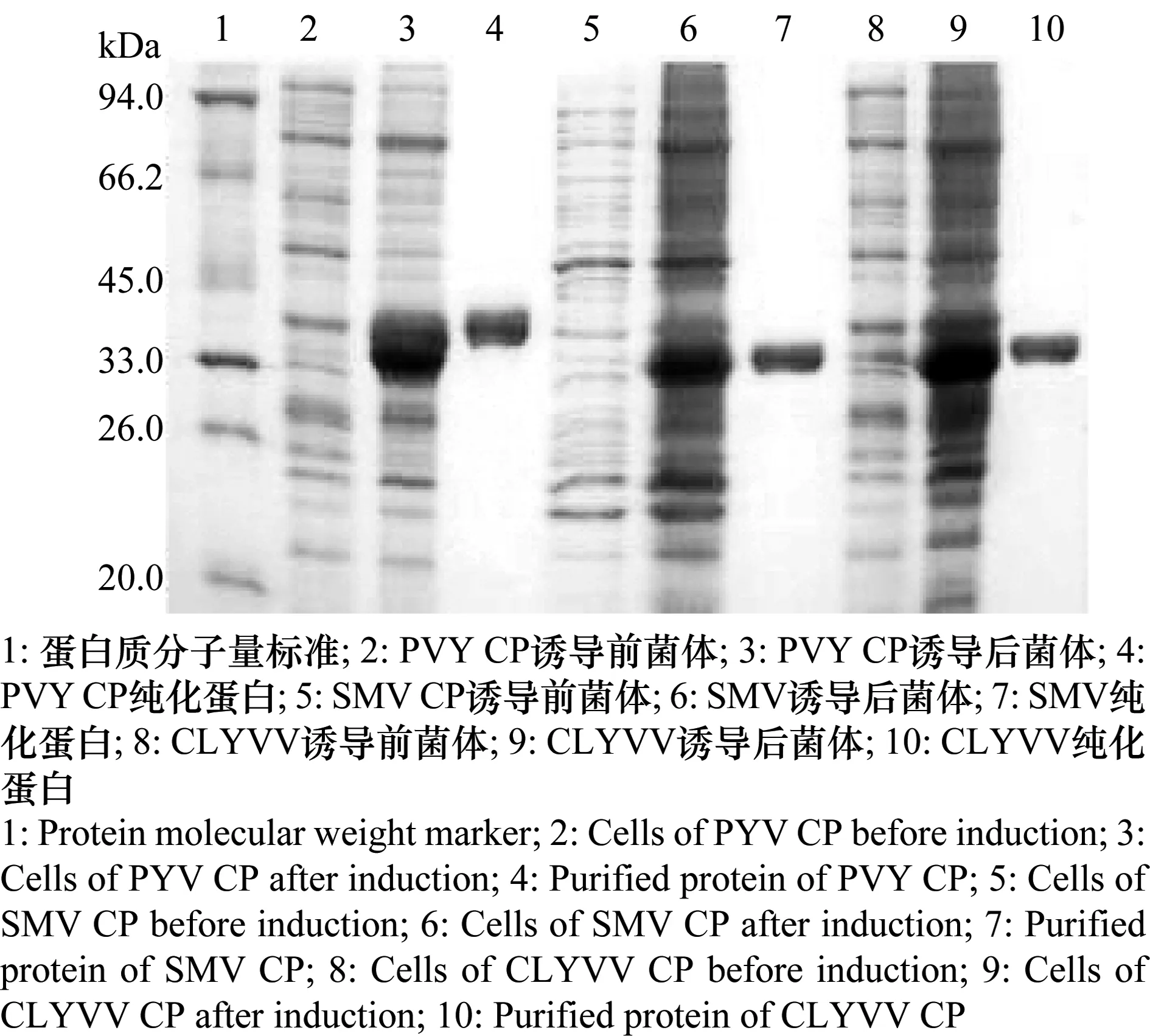
图1 马铃薯Y病毒、大豆花叶病毒、三叶草黄脉病毒衣壳蛋白的诱导及纯化Fig.1 Induction and purification of PVY, SMV and CLYVV coat proteins
2.3 PVY、SMV、CLYVV的抗体鉴定
将3种病毒叶片粗研磨上清和纯化后的CP蛋白分别与9株SMV单克隆抗体进行ELISA分析,3次重复,如表1显示,对于含PVY、SMV和CLYVV的叶片粗研磨上清液,SMV结合抗体的能力高于PVY和CLYVV,其与9株单克隆抗体均可反应; PVY能与抗体2D3、4F9、4G12和6E7结合,但是亲和力不如SMV;CLYVV与4F9和4G12反应较强;对于已纯化的衣壳蛋白:SMV、CLYVV与抗体2D3、4F9、4G12和6E7反应强烈,PVY能与抗体4F9和4G12反应。抗体4F9和4G12(表1加粗所示)能特异性识别所有这3株病毒和重组衣壳蛋白。
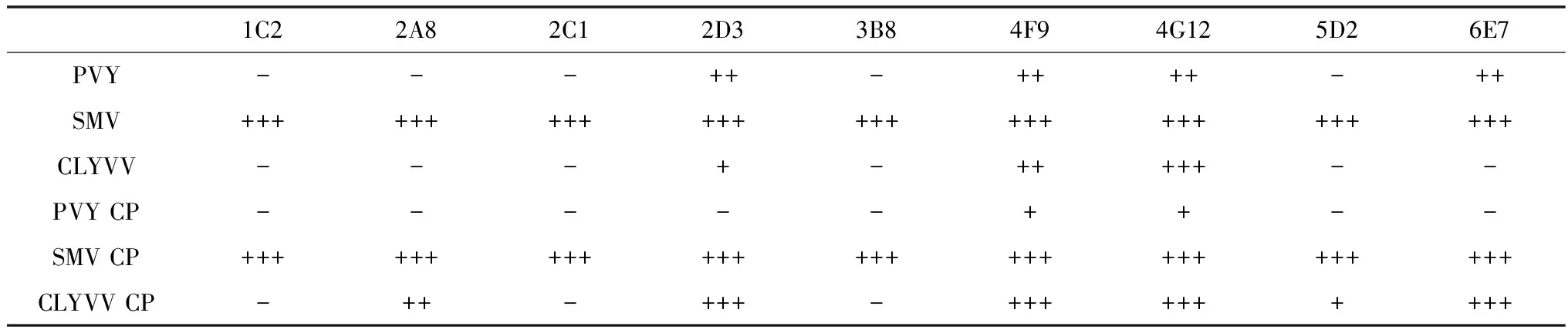
表1 病毒汁液、重组表达CP蛋白分别对9株单克隆抗体的ELISA分析1)
1) PVY:马铃薯Y病毒扎兰屯分离株;SMV:大豆花叶病毒东北3号株系;CLYVV:白三叶黄脉病毒;PVY CP:重组表达的马铃薯Y病毒衣壳蛋白;SMV CP:重组表达的大豆花叶病毒衣壳蛋白;CLYVV CP: 重组表达的白三叶黄脉病毒衣壳蛋白。-: P/N<2.1; +: 2.1≤P/N<5;++: 5≤P/N<10;+++: P/N≥10。
PVY:PotatovirusYZalantun strain; SMV:SoybeanmosaicvirusNortheast No.3 strain; CLYVV:Cloveryellowveinvirusstrain; PVY CP: Recombinant expressedPotatovirusYcoat protein; SMV CP: Recombinant expressedSoybeanmosaicviruscoat protein; CLYVV CP: Recombinant expressedCloveryellowveinviruscoat protein. -: P/N<2.1; +: 2.1≤P/N<5;++: 5≤P/N<10;+++: P/N≥10.
3 讨论
马铃薯Y病毒属的整个基因组编码一个多聚蛋白,通过自身蛋白酶切割后形成至少10个功能不同的成熟蛋白,其中衣壳蛋白是结构蛋白。完整病毒粒子的衣壳蛋白质有四级结构。病毒的CP起着保护核酸的作用,并决定着病毒的不同形态。CP在病毒的侵染过程中对寄主细胞还具有识别作用。病毒CP还含有抗原决定簇,决定着病毒的抗原特异性。
有利用相同单克隆抗体鉴别PVY不同血清型的研究[18-19]。本研究采用ELISA方法,用实验室制备的9株抗SMV蛋白的单克隆抗体对马铃薯Y病毒属的PVY、SMV和CLYVV进行检测。结果证明,这9株抗体都能不同程度地与同属不同种的病毒抗原结合,其中一些抗体可识别所有测试毒株,说明PVY、SMV、CLYVV衣壳蛋白有抗原的交叉性,即存在共同的抗原表位,且该抗原表位在马铃薯Y病毒属3种病毒中是高度保守的;进一步对抗原表位的定位研究将有助于对马铃薯Y病毒属衣壳蛋白结构和功能的理解。
同种病毒的两种抗原状态,即天然病毒分子和重组表达的衣壳蛋白针对同一株抗体反应有差别,感病叶片组织的研磨上清为天然构象分子,但在大肠杆菌中表达的衣壳蛋白缺少真核生物的蛋白折叠,与病毒蛋白结构不一致,这导致了同一抗体与同一病毒衣壳蛋白的不同结构形式的亲和力不一致。
前期研究表明,9株抗体与大豆花叶病毒结合后能阻断病毒侵染大豆植株,即具有中和活性,属于中和抗体,病毒编码基因可以作为抗病基因进行抗病育种,即利用植物抗体技术进行抗病分子育种。本研究表明,4F9和4G12这两株单克隆抗体能够识别马铃薯Y病毒属的多个成员,因此,该抗体的应用范围更广,该抗体所识别的抗原表位具有保守性,可作为抗病研究的理想靶点。
本研究鉴定的马铃薯Y病毒属通用型单克隆抗体,为病毒检测方法研究、致病机理研究和抗病研究提供了基础材料。
[1] Fauquet C M, Mayo M A, Maniloff J, et al. VirusTaxonomy: Ⅷth report of the international committee on taxonomy of virus [R]. San Diego: Elsevier Academic Press, 2005.
[2] McKern N M, Shukla D D, Toler R W, et al. Confirmation that the sugarcane mosaic virus subgroup consists of four distinct potyviruses by using peptide profiles of coat proteins [J]. The American Phytopathological Society, 1991, 81(9): 1025-1029.
[3] Riechmann J L, Laín S, García J A.Highlights and prospects ofPotyvirusmolecular biology [J]. Journal of General Virology, 1992, 73: 1-16.
[4] Urcuqui-Inchima S, Haenni A L, Bernaidi F.Potyvirus proteins: a wealth of functions [J]. Virus Research, 2001, 74: 157-175.
[5] Govier D A, Kassanis B.Evidence that a component other than the virus particle is needed for aphid transmission ofPotatovirusY[J]. Virology, 1974, 57(1): 285-286.
[6] Sako N, Ogata K. Different helper factors associated with aphid transmission of some potyviruses [J]. Virology, 1981, 112(2): 762-765.[7] Deom C M, Oliver M J, Beachy R N.The 30-kilodalton gene product ofTobaccomosaicviruspotentiates virus movement[J]. Science, 1982, 237(4813): 389-394.
[8] Hill E K, Hill J H, Durand D P.Production of monoclonal antibodies to viruses in thePotyvirusgroup: use in radioimmunoassay [J]. Journal of General Virology, 1984, 65: 525-532.
[9] 郭景荣, 陈永宣. 大豆花叶病毒单克隆抗体(SMV-McAb)的研究[J]. 植物病理学报, 1990, 20(2): 131-133.
[10]王永志, 苏颖, 米丽娟, 等. 东北地区大豆花叶病毒 3 号株系衣壳蛋白的表达、纯化及单克隆抗体制备[J]. 吉林农业科学, 2011, 36(6): 37-39.
[11]姚康生, 蔡少华, 贾士荣, 等. 分泌抗与马铃薯Y病毒株系特异性单克隆抗体杂交瘤细胞株的建立[J]. 中国农业科学, 1985(3): 91.
[12]郭军, 肖小文, 蔡少华, 等. 分泌抗马铃薯Y病毒单克隆抗体的大鼠杂交瘤细胞系的建立及抗体稳定性测定[J]. 生物工程学报, 1990, 6(3): 230-235.
[13]刘德虎, 郭军, 陈三风, 等. 植物抗体基因工程: I. 分泌马铃薯Y病毒中和抗体杂交瘤细胞系的筛选[J]. 高技术通讯, 1995(2): 42-44.
[14]Rouis S, Traincard F, Gargouri R, et al. Inhibition of potato virus Y NIa activity: preparation of monoclonal antibody directed against PVY NI protein that inhibits cleavage of PVY polyprotein [J]. Archives of Virology, 2001, 146(7): 1297-1306.
[15]高旭东, 王永志, 时圣凤, 等. 膦丝菌素乙酰转移酶的表达及单克隆抗体的制备[J]. 细胞与分子免疫杂志, 2013, 29: 4-7.
[16]王雨. 侵染大豆的病毒鉴定和部分SMV分离物CP基因的序列分析[D]. 南京: 南京农业大学, 2011: 28-30.
[17]谢联辉, 林奇英. 植物病毒学[M]. 第2版. 北京: 中国农业出版社, 2004: 26.
[18]Ounouna H, Kerlan C, Lafaye P, et al. Production of monoclonal antibodies against synthetic peptides of the N-terminal region ofPotatovirusYcoat protein and their use in PVY strain differentiation [J]. Plant Pathology, 2002,51(4):487-494.
[19]Mohamad Chikh Ali, Tetsuo Maoka, Keiko T Natsuaki. A point mutation changes the serotype of aPotatovirusYisolate; genomic determination of the serotype of PVY strains [J]. Virus Genes, 2007, 35(2):359-367.
(责任编辑:田 喆)
Identification of universal monoclonal antibodies against three viruses ofPotyvirus
You Qing1,2, Li Xiaoyu2, Zhang Chunyu2, Zhang Linlin3, Song Jingrong4, Wang Yongzhi2, Li Qiyun2
(1. Jilin Agricultural University, Changchun 130118, China; 2. Institute of Plant Protection, Jilin Academy of Agricultural Sciences, Key Laboratory of Integrated Pest Management on Crops in Northeast, Ministry of Agriculture;Jilin Key Laboratory of Agricultural Microbiology, Gongzhuling 136100, China; 3. Northeast Agricultural University,Harbin 150030, China; 4. Hulunbuir Institute of Agricultural Sciences, Zhalantun 162652, China)
Prokaryotic expression vectors pET28-SMV CP, pET28-PVY CP and pET28-CLYVV CP of threePotyvirusviruses (Soybeanmosaicvirus, SMV;PotatovirusY, PVY; andCloveryellowveinvirus, CLYVV) were constructed. Through IPTG induction, expression and purification, we obtained the CP proteins of SMV, PVY and CLYVV.The monoclonal antibodies of 9 strains prepared before were used to detect SMV, PVY and CLYVV viral suspensions and purified CP proteins. The ELISA results showed that the 9 monoclonal antibodies recognized SMV virus; the antibodies 2D3, 4F9, 4G12 and 6E7 reacted with PVY; CLYVV was recognized by the antibodies 4F9 and 4G12, but the appetency between PVY or CLYVV and antibodies was lower than that of SMV.As for the recombinant expressed CP proteins, SMV and CLYVV CPs reacted with 2D3, 4F9, 4G12 and 6E7 strongly; PVY CP reacted with 4F9 and 4G12. In general, monoclonal antibodies 4F9 and 4G12 could recognize SMV, CLYVV and PVY universally. This study provided two universal antibodies againstPotyvirus.
Soybeanmosaicvirus;PotatovirusY;Cloveryellowveinvirus; coat protein; identification
2015-12-13
2016-01-27
吉林省自然科学基金(130101089JC); 吉林省农业微生物重点实验室平台建设项目(20122105)
S 435.32
A
10.3969/j.issn.0529-1542.2016.06.012
* 通信作者 E-mail: yzwang@126.com; qyli1225@126.com
