超微血管成像技术联合超声BI-RADS分级在鉴别乳腺良恶性肿物中应用价值
2016-11-28任卫东邓力军
马 燕,郭 嵩,李 晶,任卫东,邓力军
(中国医科大学附属盛京医院超声科,辽宁 沈阳 110004)
乳腺影像学
超微血管成像技术联合超声BI-RADS分级在鉴别乳腺良恶性肿物中应用价值
马 燕,郭 嵩,李 晶,任卫东,邓力军
(中国医科大学附属盛京医院超声科,辽宁 沈阳 110004)
目的:利用超微血管成像(SMI)技术,并与CDFI对比,以明确BI-RADS分级与SMI结合是否可以提高超声对恶性病变的诊断效能。方法:超声检出并术后病理证实的乳腺肿物138例,良性肿物78例,恶性肿物60例。按照Adler分级标准,分别观察同一肿物在CDFI和SMI技术所显示血流情况,并对肿物进行常规二维灰阶超声BI-RADS分级,使用受试者工作特征(ROC)曲线计算出BI-RADS,SMI及CDFI的Adler分级的鉴别良恶性乳腺病灶的最佳诊断界点,并根据此诊断界点得出以上单一模式及联合模式的诊断效能等相关指标。结果:SMI与CDFI的内部观察者间一致性较好(CDFI:κ=0.82;SMI:κ=0.76),两种检测方法在显示全部肿物血流丰富程度有明显差异(κ=0.38);在恶性肿物中上述差异更加明显(κ=0.028);而在良性肿物中差异不明显(κ=0.61)。分别得到的ROC曲线下面积分别为0.867(BI-RADS),0.669(CDFI),0.871(SMI),0.710(BI-RADS与CDFI联合模式)及0.899(BI-RADS与SMI联合模式)。其敏感性、特异性分别为0.950,0.692(BI-RADS);0.900,0.821(SMI);0.600,0.641(CDFI)。BI-RADS与SMI的联合模式的敏感性与BI-RADS单一模式相近,差异无统计学意义(0.900 vs 0.950,P>0.05);而BI-RADS与SMI的联合模式的特异性明显高于BI-RADS单一模式(0.897 vs 0.692,P<0.01)。结论:与CDFI相比较,SMI检测肿物的微血管效果更好,SMI与BI-RADS联合可提高超声对乳腺恶性肿物的诊断效能。
乳腺肿瘤;超声检查,乳房;超声检查,多普勒,彩色
乳腺恶性肿瘤是女性最常见的肿瘤。近年来,以导管原位癌和伴有微血管浸润的导管癌为代表的乳腺恶性肿瘤的发病率有逐年上升趋势[1-2]。在临床上,超声是一种简便易行的乳腺肿物影像检查方法,并可在乳腺肿物活检中辅助定位,引导穿刺。乳腺癌是一种血管高度依赖性实体肿瘤,肿瘤内新生微血管决定了癌细胞的生长、浸润和生存。恶性乳腺肿瘤的微血管构建及丰富程度明显不同于良性肿瘤[3-4]。目前,临床广泛应用彩色多普勒血流超声显像(CDFI)评估乳腺恶性肿物的血管情况。但是有研究表明,与超声造影、增强MRI等有创性影像学检查方法相比,CDFI对血管尤其是微血管的评估效果明显低于上述有创性检查手段[5-7]。如何快速、简便无创地检测乳腺肿瘤微血管情况,并且为鉴别肿瘤良恶性提供可靠的诊断依据是临床工作者面临的问题之一,超微血管成像(SMI)是一种全新的评价微血流灌注超声显像技术,其原理是应用自适应图像处理方法,逐像素分析血流及组织图像的信息,通过自适应的多普勒算法提取微血管血流信号。在混杂分布区域,其对微细血流和组织微小运动产生的频谱信号差异进行滤波处理,显示微血管中的低速血流图像。SMI可在无需造影剂的情况下,高帧频、清晰地检测低血流速的微血管。已有的研究初步表明,在评估恶性肿瘤方面,SMI相比CDFI更易检测出低流速的微血管[8]。
本研究拟利用SMI技术,并与CDFI比对,联合乳腺肿物的BI-RADS分级进行综合评价,以明确BI-RADS分级与SMI结合是否可以提高超声对恶性病变的诊断效能。
1 资料与方法
1.1 一般资料
连续选取 2014年9月—2015年3月来我院进行乳腺病灶切除或乳腺肿物穿刺活检的122例乳腺肿物患者,所有患者均在术前进行超声检查,患者在超声检查前及术前均未经过化疗。为减少乳腺肿瘤大小对诊断的影响,本研究只纳入3 cm以下的乳腺肿物,最终纳入符合条件的实体性乳腺肿物138个。依据病理类型,将肿物分为良性组和恶性组:良性组,共66例患者 (年龄16~54岁,平均 (34.43± 11.21)岁),检出乳腺肿物78个。恶性组,共56例患者(年龄31~69岁,平均(51.07±10.19)岁),检出乳腺肿物60个。术后病理诊断依照WHO乳腺肿瘤组织学分类标准2012版。
1.2 仪器与方法
采用东芝Aplio400彩色多普勒超声,探头频率为 4~11 MHz(L14-5 Aplio400;Toshiba Medical Systems Corporation,Tochigi,Japan)。为避免观察者间的变异性,所有超声检查均由两名有5年以上乳腺超声及多普勒超声检查经验的超声医师执行。
1.3 操作过程
患者仰卧于检查床上,充分暴露其乳腺、腋窝、及锁骨上窝。常规放射状超声扫查,确定肿物的位置。每一肿物至少取得两幅垂直灰阶图像,分别记录病灶二维超声特点,包括肿物形态、纵横比、边界、回声类型、周围组织及钙化等。根据上述情况,对肿物进行常规二维灰阶超声BI-RADS分级,参照美国放射学会指南建议评估办法,1~3类疑似良性病灶,4~ 5类可疑恶性病灶。首先启动CDFI观察血流情况,操作者避免对肿物加压,仪器调节:适当调整取样框的大小,使其包含肿瘤及其周边1 cm的范围;彩色壁滤波<50Hz;彩色血流速度范围<5 cm/s,一般设置在2.5~3.5 cm/s;调整彩色增益至小血管刚好被检测到,而伪彩被抑制[3]。启动CDFI,寻找肿物血管最为丰富的切面,同时启动SMI。SMI的仪器调节参数与CDFI相同。对比并记录CDFI和SMI对肿物血流的检测情况。
1.4 评价指标
分别观察同一乳腺肿物的SMI和CDFI检测血流情况,参照Adler标准将血流信号分为4级,0级:缺乏血流信号;Ⅰ级:少量血流信号,可见1或2个点状或细短棒状信号(直径小于1.0mm);Ⅱ级:中量血流信号,可见3或4个点状或1支较长血管,血管长度接近或超过肿物半径;Ⅲ级:肿物内有多量血流,可见5个以上点状或2支以上较长血管。
使用受试者工作特征(ROC)曲线计算出BI-RADS,SMI及CDFI的Adler分级的鉴别良恶性乳腺病灶的最佳诊断界点,并根据此诊断界点得出诊断试验相关指标。如超过诊断界点,即认为该诊断模式下,肿物被判断为“恶性”。当使用“联合”模型下评估一个肿物良恶性时,SMI(或CDFI)与BI-RADS同时超过诊断界点,则认为该肿物在SMI(或CDFI)与 BIRADS相结合模式下被诊断为恶性,反之为良性。分别计算BI-RADS,SMI,CDFI及他们之间的联合模式的诊断效能。
1.5 统计学分析
采用Kappa分析评估内部观察者间一致性。计量资料以均数±标准差表示,两种血流检测方法的Adler分级比较采用Kappa分析;良恶性两组的计量资料比较采用t检验。绘制不同诊断模式的ROC曲线,并得到曲线下面积及最佳诊断界点,根据得到的最佳诊断界点,得出敏感性、特异性、阳性预测值、阴性预测值、准确性及Youden指数。采用χ2检验评估不同诊断模型的敏感性、特异性及准确性是否有差异,P<0.05为差异有统计学意义。统计分析采用SPSS 16.0统计学软件。
2 结果
2.1 内部观察者间一致性
采用Adler分级评估CDFI或SMI的分级内部观察者间一致性,Kappa系数分别为0.82及0.76,提示一致性较好,结果稳定。
2.2 病理结果
术后病理分析证实共有78例(56.52%)良性病灶,60例(43.48%)恶性病灶。良性病灶(78例)的病理类型包括纤维腺瘤(32例,41.03%)、腺病(26例,33.33%)、腺瘤样增生(14例,17.95%)、导管内乳头状瘤(4例,5.13%)及良性叶状肿瘤(2例,2.56%)。恶性病灶的病理类型包括浸润性导管癌 (53例,88.33%),导管原位癌(3例,5%),浸润性小叶癌(3例,5%)及恶性叶状肿瘤(1例,1,67%)。良性病灶的平均直径为(1.70±0.71)cm(0.6~2.9 cm),恶性病灶的平均直径为(2.03±0.63)cm(0.9~2.9 cm)。
2.3 Adler分级
SMI及CDFI的Adler分级结果见表1。在所有肿物中,无论何种病理类型,SMI的分级结果均大于或等于CDFI,两种方法在检测全部肿物血流丰富程度有明显差异(κ=0.38),SMI较CDFI更易检测出Ⅰ级以上的血流,同样,SMI与CDFI两种方法在检测恶性肿物血流丰富程度差异明显(κ=0.028),SMI较CDFI更易检测出恶性肿物的Ⅲ级血流(见图1);相反,SMI与CDFI两种方法在检测良性肿物血流丰富程度差异不明显(κ=0.61)(见图2)。
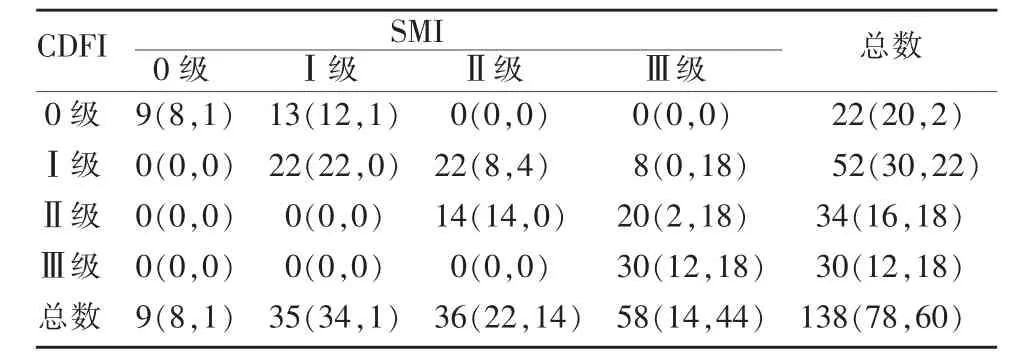
表1 血流丰富程度的Adler分级评估[n(n1,n2)]
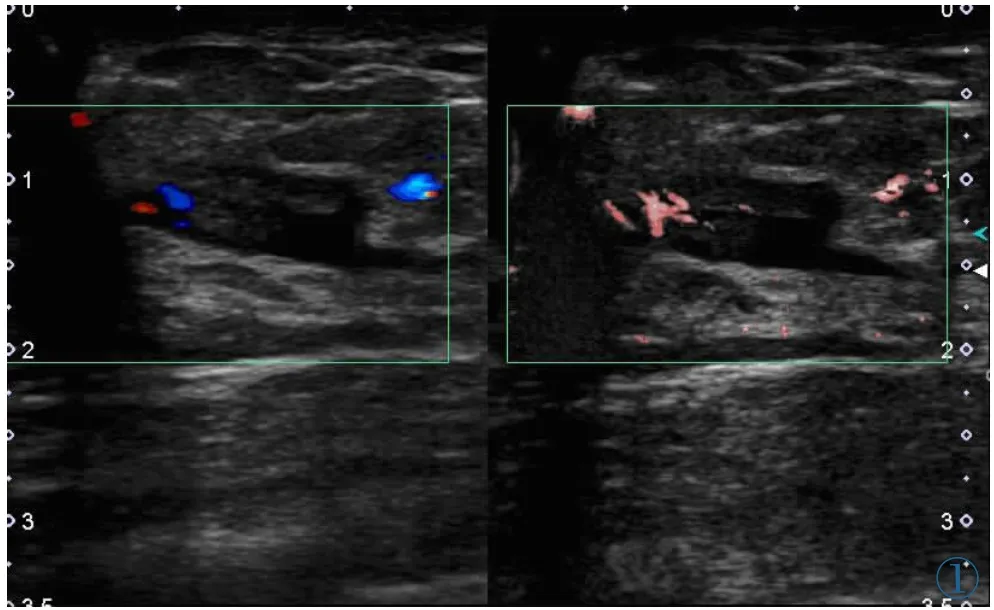
图1 女,43岁,乳腺导管原位癌。左图为CDFI显示肿物的血流情况,AdlerⅠ级;右图为cSMI显示肿物的血流情况,Adl e rⅢ级。Figure 1. A 43-year-old woman with ductal carcinoma in situ. The vascularity of the breast mass is investigated using CDFI (left), which is gradeⅠaccording to Adler’s method. The vascularity of the breast mass is investigated using cSMI(right), which is grade Ⅲ.
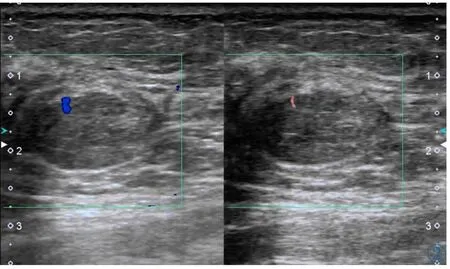
图2 女,31岁,乳腺纤维腺瘤。左图为CDFI显示肿物的血流情况,AdlerⅠ级;右图为cSMI显示肿物的血流情况,AdlerⅠ级。Figure 2. A 31-year-old woman with fibroadenoma.The vascularity of the breast mass is investigated using CDFI(left),which is grade Ⅰ according to Adler’s method.The vascularity of the breast mass is investigated using cSMI(right),which is gradeⅠ.
2.4 BI-RADS,CDFI及SMI诊断效能比较
根据绘制的ROC曲线,分别得出CDFI、SMI诊断恶性肿物最佳Adler分级界点为1.5(即≥Ⅱ级)及2.5(即≥Ⅲ级);BI-RADS诊断恶性肿物最佳界点为3.5(即≥4级)。使用BI-RADS与SMI(或CDFI)相结合的“联合”或“单一”模式诊断肿物良恶性,得到的ROC曲线下面积分别为0.867(BIRADS),0.669(CDFI),0.871(SMI),0.710(BI-RADS 与CDFI联合模式)及0.899(BI-RADS与SMI联合模式),提示在单一诊断模式下,SMI及BI-RADS的诊断效能明显高于CDFI;而BI-RADS与SMI联合模式的诊断效能高于单一的BI-RADS或SMI模式。BI-RADS单一诊断模式下的敏感性最高,达到0.950,其特异性及准确性分别为0.692及0.804;SMI单一诊断模式下的特异性最高,为0.821,其敏感性及准确性分别为0.900及0.855;。BI-RADS与SMI的联合模式的准确性最高,为0.898,明显高于BI-RADS单一模式的0.804(P<0.05);但BI-RADS 与SMI的联合模式的敏感性与BI-RADS单一模式相近,差异无统计学意义(0.900 vs 0.950,P>0.05);而BI-RADS与SMI的联合模式的特异性明显高于BI-RADS单一模式,且差异有统计学意义(0.897 vs 0.692,P<0.01)。各诊断模式的相关诊断界点及效能数据见表2。
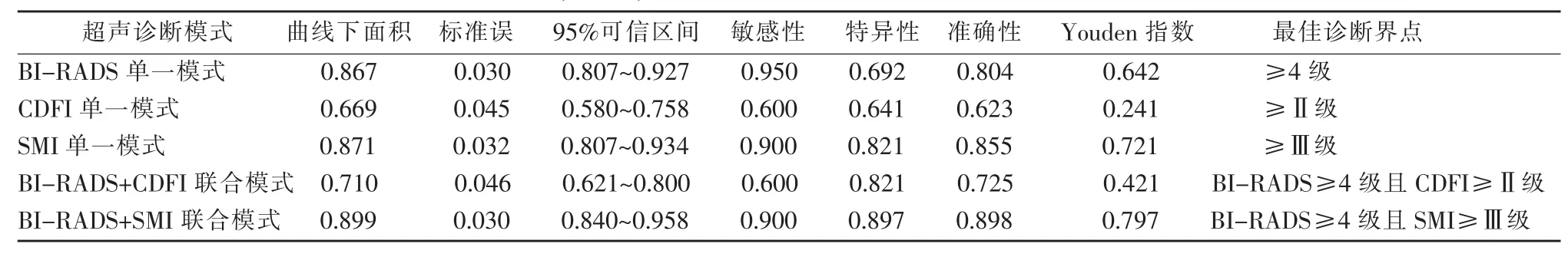
表2 BI-RADS,CDFI,SMI及其联合模式的超声诊断效能及最佳界点
3 讨论
乳腺肿瘤新生血管及微血管始终是乳腺癌研究领域的焦点之一,其与肿瘤侵袭和转移的恶性生物行为密切相关。作为临床常用的乳腺肿物血管评估方法,CDFI虽然无创简便,但对微血管评估的准确程度明显不及超声造影及动态增强MRI等有创性检查,后两者与反映血管生成的微血管密度有更高的相关性,而影像学评估乳腺恶性肿瘤血管生成是鉴别乳腺肿瘤良恶性的重要参考依据之一[9-10]。CDFI显示的血管是管径>0.2mm、流速相对较高的血流信号[11]。本研究通过SMI与CDFI对比研究发现,对于恶性肿瘤SMI及CDFI的Adler分级差异明显,SMI对于检测微血流更加敏感。某些在CDFI被忽视的高级别血流信号可被SMI清晰地显示出来。上述的差异应是两种血流检测技术的成像原理不同所致:CDFI利用壁滤器来消除杂波和运动伪像,易导致低速血流信息的丢失;而SMI能够分析杂波运动特征,采用全新的自适应算法识别和消除组织本身的运动,呈现更加真实的血流信息,可显示管径>0.1mm的低速微小血管。理论上可弥补CDFI对微血管检测不足。目前,多普勒超声检测低流速微血管的难点在于邻近组织机构造成的诸多干扰信号 (运动伪像),CDFI不能将真实血流与运行伪像相鉴别。但是本研究证实SMI可明显降低运行伪像的产生。对于良性病变,SMI与CDFI检测结果无明显差异,推测可能是良性病变本身就缺乏丰富的微血管,这也符合良性肿瘤的血管生成的一般规律。
在临床实际工作中,单独使用血流评估乳腺肿物良恶性并不实际,必须结合乳腺肿物形体、回声、边界及与周围组织关系等进行总体评价[12]。但是研究表明,BI-RADS对于诊断乳腺恶性肿瘤具有较高的敏感性,但特异性较低[13-14]。本研究将单一血流评估方法与BI-RADS相结合进行联合评估,结果提示相比较单一BI-RADS模式,BI-RADS与SMI的联合模式的总体诊断效能更高,其敏感性与BI-RADS单一模式相似,但可显著提高特异性。SMI通过对乳腺肿物的血流特征评估,可改良或校正BI-RADS单一模式的诊断效能,降低假阳性病例的比例。
本研究尚存在某些问题需进一步研究探讨:首先,本研究纳入的研究对象相对较少,进一步仍需多中心大样本研究以确认BI-RADS与SMI联合模式的最佳诊断界点;其次,评估肿物内部微血管情况的“金标准”是病理的瘤内微血管密度[15],进一步研究仍需评价SMI与微血管密度及血管内皮生长因子之间的关联性;最后,SMI对微血管评估的效能是否接近于超声造影也有待进一步研究探讨[16]。
SMI作为一种全新的血流显像技术,能够较CDFI更加敏感地探测到乳腺恶性肿瘤的微血管。通过SMI对BI-RADS进行改变校正可提高超声对乳腺恶性肿物的诊断效能,其具有较高的临床应用前景。
[1]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2]Sakorafas GH,Farley DR,Peros G.Recent advances and current controversies in the management of DCIS of the breast[J].Cancer Treat Rev,2008,34(6):483-497.
[3]Houssami N,Irwig L,Simpson JM,et al.Sydney breast imaging accuracy study:Comparative sensitivity and specificity of mammography and sonography in young women with symptoms[J].AJR,2003,180(4):935-940.
[4]Moy L,Slanetz PJ,Moore R,et al.Specificity of mammography and US in the evaluation of a palpable abnormality:Retrospective review[J].Radiology,2002,225(1):176-181.
[5]Heywang-Kobrunner SH,Schreer I,Heindel W,et al.Imaging studies for the early detection of breast cancer[J].Dtsch Arztebl Int,2008,105(31-32):541-547.
[6]Wang Y,Dan HJ,Fan JH,et al.Evaluation of the correlation between colour power Doppler flow imaging and vascular endothelial growth factor in breast cancer[J].J Int Med Res,2010, 38(3):1077-1083.
[7]Drudi FM,Cantisani V,Gnecchi M,et al.Contrast-enhanced ultrasound examination of the breast:A literature review[J].Ultraschall Med,2012,33(7):E1-E7.
[8]Wu L,Yen HH,Soon MS.Spoke-wheel sign of focal nodular hyperplasia revealed by superb micro-vascular ultrasound imaging [J].QJM,2015,108(8):669-670.
[9]Zhu Q,Cronin EB,Currier AA,et al.Benign versus malignant breast masses:Optical differentiation with US-guided optical imaging reconstruction[J].Radiology,2005,237(1):57-66.
[10]del Cura JL,Elizagaray E,Zabala R,et al.The use of unenhanced Doppler sonography in the evaluation of solid breast lesions[J].AJR,2005,184(6):1788-1794.
[11]Stanzani D,Chala LF,Barros N,et al.Can Doppler or contrast-enhanced ultrasound analysis add diagnostically important information about the nature of breast lesions?[J].Clinics(Sao Paulo),2014,69(2):87-92.
[12]吴猛,周如海.超声BI-RADS分级标准指导判断乳腺肿块良恶性的价值[J].中国临床医学影像杂志,2014,25(6):390-392.
[13]Shi XQ,Li JL,Wan WB,et al.A set of shear wave elastography quantitative parameters combined with ultrasound bi-rads to assess benign and malignant breast lesions[J].Ultrasound Med Biol,2015,41(4):960-966.
[14]Evans A,Whelehan P,Thomson K,et al.Differentiating benign from malignant solid breast masses:Value of shear wave elastography according to lesion stiffness combined with greyscale ultrasound according to bi-rads classification[J].Br J Cancer, 2012,107(2):224-229.
[15]Jiang J,Chen YQ,Xu YZ,et al.Correlation between three-dimensional ultrasound features and pathological prognostic factors in breast cancer[J].Eur Radiol,2014,24(6):1186-1196.
[16]叶玉泉,薛红元,高丽,等.颈动脉斑块内新生血管的超微血管显像:与超声造影对比[J].中国医学影像技术,2015,31(5):651-654.
The combination of superb microvascular imaging and BI-RADS in distinguishing breast benign lesions from malignant lesions
MA Yan,GUO Song,LI Jing,REN Wei-dong,DENG Li-jun (Department of Ultrasound,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective:To explicate the diagnostic performance of the combination of superb microvascular imaging(SMI) and BI-RADS in distinguishing breast benign lesions from malignant lesions.Methods:One hundred and thirty-eight breast lesions were detected by ultrasonography and pathologic types were confirmed by histopathology.Both SMI and CDFI were used to detect blood flows of breast masses according to Adler’s grading criteria,respectively.The optimal threshold drawing from ROC curve and diagnostic efficacy of single and combinative modality were calculated.Results:The inter-observer agreement of SMI and CDFI were favorable(CDFI:κ=0.82;SMI:κ=0.76).There was a significant difference between SMI and CDFI for detecting blood flows in all lesions(κ=0.38),which was more significant in malignant group(κ=0.028)but not significant in benign lesions(κ=0.61).The areas under ROC curves were 0.867(BI-RADS),0.669(CDFI),0.871(SMI),0.710(BI-RADS+ CDFI)and 0.899(BI-RADS+SMI)respectively.The sensitivities and specificities were 0.950 and 0.692(BI-RADS),0.821 and 0.900(SMI),0.600 and 0.821(CDFI),respectively.There was no significant difference between combinative modality(BI-RADS and SMI)and SMI(0.900 vs 0.950,P>0.05)for the sensitivity;but the specficity of combinative modality(BI-RADS and SMI) was significantly higher than that of SMI(0.897 vs 0.692,P<0.01).Conclusion:Comparing with CDFI,SMI provides better microvascular information in breast lesions.The combination modality of BI-RADS and SMI can improve diagnostic performance of breast malignancy.
Breast neoplasms;Ultrasonography,mammary;Ultrasonography,Doppler,color
R737.7;R445.1
A
1008-1062(2016)01-0010-04
2015-06-26;
2015-08-20
马燕(1983-),女,辽宁沈阳人,主治医师。E-mail:horsebird@163.com
李晶,中国医科大学附属盛京医院超声科,110004。E-mail:lijing@sj-hospital.org
中国医科大学附属盛京医院院内课题资助项目(MD63)。
