干旱胁迫下不同类型野生杏光合作用比较
2016-11-26木斯塔帕海比布吾木提汗卡克木加帕尔卡迪尔海利力库尔班
木斯塔帕·海比布,吾木提汗·卡克木,加帕尔·卡迪尔,海利力·库尔班
(1. 新疆农业大学林学与园艺学院,乌鲁木齐 830052;2. 吐鲁番地区鄯善县林业局,新疆鄯善 838200;3. 昌吉州木垒县林业局,新疆木垒 831900;4. 新疆安居丹生物科技有限公司,乌鲁木齐 830000)
干旱胁迫下不同类型野生杏光合作用比较
木斯塔帕·海比布1,2,吾木提汗·卡克木3,加帕尔·卡迪尔2,海利力·库尔班1,4
(1. 新疆农业大学林学与园艺学院,乌鲁木齐 830052;2. 吐鲁番地区鄯善县林业局,新疆鄯善 838200;3. 昌吉州木垒县林业局,新疆木垒 831900;4. 新疆安居丹生物科技有限公司,乌鲁木齐 830000)
【目的】以田间栽培收集于新疆伊犁地区的野生甜仁杏1号、野生甜仁杏2号、野生苦仁杏1号和野生苦仁杏2号等4种类型天山野生杏的2年生树苗为材料,持续26 d的田间自然干旱胁迫处理,研究野生杏光合作用对干旱胁迫的适应特征。【方法】对二年生野杏苗水分胁迫处理第5和26 d测定光合速率(Pn),气孔导度(Gs),细胞胞间隙CO2浓度(Ci)蒸腾速率(Tr)并计算水分利用效率(WUE),同时取样分析水势、细胞膜透性和叶绿素含量等参数。【结果】水势与膜透性的适应性变化与植物的抗逆性有关;水分胁迫第26 d净光合速率在胁迫初期的基础上下降幅度在不同类型之间有差异,下降幅度依次为:甜仁杏1号>甜仁杏2号>苦仁杏1号>苦仁杏2号。【结论】天山野生杏在水分胁迫下,净光合速率的下降是由气孔和非气孔因素共同作用的结果,气孔和非气孔因素对净光合速率下降的贡献在类型之间有差异。在野生杏叶绿素a/b比值和水分利用效率的变化与净光合速率之间有相关性。
天山野生杏;干旱胁迫;光合作用;调控机制
0 引 言
【研究意义】杏在植物分类学上属于蔷薇科(Rosaceae)李亚科(Prunoideae)杏属(ArmeniacaMill),杏树具有发达的根系,对于干旱的生态地理环境有很强的适应性[1,2]。全世界杏属共有11个种,其中我国有9种[3,4]。野生杏是新疆独特气候条件下的一种具有多种抗性的宝贵杏树种质资源,分布海拔高度为1 000~1 600 m的区域[5]。伊犁地区天山野杏林是我国野杏的重要集中地,天山野生杏(ArmeniacavulgarisLam)是栽培杏的直接祖先,两者属同类[1,2]。野生杏能在石质化贫瘠土壤中生长,被认为其抗逆性和适应性强,可作砧木用,或用于修复生态。【前人研究进展】在全球范围内水分亏缺威胁着农业生产及生态环境,特别是近年来, 干旱化对干旱或半干旱地区植物的生长发育及其生产能力的影响显得尤为突出[6]。面对农业生产对水需求量的日益增加,研究植物抗旱的生理机制便成为抗旱育种学家关注的焦点[5]。植物受逆境胁迫影响的首要生理过程是光合作用[7]。在广义上讲,作物的生物量积累与其冠层遮光以及通过光合作用转化为有机物质的能力呈稳定的直线函数关系[7],这意味着植物生长依赖于碳通量。当植物遇水分胁迫时,由于水分亏缺引起气孔关闭而导致光合作用下降,因此胁迫通过削减碳代谢,而对植物碳素状态产生消极影响,最终因处于饥饿状态而促使植物生长受抑制。逆境胁迫通过气孔、非气孔因素以及改变光合作用机制影响植物净光合速率[8,9]。其中,非气孔因素取决于1,5 -二磷酸核酮糖羧化酶/加氧酶(Rubisco)的活性和光合电子传递至RuBP的再生能力[10, 11]。研究证明,盐胁迫影响光合相关的酶类、叶绿素以及类胡萝卜素的含量[12,13]。而一些植物在长期进化过程中形成多种保护机理,以适应严酷的环境条件下生存、生长。【本研究切入点】目前相关水分胁迫条件下新疆野生杏渗透调节物质的积累[5]、山杏(Prunussibirica)光合特性及水分利用效率(WUE)等内容有初步研究[14,15],而有关水分胁迫对野生杏光合生理的影响以及野生杏适应水分胁迫的生理机制研究甚少。采用田间自然干旱的方法,测定不同类型野生杏在干旱处理过程中光合气体交换及其相关参数以及水分利用效率等生理生态指标,达到解释野生杏适应干旱胁迫机制的目的。【拟解决的关键问题】研究以4种不同类型的天山野生杏为材料,田间持续干旱处理,测定分析光合二氧化碳通化相关参数、水分利用效率、细胞膜透性和叶绿素含量等生理指标,揭示野生杏不同类型对干旱胁迫适应性的差异,以及水分胁迫抑制野生杏光合作用的生理机制。
1 材料与方法
1.1 材 料
材料采集于伊犁伊宁县吉里格朗沟,种植在新疆农业大学试验田的四类野生杏分别编号野生甜仁杏1号(甜仁1),甜仁杏2号(甜仁2),野生苦仁杏1号(苦仁1),苦仁杏2号(苦仁2)分别为实验材料[16]。
1.2 方 法
1.2.1 干旱胁迫处理
2010年11月把不同野生杏种植在新疆农业大学实验农场,在同一块试验田,土壤质地为壤土。2011年4月下旬出苗,在田间条件下漫灌育苗,灌溉条件一致。2012年7月5日土壤相对含水量达32%时第一次浇水,此后至8月中旬对两年生天山野杏进行持续26 d的田间自然干旱处理,每隔7 d取样测定。
1.2.2 水势测定
采用PSYPRO露点水势仪同步测定,从07:00至19:00每隔2 h,选择树冠中上部向阳面发育良好的枝条上部叶片,用打孔器取叶,放入C-52 样品室,每5 min记录1次数据测其水势,将连续记录三次取平均值作为该时刻的叶水势[13]。
1.2.3 细胞膜透性测定
用电导仪测定外液的电导度增加值而得知伤害程度。称取叶片个,将叶片放入50 mL小烧杯中,加入30 mL 30%的聚乙二醇600(PEG600)溶液(T)或30 mL蒸馏水(C),用纱网将叶片压入水底,与真空抽滤箱抽真空8 min后,在25℃条件下放置24 h。处理(T)和对照(C)植物组织均用蒸馏水冲洗3次再加30 mL蒸馏水, 25℃下继续放置24 h。用电导率仪(L)测定处理和对照的电导值(T1、C1)。然后将其用高压锅(以免水分蒸发)杀死植物组织,等温度达到室温时,再次测定最终电导值(T2、C2)[17]。
计算:细胞膜透性(%)=(LT-LC)/(1-LC)×100%.
式中:LT表示处理后叶片相对电导值(T1/T2);LC表示对照叶片相对电导值(C1/C2)。
1.2.4 光合作用和水分利用效率
选取4种类型野生杏持续干旱胁迫处理下的相同部位功能叶,采用便携式光合测定系统仪(LI-6400,LI-COR,NE,USA),测定净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)以及蒸腾速率(Tr)等生理指标。叶片瞬时水分利用效率(leaf water use efficiency,WUE) (μmolCO2/mmol H2O)的计算公式为:WUE=Pn/Tr。
1.2.5 叶绿素含量测定
取样:用知道确切面积的模板或打孔器切取2 cm2左右叶片(注意避开比较粗大的叶脉),切成长约5 mm,宽约1 mm的细丝。浸提:将叶片细丝投入含5 mL 80%丙酮的刻度试管中,封管口后于暗中提取至细丝完全变为白色为止(过夜即可)。比色:将管内溶液轻轻倒入比色杯中,用光波长分辨率较高的分光光度计分别于663和645 nm处读光密度(OD)。计算:首先按公式计算提取液的叶绿素浓度(CV,mg/mL)。
Ch1a=12.7 OD663-2.69 OD645.
Ch1b=22.9 OD645-4.86 OD663.
CV=Ch1a+Chlb。
按下式计算以单位叶面积表示的叶绿素含量(mg/dm2):
C(mg/L)×提取液总量(mL)/叶片面积(dm2)×1 000,A,V分别代表面积和体积。
1.3 数据统计
利用Microsoft Excel软件计算环境因子指标和光合生理特性指标的平均值,并完成制图。
2 结果与分析
2.1 水势的变化
天山野生苦仁杏1、2号和甜仁杏1、2号,在持续26 d的干旱处理期间,各类型叶片水势均不同程度下降,随着干旱胁迫时间的延长,各类型之间出现明显差异。处理第26 d各类型水势下降幅度分别为苦仁1号29%,甜仁2号27%,苦仁2号及甜仁1号均14%。由此可见,甜仁1号和苦仁2号水势变化幅度较小。图1
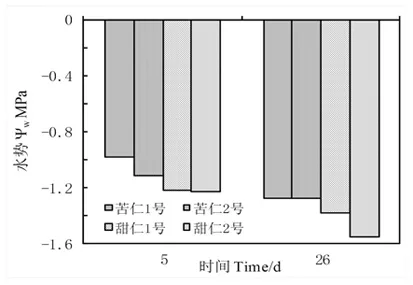
图1 持续干旱胁迫下四类野生杏叶片水势的变化
Fig.1 The changes of leaf water potential in the four types of wild apricot under continuing drought stress
2.2 细胞膜透性
不同类型野生杏叶片细胞膜透性对干旱胁迫的响应有所不同。苦仁1号在持续26 d的干旱胁迫处理期间,其细胞膜透性没有发生明显的变化,苦仁2号透性有所增加,而甜仁1号和甜仁2号细胞膜透性均下降,其中甜仁1号细胞膜透性下降幅度最大,与其他类型之间有极显著差异(P<0.01)。图2
2.3 光合作用
不同类型野生杏在干旱条件下,光合作用随干旱程度变化均呈下降趋势(图3a),干旱胁迫前期因土壤相对含水量较高[5],这时4种类型野生杏光合作用均维持在比较高的稳定水平,其中苦仁杏1号光合作用最高;在26 d的干旱胁迫处理期间,随着时间的延长,各类型野生杏光合作用均有不同程度下降,其下降比率依次为:苦仁2号下降31.8%,苦仁1号下降36.8%,甜仁2号下降47.2%,甜仁1号下降60.5%(图2A)。表明苦仁1号和2号的净光合速率下降幅度小于甜仁1和2号,相对而言,苦仁2号光合速率下降幅度最小,其光合作用维持最高;甜仁1号光合速率下降最快,最终净光合速率最低,胁迫初期与胁迫第26 d之间有显著统计学差异(P<0.01)(图3a)。
干旱胁迫初期气孔导度的下降与光合速率降低相一致(图3b),胁迫处理第26 d,除苦仁2号气孔导度维持比较稳定外,其他三种类型气孔导度均大幅度下降,其中甜仁1号气孔导度下降最快(52%),与其他类型之间有极显著的差异(P<0.01),其次苦仁1号(41%),再次甜仁2号(33%)。蒸腾速率的变化与气孔导度的变化基本相似(图3d)。
随着土壤含水量下降,植物吸收水分与蒸腾散失水分之间失去平衡,叶片处于水分亏缺的状态,气孔导度降低,CO2进入叶片受阻,这将导致植物胞间CO2浓度下降;另一方面在环境胁迫条件下,植物光合电子传递系统遭受破坏,与CO2同化相关酶类基因表达受阻或其活性下降等非气孔因素影响核酮糖1,5-二磷酸(RuBP)羧化效率[14],因此胞间CO2的浓度的高低取决于气孔和非气孔因素。随着干旱处理时间的延长各个野生品种之间的胞间CO2浓度有平缓上升趋势,除苦仁1号细胞间隙CO2浓度保持不变外,其余类型均在胁迫处理初期的基础上有所上升。上升幅度分别为苦仁2号23%、甜仁2号16%和甜仁1号6%(图3c)。图3

注:不同大字母表示为差异极显著(P<0.01),下同
图2 持续干旱条件下四类野生杏细胞膜透性变化
Fig.2 The changes of cell membrane permeability in four types of wild apricot under continues water stress

注:a光合速率(Pn);b气孔导读(Gs);c胞间CO2浓度(Gs);d蒸腾速率(Tr)
图3 持续干旱条件下四类野生杏光合作用参数的变化
Fig.3 The changes of photosynthetic parameter in four types of wild apricot under continues water stress
2.4 叶绿素
叶绿素a和 叶绿素 b在高等植物光合作用过程中,在光能的吸收、传递、激发能的耗散以及光能转中起重要作用。干旱胁迫引起叶绿素a、叶绿素b、总叶绿素含量以及叶绿素a/b比值的变化,从而影响植物光合作用。测定四种不同类型野生杏在持续26 d干旱胁迫过程中叶绿素的含量,结果显示,除甜仁1号含量基本保持稳定外,其余类型的 Ch/a含量均有上升趋势,其中苦仁2号叶绿素含量上升最明显,高达46%(P<0.01)。叶绿素b含量除甜仁1号保持不变外,其他三种野生杏均有上升趋势,其中苦仁2号的Ch b含量上升最快。总叶绿素含量是苦仁1号和甜仁2号保持不变,而苦仁2 号上升比较快。因叶绿素b的上升速率比a的快,所以叶绿素a/b 比值均有不同程度下降。野生杏Cha/b下降幅度依次为苦仁2号 33%,苦仁1号22%,甜仁2号15%,甜仁1号13%,并且都有显著的统计学意义(P<0.05)。图4
2.5 水分利用效率
干旱处理前期野生杏水分利用率保持在较高的水平。持续的干旱处理对四种类型野生杏的水分利用率有显著地影响。干旱处理期间随着光合速率和蒸腾速率的下降各个野生杏WUE均有下降趋势,其下降依次为甜仁1号36%,甜仁2号24%,苦仁1号18%,苦仁2号16%。图5
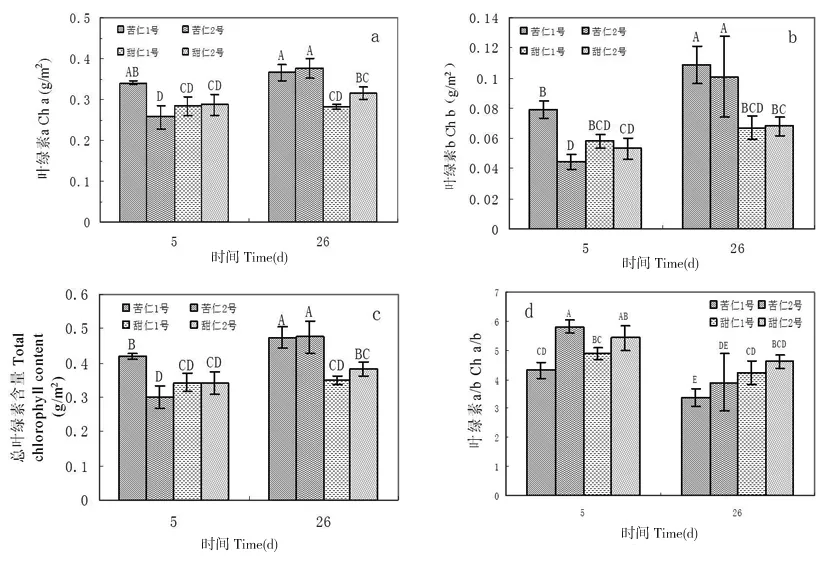
注:a:叶绿素a含量;b:叶绿素含量b;c:总叶绿素含量;d:叶绿素a/b
图4 持续干旱条件下四类野生杏叶绿素a、b和总叶绿素含量以及叶绿素a/b比值的变化
Fig.4 The changes of chlorophyll a,b, total chlorophyll contens and the ratio of chlorophyll a and b in four types of wild apricot under continues water stress
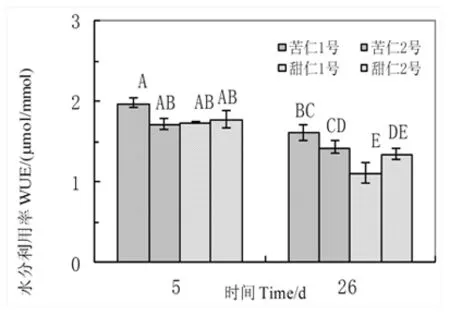
图5 持续干旱下四类野生杏水分利用率变化
Fig.5 The changes of water use efficiency in four types of wild apricot under continues water stress
3 讨 论
水势是衡量植物水分状况的重要指标之一,随着干旱胁迫处理时间的延长或胁迫加剧,组织水势逐渐下降[18],使植物细胞膜透性、渗透调节物质的积累等生理指标发生相应变化[5],同时影响光合器官的形态结构、气孔或非气孔调节光合CO2同化能力,从而导致光合速率下降[9,12]。从实验结果显示,干旱胁迫初期4类野生杏光合速率均维持较高水平,而随胁迫时间和程度加剧,其净光合速率、气孔导度和胞间CO2浓度等参数在对干旱胁迫的响应在类型之间有明显差异。净光合速率在干旱胁迫处理初期的基础上下降,不同类型间比较其下降幅度依次为:甜仁杏1号(61%)>甜仁杏2号(47%)>苦仁杏1号(37%)>苦仁杏2号(32%)。干旱胁迫引起野生杏光合速率下降主要有两个因素,其一,引起保卫细胞水分亏缺使气孔迅速关闭,导致气孔导度(Gs)降低,减少水分蒸腾。因此,气孔导度的变化与蒸腾速率的变化趋势基本一致。随着干旱胁迫的加剧,各野生杏类型气孔导度降低程度不同,气孔导度的变化趋势类似于净光合速率的变化,如果光合作用的这种变化只是由气孔导度的下降所引起,胞间CO2浓度应该也随之下降,但野生杏胞间CO2浓度仍呈现不同程度上升趋势,说明野生杏在干旱胁迫下,还有非气孔CO2同化速率的下降也对净光合速率的下降有贡献。根据陈静等[19](2009)所采取的方法研究非气孔和气孔因素对光合速率下降的贡献,结果显示,野生杏气孔导度和非气孔因素对限制净光合速率的贡献在不同类型之间有差异,苦仁杏2号的气孔导度变化不大,但胞间CO2浓度显著上升,光合速率的下降并非由CO2供应不足所致,是由非气孔CO2同化效率下降,造成CO2的积累。表明苦仁杏2号在水分胁迫下,非气孔因素对光合作用下降的贡献大于气孔阻力;其余野生杏类型非气孔因素对光合速率下降的贡献排序依次为,甜仁2号>甜仁1号,而苦仁1号气孔因素与非气孔因素对光合速率下降的贡献基本相同。不同植物在逆境条件下,气孔导度与非气孔因素对光合CO2同化速率下降的贡献不相同[8,11,20]。研究表明,同一种植物在不同品种或类型之间,气孔导度与非气孔CO2同化速率对光合CO2作用下降的贡献也不相同。
在逆境胁迫条件下导致光合抑制的非气孔因素非常多,起着相对重要的作用[21]。在环境胁迫下,植物光合机构会发生适应性变化从而调控光合作用,这体现在膜结构的变化、叶绿素含量及叶绿素a/b比值及净光合速率的变化[18]。在持续26 d干旱处理条件下,随胁迫时间的延续四种野生杏叶绿素a和叶绿素b含量,除野生甜仁1号基本保持稳定外,其余类型野生杏的 Ch a,Ch b含量均有上升趋势,其结果总叶绿素含量上升,而由于Ch b的的上升速率高于Ch a,引起叶绿素a/b比值下降,其下降幅度依次为苦仁2号(33%),苦仁1号(22%),甜仁2号(15%),甜仁1号(13%)。野生杏叶绿素a/b下降幅度在类型之间有显著差异。这种变化趋势类似于骆驼刺在盐胁迫下的变化趋势[11],这可能是植物在环境胁迫条件下,其PSII/PSI的比值发生适应性变化的结果[18]。在干旱条件下叶绿体结构变化所引起的光合作用下降是重要的非气孔因素之一,盐胁迫条件下叶绿体结构受到破坏在其它植物上也有报道[20]。野生杏叶绿素a/b下降幅度在类型之间有显著差异。研究表明,Chl a/b比值的变化与WUE之间有一定正相关性(R2=0.303),而净光合速率和WUE之间则有高度相关性(R2=0.905)。图4
4 结 论
Pn/Tr计算的叶片水分利用效率(WUE)来表示植物对其本身蒸腾耗水量的利用能力, 水分利用率越高,植物节水能力越强,光合速率越强。在持续干旱胁迫下随着光合速率和蒸腾速率的下降各个野生杏WUE均有下降趋势,其中甜仁杏1号的下降为最快,有极显著差异,其余野生型WUE下降依次为甜仁杏2号(24%),苦仁杏1号(18%),苦仁杏2号(16%)。
References)
[1] 林培钧,崔乃然. 天山野果林资源-伊犁野果林综合研究[M]. 北京:中国林业出版社,2000.
LIN Pei-jun, CUI Nai-ran. (2000).WildFruitForestsinTianshanMountains[M]. Bejing: Forestry Publishing House. (in Chinese)
[2]侯冬花,萨拉木·艾尼瓦尔,海利力·库尔班,等. 伊犁不同类型野生杏花期冻害及座果率研究[J].新疆农业科学,2007,44(2):122-125.
HOU Dong-hua, Anwar Salam, Kurban Halil. (2007). Study on the freezing injury and the fruit set percentage in flowering stage of different types of wild apricot in Yili [J].XinjiangAgriculturalSciences,44(2):122-125.(in Chinese)
[3]王利兵. 山杏开发与利用研究进展[J]. 浙江林业科技,2008,(11):76-77.
WANG Li-bing. (2008). Progress of Exploitation and Utilization Research of Wild Apricot [J].JournalofZhejiangforSci&Tech. , (11):76-77.(in Chinese)
[4]傅大立, 李炳仁, 傅建敏,等. 中国杏属一新种[J]. 植物研究, 2010, 30(1):1-3.
Fu Da-li, LI Bing-ren, FU Jian-min. (2010). A New Species of Armeniaca Scop [J].BulletinofBotanicalResearch, 30(1): 1-3.(in Chinese)
[5]海利力·库尔班,王蕾,阿卜杜许库尔·牙合甫,等. 持续干旱下天山野生杏幼苗渗透调节物质的累积特性[J]. 干旱区研究,2011,28(1):126-132.
Halil Kurban,WANG Lei,Yakup Abduxukur,et al. (2011). Osmolyte Accumulation ofArmenlacavulgarisunder Continuous Drought Stress [J].AridZoneResearch, 28(1):126-132.(in Chinese)
[6]李新周, 刘晓东, 马柱国,等. 近百年来全球主要干旱区的干旱化特征分析[J]. 干旱区研究,2004,21(2):97-103.
LI Xin-zhou, LIU Xiao-dong, MA Zhu-guo. (2004). Analysis on the Drought Characteristics in the Main Arid Regions in the World since Recent Hundred-odd Years [J].AridZoneResearch, 21(2):97-103.(in Chinese)
[7]Bertr, Muller, & Gibon, Y. (2011). Water deficits uncouple growth from photosynthesis, increase c content, and modify the relationships between c and growth in sink organs.JournalofExperimentalBotany, 62(6):1,715-1,729.
[8]Chaves, M. M., Flexas, J., & Pinheiro, C. (2009). Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell.AnnalsofBotany, 103(4):551-560.
[9]Ghannoum, O. (2009). C4 photosynthesis and water stress.AnnalsofBotany, 103(4):635-644.
[10]Caemmerer, S. V., & Farquhar, G. D. (1981). Some relationships between the biochemistry of photosynthesis and the gas exchange of leaves.Planta, 153(4):376-387.
[11]吾木提汗·卡克木, 海利力·库尔班, 陈其军, 等. 盐胁迫下骆驼刺与绿豆光合日变化特征及午休现象的成因[J]. 干旱区研究,2012, 29(6):1 039-1 045.
Umethan Kakem, Halil Kurban, CHEN Qi-jun, et al. (2012). Study on Daily Change and Midday Depression of photosynthesis of Alhagi pseudoalhagi and Vigna radiata under salt stress [J].AridZoneResearch, 29(6):1,039-1,045.(in Chinese)
[12]Misra, A. N., Sahu, S. M., Misra, M., Singh, P., Meera, I., & Das, N., et al. (1997). Sodium chloride induced changes in leaf growth, and pigment and protein contents in two rice cultivars.BiologiaPlantarum, 39(2):257-262.
[13]Santos, C. V. (2004). Regulation of chlorophyll biosynthesis and degradation by salt stress in sunflower leaves.ScientiaHorticulturae, 103(1):93-99.
[14]夏江宝,张光灿,孙景宽,等. 山杏叶片光合生理参数对土壤水分和光照强度的阈值效应[J]. 植物生态学报,2011,35(3):322-329.
XIA Jiang-bao, ZHANG Guang-can, SUN Jing-kuan, et al. (2011). Threshold effects of photosynthetic and physiological parameters in Prunus sibirica to soil moisture and light intensity [J].ChineseJournalofPlantEcology, 35(3):322-329. (in Chinese)
[15]张淑勇,周泽福,张光灿,等. 水分胁迫下天然次生灌木山桃和山杏光合气体交换特征[J]. 西北植物学报, 2008,28(12):2 492-2 499.
ZHANG Shu-yong, ZHOU Ze-fu, ZHANG Guang-can. (2008).Gas Exchange Characteristics of Natural Secondary Shrubs Prunus davidiana and Prunus sibirica under Different Water Stresses [J].ActaBot.Boreal-Occident.Sin, 28(12):2,492-2,499. (in Chinese)
[16]王蕾,海利力·库尔班,萨拉木·艾尼瓦尔,等.野生杏种子对外源赤霉素的生理响应[J]. 干旱区研究,2009,26(5):708-713.
WANG Lei, Halil Kurban, Salam Anwar, et al. (2009).Physiological Response of Wild Apricot Seeds to Exogenous Gibberellin [J].AridZoneResearch, 26(5):708-713. (in Chinese)
[17]Halil Kurban, Hirofumi Saneoka, Kunito Nehira, Rahmutulla Adilla, & Kounosuke Fujita. (1998). Effect of salinity on growth and accumulation of organic and inorganic solutes in the leguminous plants alhagi pseudoalhagi and vigna radiata.SoilScience&PlantNutrition, 44(4):589-597.
[18] Anderson, J. M. (2003). Photoregulation of the composition, function, and structure of thylakoid membranes.AnnualReviewofPlantBiology, 37(37):93-136.
[19]陈静,秦景,贺康宁,等. 水分胁迫对银水牛果生长及光合气体交换参数的影响[J]. 西北植物学报,2009,29(8):1 649-1 655.
CHEN Jing, QIN Jing, HE Kang-ning, et al. (2009). Influences of Water-stress on Shepherdia argentea Seedlings Growth and Photosynthetic Gas-exchange Parameters [J].ActaBotanicaBoreali-OccidentaliaSinica, 29(8):1.649-1,655.(in Chinese)
[20]Ball, M. C., & Farquhar, G. D. (1984). Photosynthetic and stomatal responses of the grey mangrove, avicennia marina, to transient salinity conditions.PlantPhysiology, 74(1):7-11.
[21]接玉玲,杨洪强,崔明刚,等. 土壤含水量与苹果叶片水分利用效率的关系[J]. 应用生态学报, 2001,12(3):387-390.
JIE Yu-ling, YANG Hong-qiang, CUI Ming-gang, et al. (2001).Relationship between soil water content and water use efficiency of apple leaves [J].ChineseJournalofAppliedEcology, 12(3):387-390.(in Chinese)
[21]吉晶. 干旱对苹果树叶水势变化的影响[J]. 山西农业科学, 2007, 35(1):48-50.
JI Jing. (2007).Effect of Drought to Leaf Water Potential in Apple Tree [J].JournalofShanxiAgriculturalSciences, 35(1):48-50.(in Chinese)
Fund project:Supported by Key Projects in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period. (2012BAD42B02)
The Comparison of Photosynthesis in Different Types of Wild Apricot under Water Stress
Mustapa Habibul1,2, Umetkan Kakem3, Jappar Kader2, Halil Kurban1,4
(1. College of Forestry and Horticulture, Urumqi 830052, China; 2. Forestry Bureau of Piqan County,TurpanRegion,PiqanXinjiang838200,China; 3.ForestryBureauofMuleiCounty,ChangjiPrefecture,MuleiXinjiang831900,China; 4.XinjiangAnjudanBiotechnologyCoLtd.,Urumqi830000,China)
【Objective】 The field cultivated biennial seedlings of sweet kernel No.1 and No.2, bitter kernel No.1 and No.2, 4 types of wild apricot (ArmeniacavulgarisLam.), which were collected from Ili region of Xinjiang were used for this experiment, 26 d of drought stress treatment was performed in order to investigate the adaptive traits of photosynthesis of wild apricot under water stress conditions.【Method】The 5 th and 26 th days of interception of water, the photosynthetic rate, stomatal conductance, intercellular CO2concentration and the transpiration rate were measured, and the water use efficiency was calculated, meanwhile the water potential, cell membrane permeability and the chlorophyll contents were determined.【Result】The adaptive change of water potential and the cell membrane permeability were related to the stress resistance, the range ability of net photosynthetic rate different between the types of wild apricot, the order of range ability as: sweet kernel No.1 > sweet kernel No.2 > bitter kernel No.1 > Bitter kernel No.2. 【Conclusion】The decrease of net photosynthetic rate be resulted both from stomatal and non-stomatal factors in wild apricot, and the contribution of stomatal and non-stomatal to decrease in photosynthetic rate was different between the types of wild apricot. The changes of chlorophyll a/b ratio and the water use efficiency were correlated to the variability of net photosynthetic rate.
wild apricot; water stress; photosynthesis; regulation mechanism
10.6048/j.issn.1001-4330.2016.11.011
2016-06-07
国家自然科学基金项目(30760020)
木斯塔帕·海比布(1982-),男,新疆鄯善人,硕士研究生,研究方向为果树栽培管理,(E-mail)1813242422@qq.com
海利力·库尔班(1958-),男,新疆吉木萨尔人,教授,博士生导师,研究方向是植物环境生理学,(E-mail)hkurban@163.com
S662.2
A
1001-4330(2016)11-2047-08
