亚硝酸钠提取海带中碘的实验条件探索
2016-11-25杨孝容孙国峰江滔王晓丽
杨孝容 孙国峰 江滔 王晓丽
摘要:探讨了以亚硝酸钠作为氧化剂提取海带中碘的实验条件,介绍了该实验方法和操作条件,用分光光度法测定海带中碘的含量。结果表明,该方法测定结果的重现性较好,用于样品分析的相对标准偏差为1.0%~2.3%(n=4),平均加标回收率在97.22%~99.90%。提取方法精密度高、可操作性强,可用于高中化学“从海带中提取碘”的实验教学。
关键词:海带;碘提取;亚硝酸钠;氧化萃取;实验条件探索
文章编号:1005–6629(2016)10–0045–04 中图分类号:G633.8 文献标识码:B
1 问题的提出
“从海带中提取碘”是高中化学物质的分离和提取的重要实验之一,在普通高中人教版、苏教版和鲁科版教材中均编入了“从海带中提取碘”的实验。从海带中提取碘的氧化剂有过氧化氢[1~3]、饱和氯气[4,5]、溴水[6]、重铬酸钾[7]、亚硝酸钠[8,9]等。之前对过氧化氢作氧化剂提取海带中碘的实验条件进行了优化[10],酸度对过氧化氢提取海带中碘影响很大,理想酸度是NaAc-HAc的缓冲溶液,在较高的酸度条件下,过氧化氢把碘单质进一步氧化为碘酸,提取碘量减少甚至无法获得碘。相应的电对和电位为:H2O2+2H++2e-=2H2O,Eθ(H2O2/H2O)=1.77V;I2+2e-=2I-,Eθ(I2/I-)= 0.54V;2IO3-+12H++10e-=I2+6H2O,Eθ(IO3-/I2)= 0.99V。从标准电极电位可知,过氧化氢不仅可以氧化碘离子为碘单质,而且可以氧化碘单质为碘酸。但亚硝酸钠情况就不一样,亚硝酸钠在较强酸性环境下形成亚硝酸,HNO2+H++e-=NO+H2O,Eθ(HNO2/NO)=0.99V。从标准电极电位可知,亚硝酸钠的氧化性较过氧化氢弱,可以氧化碘离子为碘单质,但不能氧化碘单质为碘酸。本研究探究优化亚硝酸钠作氧化剂提取和测定海带中碘的实验条件,为中学化学实验提供稳定性好、操作性强的实验服务。
2 实验部分
2.1 主要仪器和试剂
DHG-9075电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司)、ZN-400A型高速万能粉碎机(吉首市中诚制药机械厂)、FC204型电子天平(上海精科天平)、SX2-5-12电阻炉(上海意中电炉有限公司)、T6新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司)、TU-1950紫外-可见分光光度计(北京普析通用仪器有限责任公司)、KQ3200E型超声波清洗器(昆山市超声仪器有限公司);25mL比色管、250mL容量瓶、10mL量筒、125mL分液漏斗、移液管、烧杯、玻璃棒;瓷坩埚、泥三角、坩埚钳、小电炉
用冰醋酸稀释为1:1 HAc,以及H2SO4、HCl和H3PO4,浓度各自分别为0.1、0.2、0.4、0.6、0.8、1.0 mol/L;用亚硝酸钠固体配制成0.5%NaNO2溶液;1.40 mg/mL碘标准溶液(0.3510g I2+0.62g KI,配制成250mL,用Na2S2O3标准溶液标定其浓度):KI溶液(0.5410g配制为250mL);氯仿、无水硫酸钠(实验所有试剂均为分析纯、实验用水为一次蒸馏水)
实验样品:干海带(商场购买)
2.2 样品预处理
海带表面的附着物用刷子刷净,用DHG-9075电热恒温鼓风干燥箱90℃烘干,用ZN-400A型高速万能粉碎机粉碎成海带粉,装入自封袋备用。
2.3 实验方法
2.3.1 样品溶液制备阶段
准确称取1.5g海带粉在瓷坩埚中,用5滴酒精润湿,在电炉上灰化后移入升温至650℃电阻炉,炉门留小缝加热30min,然后关好炉门再加热30min。稍冷取出,冷却至室温后将灰分全部转入小烧杯,加5mL蒸馏水并用KQ3200E型超声波清洗器震荡溶解灰分,慢慢滴加10mL 0.5 mol/L H2SO4并转入分液漏斗中。
2.3.2 萃取和分光光度法测定阶段
将样品溶液转入分液漏斗后,加入10mL CHCl3,再加5mL 0.5% NaNO2溶液,振荡,静置。分层后将含碘的CHCl3层从分液漏斗的下端放入另一分液漏斗中,在水相层加入7mL CHCl3萃取,如此反复2次,合并CHCl3层加入一药匙无水Na2SO4,振荡以除去其中的水分,溶液变为澄清透明的玫红色,慢慢从下口放出至25mL比色管中,用CHCl3定容到25mL,摇匀,稍静置。用1cm比色皿在510nm处测定吸光度,根据标准曲线定量。回收CHCl3层用1 mol/L NaOH处理,CHCl3层经无水Na2SO4处理后可重復使用。
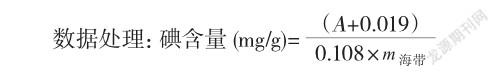
3 结果与讨论
3.1 灼烧温度选择
根据参考文献[11]电阻炉温度选择650℃。
3.2 测定波长的选择
取一定量的碘标准溶液于CHCl3中,在400~600nm扫描吸收曲线。结果表明,碘的氯仿溶液的最大吸收波长为510nm。所以碘溶液吸光度的测定波长均选510nm。
3.3 酸和浓度试验
3.3.1 醋酸试验
按“2.3.1”灰化方法灼烧10份,分别加入1:1 HAc 4.0mL、5.0mL、6.0mL、8.0mL、10mL,每体积平行分2份,酸少于10mL补蒸馏水至10mL(下同),其余与“2.3.2”方法相同。实验结果表明,1:1 HAc体积在4.0~10mL范围内,测得样品中碘的含量基本相同。上述体积相当于20%~50% HAc 10mL,说明HAc浓度在较宽范围内对实验结果没有影响。
3.3.2 硫酸试验
按“2.3.1”灰化方法灼烧6份,试验了0.1、0.2、0.4、0.6、0.8、1.0 mol/L H2SO4对测定海带碘含量的影响。实验结果表明,H2SO4浓度在 0.2~1.0 mol/L,测得海带中碘含量基本不变。
3.3.3 盐酸和磷酸试验
灰化灼烧10份,分别各自试验了0.2、0.4、0.6、0.8、1.0 mol/L HCl和H3PO4对测定海带碘含量的影响。实验结果表明,HCl和H3PO4浓度在0.4~1.0 mol/L,测得海带中碘含量基本相同。
综合上述酸和浓度试验表明,对1.5g海带,氧化剂0.5% NaNO2 5mL,酸性介质由10mL 20%~50% HAc、0.2~1.0 mol/L H2SO4、0.4~1.0 mol/L H3PO4或HCl提供,用CHCl3萃取测得海带中碘的含量基本相同。说明HAc、H2SO4、HCl和H3PO4均可选择。且浓度在较宽的范围对碘的提取没有影响。本实验选择0.5 mol/L H2SO4 10mL。
3.4 亚硝酸钠用量试验
按“2.3.1”方法灰化灼烧5份,用0.5 mol/L H2SO4 10mL,分别加入0.5% NaNO2溶液2.0mL、4.0mL、5.0mL、6.0mL和8.0mL,其余与“2.3.2”方法相同。试验结果表明,0.5% NaNO2体积在2.0~8.0mL,测得海带中碘的含量基本不变。实验选择0.5% NaNO2 5.0mL。
3.5 反应时间试验
按“2.3.1”方法灰化灼烧7份,再考察加入NaNO2反应不同时间后进行第一次萃取分离。考察时间分别为2min、4min、6min、8min、10min、15min、20min。试验结果表明,反应时间在2~20min,测得海带中碘的含量基本相同。结果说明在该条件下NaNO2氧化碘化物生成碘单质的速度较快。反应时间2min以上均可。
3.6 标准曲线的绘制
准确量取1.40 mg/mL碘标准溶液1.00mL、2.00mL、3.00mL、4.00mL、5.00mL、6.00mL、7.00mL、8.00mL于分液漏斗中,加1.0 mol/L H2SO4 5.0mL,加蒸馏水补足15mL。其余与“2.3.2”方法相同。标准曲线对应质量为1.4mg、2.8mg、4.2mg、5.6mg、7.0mg、8.4mg、9.8mg、11.2mg,质量在1.4~8.4mg之间,吸光度与碘的质量之间有良好的线性关系,用Excel回归得回归方程为A=-0.019+0.108×m(mg),相关系数γ=0.9995。
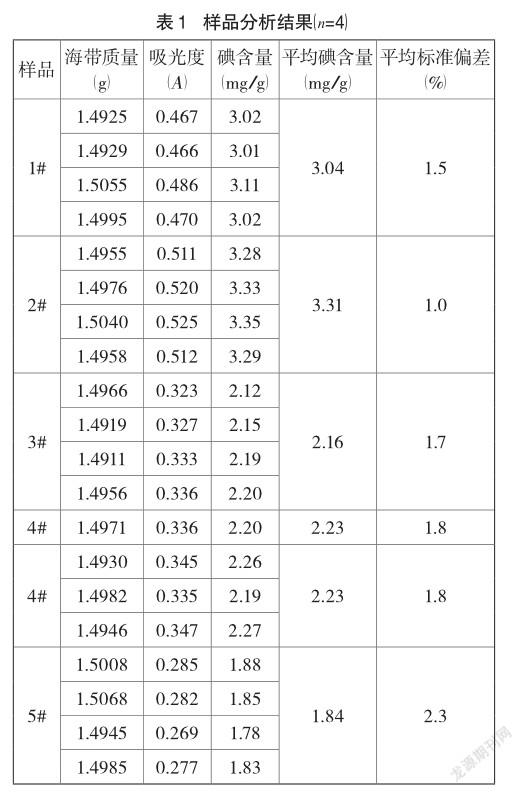
3.7 样品分析结果
根据“2.3.2”方法分析测定5批海带中的碘含量,分析结果见表1。
3.8 加标回收率试验
准确称取1g左右的海带粉,灰化后准确加入3.00mL KI溶液,在电炉上缓缓加热蒸干后再放入650℃电阻炉,其余与“2.3.2”相同;空白试验直接取KI溶液3.00mL于分液漏斗中,加2.0mL蒸馏水和10mL 0.5 mol/L H2SO4,其余与“2.3.2”方法相同。
从表1和表2可知:海带中碘含量是微量组分,但样品分析的相对标准偏差在1.0%~2.3%,说明海带样品粉末比较均匀且方法的稳定性和精密度好;加标回收率在97.22%~99.90%,说明方法的准确度高。
4 结论

以亚硝酸钠作氧化剂提取海带中碘,以氯仿萃取分光光度法监测碘含量。海带粉1.5g灰化后650℃灼烧,当用10mL 20%~50% HAc或0.2~1.0 moL·L-1 H2SO4或0.4~1.0 moL·L-1 HCl或H3PO4处理灰分,2.0~8.0mL 0.5% NaNO2作氧化剂,反应时间2~20min,以氯仿萃取分光光度法测得碘含量基本相同。方法用于5批海带样品碘含量测定的相对标准偏差为1.0%~2.3%(n=4);3批样品加标回收率在97.22%~99.90%,相对标准偏差为0.54%~1.8%(n=4)。说明以亚硝酸钠作氧化剂提取海带中的碘用硫酸、盐酸、磷酸和醋酸处理灰分调节酸度均可,反应速度快,操作简单,方法的稳定性和精密度好,准确度高。本文研究成果可用于高中化学“从海带中提取碘”的实验教学。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·实验化学[M].北京:人民教育出版社,2007:20~22.
[2][10][11]楊孝容,熊俊如,张桃.过氧化氢提取海带中碘的实验条件优化[J].化学教学,2015,(8):48~51.
[3]沈文敏,李永红.“从海带中提取碘”最佳实验条件的探讨”[J].化学教育,2013,(6):66~68.
[4]王祖浩主编.普通高中课程标准实验教科书·实验化学[M].南京:江苏教育出版社,2009:2~4.
[5]王磊主编.普通高中课程标准实验教科书·实验化学[M].济南:山东科学技术出版社,2007:9~12.
[6]中华人民共和国水产行业标准海带碘含量的测定SC/T3010-2001.
[7]胡小莉,李原芳,凌莉莎等.海带中提取碘的微型实验研究[J].西南师范大学学报(自然科学版),2007,32(5):168~170.
[8]汤春兰,杨文珍.光度法测定海带中微量碘[J].精细石油化工,1999,(2):57~59.
[9]王清,李肖媛,江丽等.分光光度法测定海带中的碘[J].广西化工,2002,31(2):26~28.
