利用紫甘蓝汁和pH传感器探究二氧化碳与氢氧化钠溶液的反应
2016-11-25夏琴杨砚宁毛明
夏琴 杨砚宁 毛明
摘要:针对沪教版初中化学教材中“氢氧化钠溶液与二氧化碳气体反应”的实验作了改进设计。利用紫甘蓝汁稀释液作指示剂、干冰代替二氧化碳气体,由手持pH计的“断点式”检测,继而改用pH数字传感器“连续式”检测干冰与氢氧化钠溶液的反应过程,通过观察混合液酸碱度和紫甘蓝汁的色差变化,从定性、定量和时间延续三个维度证明氢氧化钠与二氧化碳发生反应的变化过程。实验方法严谨,实验现象明显,突破了传统实验只用试管间断性检验的局限性。
关键词:CO2与NaOH溶液反应;自制紫甘蓝汁指示剂;酸碱度;pH传感器;实验探究
文章编号:1005–6629(2016)10–0039–03 中图分类号:G633.8 文献标识码:B
《义务教育化学课程标准(2011年版)》在“课程性质”中指出“化学是一门以实验为基础的学科,在教学中创设以实验为主的科学探究活动,有助于激发学生对科学的兴趣,引导学生在观察、实验和交流讨论中学习化学知识,提高学生的科学探究能力”[1]。可见,实验教学在化学课堂教学中占据着十分重要的地位,而创新实验增强了化学课堂的趣味性与探究性,更加高效地服务于教学,贴合现代化学教学的需求。
氢氧化钠溶液与二氧化碳气体的反应是沪教版九年级化学教材“常见的酸和碱”[2]中的一个知识点。作为知识点的引入,如果这个反应在试管或者烧杯中进行,一般没有明显的实验现象。以往教学中,通常在密闭容器中探究实验过程中的气压变化,或者通过检验反应后的生成物碳酸钠[3]间接证明反应的发生。以上方法比较传统,趣味性和自主性不强。本研究试图通过指示剂颜色的多层次变化和连续计量的方式来证明该反应的发生,使实验变得可视、科学、有趣。
为了增强趣味性和自主性,笔者先对指示剂进行了改进,利用紫甘蓝汁稀释液作为酸碱指示剂[4]。先用手持式pH计检测不同酸碱度溶液的pH,然后加入一定比例的紫甘蓝汁稀释液,通过观察紫甘蓝呈现的颜色,来确定相应颜色对应的pH范围,从而选择紫甘蓝汁稀释液的最佳显色区域。考虑到教学现场制取大量二氧化碳耗时较长,因此本实验选用干冰来代替二氧化碳气体。将pH数字传感器[5]的探头浸入一定浓度的氢氧化钠溶液中,连接传感器,然后向氢氧化钠溶液中加入干冰。由于干冰易升华,沉到容器底部的干冰,能快速地产生大量二氧化碳气体并向上散逸,与氢氧化钠溶液持续发生反应。在此反应过程中,紫甘蓝的颜色也随之发生丰富的变化,pH传感器则连续测出溶液pH变化的数据和曲线,从而定量测定溶液酸碱度的变化。前者为表象,后者为数据,二者互为佐证,证明了二氧化碳与氢氧化钠溶液反应的发生。
1 背景实验
1.1 自制紫甘蓝汁指示剂
(1)将紫甘蓝切成小块,进行榨汁。
(2)用棉质纱布做过滤层,将纱布覆盖在烧杯上并用棉线固定,将榨取的紫甘蓝汁静置后进行过滤。
(3)将紫甘蓝汁与蒸馏水以1:25的体积比混匀、稀释。
1.2 用紫甘蓝汁稀释液作指示剂间歇测定溶液酸碱度变化
(1)用稀盐酸与稀氢氧化钠溶液配制8种不同酸碱度的溶液,在室温下(25℃),用手持pH计测定其酸碱度。
(2)向8种溶液中分别加入紫甘蓝汁稀释液,充分搅拌,溶液呈现不同颜色。
1.3 测试结果
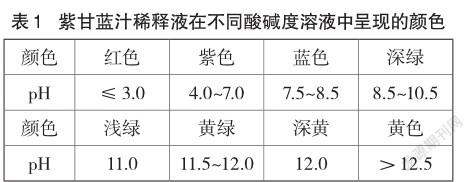
2 创意实验
2.1 实验用品
笔记本电脑、Vernier数据采集器、Vernier pH传感器、普通家用原汁机、直口厚壁玻璃瓶(直径8cm,高25cm)3个、烧杯(250mL)1个、细口瓶(500mL)6个、量筒(1000mL)2个、玻璃棒3根、手电筒1个、手套1副
氢氧化钠溶液(0.1 mol·L-1)、干冰、紫甘蓝1棵、蒸馏水等
2.2 实验过程
(1)在3个玻璃瓶上分别标注1号、2号、3号,在3个瓶中各加入400mL一定浓度的紫甘蓝汁稀释液。
(2)在1號瓶中加入200mL蒸馏水,在2号、3号瓶中分别加入200mL 0.1 mol·L-1的氢氧化钠溶液,使3个瓶内的溶液体积保持一致。其中,1号瓶是用作空白对照,2号瓶与3号瓶起始状态一致,用来与3号瓶即将发生的反应作对比。
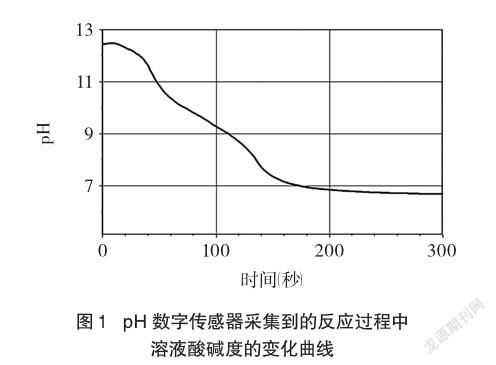
(3)在3号瓶中插入pH传感器探头,浸入溶液中,再连接数据采集器。向3号瓶所盛溶液中投入几块干冰。测定溶液的pH变化,观察实验过程中的现象(如图1所示)。
2.3 现象描述
观察3号瓶内发生的现象:干冰在溶液中立即产生了大量气泡,在瓶口形成了云雾缭绕的景象,瓶内溶液的颜色由原来的绿色逐渐转变为深绿,继而变为翠绿,紧接着转化为浅绿,然后慢慢变为湖蓝、天蓝、青蓝,最终变为紫色。从紫甘蓝汁颜色变化的多样性,结合图1所测得的相关数据,从定性和半定量的角度,可以感知到溶液的酸碱度发生了变化。
与此同时,pH数字传感器采集到反应过程中连续变化的数据,形成了pH曲线,直观、形象地表明了溶液中pH的变化[6]——pH由最初的12逐渐变化到小于7,从而揭示了氢氧化钠溶液与二氧化碳发生反应的过程。
2.4 结论
(1)打破传统的通过检验实验中气压变化或产物来间接证明反应发生的方法,将二氧化碳与氢氧化钠溶液的反应过程从视觉上和数据上连续地呈现出来,奇妙的化学现象给教学带来了丰富的视觉刺激。整个实验过程所需要的时间在2分钟以内,既适合作为课堂演示实验,也可以作为学生的探究实验,有较好的教学价值。
(2)用干冰代替二氧化碳气体,操作简便,既体现了物质的多样性,又营造出了云雾缭绕的奇妙景象,增强了实验的趣味性,让学生体验化学之美;用生活中的常见蔬菜紫甘蓝汁液代替传统的指示剂紫色石蕊试液,拉近了化学与生活的距离,体现了生活化学的理念;利用紫甘蓝颜色多变的特点,也让学生初步了解指示剂变色范围的概念,为将来指示剂的学习作铺垫。
(3)用pH计间断性检测与用数字传感器连续性检测作对比,使氢氧化钠与二氧化碳的反应更具有可视性、科学性。本实验的改进体现了实验的定性、定量的融合和数字传感技术的有效使用。
3 本实验用紫甘蓝汁调配与显色区域的探究
3.1 紫甘蓝汁提取液稀释调制的配比
本实验用原汁机榨取紫甘蓝汁原液,原液为深紫色,若浓度过大,紫甘蓝汁自身的紫色会干扰实验现象的观察。为了增强实验的视觉效果,通过控制变量进行反复实验,得出紫甘蓝汁原液与蒸馏水以1:25的体积比进行稀释,能获得较好的实验效果。
3.2 紫甘蓝汁稀释液显色区域的选擇
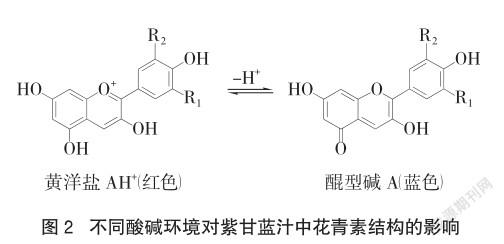
从使用手持pH计间歇测定紫甘蓝汁稀释液在不同酸碱度溶液中的显色情况可知,其在不同pH环境的溶液中颜色变化非常丰富。查阅资料可知紫甘蓝汁液显色的有效成分是花青素(其结构如图2所示)[7],花青素在碱性较强时,其结构会发生转变,因此实验结束时无法转变为紫色。
为了观察到溶液更多层次的颜色变化,笔者反复多次实验。发现若使紫甘蓝汁与氢氧化钠溶液混合后起始色为黄色(此时溶液碱性较强),在实验过程中,纵使加入足量的干冰,直至溶液pH小于7时,溶液颜色的变化始终在黄色区间,最终呈现灰色,溶液色彩变化比较单一,少了感官上的视觉美感。本实验中,笔者选择pH约为12.8的绿色溶液(传感器测定与手持pH计测定有一定误差)作为起始颜色,整个实验过程中,溶液的颜色在绿色、蓝色、紫色三个颜色区间内进行逐层次的转变,可谓美轮美奂。
参考文献:
[1]中华人民共和国教育部制定.义务教育化学课程标准[S].北京:北京师范大学出版社,2011:2.
[2]王祖浩主编﹒义务教育教科书·化学(九年级下册)[M].上海:上海教育出版社,2012:46.
[3]李琼﹒二氧化碳和氢氧化钠溶液反应的实验探究[J].新课程学习(上旬),2014,(8):6.
[4]张小平,张旻媛﹒紫甘蓝色素变色实验的设计[J].化学教学,2014,(6):50.
[5]蔡碧霞﹒利用现代传感技术绘制酸碱中和滴定曲线[J].化学教育,2009,(11):56.
[6]华中师范大学等编.分析化学(上册)[M].北京:高等教育出版社,2001:139.
[7]高攀峰,侯金丽,傅海燕等﹒紫甘蓝花青素三种提取工艺对比研究[J].食品研究与开发,2015,(12):37.
