超级铝热剂Al/FeO对硝化棉热分解特性的影响
2016-11-25赵宁宁马海霞赵凤起胡荣祖
赵宁宁,马海霞,安 亭,赵凤起,胡荣祖
(1. 西北大学化工学院,陕西 西安710069;2. 西安理工大学理学院,陕西 西安710048;3. 西安近代化学研究所燃烧与爆炸技术重点实验室,陕西 西安 710065)
超级铝热剂Al/FeO对硝化棉热分解特性的影响
赵宁宁1,2,马海霞1,安 亭3,赵凤起3,胡荣祖3
(1. 西北大学化工学院,陕西 西安710069;2. 西安理工大学理学院,陕西 西安710048;3. 西安近代化学研究所燃烧与爆炸技术重点实验室,陕西 西安 710065)
采用水热法制备了纳米Fe2O3,并用超声分散法将其与纳米Al颗粒复合制备了超级铝热剂Al/Fe2O3,利用X-射线粉末衍射(XRD)、透射电子显微镜(TEM)、扫描电镜及能量散射光谱仪(SEM-EDS)对复合物的物相、组成、形貌和结构进行了分析表征,采用差示扫描量热法(DSC)和热红联用技术(TG-FTIR)研究了Al/Fe2O3对硝化棉(NC)热分解过程的影响。结果表明,Al/Fe2O3-NC和NC的热分解过程遵循Avrami-Erofeev 方程f(α)=1.5(1-α)[-ln(1-α)]1/3;超级铝热剂Al/Fe2O3可降低硝化棉的表观活化能、临界点火温度和临界爆炸温度,在促进硝化棉O-NO2键断裂和凝聚相二次自催化反应中起到至关重要的作用。
超级铝热剂; 硝化棉;NC;超声分散法; 热分解; TG-FTIR; 纳米Fe2O3; 水热法
引 言
三氧化二铁(Fe2O3)作为一种常见的过渡金属氧化物,具有自然储量大、无毒、抗腐蚀能力强、制备成本低及优良的可见光吸收能力等特点[1-2],广泛用于光电学[3]、气体传感器[4]、锂离子电池[5]、水处理[6]及固体推进剂领域[7-8]。Fe2O3有α、β和γ三种晶型,其中α-Fe2O3(赤铁矿)可在自然界中稳定存在,将其制备成不同形貌及粒径大小的纳米结构后,可获得优异的光、电、磁、催化等物理及化学性质[9-11]。
将纳米α-Fe2O3与纳米Al粉复合处理得到超级铝热剂Al/Fe2O3,与传统Al/Fe2O3铝热剂相比,该纳米级金属基高能量密度含能材料实际反应活性更高,发生铝热反应时可瞬间释放大量热量,燃烧波传播速度快,可将其作为燃烧催化剂应用于固体推进剂领域。影响超级铝热剂Al/Fe2O3性质的主要因素有:(1)纳米Fe2O3的形貌和尺寸;(2)纳米铝粉颗粒尺寸小,表面能较高,极易被氧化,且易发生团聚;(3)铝热剂中还原剂与氧化剂组分的配比。考虑到纳米铝粉表面的Al2O3层和文献关于Al/Fe2O3铝热体系的最大反应速率,根据文献报道[12],实际的燃料Al粉和氧化剂Fe2O3的化学计量比为其化学计量数的1.2倍。
本研究采用水热法合成纳米Fe2O3,并用超声分散法制备了超级铝热剂Al/Fe2O3。对纳米Fe2O3和Al/Fe2O3的微观结构进行了表征,研究了超级铝热剂Al/ Fe2O3对硝化棉(NC)热分解特性的影响,并对NC及Al/Fe2O3-NC的热分解产物进行分析,为超级铝热剂Al/Fe2O3在火炸药、推进剂等方面的应用提供理论和实验依据。
1 实 验
1.1 原料及仪器
六水合氯化铁(FeCl3·6H2O)、尿素(H2NCONH2),均为析纯,纯度≥99.0%,天津市恒兴化学试剂制造有限公司;甘氨酸(C2H5NO2),分析纯,纯度≥99.5%,上海山浦化工有限公司;无水乙醇(C2H5OH),分析纯,纯度≥99.7%,天津市富宇精细化工有限公司;正己烷(C6H12),纯度≥98.0%,分析纯,天津市富宇精细化工有限公司;纳米铝粉(含活性铝粉80%),粒径50nm,焦作伴侣纳米材料工程有限公司;硝化棉(NC,含氮量12.6%,西安近代化学研究所)。所有试剂未经进一步纯化,实验用水均为去离子水。
50 mL水热釜;KH-100DE型数控超声波清洗器,昆山禾创超声仪器有限公司;DHG-9023AD型台式电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;DZF-6050型真空干燥烘箱, 上海一恒科技有限公司;SHB-95型循环水真空泵,郑州杜甫仪器厂;Quanta 400场发射环境扫描电子显微镜,美国FEI公司,设定场发射环境扫描电子显微镜高压为30 kV,电流为4 A,工作距离为7.0~10.0 mm;INCAIE350 能谱仪,英国牛津公司;Carl Zeiss SMT Pte Ltd型透射电子显微镜,德国蔡司公司,操作电压200 kV,点分辨率≤0.24 nm,信息分辨率≤0.14 nm,能量分辨率≤0.7 eV;D/MAX-3C型粉晶衍射仪,日本理学公司,CuKα,波长为0.15406nm,测角仪精度为±0.02°,重现性为±0.03°(2θ),强度综合稳定度为±0.5%。
1.2 纳米Fe2O3的制备
将1.0 g FeCl3·6H2O、0.9 g尿素、0.5g甘氨酸溶于30mL水中,搅拌均匀,移至50mL水热釜,设定反应温度为160℃,反应时间为10h。反应完后,冷却至室温,将沉淀物分离,用去离子水和无水乙醇交替洗涤数次,置于烘箱中干燥,获得纳米Fe2O3样品。
1.3 超级铝热剂Al/Fe2O3的制备
称取一定量纳米Fe2O3和纳米Al粉分别置于装有正己烷的反应容器中超声分散1h,随后将分散好的两种样品置于同一反应容器中,在60℃下继续超声分散2h左右。分散剂蒸发后于室温下老化,最后移至真空干燥箱中干燥。
1.4 性能分析
将超级铝热剂Al/Fe2O3与NC按质量比1∶1均匀混合,得到Al/Fe2O3-NC复合物。在动态高纯氮气气氛保护下,采用差示扫描量热仪分析超级铝热剂Al/Fe2O3对NC热分解特性的影响, 动态氮气流速为50 mL/min,温度范围50~400℃,升温速率分别为5.0、10.0、15.0、20.0、25.0、30.0℃/min,参比物为α-Al2O3,试样质量0.20~0.50 mg,盛放试样的样品池为铝质坩埚。采用TG-IR热红联用分析气体产物,铝坩埚,氮气气氛,流速为100 mL/min,升温速率为10 ℃/min。
2 结果与讨论
2.1 XRD分析
利用X-射线粉末衍射对样品进行物相和组成分析,结果如图1所示。

图1 纳米Fe2O3和超级铝热剂Al/Fe2O3的XRD图Fig.1 XRD patterns of Fe2O3 nanoparticles and superthermites Al/Fe2O3
图1(a)中,2θ为24.30°、33.29°、35.75°、40.99°、49.58°、54.28°、57.50°、62.64°、64.14°、72.06°和75.71°处的衍射峰,分别与斜方六面体结构Fe2O3的(0 1 2)、(1 0 4)、(1 1 0)、(1 1 3)、(0 2 4)、(1 1 6)、(1 2 2)、(2 1 4)、(3 0 0)、(1 1 9)和(2 2 0)晶面(JCPDS No. 33-0664)对应,该样品为Fe2O3,其衍射峰出现宽化现象,说明Fe2O3粒径较小。图1(b)谱图中不仅出现了Fe2O3斜方六面体结构的特征衍射峰,同时出现Al的特征衍射峰,依次对应于面心立方结构的(1 1 1)、(2 0 0)、(2 2 0)和(3 1 1)晶面,无其他杂峰出现。但图1(b)所示Fe2O3的衍射峰对应2θ的值略大于图1(a)样品相应晶面对应的2θ值。可见,加入纳米Al后,Fe2O3的特征峰受到影响。图1(b)中只出现Fe2O3和Al的特征峰,未出现其他杂质的特征峰,说明铝热剂中两组分未发生化学反应;与单独Fe2O3的XRD衍射峰(图1(a))相比,图1(b)所示Fe2O3特征峰发生红移。综上所述,铝热剂样品是以分子复合物的形式存在。
2.2 形貌及结构表征
采用扫描电镜和能谱分析对样品进行结构和组成分析,结果如图2和图3所示。

图2 纳米Fe2O3 和超级铝热剂Al/Fe2O3的SEM图Fig.2 SEM images of nano-Fe2O3 and superthermites Al/Fe2O3

图3 纳米Fe2O3 和超级铝热剂Al/Fe2O3的EDS图Fig.3 EDS pattern of nano-Fe2O3 and superthermites Al/Fe2O3
由图2(a)可见,纳米Fe2O3为颗粒状,表面不光滑。由图2(b)可见,纳米Fe2O3与纳米Al粉超声复合后, Fe2O3纳米颗粒与球形纳米Al颗粒相互“粘附”在一起,由于两者颗粒均较小,表面能较大,复合后呈现一定的团聚现象。由图3可知,水热法得到的是仅含Fe、O两种元素的铁氧化物,XRD结果(图1(a))表明该铁氧化物为Fe2O3。对比图3(a)与图3(b)发现,铁元素及氧元素的质量比变化较大,这是由于两次能谱分析分别取自Fe2O3与铝热剂Al/Fe2O3内部不同位置的极微小部分,所得结果中铁元素及氧元素的比例会有所差异。但对于样品整体而言,铁/氧质量比符合Fe2O3中两元素的比。结合Al/Fe2O3的XRD表征结果(图1(b)),谱图上并未出现其他杂质的特征衍射峰,因此,Fe与O的质量比发生变化,未受到Al2O3的影响。
采用透射电镜对样品结构作进一步表征分析,结果如图4所示。

图4 纳米Fe2O3和超级铝热剂Al/Fe2O3的透射电镜图Fig.4 TEM images of nano-Fe2O3 and superthermites Al/Fe2O3
由图4(a)可以看出,纳米Fe2O3颗粒为不规则的椭球体,表面有凹陷或棱角,有一定程度的团聚现象。颗粒尺寸在100~400nm,平均粒径约为220nm。由图4(b)可看出,该样品具有良好的单晶结构,只测得一组明显的晶格条纹,晶格间距为0.25nm,与斜方六面体Fe2O3结构的(1 1 0)晶面相对应。同样的结果可由对应于图4(b)区域“A”的快速傅里叶变换图(插图(i))得到。水热法合成的纳米颗粒由于合成过程中受压力、温度、浓度等因素影响,其单晶结构通常存在晶格缺陷。图4(b)区域“B”及其表面位错缠结/网络的放大图(插图ii)显示纳米Fe2O3颗粒表面呈现位错缺陷。图4(c)及插图(iii)所示纳米Fe2O3颗粒表面存在堆叠层错现象。这些线缺陷和面缺陷对纳米Fe2O3颗粒的性质具有深刻影响。由图4(d)可以看出,超级铝热剂Al/Fe2O3样品内部出现明显的团聚现象。图4(e)中区域“C”和“D”分别为Al颗粒和Fe2O3颗粒表面,两者均具有良好的结晶性。区域“C”显示仅有一组晶格间距为0.20nm的晶格条纹,与Al立方结构的(2 0 0)面对应,同样的结果可由对应于图4(e)区域“C”黑色方框选区的快速傅里叶变换图(插图v)得到。区域“D”分析结果与图3(b) 区域“A”结果一致,仅有一组晶格间距为0.25nm的晶格条纹,与Fe2O3的(1 1 0)面对应,该分析结果同样可由相应的快速傅里叶变换图(插图(iv))得到。
2.3 超级铝热剂Al/Fe2O3对NC热分解的影响
将Al/Fe2O3-NC复合物进行扫描电镜分析,结果如图5所示。

图5 Al/Fe2O3-NC的SEM图Fig.5 SEM images of Al/Fe2O3-NC
由图5(a)可见,Al/Fe2O3-NC复合材料呈棒状分布,部分小块状物质为未粘附在硝化纤维表面的Al/Fe2O3团聚体。由图5(b)可知,超级铝热剂Al/Fe2O3由颗粒状的Al粉及Fe2O3混合而成,二者相互“粘附”,混合效果较好,但由于纳米颗粒尺寸小、表面能大,使得铝热剂Al/Fe2O3呈一定的团聚现象。
图6为在升温速率10℃/min下NC和Al/Fe2O3-NC的DSC曲线。
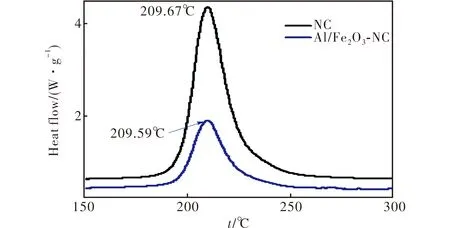
图6 升温速率为10 ℃/min时NC和Al/Fe2O3-NC的DSC曲线Fig.6 DSC curves of NC and Al/Fe2O3-NC obtained at a heating rate of 10 ℃/min
由图6可知,NC和Al/Fe2O3-NC的热分解峰温分别为209.67和209.59 ℃。与NC单组分热分解峰温相比,Al/Fe2O3-NC的热分解峰温低0.08℃。图7为Flynn-Wall-Ozawa法[13]计算得到的NC和Al/Fe2O3-NC的Ea-α曲线。
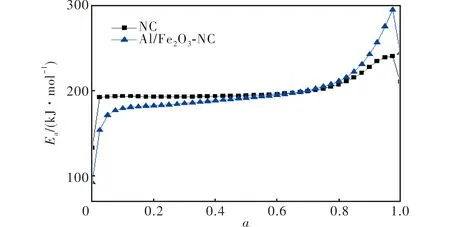
图7 Flynn-Wall-Ozawa法计算得到的NC和Al/Fe2O3-NC的Ea-α曲线Fig.7 Eα vs. α curves of NC and Al/Fe2O3-NC calculated by Flynn-Wall-Ozawa′s method
由图7可见,α在0.100~0.800时,活化能变化不大,说明在该范围内分解机理未发生本质改变,或发生的转变可忽略不计。将α为0.100~0.800,升温速率(β)为5.0、10.0、15.0、20.0、25.0和30.0 ℃/min的数据代入MacCallum-Tanner方程、atava-esták方程、Agrawal方程、普适积分方程和一般积分方程[14],用线性回归处理和逻辑选择法确定NC和Al/Fe2O3-NC放热分解反应的动力学参数,结果见表1。由此计算得到的E和A值与Kissinger法及Ozawa法得到的数据基本一致,因此确定NC和Al/Fe2O3-NC热分解的动力学函数为14号Avrami-Erofeev方程:f(α)=1.5(1-α)[-ln(1-α)]1/3,G(α)=[-ln(1-α)]2/3,n=2/3。

表1 NC和Al/Fe2O3-NC分解反应动力学参数的计算值
注:d为可信因子,d= (1-r)Q;r为线性相关系数;Q为标准均方差;Eeo为不同外推起始温度(Te)下由Ozawa法计算得到的表观活化能;Epo为不同Tp下由Ozawa法计算得到的表观活化能;Ek为不同峰温(Tp)下由Kissinger方程[15]计算得到的表观活化能。

对于含能材料而言,计算获得其热爆炸临界温度值,以及β→0时的热分解峰温所对应的活化熵、活化焓及活化吉布斯自由能具有重要意义。
由式(1)和式(2)求得β→0时NC和Al/Fe2O3-NC的自加速分解温度(Te0)、峰温(Tp0)、热点火温度(Tbe0或TTIT)及热爆炸临界温度(Tbp0或Tb),结果见表2。
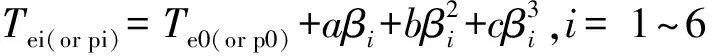
(1)
(2)
式中:a、b和c为常数,Eo为Ozawa方程对应的表观活化能。
当T=Tpo,Eα=Ek,A=Ak时,NC和Al/Fe2O3-NC的热分解放热反应的活化熵(ΔS≠),活化焓(ΔH≠)和活化自由能(ΔG≠)可由式(3)、(4)和(5)计算得到,结果见表2。
(3)
(4)
ΔG≠=ΔH≠-TΔS≠
(5)
式中:kB为Boltzmann常数,取1.38066×10-23J/K;h为Plank常量。

表2 NC和Al/Fe2O3-NC分解反应动力学参数的计算值
2.4 TG-IR分析
图8为升温速率10℃/min时,NC、Fe2O3-NC和Al/Fe2O3-NC的TG-DTG曲线。
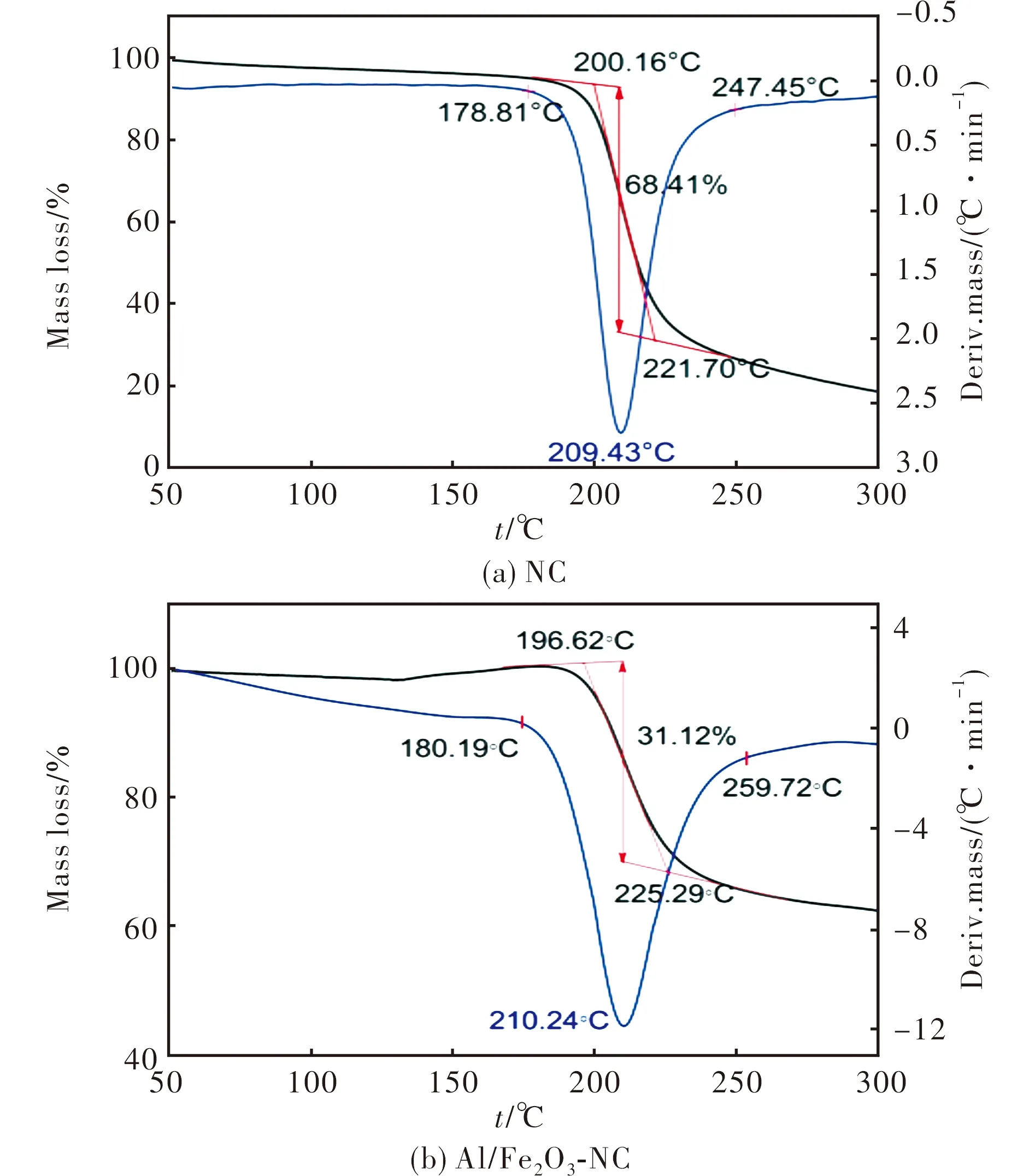
图8 NC和Al/Fe2O3-NC的TG-DTG曲线Fig.8 TG-DTG curves of NC and Al/Fe2O3-NC
由图8可分析NC和Al/Fe2O3-NC热分解过程的起始分解温度(Ti)、外推起始分解温度(Te)、峰温(TL)、外推终止分解温度(Tc)及终止分解温度(Tf),见表3。由图8可得,热分解过程中NC、Al/Fe2O3-NC的失重量依次为68.41%、31.12%。由于Al/Fe2O3-NC中加入Al/Fe2O3,不能转化为气体溢出,因此较NC而言,Al/Fe2O3-NC失重量较小。

表3 NC和Al/Fe2O3-NC热分解特性参数
随加热温度升高,NC、Al/Fe2O3-NC发生热分解反应,生成的气体可由红外光谱分析仪检测分析,结果如图9所示。其中,曲线Ii、Ie、IL、Ic、If及Ix依次为Ti、Te、TL、Tc、Tf及起始分解温度之前某一温度Tx对应的IR谱图。表4所列数据为NC、Al/Fe2O3-NC在温度为Ti、Te、TL、Tc、Tf及Tx时检测到的气体。
由图9及表4可知,NC、Al/Fe2O3-NC热分解产生的气体包括H2O、CO2、NO2、CO、NO2、NO、N2O、HCHO、HCOOH,且在整个热分解过程中检测到气体的温度及种类不同。N2可能为NC及Al/Fe2O3-NC热分解产生的气体之一,但由于其对称性不产生偶极距变化,故需采用其他检测方法进行分析。
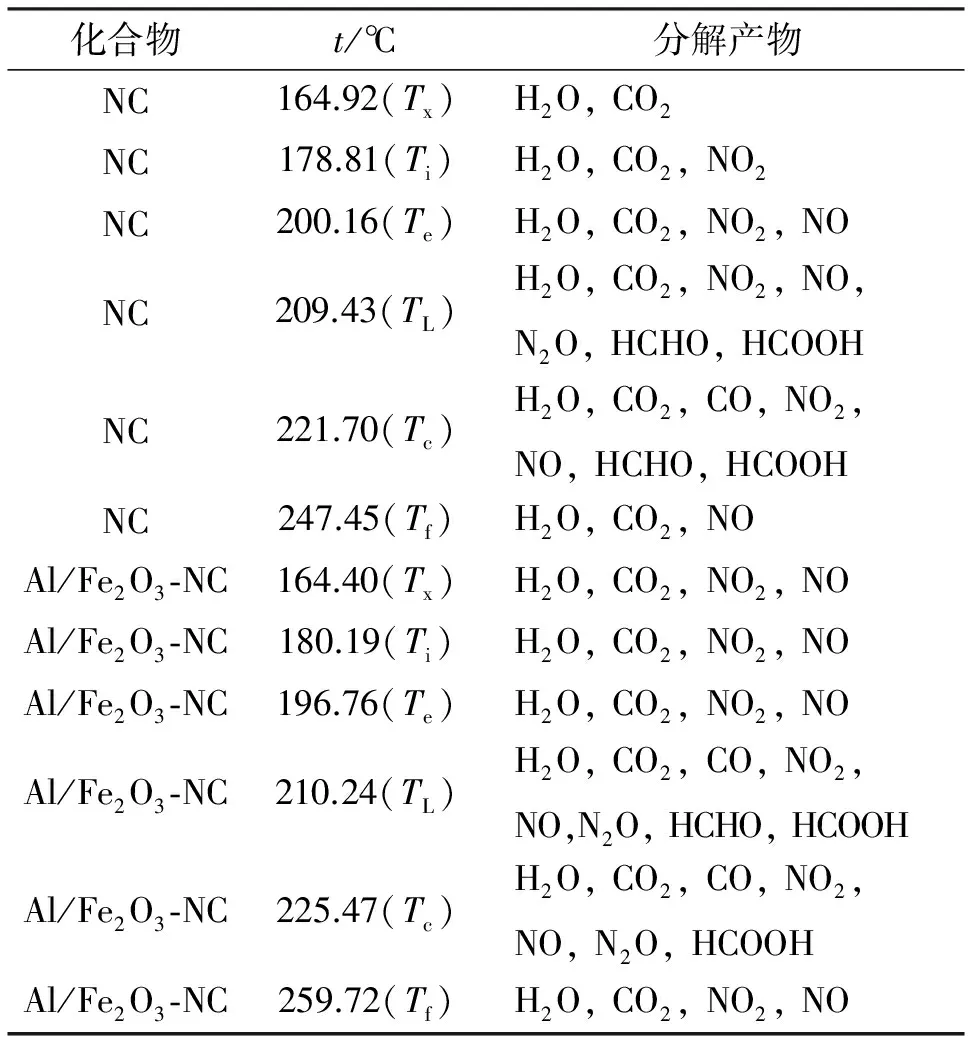
表4 NC和Al/Fe2O3-NC热分解过程中不同温度下产生的气体

图9 NC、Al/Fe2O3-NC热解过程中生成气体的IR图谱Fig.9 IR spectra of the gases evolved from the degradation of NC and Al/Fe2O3-NC
NC开始发生热分解时可检测到H2O和NO2(1593~1635cm-1)[16-17]。在整个测试过程中,环境中存在的H2O和CO2不容忽视。为证明在178.81℃下检测到的H2O和CO2为NC的热分解产物,故取NC热分解开始前在164.92 ℃时获得的IR图谱,见图9(a)Ix曲线。如图9所示,在3600~3740cm-1范围内检测到O-H的伸缩振动峰,且发现在164.92 ℃和178.81 ℃时该峰强度无明显变化,由此可确定在178.81 ℃时检测到的H2O峰为环境中的水产生的峰,为杂质峰。除此之外,对比图9(a)Ix、Ii曲线可得,178.81 ℃时检测到的CO2峰同样为环境中的CO2产生的杂质峰。
由图9可知,164.92 ℃和178.81 ℃时H2O和CO2的峰形及峰强度基本不变,同样由此图可得178.81 ℃时测得的H2O和CO2吸收峰为杂质峰。经分析,NC开始分解时在1593~1635cm-1处测得NO2的特征吸收峰,且NO2为NC分解的初始分解产物,该结果与文献[18-21]相吻合。文献所述,O-NO2键断裂为NC分解初始决定步骤,放出NO2气体,该反应如下:
NC的分解属于硝氧和骨架产物竞争类型,即O-NO2键断裂生成的NO2气体大量滞留在聚合物骨架中,而后与RO·原子团或其热解产物反应,最终使二次自催化反应明显加强。加入Al/Fe2O3后,混合物Al/Fe2O3-NC的热分解在初始阶段明显不同于NC热分解,如图9、表4所示。由于Al/Fe2O3的催化作用,随加热温度升高,加快了NC的分解速度。对于Al/Fe2O3-NC而言,在初始分解温度180.19 ℃及164.40 ℃不仅可测得H2O (3600~3740cm-1)、CO2(2360,670cm-1)和NO2(1593~1635cm-1)的特征吸收峰,在1762~1965cm-1还出现了NO的吸收峰,可见Al/Fe2O3能加速O-NO2键断裂并加快聚合物骨架的进一步分解。出现该结果的原因是,除Fe2O3能催化NC分解外[22],加入的Al粉平均粒径为50 nm,颗粒尺寸小,表面能较大,加强了Al/Fe2O3混合物的催化能力。
当NC及Al/Fe2O3-NC到达分解峰温时,NC分解产生的气体为H2O、CO2、NO2、NO、N2O、HCHO、HCOOH,Al/Fe2O3-NC分解产生的气体为H2O、CO2、CO、NO2、NO、N2O、HCHO、HCOOH。在2814cm-1和1746cm-1为HCHO的C-O和C=O键的伸缩振动峰,由基团-CH2ONO2断裂产生。HCOOH气体来自NC的二次自催化反应过程。在峰温处,Al/Fe2O3-NC热分解产生的气体种类较多,且在较长时间内可检测到多种气体产物。Al/Fe2O3-NC分解过程中可能发生以下反应[23]:
8NO2+ 6HCHO→8NO + 2CO2+ 3CO +5H2O+ HCOOH
Al/Fe2O3颗粒尺寸小,表面能大,具有较强的表面吸附能力,能吸附分解产生的气体,将其禁锢在聚合物骨架中,不仅可使NO2和HCHO反应发生,还可促进复合物热分解的二次自催化反应。类似的现象同样出现在NiO催化NC的热分解过程中[24]。
图10为在升温速率10 ℃/min下获得的NC、Al/Fe2O3-NC热分解过程的TG-IR联用3D图谱。

图10 NC和Al/Fe2O3-NC在升温速率为10 ℃/min时气体产物的TG-IR 联用3D图谱Fig.10 3D stacked plots of IR spectra of gas products of NC and Al/Fe2O3-NC at a heating rate of 10 ℃/min
从图10可以看出,当热分解反应进行至最后阶段时,对于NC而言,在其外推终止温度下仍能检测到HCHO及HCOOH峰,而Al/Fe2O3-NC在其外推起始温度下只能检测到HCOOH峰,说明Al/Fe2O3-NC热分解反应中基团-CH2ONO2最先断裂,或产生的HCHO被铝热剂Al/Fe2O3吸附使之与NO2发生反应生成HCOOH。在Al/Fe2O3-NC终止反应温度259.72 ℃下仍能检测到NO2的特征吸收峰,这可能由于被铝热剂吸附的NO2气体脱附作用造成的。
综上所述,超级铝热剂Al/Fe2O3对NC的热分解起到催化作用,不仅可以促进O-NO2键断裂,加速NC二次自催化反应,还可促进气体NO2和HCHO之间的反应。且由于铝热剂中含有颗粒尺寸更小的纳米Al粉使得其催化效果更好。这一点可由Al/Fe2O3-NC的热分解动力学分析结果得到,Al/Fe2O3-NC的活化能小于NC的活化能,证明加入超级铝热剂Al/Fe2O3后,复合物的热分解反应更容易发生。
3 结 论
(1)采用水热法制备了颗粒状纳米Fe2O3,并用超声分散法将其与纳米Al颗粒复合制备成超级铝热剂Al/Fe2O3。
(2)非等温热分解动力学研究表明,复合物Al/Fe2O3-NC与NC的热分解都遵循Avrami-Erofeev机理方程。与NC相比,复合物Al/Fe2O3-NC的表观活化能、临界点火温度及临界爆炸温度依次降低21.14kJ/mol、5.71℃和7.10℃。
(3)热红联用技术分析结果表明,Al/Fe2O3可促进O-NO2键断裂,加速凝聚相分解,生成NO2和HCHO气体。
[1] Chen L, Li F, Ni B, et al. Enhanced visible photocatalytic activity of hybrid Pt/α-Fe2O3nanorods[J]. RSC Advances, 2012, 26(2): 10057-10063.
[2] Eggleston C M. Geochemistry. Toward new uses for hematite[J]. Science, 2008, 320(5873): 184.
[3] Ando M, Kadono K, Haruta M, et al. Large third-order optical nonlinearities in transition-metal oxides[J]. Nature, 1995, 374(6523): 625-627.
[4] Sun B, Horvat J, Kim H S, et al. Synthesis of mesoporous α-Fe2O3nanostructures for highly sensitive gas sensors and high capacity anode materials in lithium Ion batteries[J]. The Journal of Physical Chemistry C, 2010, 114(44): 18753-18761.
[5] Reddy M V, Yu T, Sow C H, et al. Thin space (1/6-em)[J]. Rao and BVR Chowdari, Adv Funct Mater, 2007, 17: 2792-2799.
[6] Zhong L S, Hu J S, Liang H P, et al. Self-assembled 3D flowerlike iron oxide nanostructures and their application in water treatment[J]. Advanced Materials, 2006, 18(18): 2426-2431.
[7] Zhao N N, He C C, Liu J B, et al. Dependence of catalytic properties of Al/Fe2O3thermites on morphology of Fe2O3particles in combustion reactions[J]. Journal of Solid State Chemistry, 2014, 219: 67-73.
[8] 贺翠翠, 赵宁宁, 刘健冰, 等. 纳米氧化铁的合成及对NTO热分解性能的影响[J]. 火炸药学报, 2013, 36(5): 29-34.
HE Cui-cui,ZHAO Ning-ning,LIU Jian-bing,et al. Synthesis of Fe2O3nanoparticles and its effect on the thermo decomposition property of NTO [J]. Chinese Journal Explosives & Propellants(Huozhayao Xuebao), 2013, 36(5): 29-34.
[9] Gotié M, Dražié G, Musié S. Hydrothermal synthesis of α-Fe2O3nanorings with the help of divalent metal cations, MN2+, Cu2+, ZN2+and Ni2+[J]. Journal of Molecular Structure, 2011, 993(1): 167-176.
[10] Lv B, Xu Y, Wu D, et al. Single-crystal α-Fe2O3hexagonal nanorings: stepwise influence of different anionic ligands (F-and SCN-Anions)[J]. Chemical Communications, 2011, 47(3): 967-969.
[11] 赵文忠, 郑邯勇, 林碧亮.纳米氧化铁的制备及其对高金属含量燃料的催化作用[J]. 火炸药学报, 2008, 31: 69-72.
ZHAO Wen-zhong, ZHENG Han-yong, LIN Bi-liang. Preparation of iron oxide nanoparticles and its catalysis on fuel with high metallic content [J]. Chinese Journal Explosives & Propellants(Huozhayao Xuebao), 2008, 31: 69-72.
[12] Prentice D, Pantoya M L, Clapsaddle B J. Effect of nanocomposite synthesis on the combustion performance of a ternary thermite[J]. The Journal of Physical Chemistry B, 2005, 109(43): 20180-20185.
[13] Ozawa T. Initial kinetic parameters from thermogravimetric rate and conversion data [J]. Bulletion of the Chemical Society of Japan, 1965, 38(11): 1881-1886.
[14] 胡荣祖, 史启祯. 热分析动力学[M]. 北京: 科学出版社, 2001.
HU Rong-zu, SHI Qi-zhen. Thermal Analysis Dynamics [M]. Beijing: Science Press, 2001.
[15] Kissinger H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29(11): 1702-1706.
[16] Li Y, Chenxia K, Huang C, et al. Effect of MnC2O4nanoparticles on the thermal decomposition of TEGDN/NC propellant[J]. Journal of Thermal Analysis and Calorimetry, 2012, 109(1): 171-176.
[17] Dong Q. Infrared Spectrometry[M]. Beijing: Petroleum Chemical Industry Press,1977:165-170.
[18] Makashir P S, Mahajan R R, Agrawal J P. Studies on kinetics and mechanism of initial thermal decomposition of nitrocellulose[J]. Journal of Thermal Analysis and Calorimetry, 1995, 45(3): 501-509.
[19] Shehata A B, Hassan M A, Nour M A. Effect of new poly 2-Acryloyl-N, N′-bis (4-Nitrophenyl) propandiamide and poly 2-Acryloyl-N, N′-bis (4-Methylphenyl)propandiamide and their synergistic action on the stability of nitrocellulose[J]. Journal of Hazardous Materials, 2003, 102(2): 121-136.
[20] Katoh K, Higashi E, Nakano K, et al. Thermal behavior of nitrocellulose with inorganic salts and their mechanistic action[J]. Propellants, Explosives, Pyrotechnics, 2010, 35(5): 461-467.
[21] Gratien A, Nilsson E, Doussin J F, et al. UV and IR absorption cross- sections of HCHO, HCDO, and DCDO[J]. The Journal of Physical Chemistry A, 2007, 111(45): 11506-11513.
[22] Zhao N N, Li J C, Gong H J, et al. Effects of α-Fe2O3nanoparticles on the thermal behavior and non-isothermal decomposition kinetics of nitrocellulose[J]. Journal of Analytical and Applied Pyrolysis, 2016, 120: 165-173.
[23] Wei W, Cui B, Jiang X, et al. The catalytic effect of NiO on thermal decomposition of nitrocellulose[J]. Journal of Thermal Analysis and Calorimetry, 2010, 102(3): 863-866.
[24] 刘子如. 含能材料热分析[M]. 北京:国防工业出版社, 2008.
LIU Zi-ru. Thermal Analyses for Energetic Materials[M]. Beijing: National Defense Industry Press, 2008.
Effects of Superthermite Al/Fe2O3on the Thermal Decomposition Characteristics of Nitrocellulose
ZHAO Ning-ning1,2, MA Hai-xia1, AN Ting3, ZHAO Feng-qi, HU Rong-zu3
(1. College of Chemical Engineering, Northwest University, Xi′an 710069, China;2.School of Sciences,Xi′an University of Technology, Xi′an 710048, China;3. Science and Technology on Combustion and ExplosionLaboratory, Xi′an Modern Chemistry Research Institute, Xi′an 710065, China)
The nano-Fe2O3was prepared by hydrothermal method, and then combined with Al nanoparticles using ultrasonic dispersion method to prepare superthermite Al/Fe2O3. The physical phase, composition, morphology and structure of the composite were characterized by X-ray powder diffraction (XRD), transmission electron microscopy (TEM) and scanning electron microscope-energy dispersive spectrometer (SEM-EDS). The differential scanning calorimetry (DSC) and the thermogravimetry with Fourier transform infrared analysis (TG-FTIR) were employed to investigate the effects of the superthermite Al/Fe2O3on the thermal decomposition process of nitrocellulose (NC). The results show that the thermal decomposition reactions of Al/Fe2O3-NC composite and NC follow the same thermal decomposition mechanism with the Avrami-Erofeev equation off(α)=1.5(1-α)[-ln(1-α)]1/3. The superthermite Al/Fe2O3can reduce the activation energy of the decomposition reaction, the thermal ignition temperature and the critical temperature of thermal explosion of NC,and it plays a crucial role in promoting the O-NO2bond cleavage of NC and secondary autocatalytic reactions in condensed phase.
superthermite;nitrocellulose;NC;ultrasonic dispersion method; thermal decomposition; TG-FTIR; nano-Fe2O3; hydrothermal method
10.14077/j.issn.1007-7812.2016.05.014
2016-08-17;
2016-08-29
国家自然科学基金(No.21373161);国防科技重点实验室基金(9140C3501041001)
赵宁宁(1987-),女,讲师,从事纳米含能材料研究。E-mail:zhaoningning501@sina.com
马海霞(1974-),女,教授,博士生导师,从事含能材料研究。E-mail:mahx@nwu.edu.cn
TJ55;O614.3+1
A
1007-7812(2016)05-0084-09
