三种植物生长调节剂对两个品种葡萄硬枝扦插生根及生长的影响
2016-11-24石晓昀张军宝王延秀党兆霞王淑华陈佰鸿
石晓昀,张军宝,王延秀,党兆霞,王淑华,陈佰鸿
(1.甘肃农业大学园艺学院,甘肃 兰州 730070,2.甘肃省泾川县林业局,甘肃 泾川 744300)
三种植物生长调节剂对两个品种葡萄硬枝扦插生根及生长的影响
石晓昀1,张军宝2,王延秀1,党兆霞1,王淑华1,陈佰鸿1
(1.甘肃农业大学园艺学院,甘肃 兰州 730070,2.甘肃省泾川县林业局,甘肃 泾川 744300)
【目的】 筛选适宜葡萄硬枝扦插生根的生长调节剂及其浓度配比.【方法】 以‘红地球’(Red globe grape)和‘藤稔’(Fujiminori grape)葡萄一年生枝条为试材,研究不同质量浓度(50、100、150 mg/L)的萘乙酸(NAA)、吲哚乙酸(IAA)和吲哚丁酸(IBA)对其生根及生长的影响.【结果】 3种植物生长调节剂不同质量浓度对葡萄硬枝扦插生根及枝条生长均有显著促进影响,表现为生根率、根系活力、根鲜质量、根干质量、冬芽萌发率、新梢长度、节间数增加,并存在浓度效应.3种生长调节剂均为100 mg/L时生根率最高,其单株根数最多,根长较长,根系活力较高.3种生长调节剂在质量浓度为50 mg/L时,2种葡萄冬芽萌发率最高,新梢节间数最多、最长.吲哚丁酸(IBA)对2种葡萄枝条扦插促进生根及生长效果最好.【结论】 3种生长调节剂种类及其浓度对2种葡萄生根及生长效应不同,对‘红地球’的促进效果优于‘藤稔’.
葡萄;生长调节剂;扦插;生根;生长
我国是世界上重要的葡萄生产国,至2013年,全国葡萄栽植面积达57万hm2[1].长期以来硬枝扦插一直是我国最主要的葡萄繁殖方式[2].生长调节剂对植物扦插生根具有重要的促进作用.王关林等[3]研究表明,生长调节剂能够促进插条内源激素的作用表达和内部营养物质的重新分配,提高插条吸水力、酶活性和细胞渗透压,进而使细胞顺利完成脱分化和再分化,从而促进插条生根.经济利用繁殖材料和快速扦插技术一直都是葡萄繁殖的研究重点.Robitaille[4]以‘Redhaven’为材料,用IBA液浸泡叶芽已部分膨大的硬木,弥雾扦插生根效果良好.王晓明等[5]以灰毡毛忍冬新品种‘金翠蕾’组培苗为试验材料,发现较高浓度IAA有利于根原基的分化形成及生长发育.Goldfarb等[6]在研究火炬松(Pinustaeda)下胚轴生根诱导时发现,用NAA处理后24 h内,由生长调节剂类诱导的早期基因的表达达到高峰.前人对葡萄扦插苗的繁育研究多集中在单一生长调节剂对生根的效应方面,针对多生长调节剂对生根的效应还少有报道.
本试验以不同生长调节剂处理后的‘红地球’和‘藤稔’葡萄枝条为试验材料,探讨不同生长调节剂处理对葡萄硬枝扦插生根及生长的影响.
1 材料与方法
1.1 试验材料
一年生‘红地球’(‘Red Globe’ grape)和‘藤稔’(Fujiminori grape)葡萄枝条于2013年11月取自甘肃省农科院林果花卉所试验基地.秋季落叶后,从盛果期葡萄树上剪取充分成熟、芽饱满、无病虫害的一年生健壮枝条,将其剪成长度为80 cm的枝段, 每50枝绑成1捆,进行沙埋储藏.
选择一年生健壮枝条,剪成长15.00 cm左右,留1~2个芽,上端在上芽的1.50~2.00 cm处剪成平茬,下端在下芽处剪成马耳形斜口,清水浸泡3 d,待用.
先在培养箱底部铺一层塑料薄膜,然后将蛭石与珍珠岩按1∶1配成的混合基质,均匀铺在塑料薄膜上,厚度5~8 cm,浇透水待用.
试验所用吲哚丁酸(IBA)、吲哚乙酸(IAA)、萘乙酸(NAA)等药剂购自艾康生物有限公司.
1.2 处理方法
IAA、IBA、NAA处理质量浓度分别为50、100、150 mg/L.在各质量浓度试剂中浸泡时间为12 h(浸泡枝条下部4~6 cm处部位),每处理25个插条.清水为空白对照(CK).将处理后插条均匀、整齐地扦插到苗床内,并标记.
1.3 试验管理及样品采集
室内温度控制在25 ℃,苗床温度28 ℃左右,湿度80%以上.从扦插第2天开始隔天进行观察,当湿度过低时对基质进行水分补充.将经处理后的插条插入培养箱,根据随机采样法则,随机取出3株枝条作为试验样品.培养期为40 d.
1.4 测定指标
测定样品的生根率、根鲜质量、根干质量、根系活力、萌发率、节间数、枝条长度.根鲜质量:将扦插苗根系上土壤用水冲去,再用滤纸吸去水分后称质量;根干质量:将扦插苗根系烘干后称质量;节间数、枝条长度利用常规记数法测得;利用氯化三苯基四氮唑(TTC)法测定根系活力[7].
生根率=生根扦插苗数/扦插苗总数
萌发率=萌发扦插苗数/扦插苗总数
1.6 数据分析
试验数据采用Excel 2003和SPSS 17软件进行统计分析.
2 结果与分析
2.1 IBA对两种葡萄扦插生根的影响
由图1可知,不同浓度IBA处理对‘红地球’和‘藤稔’两种葡萄扦插生根率、根系干鲜质量、根系活力均具有显著的促进作用.各浓度IBA处理后的两种葡萄生根率显著提高,其中100 mg/L IBA处理后‘红地球’的生根率最高,比对照及50、150 mg/L处理生根率提高69.00%、8.20%、11.50%(P<0.05);同样100 mg/L浓度IBA处理后根系干质量、鲜质量、根系活力均显著高于对照及50、150 mg/L处理,分别提高0.05、0.03、0.02 g及1.20、0.60、0.40 g与240.00、130.00、190.00 mg/(g·h).‘藤稔’葡萄的扦插生根率、根系干鲜质量、根系活力也呈现出相同的浓度效应.100 mg/L IBA处理后,‘藤稔’葡萄的生根率显著高于对照及50、150 mg/L处理,分别提高71.20%、3.60%、4.00%;100 mg/L浓度IBA处理后根系鲜质量、干质量、根系活力均显著高于对照及50、150 mg/L处理,分别提高1.15、0.58、0.36 g及0.05、0.01、0.02 g与210、110、200 mg/(g·h).红地球’根系生长情况优于‘藤稔’.100 mg/L浓度IBA处理对两品种葡萄扦插苗生根促进效果显著优于其他处理.
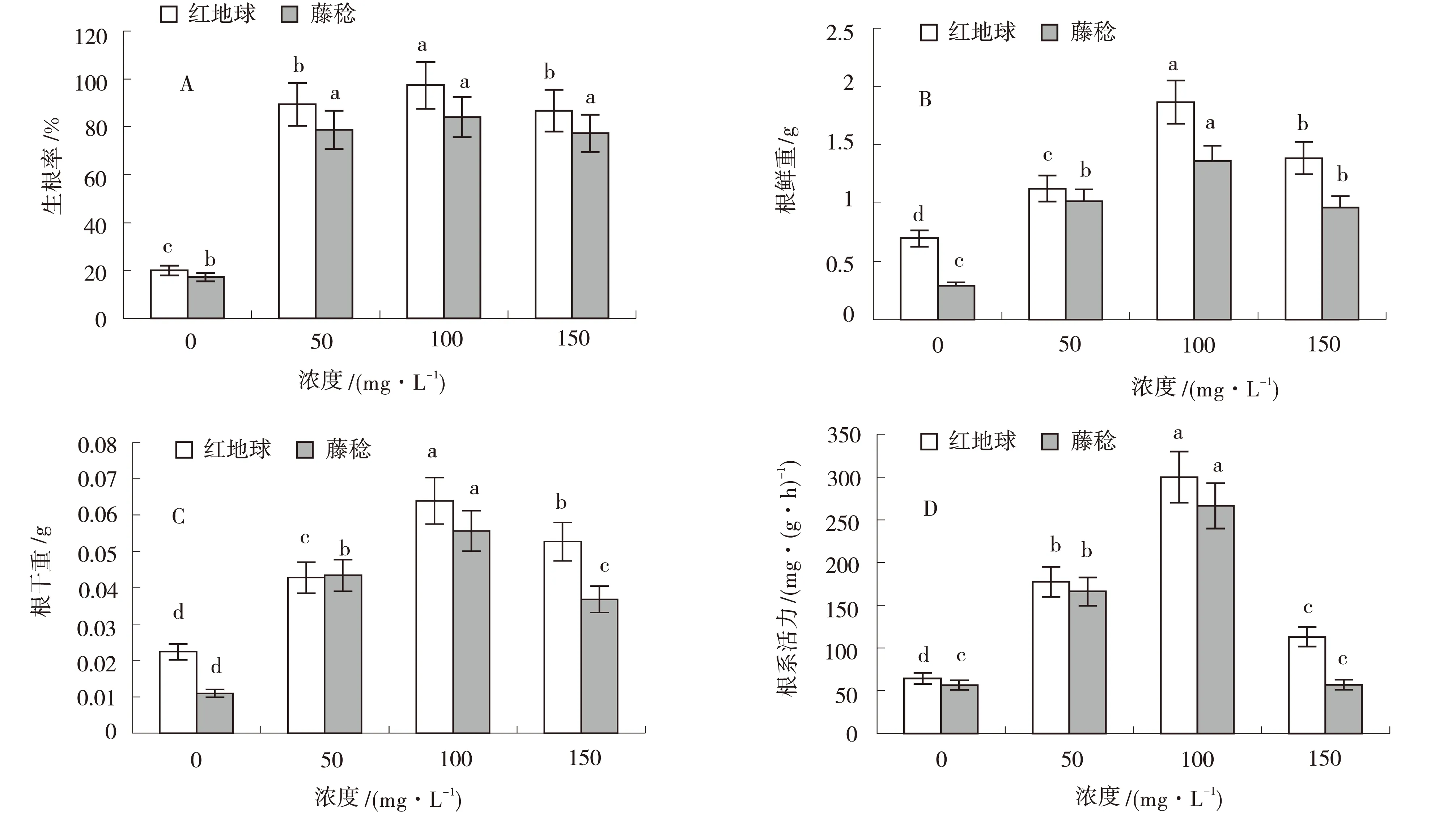
同一品种不同小写字母者表示差异显著(P<0.05),下同

图2 不同浓度IBA处理下的两种葡萄扦插生根图
2.2 NAA对两种葡萄扦插生根的影响
与CK相比,50、100、150 mg/L NAA处理对促进‘红地球’和‘藤稔’两种葡萄扦插生根效果显著(图3~4).100 mg/L处理对提高‘红地球’根系生长最优,相较于对照及50、150 mg/L NAA处理,生根率分别提高了75.60%、2.80%、4.00%,其中50 mg/L处理与对照无显著差异,而100 mg/L和150 mg/L处理生根率显著高于对照;与CK相比,50、100、150 mg/L NAA处理根系鲜质量分别增加了0.87、0.42、0.27 g,根系干质量分别增加了0.04、0.02、0.01 g,根系活力分别提高了20、15、12 mg/(g·h),各处理指标均显著高于对照.同时100 mg/L NAA处理也提高了‘藤稔’根系生长状况,与CK、50、150 mg/L处理相比,生根率分别增加了78.90%、2.00%、3.60%,其中50 mg/L处理与对照无显著差异,而100 mg/L和150 mg/L处理生根率显著高于对照.与对照相比,根系鲜质量、干质量及根系活力分别提高了0.88、0.48、0.23 g和0.04、0.02、0.01 g及13.00、8.00、9.00 mg/(g·h)(P<0.05).NAA显著改善了‘红地球’和‘藤稔’两种葡萄根系生长状况,但高浓度处理会抑制根系生长.生长调节剂NAA对‘红地球’的生根促进效果优于‘藤稔’.
2.3 IAA对两种葡萄扦插生根的影响
由图5~6中可知,不同浓度IBA处理对‘红地球’和‘藤稔’两种葡萄扦插生根均有明显的促进作用,表现为插条生根率提高,根系鲜质量、干质量增加,根系活力提高.50、100、150 mg/L质量浓度的IAA处理效应均显著优于对照,其中100 mg/L IAA处理对‘红地球’葡萄不定根效果最显著,与CK、50、150 mg/L处理相比生根率分别提高62.50%、4.80%、5.00%,根系鲜质量分别增加0.68、0.36、0.08 g,根系干质量分别增加0.03、0.01、0.02 g,根系活力分别提高76.85、43.60、47.23 mg/(g·h).而对于‘藤稔’葡萄扦插苗,100 mg/L IAA处理生根率显著高于对照和150 mg/L,但与50 mg/L差异不显著,与CK、50、150 mg/L IAA处理相比,生根率分别提升了69.70%、3.50%、4.80%;100 mg/L处理后根系鲜质量、干质量及根系活力与其他3个处理差异显著,分别提高了0.70、0.66、0.38 g与0.03、0.02 、0.01 g及81.73、56.28、98.40 mg/(g·h).IAA显著改善了‘红地球’和‘藤稔’两种葡萄根系生长状况,但高浓度处理存在抑制作用.生长调节剂IAA对‘红地球’的生根促进效果优于‘藤稔’.
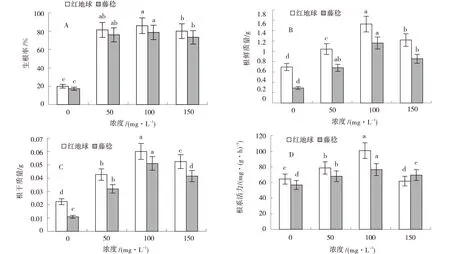
图3 不同浓度NAA对两种葡萄扦插生根的影响

图4 不同浓度NAA处理下的两种葡萄扦插生根图
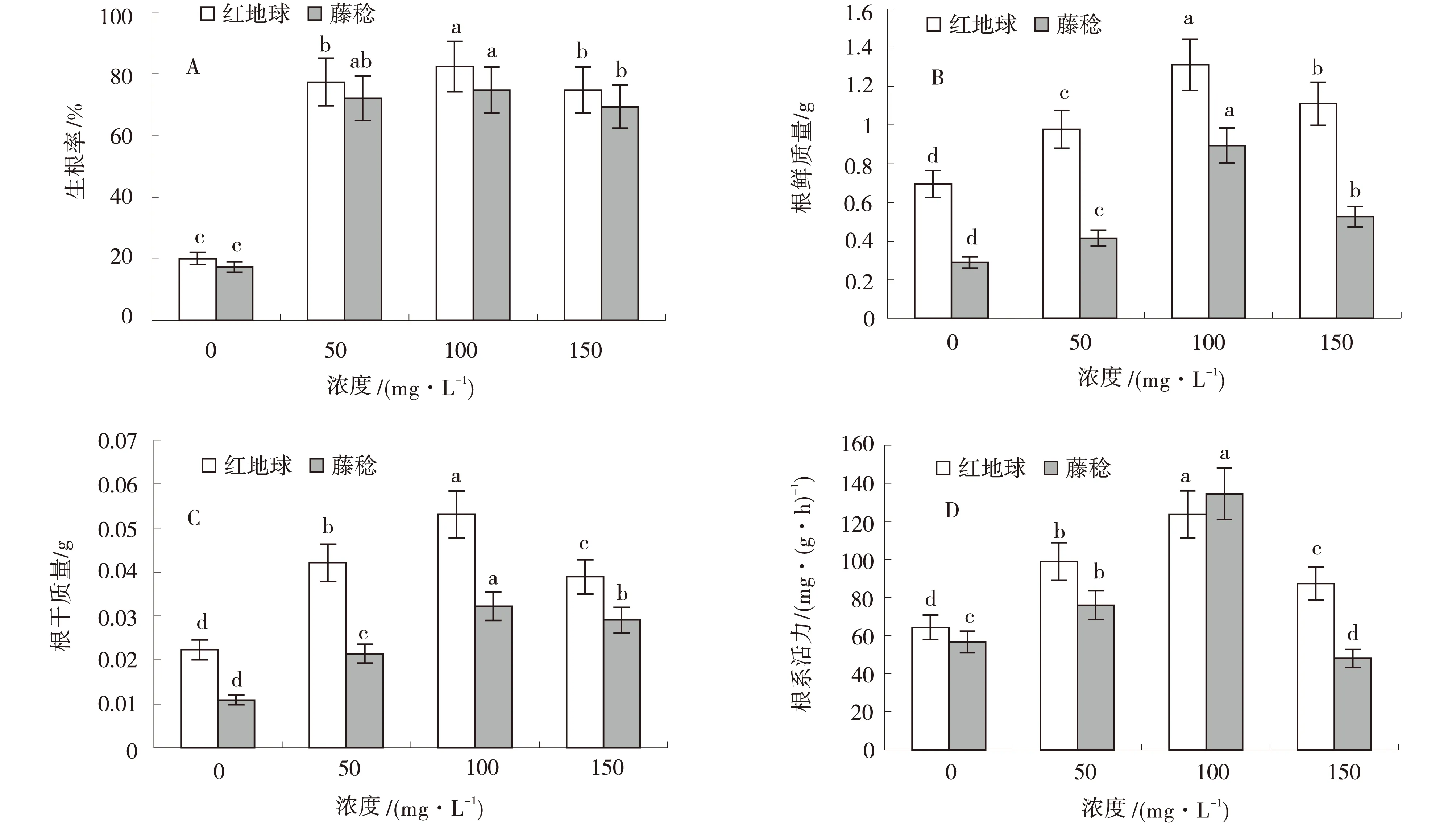
图5 不同浓度IAA对两种葡萄扦插生根的影响
2.4 不同生长调节剂对两种葡萄萌发率的影响
由表1可知,供试‘红地球’葡萄枝条经IBA不同浓度处理后,除150 mg/L IBA处理后萌发率显著低于对照,降低了13.30%外,其他处理之间无显著差异;NAA处理后,与CK相比,‘红地球’扦插苗萌发率显著降低,50,100,150 mg/L分别降低了16.00%、12.60%、17.30%;IAA处理后,与CK相比,100、150 mg/L处理的萌发率显著降低,低浓度50 mg/L与对照之间无显著差异.3种生长调节剂处理后,50、100 mg/L IBA处理对‘红地球’萌发效果最好.‘藤稔’葡萄枝条经IBA不同浓度处理后,各浓度萌发率均显著高于对照,分别增加了17.30%、10.70%、5.30%,但各浓度之间差异不显著;而NAA处理后,除50 mg/L浓度处理使萌发率显著升高2.70%外,其他两浓度处理萌发率分别降低5.30%、9.30%,且高浓度处理间差异不显著;IAA处理后,3种浓度处理萌发率分别升高6.00%、2.30%、5.30%,与对照差异显著,但各浓度间差异不显著.综合比较,50 mg/L IBA处理对两种葡萄枝条扦插苗萌发率提高效果最好,且对‘藤稔’促进效果显著优于‘红地球’.

图6 不同浓度IAA对两种葡萄扦插生根图
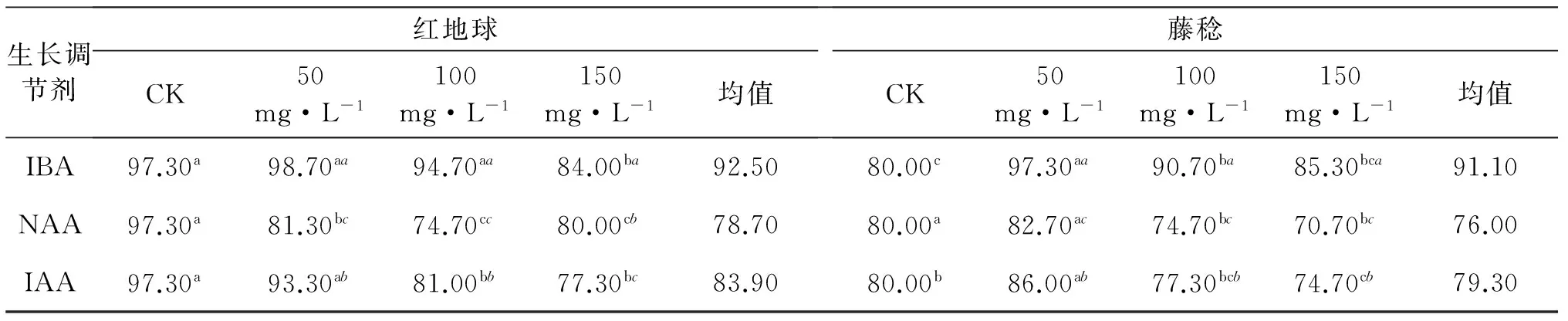
表1 不同浓度生长调节剂对两种葡萄萌发率的影响
表中数值后正体字母表示行间数据分析结果,斜体字目表示列间数据分析结果.
2.5 不同浓度生长调节剂对两种葡萄节间数的影响
由表2可知,不同生长调节剂处理,扦插枝条萌发后新梢的节间数之间存在显著差异,且存在随生长调节剂浓度增大,节数减少的趋势.IBA处理‘红地球’,节间数分别较对照高5.70,4.40,2.40节(P<0.05);NAA处理后,100 mg/L与其他两个处理差异不显著,但均显著高于对照;IAA处理后,150 mg/L与对照的节数显著低于其他两个低浓度的处理;而IBA处理效果优于NAA和IAA,平均节间数比其他两种生长调节剂分别高0.90、2.90节.IBA处理的供试‘藤稔’硬枝扦插苗中,各浓度节间数显著高于对照,节间数分别增加了2.70、1.70节、2.50节;NAA处理后,各浓度节间数显著高于对照,但各处理间差异不显著;IAA处理后,各处理节间数均显著高于对照,但处理间差异不显著;不同生长调节剂间相比,IBA对两种葡萄节间数提升效果最为显著,分别高于NAA、IAA处理的1.30节和1.70节.综合分析认为,50 mg/L IBA处理对提高两种葡萄扦插苗效果最为显著,但高浓度会抑制扦插苗节间生长.生长调节剂对‘红地球’节间数增加效果显著优于‘藤稔’.
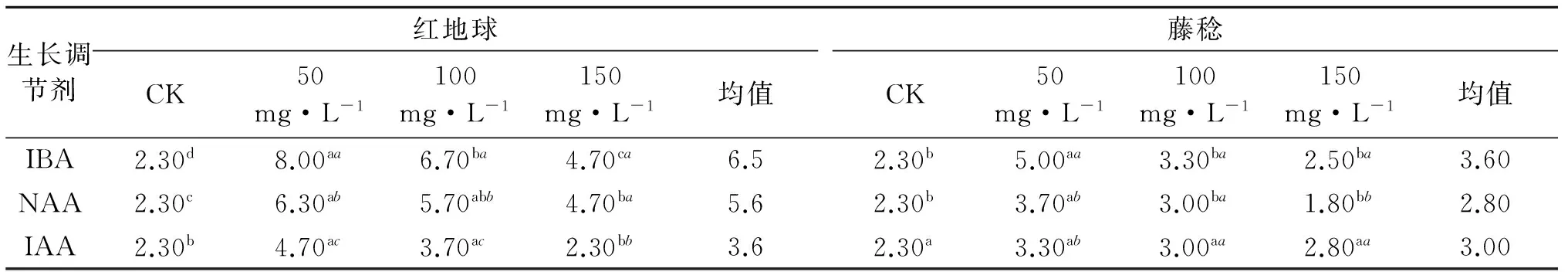
表2 不同浓度生长调节剂对两种葡萄节间数的影响
表中数值后正体字母表示行间数据分析结果,斜体字目表示列间数据分析结果.
2.6 不同浓度生长调节剂对两种葡萄枝条生长量的影响
由表3可知,3种生长调节剂处理后,‘红地球’葡萄扦插苗的生长量均随处理浓度的增大呈下降趋势,150 mg/L的生长调节剂处理后,生长量均显著低于对照.IBA处理后,‘红地球’枝条生长量变化显著,50 mg/L处理显著高于100、150 mg/L及对照,分别提高了44.44、4.65、71.09 mm;NAA处理后,50 mg/L显著高于对照及100、150 mg/L,且150 mg/L处理后,生长量较对照和其他处理浓度显著降低;IAA处理后,50 mg/L处理生长量显著高于100、150 mg/L及对照,分别提高了41.45、22.18、63.47 mm.比较种生长调节剂效果,IBA的处理效果显著优于NAA和IAA,平均枝条生长量分别增加了14.40、6.30 mm.‘藤稔’葡萄扦插苗在IBA处理后,各浓度枝条生长量均显著高于对照,较对照分别增加了43.47、21.67、12.23 mm,且50 mg/L处理显著优于其他两个浓度;NAA处理后,各浓度枝条生长量均显著高于对照,且浓度间差异不显著;IAA处理后,枝条生长量均显著高于对照,其中100 mg/L处理后生长量显著低于其他两处理,分别降低了7.28、3.40 mm.综上所述,50 mg/L IBA处理对两种葡萄硬枝扦插苗枝条生长量提升效果显著优于其他处理,且3种生长调节剂对‘红地球’的处理效果均优于‘藤稔’.且扦插苗生长量随处理浓度的升高而减少.
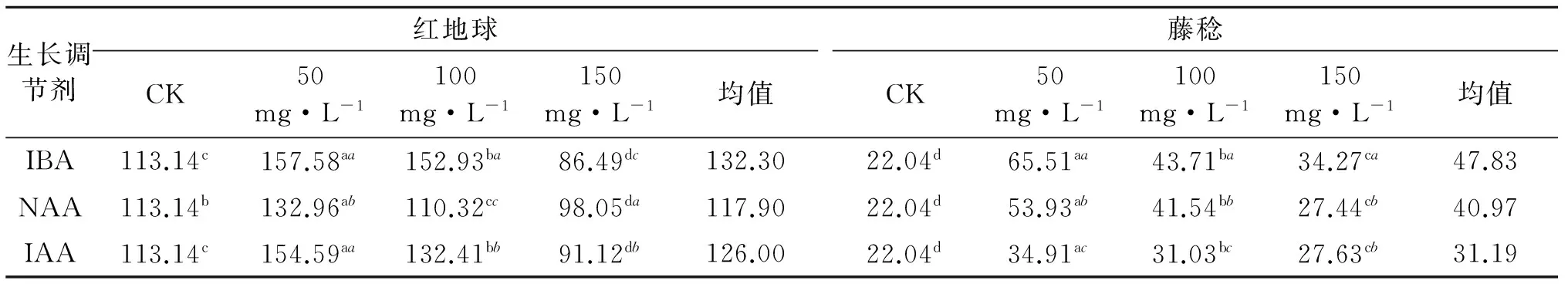
表3 不同浓度生长调节剂对两种葡萄枝条生长量的影响
表中数值后正体字母表示行间数据方差分析结果,斜体字目表示列间数据方差分析结果.
3 讨论
3.1 不同生长调节剂对葡萄生根的影响
葡萄根系难以产生不定芽,因此葡萄不能用根插,由于葡萄枝蔓的节或节间皮层下面的中轴鞘与髓射线交接部分的细胞能分裂形成不定根,故大多数葡萄品种能通过枝蔓扦插繁殖苗木[8].扦插繁殖作为一种最常用的无性繁殖方法,具有遗传性状稳定、开花结实早、育苗周期短、繁殖系数高、技术设备简单、规模大、成本低等优点[9].本试验表明IBA、NAA、IAA 3种植物生长调节剂对‘红地球’与‘藤稔’两种葡萄插条生根产生了不同程度的影响.在浓度为100 mg/L时,IAA、NAA和IBA 3种生长调节剂对两种葡萄硬枝扦插枝条的生根率、根鲜质量和根干质量都明显高于对照和其他浓度处理,表明100 mg/L质量浓度的生长调节剂,更能促进葡萄插条基部的薄壁细胞脱落分化,使细胞恢复生理机能,从而可以产生愈伤组织,然后产生大量的不定根,且生长调节剂IAA对‘红地球’的提升效果优于‘藤稔’,具有种间差异.生长调节剂可以促进葡萄扦插枝条生根,在一定的浓度范围内,用生长调节剂处理葡萄枝条的基部,可以使葡萄插条基部的薄壁细胞脱落分化,使细胞恢复生理机能,从而产生愈伤组织,进而产生大量的不定根[8].韩其谦等[10]报道葡萄插条不定根的根原基是发生于韧皮射线薄壁组织和形成层,随着它的增粗和伸长而长出皮层和表皮.许多学者研究认为[10-17],生长调节剂(auxin)在不定根形成中起关键的作用,乙烯(ethylene,ETH)、细胞分裂素(cytokinin,CTK)、赤霉素(gibberellin,GA)和脱落酸(abscisic acid,ABA)等在不定根形成中也起作用.生长调节剂主要是通过调节插条内代谢物质的含量来促进插条生根,生长调节剂提供了细胞分化和分裂过程中所需的营养物质,激活了插条细胞内生化物质的代谢,从而促进插条不定根原基的形成,进而发育为不定根[18].IBA、NAA、IAA 3种植物生长调节剂对‘红地球’与‘藤稔’两种葡萄插条生根产生了不同程度的影响.
本试验所采用的IBA、NAA、IAA 3种生长调节剂中,不同浓度IBA处理的两种葡萄插条生根率、根鲜质量和根干质量效果均优于NAA和IAA处理;NAA次之,IAA较低.其中100 mg/L IBA处理效果最好,对提升扦插苗生根率效果最为明显.已有研究表明[19],IBA是比NAA和IAA生根作用更强的一类生长调节剂.IBA在植物体内与葡萄脂酶结合较慢,室温下比较稳定,释放出游离IBA也较慢[20],而IAA易受氧化酶氧化,而IBA不受此酶氧化,因此是一类非常有前景的生根剂[21-22].NAA对植物生根能产生促进作用[24-25],而IAA则具促进不定根形成的作用[26-28],低浓度IAA有利于启动不定根原基细胞分裂,导致根原基膨大,但高浓度IAA处理反而会抑制不定根形成,原因与IBA和IAA相似.
3.2 不同生长调节剂对葡萄生长的影响
生长调节剂对细胞分裂、伸长的促进作用与生长调节剂浓度、植物种类、品种有关,一般在低浓度时可促进生长,高浓度则抑制生长[29].本研究表明,IBA最适质量浓度为50 mg/L,能显著提高植株萌发率、节间数及生长量,浓度过高或者过低都会抑制葡萄扦插苗不定根的形成.有资料表明,生长调节剂对插条生根的作用在超过一定浓度后会随药剂浓度增加而降低[30].生长调节剂能促进有机质的交换和积累,加强淀粉和脂肪的分解,提高过氧化氢酶的活性和新陈代谢,加强可溶性物质流向插穗下部,提高再生能力等.所以,利用生长调节剂可以促进插穗下部形成不定根.常用的效果较好的生长调节剂有2,4-D、吲哚丁酸(IBA),吲哚乙酸(IAA)和萘乙酸(NAA)等[31].
综合各项生理指标,IBA对两种葡萄扦插枝条的生根率、根鲜质量、根干质量和根系活力促进效果最好,优于其他两种生长调节剂,并且100 mg/L的生根率、根鲜质量、根干质量、根系活力最高.而50 mg/L IBA处理对供试植株萌发率、节间数及生长量提升效果最为显著.因此IBA对两种葡萄硬枝扦插生根效果最好,最适浓度为100 mg/L.不同浓度生长调节剂处理的‘红地球’插条的各项指标均高于‘藤稔’插条,由此可见生长调节剂对‘红地球’的扦插苗生根及生长效应较好.
[1] 孔庆山.中国葡萄[M].北京:中国农业科学技术出版社,2004
[2] 曹孜义,杨德龙,梁庆丰,等.39号葡萄株系的离体快繁技术研究[J].果树学报,2002,19(26):427-429
[3] 王关林,吴海东,苏冬霞,等.NAA、lBA对樱桃砧木(PrunuspseudocerasusColt)插条的生理.生化代谢和生根的影响[J].园艺学报,2005,32(4):691-694
[4] Robitaille H A,YU K S.Rapid multiplication of peach clones from sprouted nodal cuttinfs[J].Hortaciences,1980,15(5):579-580
[5] 王晓明.灰毡毛忍冬新品种ISSR分子标记及组织培养的研究[D].长沙:中南林业科技大学,2012
[6] Goldfarb B,Keevers C,Hausman J F.Biology of root formation and Development[M].New York:Altmao and Waisel Plenum Press,1997:163-167
[7] 董雅致,徐克章,崔喜艳,等.不同年代大豆品种根系活力的变化及其与植株生物量的关系[J].植物生理学报[J],2015(3):345-353
[8] 王金祥,严小龙,潘瑞炽.不定根形成与植物激素的关系[J].植物生理学通讯,2005,4l(2):133-142
[9] 廖伟彪,张美玲,杨永花,等.植物生长调剂浓度和处理时间对月季扦插生根的影响[J].甘肃农业大学学报,2015,47(3):47-51
[10] 韩其谦,李万军,武伏珍,等.葡萄插条生根解剖学初步观察[J].河北农业大学学报,1983,6(3):45-47
[11] 王军辉,张建国,张守攻,等.青海云杉硬枝扦插的激素、年龄和位置效应研究[J].西北农林科技大学学报:自然科学版,2006,34(7):65-71
[12] 邓建平,杨国顺.生长调节剂对葡萄扦插生根效应的研究[J].湖南农业科学,2001(1):26-27
[13] Bollmark M,Eliasson L.Effects of exogenous cytokininson on root formation in pea cuttings[J].Physiol Plant,1986,68:662~666
[14] Bollmark M,Kubat B,Eliasson E.Variation in endogeneous cytokinin content during adventitious root formation in pea cuttings[J].J Plant Physiol,1988,132:262-265
[15] 江月玲,潘瑞炽.吲哚丁酸和PP333对绿豆下胚轴插条生根的影响[J].植物学报,1995,12(增):57-58
[16] Blakesley D,Weston G D,Elliott M C.Endogeneous levels of indole-3-acetic acid and abscisic acid during the rooting ofCornuscoggygriacuttings taken at different times of the year[J].Plant Growth Regul,1991,10:1-12
[17] Pan R C,Zhao Z J.Synergistic effects of plant growth retardant and IBA on the formation of adventitious roots inhypocotyls cuttings of mung bean[J].Plant Growth Regul,1994,14:15-19
[18] 潘瑞炽.植物生长调节剂与插条生根[J].植物学通报,1995(植物生长调节剂专集):4-14
[19] 何建辉,田兴山,潘瑞炽.S-3307对绿豆下胚轴插条生根的促进作用[J].华南师范大学学报:自然科学版,1997,(3)
[20] 潘瑞炽,董愚得.植物生理学[M].3版.北京:高等教育出版社,1995
[21] 刘会宁,史伟.不同药剂处理对早紫葡萄的扦插效应[J].长江大学学报:自然科学版,2005,2(8):23-25
[22] 张存智,陈雄,姚志忠,等.葡萄砧木在贺兰东麓扦插生根与成苗特性初探[J].北方园艺,2010(2):49-51
[23] 任秋萍.我国果树栽培技术发展特点[J].农业新技术,2006(1):59-60
[24] Javis B C.Endogenous control of adventitious rooting in no woody cutting[M]//Jackon M B.New root formation in plants and cuttings.Doreht:Martinus Nijh of Publisher,1986:191-222
[25] Sun W Q,Bassuk N.Auxin-induced ethylene synthesis during rooting and inhibition of budbreak of ‘Roy alty’ rose cuttings[J].Journal of American Society,for Horticulture,1993,(8):131-141
[26] Ahmad A,Andersen A S,Engvild K.Rooting,growth and ethylene evolution of pea cuttings in response to chloroindole auxins[J].Physiol Plant,1987,69:137-140
[27] Pan R,Tian X.Comparative effect of IBA,Bsaa and 5,6-Cl2-IAA-Me on the rooting of hypocotylin mung bean[J].Plant Growth Regul,1999,27:91-98
[28] Sudarsono,Goldy R G.Growth regulator and axillary bud position effects oninvitroestablishment ofVitisrotundifolza[J].Hort Sci,1991,26 (3):304-307
[29] Omkins B.Effect of prw-packaging on as paragus quality after simulated transportation and marketing[J].Sci,1988,36:25-35
[30] Liao W B,Huang G B,Yu J H,et al.Nitric oxide and hydrogen peroxide are involved in indole-3-butyric acid-induced adventitious roots development in marigold[J].J Hortic Sci Biotech,2011,86(2):159-165
[31] Liao W B,Xiao H L,Zhang M L.Effect of nitric oxide and hydrogen peroxide on adventitious root development from cuttings of ground-cover chrysanthe mum and associated biochemical changes[J].J Plant Growth Regul,2010,29(3):338-348
[32] Bouza L,Sotta J B,Miginiac E.Relation between auxin and cytokinin contents andinvitrorooting of tree peony (FaeomiasuffruticosaAndr.)[J].Plant Gro -wth Regul,1994(15):69-73
[33] Hannerz M,Almqvist C,Ekberg I.Rooting success of cutting from yong Picea abies in transition to flowering competent phase[J].Scand J For Res,1999,14:498-504
(责任编辑 胡文忠)
Effect of three growth regulators on rooting and growth of hard branch cuttage of two cultivars of grapes
SHI Xiao-yun1,ZHANG Jun-bao2,WANG Yan-xiu1,DANG Zhao-xia1, WANG Shu-hua1,CHEN Bai-hong1
(1.College of Horticulture,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Jingchuan County Forestry Bureau,Jingchuan 744300,China)
【Objective】 In order to screen types and concentrations of growth regulator for hard branch cutting rooting of grape.【Method】 Annual branches of two cultivars grapes,‘Red Earth Globe’ and ‘Fujiminori’ were used as test materials,the effects of types and concentrations (50,100,150 mg/L) of three growth regulators,naphthalene acetic acid (NAA),indole acetic acid (IAA) and indole butyric acid (IBA),were studied on rooting and growth.【Result】 IBA,NAA and IAA had significant effects on the rooting and growth of annual branches,the treatments increased rooting rate,root activity,root fresh weight,root dry weight,winter bud germination rate,new shoot length and number of internodes.There was a concentration effect among the treatments.The treatments had the maximum rooting rate,the highest root number per plant,longer root length,and higher root activity when the concentration of three chemicals at 100 mg/L.The treatments had the maximum winter bud germination rate,and number and length of internode when the concentration of three chemicals at 50 mg/L.IBA showed the optimum effect on rooting and growth.【Conclusion】 The types and concentrations of three kinds of auxin had different effect on rooting and growth of two cultivar grapes,‘Red Earth Globe’ showed better than ‘Fujiminori’.
grape;growth regulators;cutting;rooting;growth
石晓昀(1992-),男,硕士,研究方向为果树栽培生理及技术.E-mail:525173816@ qq.com
王延秀,女,博士,副教授,从事果树栽培生理生化的科研和教学工作.E-mail:wangxy@gsau.edu.cn
甘肃省农牧厅生物技术专项(035-034070);甘肃省教育厅基本科研业务项目(035-041051).
2015-08-23;
2015-09-24
S 663.1
A
1003-4315(2016)05-0062-06
