微流控技术应用于细胞分析的研究进展
2016-11-19庄琪琛宁芮之麻远林金明��
庄琪琛 宁芮之 麻远 林金明 ��

摘 要 微流控技术由于其固有的优势已发展成为细胞分析中一个强有力的工具。本文从微流控芯片上的细胞培养、细胞微环境的模拟和控制、单细胞分析、芯片器官以及微流控芯片与质谱联用技术等方面对微流控技术在细胞分析研究中的应用进展进行了介绍,并对这一技术的发展前景进行了总结和展望,希望能为相关研究的开展提供启发。
关键词 微流控芯片;细胞培养;微环境;单细胞;芯片器官;微流控芯片质谱联用技术;细胞分析; 综述
1 引 言
微流控是一门研究如何在微米和亚微米尺度下控制微小流体和颗粒的科学,同时也是为实现上述目标而诞生的多种技术的总称。微流控最早起源于20世纪90年代,当时人们认识到微电子加工技术可以应用于加工制作微型色谱和毛细管电泳装置,并且具有颠覆传统实验室分析方法的应用前景[1]。与传统实验室分析方法相比,微流控技术具有样品消耗量小、分析速度快、自动化程度高、微型化、易于集成等优势[2]。尤其是其强大的集成能力,使得包括反应、前处理、检测等实验流程都能够集成到一个微流控系统中完成。
在微流控技术的众多应用中,人们更加关注其在生命科学领域尤其是细胞分析领域所能发挥的作用,例如细胞细胞共培养和相互作用、体外细胞微环境的构建和模拟、单细胞操控和分析以及芯片器官等。除上述优势满足了生命科学对细胞等生物样品进行更高效、更灵敏、更快速分离分析的需求外,微流控系统特征长度的尺度与细胞和其他微生物实体的大小相称,更有利于对少量细胞甚至是单个细胞的操控和分析。而且,大多数生物体系中都会涉及到微米甚至纳米尺度下的物质或信号传递,特别是在细胞细胞间相互作用及通讯中,这使得能够应用微流控技术在体外有效模拟细胞微环境尤其是模拟可溶性因子所构成的微环境[3]。系统比表面积与其特征长度成反比意味着在微流控系统中,传热和传质等过程被大大加强,一些在宏观维度下通常不会遇到的物理化学界面现象也能够利用微流控平台进行研究。而且,在微小尺度下物质的分离也能够更快速更有效的进行。
本文将从微流控芯片上的细胞培养、细胞微环境的模拟和控制、单细胞分析、芯片器官以及微流控芯片质谱联用技术等方面对微流控技术在细胞分析研究中的应用进展进行介绍。
2 微流控芯片上的细胞培养
对细胞进行培养是在体外开展细胞研究的基础。目前,微流控芯片上的细胞培养方式有二维(2D)和三维(3D)两种培养方式。
微流控芯片上2D培养与将细胞培养于培养皿或培养瓶中相似,一般都是细胞贴壁于刚性的2D基底(例如玻璃的表面)上,从细胞上方流过培养基等液体来为细胞提供营养物质、冲走代谢废物或者提供药物刺激等[4,5]。而在将细胞2D培养前,一般会对芯片通道进行表面处理,改善其亲水性以利于细胞贴壁生长,常用的修饰试剂有多聚赖氨酸(PolyLlysine,PLL)[6]、胶原蛋白[7]等。PLL为多聚阳离子化合物,而细胞表面带负电荷,使用PLL修饰微通道表面后通过正负电荷的吸引作用促进细胞的贴壁和生长。Gao等[8]利用0.1% PLL溶液对细胞培养室的玻璃表面进行修饰后进行细胞的接种、培养和药物刺激(图1),A549细胞在该细胞培养室中能保持至少5天的活性。在该工作中,Gao等利用聚乙烯管将细胞培养室与填充有固相萃取材料的功能单元连接起来,并与电喷雾四极杆飞行时间质谱(ESIQTOFMS)直接联用实现了对A549细胞对维生素E代谢的研究。Liu等[9]构建了一种微透析纸喷雾离子化质谱的一体化平台用于细胞培养的在线化学监控。在该工作中,频率和大小可控的液滴在微透析后产生并通过质谱进行检测和分析。但是,这种直接在细胞培养上方流过培养基的培养方式所产生的流体剪切力会对细胞的正常生长产生影响[10~12]。Lecault等[13]开发了一种等渗灌注微流控细胞培养阵列实现了低剪切力条件下的细胞连续培养。
(A)芯片上2D细胞培养和固相微萃取单元的示意图。(B)2D细胞培养单元的尺寸,接种细胞前使用0.1% PLL修饰玻璃基底。(C)固相微萃取单元的尺寸。(D)微流控芯片装置的实物图。
(A) Schematics of one unit for cell culture and sample pretreatment prior to ESIQTOFMS detection. (B) Dimensions of cell culture channel, precoated by 0.1% PolyLlysine (PLL) before cells seeded on the glass substrate. (C) Dimensions of microSPE column. (D) An image of microfluidic device.
芯片上2D培养的优势在于操作简单并易于实现,但2D培养的细胞环境与体内细胞所处的3D环境相差较大,因而细胞对药物刺激等的反应有可能不能反映体内的真实情况。针对2D培养的上述缺陷,微流控芯片上细胞的3D培养得到了越来越多的关注。微芯片中细胞的3D培养最常用的策略是将细胞培养在自然或合成的各种模拟细胞外基质(Extra cellular matrix,ECM)的材料中,例如基质胶(Matrigel)[14]、胶原蛋白(Collagen)[15]和水凝胶(Hydrogel)[16~18]等。Wu等[19]利用琼脂糖凝胶成功开发出一个基于模拟血管和组织间扩散过程的三维培养微流控芯片用于量子点的细胞毒性分析(图2A)。Wu等在此3D微流控平台上模拟了血管与组织间的扩散作用,证明了细胞自吞噬是导致量子点细胞毒性的原因之一,为在更精确的微环境下研究量子点细胞毒性开拓了新的思路。除此之外,水凝胶以外的材料用于细胞3D培养的方法也有报道[20~22]。Toh等[23]通过在微流控芯片上集成微柱结构实现了芯片上的3D细胞培养,并成功保持了肝细胞正常的解毒功能(图2B)。
图2 微流控芯片上的3D细胞培养。(A)3D培养微流控芯片模拟血管和组织间扩散过程来分析量子点的细胞毒性[19]。(B)用于药物毒性测试的3D微流控肝细胞芯片[23]
Fig.2 3D cell culture on microfluidic chips. (A) Cytotoxicity of quantum dots assay on a microfluidic 3Dculture device based on modeling diffusion process between blood vessels and tissues[19]. (B) A microfluidic 3D hepatocyte chip for drug toxicity testing[23]
细胞细胞间相互作用的研究在组织工程、肿瘤生长和转移以及揭示癌症等疾病的机理等方面都有着重要作用。在体内,细胞细胞间的相互作用通过细胞细胞间的直接接触或者可溶性因子的交换而频繁发生。微流控技术为研究细胞细胞共培养提供了更为灵活可靠的方式,能够在体外模拟细胞细胞间通过可溶性信号或者直接接触的相互作用。目前常采用胶原蛋白轨道[24,25]、半透膜[26]、聚二甲基硅氧烷(PDMS)多孔薄膜[27,28]、聚碳酸酯(PC)多孔薄膜[29]以及表面张力栓等[30,31]将微流控芯片在空间上分为几个区域来分别培养不同类型的细胞以开展芯片上细胞细胞间相互作用的研究。Wong等[25]将包含细胞的基质胶流过一个多入口的微通道,借助层流作用利用一个或多个水凝胶微板将微通道分隔为几个子通道从而构造了一个可调的3D共培养系统。Wei等[32]使用具有高度差的微通道实现了PC12细胞和GH3细胞的共培养,并与质谱联用对神经元调节垂体细胞分泌生长激素的行为进行了定性和定量的研究。Chen等[28]将小鼠胚胎干(mES)细胞和饲养层细胞技术性地分别培养于PDMS多孔膜的两侧,并保持了饲养层细胞较好的增殖状态和细胞活性,同时维持了mES细胞的自我更新和未分化潜能。该工作与常规干细胞培养方法相比,不需要对饲养层细胞进行灭活以及无需进一步地纯化就能够直接获取高纯度的胚胎干细胞。Zhuang等[29]通过集成聚碳酸酯多孔膜的双层通道微芯片装置模拟了神经细胞肾细胞的相互作用(图3A)。Mao等[30]则首次在微流控芯片上集成了“表面张力栓”控制和模拟了肝脏在肾上腺素的作用下将肝糖原分解为葡萄糖并释放到血液中的过程。将该集成表面张力栓的微芯片与ESIQTOFMS联用成功检测到了信号分子肾上腺素和细胞通讯的最终代谢物葡萄糖(图3B)。
图3 用于细胞细胞间相互作用研究的微流控芯片平台。(A)集成聚碳酸酯多孔膜的微流控芯片研究神经细胞肾细胞相互作用[29]。(B)集成表面张力栓的微流控芯片研究肾细胞肝细胞的相互作用[30]
Fig.3 Microfluidic platform for cellcell interaction study. (A)Nephrocyteneurocyte interaction on polycarbonatemembrane integrated microfluidic device[29]. (B)Nephrocytehepatocyte interaction on surface tension plug integrated microfluidic device[30]
3 微流控芯片上细胞微环境的模拟和控制
在体内,细胞的微环境由复杂的化学和机械力因素组成,包括特定的物理化学性质(氧含量、温度、pH和渗透压等)、可溶性因子、细胞间接触和细胞基质间相互作用等[33]。在体内,细胞所处的微环境是动态变化的。微流控芯片上细胞培养的一大优势就在于能够在微尺度上控制细胞所处的微环境。
在药物筛选的研究中,微流控技术能够通过结构设计产生浓度梯度来满足进行系列浓度的平行实验的需求。微芯片上产生浓度梯度最经典的设计是“圣诞树形”结构,该设计利用两种液体的层流作用进行混合进而产生浓度梯度[34,35]。Gao等[36]通过集成“圣诞树形”浓度梯度发生装置的微流控芯片平台实现了高通量的细胞毒性测试、药物吸收和代谢物的同时表征。近年来,陆续开发了一些产生浓度梯度的方法。Chen等[37]开发出一种用于细胞培养和药物筛选中浓度梯度生成的微流网络混合通道。该微流网络混合通道的混合过程是上下混合流所产生的,这比直通道对于药物的混合效果要更好。针对质谱只能半定量的缺点,Chen等在该工作中使用了同位素内标法,不仅扩大了芯片上质谱检测的线性范围而且提高了线性指数,真正实现了芯片质谱(ChipMS)联用对细胞代谢物的定性和定量检测。Scherber等[38]则在芯片上观察了内皮细胞根据内皮生长因子(EGF)的梯度在微流控芯片迷宫中“感知”路径。
缺氧环境能够促进肿瘤的生长、侵袭和转移,因此,模拟和研究体内缺氧微环境对肿瘤发展的影响是肿瘤研究的一大热点[39]。Wang等[40]在微流控芯片上设计产生了O2分子的浓度梯度,并研究了动态缺氧环境下细胞对药物刺激的反应。而Lin等[41]则利用一个集成化的双层微流控芯片模拟了肿瘤细胞体内氧浓度梯度的微环境,并通过在芯片通道的两层固定核酸适配体,实现了血管内皮生长因子165(VEGF165)的在线检测(图4)。此外,他们在该工作中还研究了不同距离对内皮细胞肿瘤细胞间相互作用的影响,以及不同的氧浓度梯度微环境对细胞迁移的影响,深入探索了肿瘤血管新生的信号通路以及细胞迁移行为,为宫颈癌的发生发展研究提供了重要实验数据支持。
图4 在氧梯度下进行细胞共培养的集成化微芯片装置[41]。(A)氧气能够影响细胞细胞间通讯并促进细胞迁移。(B)该集成化微芯片装置的示意图。(C)芯片上集成的微阀。(D)在低氧条件下共培养细胞的双层微通道截面图。(E)利用核酸适配体检测VEGF165的示意图。(F)微芯片的实物图
Fig.4 Integrated microfluidic device for cell coculture under oxygen gradient system[41]. (A) Oxygen effects cellcell communication and promotes cell migration. (B) Schematic diagrams of integrated microfluidic device. (C) Micro valve integrated on the microchip. (D) Twolayer microfluidic channel for cells coculture under low oxygen conditions. (E) Schematic illustration for determination VEGF165 based on nucleic acid aptamer. (F) Actual microfluidic device
细胞密度的差异会引起细胞间基质、自分泌或旁分泌的细胞因子局部浓度的不同,从而会导致不同的细胞反应。因此,细胞密度在一定程度上影响着细胞细胞间相互作用,进而影响生物体内相关组织的功能[42]。Wu等[43]设计了一种精确性好、重复性高的微流控方法用于细胞密度梯度的产生。在该工作中,通过控制通道中微坑的个数就能够调控细胞密度,细胞密度随着微坑个数的增加而增加,而且所产生的细胞密度梯度与理论计算值一致。他们利用此微芯片装置考察了不同细胞密度下量子点的细胞毒性,发现量子点在高细胞密度条件下比低细胞密度条件下表现出较低的细胞毒性。
此外,微流控技术对细胞微环境的控制已被用来阐明一些关键蛋白在诸如成纤维细胞的趋化性[44]和趋电性[45]等细胞行为中的作用。微流控芯片还被用来阐释一些蛋白的功能,如在炎症反应里中性粒细胞粘附过程中选择素的作用[46]。微流控芯片平台也被报道通过调节细胞微环境来研究旁分泌和自分泌信号。例如,使用微流控流体减少小鼠胚胎干(mES)细胞分泌因子的浓度为深入研究信号分子的动态变化和干细胞分化提供了有价值的手段[47,48]。
4 微流控芯片上的单细胞分析
目前的研究表明,单个细胞之间存在着显著的差异性。开发单细胞的操纵、筛选以及分析方法,研究细胞的异质性,对于疾病诊断、药物筛选等方面都具有十分重要的意义。微流控技术具有能够精确操控小体积样品的优势,因此在操纵单个细胞融合、转染、染色、分选、测序等研究中有着广泛的应用前景[49]。
细胞分选和捕获技术已被应用来研究完整的单细胞或分析裂解的单细胞中的内容物。微流控技术起源于集成电路芯片的制作,由此通过设计各种微结构实现了细胞分选和捕获 [52,53]。Chen等[50]则开发了一种新型的基于核酸适配体的微坑阵列来实现单细胞的特异性捕获(图5A)。该工作中具有三维形貌的微坑结构加强了细胞与微坑表面的核酸适配体之间的相互作用,使得单细胞占有率高达88.2%。利用这种对单细胞具有特异性的捕获技术实现了从复杂细胞样品中获得靶向单细胞阵列,并进一步进行了单细胞水平上的酶反应动力学分析,揭示了单细胞水平上细胞代谢的差异性。Chen等所使用的微坑阵列是由湿法刻蚀法获得的,而Liu等[51]则在玻璃基底表面利用聚苯乙烯微球的自组装制作出了PDMS微坑阵列(图5B)。这种制作微坑的方法与湿法刻蚀法相比,操作更加简捷,而且所使用的试剂对环境的危害也更小,更符合绿色化学的原则。Mach等[54]开发了一种芯片离心机(Centrifugeonachip),利用流体的涡流进行细胞分选,并与后续的样品浓缩、染色和清洗等处理操作集成在一起。而Wang等[55]将微流控技术与化学发光技术相结合,建立了一种将单细胞分散在油相包围的水相液滴中并进行培养和分析的高通量方法。利用该方法可以实现从104个细胞中筛选出唯一一个过量消耗木糖的酿酒酵母细胞,并分析确定导致木糖高消耗的基因组变化。
图5 微流控芯片上的单细胞分析:(A)微流控芯片上核酸适配体修饰的微坑阵列用于单细胞特异性捕获及酶动力学分析[50];(B)利用聚苯乙烯微球自组装制作微坑阵列进行高通量的单细胞分析[51]
Fig.5 Single cell analysis on microfluidic chips: (A) Target isolation and analysis of single tumor cells with aptamerencoded microwell array on microfluidic device[50];(B) Fabrication of microwell arrays based on twodimensional ordered polystyrene microspheres for highthroughput single cell analysis[51]
随着微流控技术的不断发展,单细胞分析也将得到更好的发展和应用,也将更清晰的揭示被细胞群体性研究所掩盖的细胞异质性。
5 芯片器官
近年来,细胞生物学、精密加工和微流控技术的发展使得模拟和开发芯片器官的研究得到迅速的发展,芯片器官能够为临床化验提供更强大的预测能力。Huh等[56]实现了在芯片上模拟器官水平的肺功能(图6A)。该仿生微系统的核心部分是一个PDMS多孔薄膜,人肺泡上皮细胞和人肺微血管内皮细胞被分别培养在PDMS多孔薄膜的两侧成功构建了功能化的人肺肺泡毛细血管界面。由于PDMS多孔薄膜具有弹性,将该微芯片装置与编程控制的真空联用能够成功模拟肺的呼吸运动,并研究了该条件下两种细胞对纳米颗粒的吸入量。近年来,在微流控芯片上模拟血管生成和心血管系统得到了极大地关注。Yeon等[57]通过在纤维蛋白凝胶的任意一侧培养人脐带静脉内皮细胞(HUVECs)实现了芯片上诱导毛细血管的生成。而Miller等[58]则报道在内皮细胞培养中加入可降解的玻璃纤维能够更好地模拟血管网络。Song等[59]研究了间隙渗流、血管内皮生长因子梯度和剪切力对内皮细胞在胶原蛋白基质中出芽生长的影响。其它一些心血管芯片器官系统则研究了心肌细胞对电的和机械力刺激的反应。例如,Ma等[60]在一个多电极阵列生物芯片平台上构造了心肌并成功监测了干细胞桥接心肌细胞过程中的导电性,该因素是成功移植干细胞治疗局部缺血或梗塞的关键因素(图6B)。而Grosberg等[61]则将心肌细胞培养在弹性膜上,成功监测了心肌细胞收缩过程中的应力变化。
图6 芯片器官。(A)在芯片上重构器官水平的肺功能[56]。(B)在多电极阵列生物芯片平台上构造了心肌并成功监测了干细胞桥接心肌细胞过程中的导电性[60]
Fig.6 Organonachip. (A) Reconstituting organlevel lung functions on a chip[56]. (B) Constructing cardiac muscle on a multielectrode arraybased biochip and successfully measuring the electrical conductivity of stem cells bridging cardiomyocytes[60]
6 微流控芯片质谱联用技术
在众多分离检测方法中,微流控芯片、电泳化学发光、激光诱导荧光和电化学检测等作为最早被使用的技术得到了广泛的应用和发展,但主要被用于分离或者检测已知或者种类较少的目标分子[62,63]。Lin等[64]通过将聚合酶链式反应(PCR)和微芯片毛细管电泳技术(MCE)结合,实现了多元迷你短串联重复序列(miniSTR)位点的快速灵敏检测。在最优条件下,仅0.001 ng DNA模板便足够产生miniSTR,且15种miniSTR尺寸的相对标准偏差为0.49 %~4.41%,浓溶液为0.94%~4.95%。同时,由于这种miniSTR检测技术在对实际样品的检测下证实具有可靠性,在刑事鉴定和亲子鉴定方面具有巨大潜力。Yi等[65]也使用类似的技术实现了对11种人乳头瘤病毒(HPV)的高灵敏和精确的分型检测,检出限为200 copies,且对临床样品也具有检出可靠性,可用于宫颈癌的筛选和预后。
由于质谱检测能够一次性快速、高灵敏度地检测多组分化合物,检测范围覆盖了小分子、多肽、氨基酸、蛋白质等多尺寸生物产物,且根据质荷比的不同能够分析和判断未知产物,在细胞分析中具有日趋重要的地位。虽然质谱检测具有以上优势,但由于细胞产物复杂,干扰基质强,难以直接用于细胞产物分析检测。因此,将质谱与有效的分离模块联用是细胞分析中的常用手段。从20世纪50年代至今,开发出的与质谱检测器联用的分离模块依次经历了气相色谱、液相色谱、毛细管电泳以及近些年的微流控芯片。但与其它基于柱分离的分离技术不同的是,微流控芯片平台不仅能够实现有效分离,同时还具有高度集成性、在线处理且试剂消耗量更低等,在细胞研究方面具有无可比量的优势[66]。
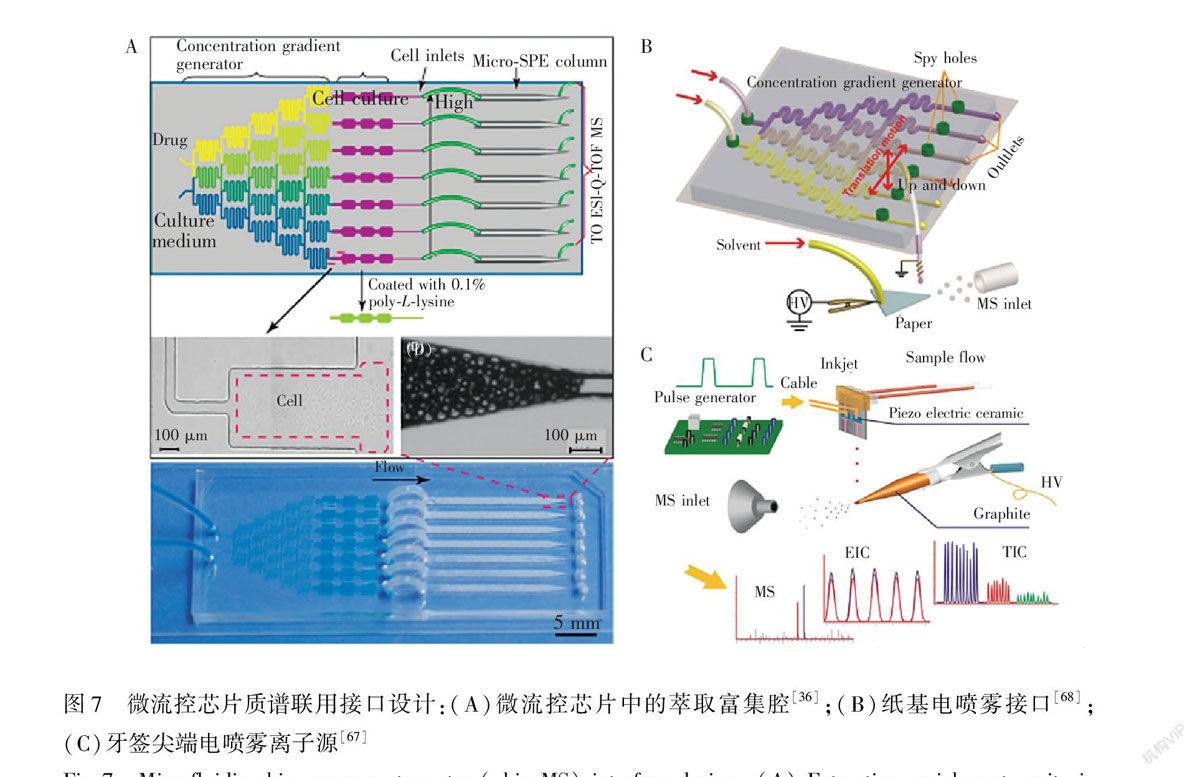
在微流控芯片质谱联用中,目前主要使用的是电喷雾质谱(ESIMS)。微流控芯片平台上的样品前处理和与质谱连接的接口设计是实现细胞分析的关键。微流控芯片上的样品前处理通常是通过在芯片中集成整体柱或者萃取材料[8,36,37],对含有血清等复杂成分的溶液进行脱盐富集处理,提高目标检测物的质谱信号强度。Gao等[36]在微流控平台上结合了固相萃取微柱,在质谱检测前对流体进行了洗净和浓缩处理,选用甲氨蝶呤(叶酸代谢酶体系的一种抑制剂)为药物模型,HepG2和Caco2为目标细胞,证实了其微流控芯片平台对药物吸收的有效性,有望用于对活细胞的实时药物动力学研究(图7A)。此外,为了简化芯片上样品前处理单元的复杂设计和操作,本研究组还提出了液滴纸喷雾离子源接口和inkjet牙签喷雾针离子源技术[67]。通过液滴纸喷雾,实现在纸纤维上对复杂成分溶液的同步分离和纯化过程,将不易离子化的物质保留在纸纤维上。Liu等[68]建立了一种多通道可移动微流控芯片检测平台,使用纸基电喷雾质谱,对非共价键结合的蛋白蛋白复合物的缔合常数进行了测定(图7B)。结果证明了该平台对蛋白分析的有效性。同样,Inkjet牙签喷雾针离子源技术对样品的直接分析也是利用了牙签的木质纤维对复杂基质的分离纯化作用,且inkjet芯片能可控产生皮升级微液滴,精确定位滴于牙签尖端处形成喷雾用于质谱分析。Luo等[67]建立了这种装置(图7C),并用可可碱作为内标,对咖啡因进行了定量检测。结果证明在1~200 mg/L范围内都具有良好的线性,且由于电喷雾持续时间短,峰强比近似为峰面积比,可用于定量研究。
图7 微流控芯片质谱联用接口设计:(A)微流控芯片中的萃取富集腔[36];(B)纸基电喷雾接口[68];(C)牙签尖端电喷雾离子源[67]
Fig.7 Microfluidic chipmass spectrometry (chipMS) interface design: (A) Extraction enrichment cavity in microfluidic chips[36], (B) Paperbased electrospray interface[68] and (C) Toothpick electrospray ion source[67]
基质辅助激光解吸电离质谱(MALDIMS)由于对盐度具有较好的耐受度,常用于对生物大分子,如蛋白质、多肽等进行检测,但由于MALDI需要将激光直接照射于样品和基质的共晶层以实现样品的离子化,因此需要检测样品区域为开放式,从而导致其与微流控芯片的联用受到了限制。尽管如此,由于MALDI的点阵化检测特点,其在单细胞和点阵化分析方面具有独特的优势。Zhang等[69]将哺乳动物细胞直接培养在氧化铟锡导电玻璃表面,然后通过电喷雾的方式将基质喷涂在其表面形成一个均匀的结晶层,利用MALDI质谱对细胞膜脂质进行了原位表征,获得了丰富的膜脂信息,这种较为粗略的分子图谱可以对细胞类型的识别提供佐证。
7 总结与展望
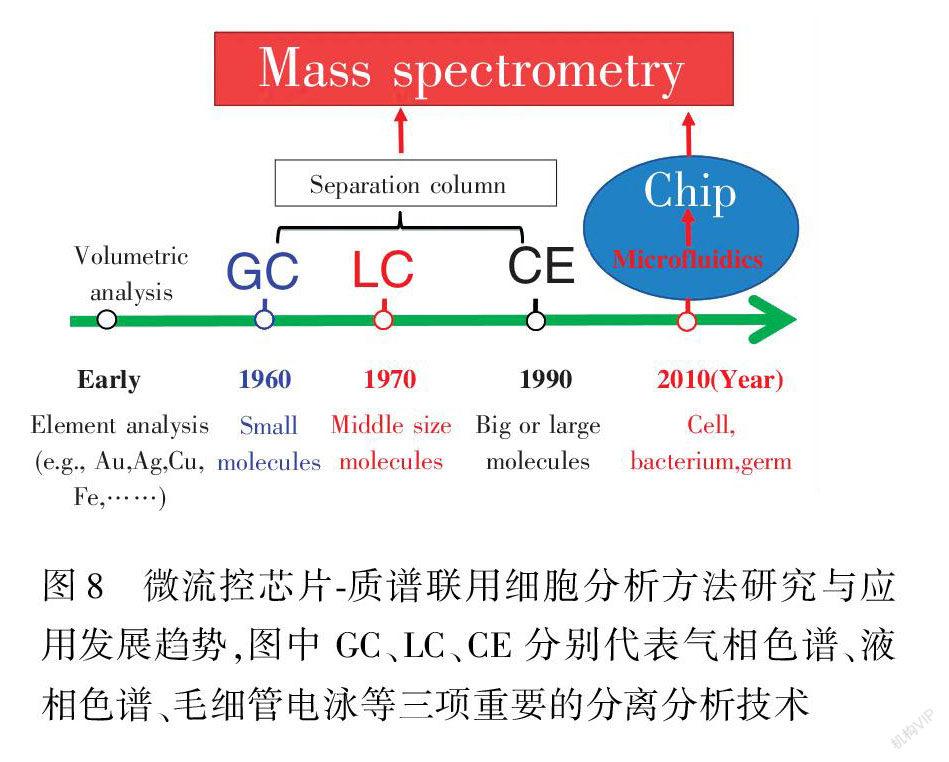
经过二十多年的发展,微流控技术在细胞生物学及细胞分析的研究中发挥出了不可替代的作用。与传统的细胞培养方法相比,微流控芯片上的细胞培养有许多优势,比如能够在时间和空间上使细胞所处的微环境与体内相似,从而使得基于细胞的分析能够获得更为真实可靠的结果。研究者们已经开发出许多种方法来提高微流控系统的能力,例如在同一芯片平台上集成不同的功能单元或者设计更为有效的结构来对流体或者细胞进行操控等。我们有理由相信,用于细胞分析的芯片设计将会更加灵活有效,更重要的是用于细胞分析的标准化微流控系统的设计和制备,尤其是微流控芯片质谱联用分析技术(ChipMS),也将逐步成熟,发展成继气相色谱质谱(GCMS)、液相色谱质谱(LCMS)、毛细管电泳质谱(CEMS)联用3个不同阶段的一项新技术,分别应用于小分子、中等大小的分子、大分子等无生命的化合物的分离分析,
图8 微流控芯片质谱联用细胞分析方法研究与应用发展趋势,图中GC、LC、CE分别代表气相色谱、液相色谱、毛细管电泳等三项重要的分离分析技术
Fig.8 Development of chipmass spectrometry following with gas chromatography (GC), liquid chromatography (LC) and capillary electrophoresis (CE)到目前能够初步应用于具有生命最小单元的细胞的微流控芯片质谱联用分析,其发展趋势将有可能如图8所示。所以,我们有理由推测并且相信,微流控芯片的出现,不单单是为了实现分析仪器的小型化,其主要是为了适应具有微小尺寸的细胞、细菌等的研究与分析[66,70,71]。虽然微流控技术在细胞分析领域仍然面临许多挑战,但由于其所具备的低试剂消耗、高通量、易于集成、设计灵活、能够模拟复杂微环境等明显优于传统细胞生物学方法的优势使得微芯片技术依然在生物医学、药物筛选和现场即时诊断等许多基于细胞的分析研究中不可替代。随着微流控芯片制作材料和微加工技术的进一步发展,我们有望在未来实现将便宜且便携的手持设备用于大规模集成化的高通量药物研发或者现场即时诊断的个性化医疗。而更重要的是,我们希望通过完善各种技术、加大技术推广和宣传,使多通道微流控芯片质谱联用技术能够在细胞的研究领域得到广泛的使用,为生命科学研究提供一种新的工具。
References
1 Yeo L, Chang H, Chan P, Friend J. Small, 2011, 7(1): 12-48
2 CHEN Li, ZHENG XiaoLin, HU Ning, YANG Jun, LUO HongYan, JIANG Fan, LIAO YanJian. Chinese J. Anal.Chem., 2015, 43(2): 300-309
陈 礼, 郑小林, 胡 宁, 杨 军, 罗洪艳, 姜 帆, 廖彦剑. 分析化学, 2015, 43(2): 300-309
3 Meyvantsson I, Beebe D. Annu. Rev. Anal. Chem. (Palo.Alto. Calif.), 2008, 1: 423-449
4 Mao S, Gao D, Liu W, Wei H, Lin J M. Lab Chip, 2012, 12(1): 219-226
5 Gao D, Liu H, Lin J M, Wang Y, Jiang Y. Lab Chip, 2013, 13(5): 978-985
6 Wei H, Li H, Gao D, Lin J M. Analyst, 2010, 135(8): 2043-2050
7 Camelliti P, Mcculloch A D, Kohl P. Microsc. Microanal., 2005, 11(3): 249-259
8 Gao D, Wei H, Guo G S, Lin J M. Anal. Chem., 2010, 82(13): 5679-5685
9 Liu W, Wang N, Lin X, Ma Y, Lin J M. Anal. Chem., 2014, 86(14): 7128-7134
10 Vedel S, Tay S, Johnston D M, Bruus H, Quake S R. Proc. Natl. Acad. Sci. U. S. A., 2013, 110(1): 129-134
11 Huh D, Hamilton G A, Ingber D E. Trends. Cell Biol., 2011, 21(12): 745-754
12 Zheng C, Zhao L, Chen G, Zhou Y, Pang Y, Huang Y. Anal. Chem., 2012, 84(4): 2088-2093
13 Lecault V, Vaninsberghe M, Sekulovic S, Knapp D J, Wohrer S, Bowden W, Viel F, Mclaughlin T, Jarandehei A, Miller M, Falconnet D, White A K, Kent D G, Copley M R, Taghipour F, Eaves C J, Humphries R K, Piret J M, Hansen C L. Nat. Methods., 2011, 8(7): 581-586
14 Lii J, Hsu W J, Parsa H, Das A, Rouse R, Sia S K. Anal. Chem., 2008, 80(10): 3640-3647
15 Chung S, Sudo R, Mack P J, Wan C R, Vickerman V, Kamm R D. Lab Chip, 2009, 9(2): 269-275
16 Tumarkin E, Tzadu L, Csaszar E, Seo M, Zhang H, Lee A, Peerani R, Purpura K, Zandstra P W, Kumacheva E. Integr. Biol. (Camb.), 2011, 3(6): 653-662
17 Tsuda Y, Morimoto Y, Takeuchi S. Langmuir, 2010, 26(4): 2645-2649
18 Liu J, Gao D, Li H, Lin J M. Lab Chip, 2009, 9(9): 1301-1305
19 Wu J, Chen Q, Liu W, Zhang Y, Lin J M. Lab Chip, 2012, 12(18): 3474-3480
20 Ong S M, Zhang C, Toh Y C, Kim S H, Foo H L, Tan C H, van Noort D, Park S, Yu H. Biomaterials, 2008, 29(22): 3237-3244
21 Toh Y C, Zhang C, Zhang J, Khong Y M, Chang S, Samper V D, van Noort D, Hutmacher D W, Yu H. Lab Chip, 2007, 7(3): 302-309
22 Choi J, Kim S, Jung J, Lim Y, Kang K, Park S, Kang S. Biomaterials, 2011, 32(29): 7013-7022
23 Toh Y C, Lim T C, Tai D, Xiao G, van Noort D, Yu H. Lab Chip, 2009, 9(14): 2026-2035
24 Ravula S K, Wang M S, Asress S A, Glass J D, Bruno F A. J. Neurosci. Methods, 2007, 159(1): 78-85
25 Wong A P, PerezCastillejos R, Christopher L J, Whitesides G M. Biomaterials, 2008, 29(12): 1853-1861
26 Kimura H, Yamamoto T, Sakai H, Sakai Y, Fujii T. Lab Chip, 2008, 8(5): 741-746
27 Yuan B, Li Y, Wang D, Xie Y, Liu Y, Cui L, Tu F, Li H, Ji H, Zhang W, Jiang X. Adv. Funct. Mater., 2010, 20(21): 3715-3720
28 Chen Q, Wu J, Zhuang Q, Lin X, Zhang J, Lin J M. Sci. Rep., 2013, 3: 2433
29 Zhuang Q, Wang S, Zhang J, He Z, Li H, Ma Y, Lin J M. Sci. China Chem., 2015, 58(8): 1-8
30 Mao S, Zhang J, Li H, Lin J M. Anal. Chem., 2013, 85(2): 868-876
31 Zhang J, Wu J, Li H, Chen Q, Lin J M. Biosens.Bioelectron., 2015, 68: 322-328
32 Wei H, Li H, Mao S, Lin J M. Anal. Chem., 2011, 83(24): 9306-9313
33 Gao D, Liu H, Jiang Y, Lin J M. TRACTrend Anal. Chem., 2012, 35: 150-164
34 Toh A G G, Wang Z P, Yang C, NamTrung N. Microfluid. Nanofluid., 2014, 16(12): 1-18
35 Jeon N L, Dertinger S, Chiu D T, Choi I S, Stroock A D, Whitesides G M. Langmuir, 2000, 16(22): 8311-8316
36 Gao D, Li H, Wang N, Lin J M. Anal. Chem., 2012, 84(21): 9230-9237
37 Chen Q, Wu J, Zhang Y, Lin J M. Anal. Chem., 2012, 84(3): 1695-1701
38 Scherber C, Aranyosi A J, Kulemann B, Thayer S P, Toner M, Iliopoulos O, Irimia D. Integr. Biol.Uk., 2012, 4(3): 259-269
39 Byrne M B, Leslie M T, Gaskins H R, Kenis P J. Trends Biotechnol., 2014, 32(11): 556-563
40 Wang L, Liu W, Wang Y, Wang J C, Tu Q, Liu R, Wang J. Lab Chip, 2013, 13(4): 695-705
41 Lin X, Chen Q, Liu W, Zhang J, Wang S, Lin Z, Lin J M. Sci. Rep., 2015, 5: 9643
42 Rosso F, Giordano A, Barbarisi M, Barbarisi A. J. Cell Physiol., 2004, 199(2): 174-180
43 Wu J, Chen Q, Liu W, Lin J M. Lab Chip, 2013, 13(10): 1948-1954
44 Wu C, Asokan S B, Berginski M E, Haynes E M, Sharpless N E, Griffith J D, Gomez S M, Bear J E. Cell, 2012, 148(5): 973-987
45 Sun Y S, Peng S W, Cheng J Y. Biomicrofluidics, 2012, 6(3): 34117
46 Tong Z, Cheung L S, Stebe K J, Konstantopoulos K. Integr. Biol. (Camb.), 2012, 4(8): 847-856
47 Przybyla L M, Voldman J. Proc. Natl. Acad. Sci. U. S. A., 2012, 109(3): 835-840
48 Moledina F, Clarke G, Oskooei A, Onishi K, Gunther A, Zandstra P W. Proc. Natl. Acad. Sci. USA, 2012, 109(9): 3264-3269
49 YU ZhiLong, HUANG YanYi. Sci. China Chem., 2015, 45(11): 1090-1101
虞之龙, 黄岩谊. 中国科学: 化学, 2015, 45(11): 1090-1101
50 Chen Q, Wu J, Zhang Y, Lin Z, Lin J M. Lab Chip, 2012, 12(24): 5180-5185
51 Liu C, Liu J, Gao D, Ding M, Lin J M. Anal. Chem., 2010, 82(22): 9418-9424
52 Wei H, Chueh B H, Wu H, Hall E W, Li C W, Schirhagl R, Lin J M, Zare R N. Lab Chip, 2011, 11(2): 238-245
53 Wu J, Li H, Chen Q, Lin X, Liu W, Lin J M. RSC. Adv., 2014, 4(47): 24929-24934
54 Mach A J, Kim J H, Arshi A, Hur S C, Di Carlo D. Lab Chip, 2011, 11(17): 2827-2834
55 Wang B L, Ghaderi A, Zhou H, Agresti J, Weitz D A, Fink G R, Stephanopoulos G. Nat. Biotechnol., 2014, 32(5): 473-478
56 Huh D, Matthews B D, Mammoto A, MontoyaZavala M, Hsin H Y, Ingber D E. Science, 2010, 328(5986): 1662-1668
57 Yeon J H, Ryu H R, Chung M, Hu Q P, Jeon N L. Lab Chip, 2012, 12(16): 2815-2822
58 Miller J S, Stevens K R, Yang M T, Baker B M, Nguyen D H, Cohen D M, Toro E, Chen A A, Galie P A, Yu X, Chaturvedi R, Bhatia S N, Chen C S. Nat. Mater., 2012, 11(9): 768-774
59 Song J W, Munn L L. Proc. Natl. Acad. Sci. USA, 2011, 108(37): 15342-15347
60 Ma Z, Liu Q, Liu H, Yang H, Yun J X, Eisenberg C, Borg T K, Xu M, Gao B Z. Lab Chip, 2012, 12(3): 566-573
61 Grosberg A, Alford P W, Mccain M L, Parker K K. Lab Chip, 2011, 11(24): 4165-4173
62 Lin X, Leung K H, Lin L, Lin L, Lin S, Leung C H, Ma D L, Lin J M. Biosens. Bioelectron., 2016, 79: 41-47
63 SU WenTao, FENG Ke, QIN JianHua. Chinese J. Anal. Chem., 2015, 43(10): 1490-1498
苏文涛, 冯 可, 秦建华. 分析化学, 2015, 43(10): 1490-1498
64 Lin X, Wu J, Li H, Wang Z, Lin J M. Talanta, 2013, 114: 131-137
65 Yi L, Xu X, Lin X, Li H, Ma Y, Lin J M. Analyst, 2014, 139: 3330-3335
66 LI HaiFang, ZHANG Ying, LIN JinMing. Scientia Simia Chimica, 2014, 44(5): 777-783
李海芳, 张 英, 林金明. 中国科学: 化学, 2014, 44(5): 777-783
67 Luo C, Ma Y, Li H, Chen F, Uchiyama K, Lin J M. J. Mass Spectrom., 2013, 48: 321-328
68 Liu W, Chen Q, Lin X, Lin J M. Analyst, 2015, 140: 1551-1554
69 Zhang Y, Li H, Ma Y, Lin J M. Sci. China Chem., 2014, 57(3): 442-446
70 He X, Chen Q, Zhang Y, Lin J M. TRACTrends Anal. Chem., 2014, 53: 84-97
71 Lin L, Lin J M. Journal of Pharmaceutical Analysis, 2015, 5(6): 337-347
Recent Development in Microfluidic Chips for
in vitro Cellbased Research
ZHUANG QiChen1, NING RuiZhi1,2, MA Yuan1, LIN JinMing*1
1(Department of Chemistry, Beijing Key Laboratory of Microanalytical Methods and Instrumentation,
The Key Laboratory of Bioorganic Phosphorus Chemistry and Chemical Biology, Tsinghua University, Beijing 100084, China)
2(Department of Biomaterial Sciences, The University of Tokyo, Tokyo 1138657, Japan)
Abstract Microfluidic technology has become a powerful tool in cellbased research due to its inherent advantages. The research progress of cell culture on chips, simulation and manipulation of cell microenvironment on chips, single cell analysis on chips, organonachip, and chipmass spectrometry technology was introduced in this review. Morover, the summary and prospect on the microfluidic technology were introduced to give some insights for researchers who were interested in developing microfluidic platforms for cellbased research.
Keywords Microfluidic chip; Cell culture; Microenvironment; Single cell; Organonachip; Chipmass spectrometry; Cell analysis; Review
(Received 3 January 2016; accepted 16 January 2016)
This work was supported by the National Natural Science Foundation of China (Nos.81373373, 21227006, 21435002) and the China Equipment and Education Resources System (No. CERS175)
