从2015年国际微全分析系统会议看当前微流控芯片领域的研究热点和发展趋势
2016-11-19刘雯雯马妍魏岩潘建章祝莹方群
刘雯雯 马妍 魏岩 潘建章 祝莹 方群

摘 要 本文根据2015年国际微全分析系统会议上的报告内容,分别从微流控芯片技术发展和应用角度,讨论了当前微流控芯片领域发展的热点和趋势。
关键词 微流控芯片; 国际微全分析系统会议; 研究热点趋势; 综述
1 引 言
微流控芯片(Microfluidic chip)技术起源于分析化学领域的微全分析系统(Miniaturized total analysis systems, MicroTAS)概念,目前其研究和应用范围已经逐渐扩大至生物学、医学、药学、组织工程、材料科学等重要领域,成为其核心研究工具。国际微全分析系统会议(International Conference on Miniaturized Systems for Chemistry and Life Sciences,简称为MicroTAS Conference)是目前全世界规模最大、综合性最强、参与人数最多的微流控芯片研究领域学术会议。首届MicroTAS会议于1994年在荷兰的恩斯赫德(Enschede)举办,参与人数约200人。2000年之前,MicroTAS会议每隔2年分别在北美和欧洲举办一次。2000年之后,MicroTAS会议变为年度性会议,以三年为一个循环,每年分别在欧洲、北美洲和亚太地区的城市轮流举办,迄今已成功举办了19届。近5年会议的参与人数均超过千人,参会人员的学科背景也涵盖化学、生物学、医学、药学、生物医学工程、微机电系统、材料学、物理学、计算机学等众多学科。
目前,MicroTAS会议由位于美国北卡罗来纳州的化学和生物微系统学会(The Chemical and Biological Microsystems Society, CBMS)负责管理,职能包括会议举办城市、会议主席和技术委员会的选定等。MicroTAS会议论文的审稿程序较为严格,通常中稿率为60%~70%。自2003以来历届的MicroTAS会议的论文集可在Lab Chip期刊网站(http://www.rsc.org/Publishing/Journals/LC/news/uTAS_Abstracts_2003_to_Present.asp)下载。MicroTAS会议鼓励年轻人参与学术交流,学术报告中除了少数的大会报告和主题报告的报告人为资深科学家外,大量的口头报告人均为年轻研究人员。会议日程中每天均安排专门的、长时间的墙报交流部分。鼓励微流控技术的产业化,为厂商和与会者提供了充分的交流机会以促进微流控公司的仪器和技术推广。
2015年MicroTAS会议(MicroTAS 2015)于10月25~29日在韩国庆州市召开。大会分设8个主题:微/纳流控基础、微/纳米工程、传感器/执行器/检测方法、集成化微流控系统、细胞分离与分析、细胞/模式生物/器官芯片、诊断/治疗/转化医学的应用、分离/反应及其它应用。会议收到论文摘要共计1008篇,其中99篇摘要被选作口头报告,616篇摘要被选作墙报展示(中稿率74.4%)。如表1所示,根据其研究主题统计,位于前三的分别为:传感器/执行器/检测方法、细胞/模式生物/器官芯片细胞分离与分析。这表明了新型传感和检测技术仍然是微流控领域的研究热点。以人体芯片(Human on a chip)为最终目的的器官集成芯片(Organs on a chip )研究异军突起,以循环肿瘤细胞分离鉴定为代表的细胞分析受到更多的关注,表明了微流控应用研究的重心已经深入生物医学领域,成为其重要的研究平台技术。此外,集成化微流控系统的稿件排名,表明便携化、家用化的分析仪器仍然是微流控领域研究的重点。
2 微流控基础技术
2.1 液滴微流控(多相微流控)技术
近年来,液滴微流控技术因其在单分子/单细胞分析,高通量、高效生化反应和筛选的研究中所展现出的巨大应用潜力而获得快速发展,已成为新一代微流控技术的典型代表,并逐渐发展成为新的研究领域——多相微流控(Multiphase microfluidics)技术。多相微流控技术是指利用多相微流体的物理化学特性和尺度效应,在微系统中进行多相微功能单元(微液滴、微颗粒或微气泡等)的生成、操控、反应、分析和筛选。液滴作为一种典型的多相微功能单元,可作为微型反应器,体积一般在pL级至nL级,生成速率可达1000液滴/s以上,具有限制扩散、加速混合、提高传热和传质效率等优点。此外,微通道中的液滴被其不互溶相包裹,有效降低了微通道表面对液滴内物质的吸附,减少了交叉污染。目前,液滴微流控的研究主要集中在多步骤液滴操控技术的研究以及液滴技术在高通量筛选中的应用。
利用液滴系统中油相优异的间隔能力,Park等[1]发展了一种基于多孔板和液滴阵列的自动化免疫分析系统。反应液(含免疫磁性微球)、洗脱液、以及显色底物液滴分别置于多孔板的微孔中,微孔以微通道相连通。包被特异性抗体的免疫磁性微球在外界磁场驱动下,借助微通道顺序经过反应液、清洗液、以及酶反应底物液滴,依次完成免疫分析所需的反应、清洗、检测的步骤,实现了高通量、自动化的酶联免疫分析。该系统可在1 h内完成32个样品的免疫分析测定,并显著降低了试样消耗。该方法成功用于合成β淀粉样蛋白的定量分析,样品消耗量降低至10
SymbolmA@ L, 检出限为15 pg/mL。
Serra等[2]将磁镊集成在聚二甲基硅氧烷(Polydimethylsiloxane, PDMS)芯片微通道侧边,微通道内则顺序通入携有磁性微球的样品液滴、清洗液滴及反应液液滴。通过程序控制磁镊的开关,样品液滴中的磁性微球在磁力作用下被固定在磁镊上,经过清洗除去多余物质后,再被释放进入反应液液滴中进行反应。该方法用于提取总RNA中的mRNA,并定量测定了乳腺癌细胞的HER2基因表达。
对不同尺寸的液滴进行分选在单细胞分析和高通量筛选中具有重要意义。常规液滴分选方法一般只能进行一级的尺寸分选。文献[3,4]报道了一种基于线型轨道和点轨道技术的被动型液滴多级分选方法。通过设计宽度不同的线型轨道,尺寸小的液滴则会一直保持在原有轨道中,尺寸较大的液滴则横向跨越进入相邻较宽的轨道中,实现分选。在下一级的分选中,专门设计了点型轨道代替常规的线型轨道,实现液滴形状的恢复,便于进行下一次的分选。该方法可进行三级液滴分选,可分选液滴尺寸范围是29~48
随着液滴系统在生物学和医学等研究领域的应用,不少公司展出了液滴微流控相关的仪器,仪器功能涵盖液滴生成、反应、检测等多个步骤。HahnSchikard公司利用离心力驱动的流体聚焦微流控芯片来形成单分散的液滴,反应后通过成像检测实现计数分析。Dolomite Microfluidic公司则通过在油下顺序吸取油相试剂油相的方法形成不同组分的试剂液滴,并通入芯片与其他液滴融合、反应,用于微量的生化筛选中。
2.2 纸芯片
纸芯片是一种新兴的微流控分析平台,具有成本低、易携带、加工简单、生物相容性好等优点。纸芯片作为一次性使用的分析工具,在医学诊断、环境监控等领域有着巨大的应用前景。
Mosadegh等[5]采用具有多层结构的纸芯片作为细胞培养的支架,用于癌细胞的三维培养和迁移测定(图1)。该工作中,包含细胞和基质胶的纸层位于中部,上下各堆叠层只含基质胶的纸层。由于氧气只能从顶部进入,因此在堆叠的纸层中形成从高到低的氧气浓度分布。多层纸芯片结构能较好地模拟肿瘤微环境,而纸层的透气性质也便于研究氧气梯度对肿瘤细胞的三维迁移性质的影响。采用该方法研究了三维培养人肺腺癌A549细胞向高浓度氧区域的快速迁移现象。
纸芯片作为一次性的生物传感器受到广泛的关注。Li等[6]在纸芯片上原位生长具有高比表面积的氧化锌纳米线,用于抗体的高效固定。并在芯片上集成了碳对电极和Ag/AgCl参比电极,建立了基于电化学阻抗谱的免疫分析方法,实现了高灵敏、无标记的免疫分析。该方法的单次测定样品消耗为3
SymbolmA@ L,检测时间约20 min,对RabbitIgG的检出限为60 fg/mL,比常规显色检测方法降低了100倍。
纸芯片中的样品溶液在毛细力驱动下流动,无需额外辅助驱动系统即可完成样品的引入与反应。然而,毛细力驱动方法难以进行多步和复杂化的液体操控。Park等[7]通过在硝化纤维膜施加压力的方法,构建了具有不同流体阻力的纸芯片,用于多步免疫分析操作(图2)。硝化纤维膜经过加压后,其多孔结构紧缩,流体阻力增大,会阻止或延迟流体流动。样品经一步浸渍法引入后,优先流经未加压区域与捕获抗体结合,并在检测区域富集。由于流体的延迟,加压区域上预先固定的信号增强试剂在结合和富集步骤之后到达检测区域,信号得以放大。该加压纸基芯片通过简单的浸渍步骤,即可完成预设的多步操作,适合用于即时检验领域。
除了常规的纸基材料,聚合物也可用于构建纸芯片。Hansson等[8]采用多向紫外光刻技术,加工了具有不同密度、不同方向交联多聚物微柱的纸芯片。结果显示,高密度的多聚物微柱具有更高的毛细作用力,液体会优先聚集在高密度区域。通过设计不同密度间隔的多聚物微柱,可将液体限制在特定区域,减少其向外周扩散,便于后续生化试剂的加入。此外,聚合物纸芯片的透明性较高,可显著增加信号强度,比常用的硝化纤维纸基提高了3倍。
2.3 3D打印
近年来发展迅速的3D打印技术,采用光固化立体造型、选择性激光烧结、熔融沉积造型等加工方式,直接将计算机设计模型转为实物,可在短时间内高分辨地完成复杂结构的加工,具有高效、简单、易学的特点。
利用3D打印技术,可以一步加工出常规光刻或热压等方法难以加工的具有复杂立体结构的微流控芯片。Olanrewaju等[9]使用3D打印技术代替SU8光刻技术,加工出微结构阳模。然后PDMS倒模后得到含有触发阀、止流突破阀、微通道以及不同深度腔室的PDMS芯片。在毛细作用驱动下,预先加入的抗体标记微球在通道腔室内堆积。随后样品溶液、标记抗体溶液、以及清洗溶液自发顺序地突破阀门进入通道内与磁珠反应,自动化完成捕获、标记、清洗等步骤。该芯片成功应用于直接定量检测大肠杆菌O157:H7抗体。
Bula等[10]使用3D打印机加工了微反应室、试剂储存器、光学检测流通池等模块,搭建了一套低成本、集成化水质监控装置,用于定量分析饮用水的残留氯含量。3D打印技术显著降低了整体仪器的成本,并结合RGB 3个波长LED进行检测矫正,减少了基线漂移和流体中气泡的影响,对水中残留氯的检出限降低至15 μg/L。
3D打印技术也被应用于模拟血管的研究。Chan等[11]利用3D打印技术加工了立体的管道支架,随后通过模具浇筑、降解等方法形成海藻酸钙的三维支架结构,将其放在琼脂糖溶液中,冷却后裂解海藻酸,最后形成三维血管结构。
除了常规的打印材料,3D打印也能打印三维的细胞结构。Cho等[12,13]先利用聚合物材料构筑了三维框架,再将活细胞、水凝胶、生长因子等同时置于特殊设计的打印机喷头中。精确控制含细胞液体的沉积位置,实现层层的精确可控沉积,最后得到含活细胞的三维结构(图3)。
Dolomite Microfluidic等公司也展示了小型的用于微流控芯片加工的3D打印机,机器内置多种微流控芯片构型设计,便于用户操作。展示的3D打印机大多选用成本低的熔融沉积造型方式进行芯片加工,精度约在200
SymbolmA@ m。虽然目前3D打印精度比不上传统光刻加工技术,但3D打印快速成型的优点可为研究初期的探索实验节省时间。
2.4 检测方法
随着智能手机的广泛应用,其自带的摄像头逐渐被应用于微流控系统的成像检测中。同时,大量开源的手机应用也便于科研工作者自行编写应用程序,进行成像结果的现场分析。Shan等[14]结合单细胞液滴培养与基于智能手机成像的浊度检测,发展了一种便携式、低成本的细菌快速定量分析系统(图4)。该工作将待测细菌分散至大量液滴中,每个液滴至多含有一个细菌。在后续培养中,液滴里的细菌会增殖,含有细菌的液滴浊度增加,而空白液滴依旧澄清。通过智能手机对铺展液滴成像检测、内置应用程序分析图像浊度,即可快速计数细菌数目。
图4 结合液滴内单细胞培养与智能手机成像技术的细菌定量分析方法示意图
Fig.4 Schematic workflow of droplet singlecell culture coupled with smartphone imaging for bacteria quantification[14]
Kim等[15]发展了一种操作简单、便携式的芯片荧光成像检测装置,并结合微流控捕获和尺寸筛选芯片,进行水中寄生虫的快速检测。该检测装置主要由集成有激发滤光片的CMOS图像传感器、基于发光二极管阵列的明场照明装置和基于大功率LED的荧光激发模块组成。通过在微通道中加工有不同宽度微槽的方法,实现基于尺寸选择的寄生虫捕获和分选。最后,利用明场成像和荧光检测,实现对水中3种不同寄生虫的检测和定量。
Swyer等[16]结合数字微流控与平面微线圈技术,发展了一种基于高场强核磁共振谱的微量样品检测方法,并用于自动化和实时化学反应的监控。该工作将数字微流控装置固定在平面微线圈上方,程序化操控nL级样品液滴在平面微线圈上的移动、混合、和反应。该方法分别检测了木糖液滴与硼酸盐液滴混合前后的核磁共振谱,并实时监测反应产物的生成过程。
Liszkaa等[17]报道了基于拉曼光谱技术的高分辨单细胞成像方法。为了降低拉曼光谱技术的高检测背景, 提高成像灵敏度和分辨率,设计了以石英材料为基底的PDMS芯片,用于匹配高数值孔径和短工作距离的激光聚焦透镜。PDMS芯片的透气性质适合细胞的长时间培养和检测。利用该技术,可进行无标记成像检测单个乳腺癌细胞,获得细胞内的化学组分二维空间分布信息。
3 微流控芯片的应用趋势
3.1 细胞分离/捕获
循环肿瘤细胞(Circulating tumor cells, CTCs)是从原发或转移肿瘤病灶上脱落并进入外周血的肿瘤细胞。CTCs的定量分析在研究癌症转移进程、癌症早期诊断、以及药物疗效快速评估中起着重要作用。然而,CTCs在循环血中的数量极少,10 mL全血中约有800亿个红细胞和5亿个白细胞,CTCs数量仅仅有1~100个。因此,如何高效快速地分离和捕获全血中的CTCs是CTCs研究的关键。哈佛大学Toner在本次会议上作了题目为“未来癌症病人的管理:寻找稀有循环肿瘤细胞的探索(Future of managing cancer patients: A quest to find rare circulating tumor cells)”的大会报告[18]。介绍了其研究组利用微流控技术分离全血中CTCs的最新研究进展,以及在细胞、基因水平上对被捕获的CTCs进行了后续分析研究,包括单个CTC培养、CTCs上皮间充质转化研究、单细胞RNA测序等。该研究组自2007年开始进行基于微流控芯片技术的CTCs相关研究,已发展了三代CTCs捕获芯片。第一代芯片是利用上皮细胞粘附因子(EpCAM)抗体修饰高密度微柱阵列进行高效的CTCs捕获。第二代的Herringbone chip在EpCAM抗体捕获的基础上,在通道中增加工人字形涡流生成微结构,增强CTC与包被EpCAM抗体表面的相互作用,提高捕获效率。第三代的CTCiChip则利用惯性聚焦、磁分离等物理方法来除去白细胞和红细胞,只保留CTCs。该方法解决了部分CTCs低表达或者不表达EpCAM,无法采用抗体法进行捕获的问题,显著提高了样品处理通量。CTCiChip已成功用于分离男性前列腺癌血液样本中的CTCs,并对捕获得到的CTCs进行单细胞RNA测序分析。研究揭示了前列腺癌的耐药机制与非经典Wnt信号相关[19]。该研究组还发展了一种名为ClusterChip的芯片技术,利用尺寸分离的方法直接从全血中高效分离CTCs多细胞群体,同时保持了CTCs多细胞群体的完整性。Lim等[20]介绍了一种基于尺寸选择的离心力驱动CTCs分离装置。该装置的主体是8
SymbolmA@ m的多孔聚碳酸酯膜,离心力驱动反应室中的全血样品经过多孔膜过滤后进入废液池。由于CTCs尺寸大于白细胞和红细胞,且刚性较大,因此会被保留在膜上,而白细胞和红细胞会被滤掉进入废液池,实现快速、高效地从全血中分离CTCs。
Kim等[21]发展了一种基于电激活双孔阵列技术(Electroactive doublewell array, EdWA)的单细胞捕获和分析方法,对单细胞的捕获率可达95%。芯片中每个单细胞操控单元由一个基于介电操控的细胞捕获孔以及一个基于PDMS薄膜密封的反应孔组成。在介电力的作用下,单个细胞被固定至捕获孔中。然后利用PDMS薄膜形变,将反应腔室封闭形成包含有单个细胞的独立反应器。最后,提高电压直接进行细胞裂解来释放细胞内组分。该技术被应用于研究单个PC3细胞中的βgal酶活性差异。
Dura等[22]介绍了在芯片单个微结构中高通量捕获两种不同的细胞,形成细胞对的方法,实现规模化的在单细胞层次上研究免疫应答级联反应过程(图5)。该芯片在每个捕获结构上都设计了双向的捕获微腔,两次改变流向后,即可形成成对细胞,细胞成对成功率约在40%~85%。该工作研究了成对OTI CD8T细胞与抗原呈递细胞的免疫级联反应,包括钙离子信号释放、磷酸化、以及下游效应等功能。
图5 单细胞免疫应答级联反应过程研究:(a)微流控芯片照片, (b)细胞捕获微结构的SEM图, (c)细胞引入及配对的4步操作, (d)小鼠淋巴细胞在捕获结构中的相差及荧光叠加图像[22]
Fig.5 Immune cell pairing: (a) Image of the device, (b) SEM of the cell trap array showing the backside single cell traps, and frontside twocell traps and support pillars, (c) Fourstep cell loading and pairing protocol and (d) Overlaid phase contrast and fluorescence images showing primary mouse lymphocytes stained with DiI (red) and DiO (green) membrane dyes paired in the traps[22]
对白细胞和红细胞的定量检测有助于对白血病、贫血和炎症等疾病进行诊断,然而现有检测仪器成本较高,限制了其在经济落后地区和国家中的使用。Ahn等[23]发展了一种基于水跃(Hydraulic jump)现象的白细胞和红细胞的分离方法。该工作通过在微通道中集成不同高度和宽度的微腔来诱发水跃现象。由于白细胞和红细胞存在尺寸差异,通过精确调整驱动流速,两种细胞在微腔区域存在不同的捕获和释放行为,从而实现分离,分离效率为80%。
3.2 单细胞分析
由于细胞间存在异质性,基于群体细胞的研究会掩盖潜在的分子机制。单细胞分析有助于深入了解细胞异质性,对癌症研究、术后疗效评估、免疫应激研究等具有重要意义。
单细胞研究常用荧光染料标记目标分子进行成像分析,但部分小分子如离子、氨基酸等代谢物很难寻找到合适的荧光染料进行标记。Türkcan等[24]发展了一种基于辐射发光的分析方法,研究单个肿瘤细胞对氟标记脱氧葡萄糖(FDG)的摄取情况。辐射发光基于细胞中的FDG在衰变时会放射出β粒子,从而激发CdWO4基底辐射出可被显微检测的可见光。该方法结合了液滴系统通量高、无交叉污染的特点。将摄入FDG的单细胞包裹至液滴中,并利用微孔阵列固定液滴进行长时间的追踪与成像分析, 应用于研究不同摄入时间下乳腺癌单细胞中的FDG含量分布,以及野生型葡萄糖转运蛋白敲除型结肠癌单细胞中的FDG含量分布。
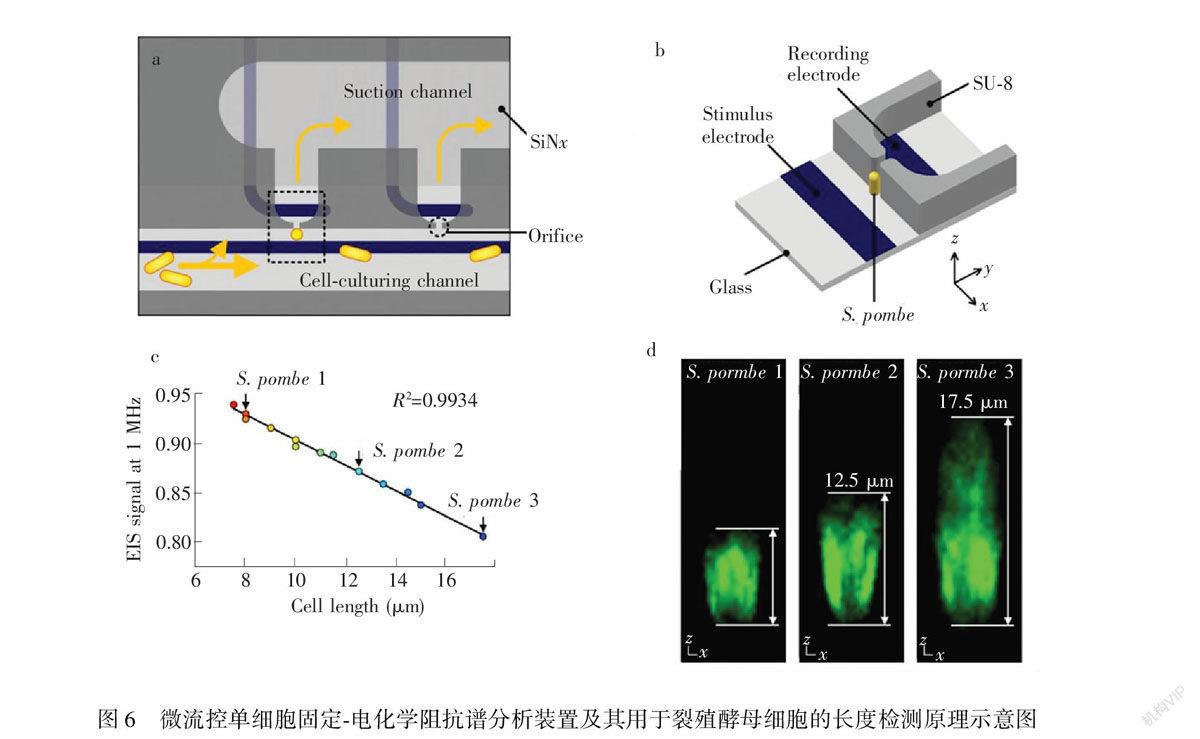
Zhu等[25]报道了利用电化学阻抗谱实时监控单个裂殖酵母细胞的动态成长过程(图6)。在集成加工了平面电极、培养通道、负压通道及细胞捕获结构的微流控芯片上,借助负压作用,将单个杆状的裂殖酵母细胞固定在捕获结构上,培养通道内通入培养液进行培养。由于裂殖酵母细胞是通过细胞端部的延长进行生长,其长度变化会影响原有通道的阻抗。利用共聚焦成像的方法得到细胞长度与阻抗的线性关系。通过实时监测电阻抗信号,实现了单个细胞生长情况的持续动态监控。
Wheeler等[26]发展了一种基于数字微流控的免疫细胞化学方法,应用于单细胞信号通路的研究。该芯片系统为间隔一定高度的双层平板装置,其中上层平板表面加工有亲水区域用于单个细胞固定,下层为用于液滴操控的数字微流控装置。不同的试剂液滴顺序经过细胞固定区域,依次完成配体刺激、清洗、固定、免疫染色的步骤。最后将上层平板取下,使用共聚焦荧光定量检测信号分子的活化程度。该方法成功用于定量研究不同浓度、不同时间血小板源性生长因子(PDGF)对成纤维细胞中PDGFRAkt信号应答通路的影响。
Kang等[27]介绍了一种单细胞水平的蛋白质免疫印迹分析方法,能在4 h内同时定量分析1000个细胞中特定蛋白,并将其应用于乳腺癌细胞的抗药性研究(图7)。该工作在凝胶涂层芯片上集成了关键的蛋白质印迹法步骤,包括单细胞捕获、细胞裂解、梯度PAGE胶蛋白电泳分离、光致交联固定蛋白、荧光标记抗体杂交,以及成像检测。该方法用于定量检测乳腺癌细胞中HER2蛋白、相互作用蛋白(HER3和MUC4)、以及抗药性相关蛋白的表达。结果显示HER2在20%乳腺癌细胞中过量表达,也观察到由于其表达差异性带来的信号通路的差异激活现象[28]。
3.3 器官芯片
器官芯片(Organs on a chip)指利用微流控系统对微流体、细胞及其微环境的灵活操控能力,在微流控芯片上构建可模拟器官功能的集成微系统,为体外药物筛选和生物医学研究提供更接近人体真实生理和病理条件的,成本更低的筛选和研究模型。从简单细胞三维培养、多细胞共培养开始,器官芯片已经向着结构和功能都更接近真实器官的方向发展。目前研究工作大多是利用芯片微结构、生物材料辅助、多种细胞共同培养等方法模拟某个器官或组织,如骨骼、血管、皮肤[29],或者更进一步模拟出肝小叶的形状、小肠绒毛的褶皱、肺器官的气液界面等。
最后一天的大会报告由横浜市立大学Taniguchi博士[30]介绍了利用诱导人多潜能干细胞(iPSCs)重建功能性器官的研究工作,该方法模拟胚胎发育过程中肝脏形成的过程,即肝祖细胞从前肠内胚层分层,形成肝芽,肝芽的迅速血管化。将由iPSCs分化形成的肝细胞、间质细胞、血管内皮细胞共培养,3种细胞自组装, 3天后形成直径约4~5 mm的三维肝芽,这一变化依赖于肝细胞、间质细胞、血管内皮细胞的相互协调作用。将形成的肝芽移植到小鼠体内,48 h内即可与宿主血管连接,形成的血管网络进一步促进肝芽在宿主体内的持续生长,并能够执行肝脏的部分功能,如清除血液中的毒素、产生人类特异性代谢物等。该研究组还将这一器官芽(Organ bud)移植方法用于胰腺和肾脏器官的构建中,并有望进一步应用于组织重建和器官移植[31]。在上述研究中虽尚未使用微流控技术,但其研究思路和方法无疑对器官芯片的研究具有重要的指导和借鉴意义。
Jusoh等[32]发展了一种用于仿生模拟骨骼中血管生成过程的微流控芯片。该工作利用纤维蛋白和骨矿物质羟基磷灰石纳米晶体混合物来形成人工骨骼,并将其置于人脐静脉上皮细胞通道和肺成纤维细胞通道中间的微通道中。在肺成纤维细胞释放的血管内皮生长因子的诱导下,人脐静脉上皮细胞进入人工骨骼通道中形成三维血管结构。羟基磷灰石的纳米晶体具有大量吸附血管内皮生长因子并缓慢释放的功能,对血管形成产生影响。实验研究了含有不同浓度羟基磷灰石的人工骨骼对血管生成的影响,结果显示0.2%的浓度效果最好,血管深入人工骨骼的长度最长,三维结构也最为丰富。
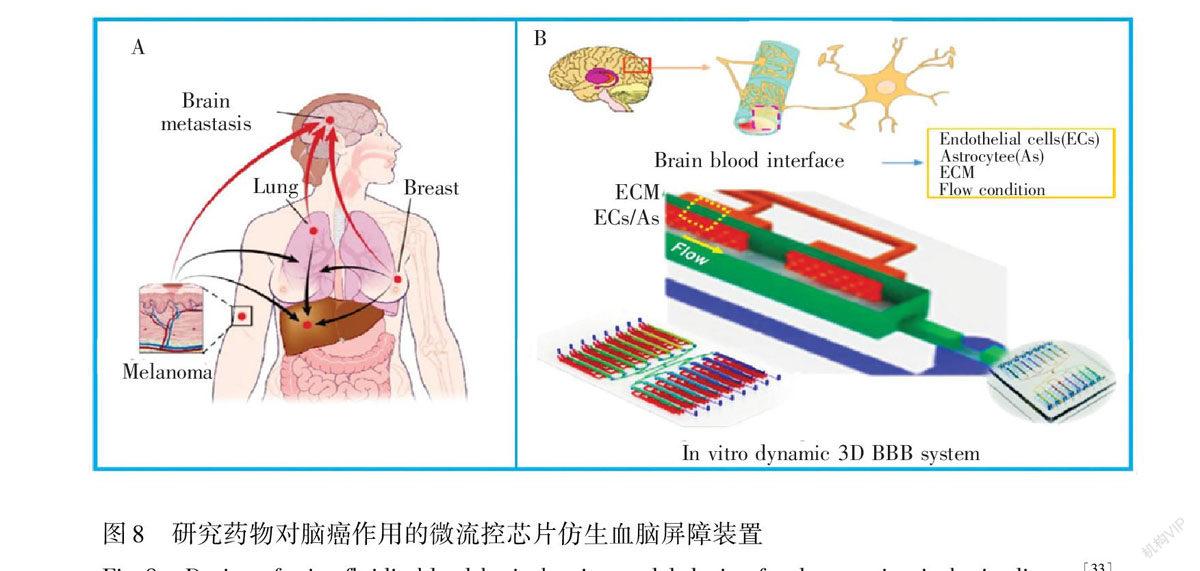
Xu等[33]利用微流控芯片技术,在细胞外基质界面的两侧分别培养形成微血管内皮细胞层和星形胶质细胞层,建立了一种3D血脑屏障仿生系统(图8)。通过测定内皮细胞中紧密连接蛋白(钙粘素),P糖蛋白和葡萄糖转运等功能蛋白的表达升高,以及内皮细胞层对荧光小分子的通透性,验证了该系统能够实现血脑屏障的功能。利用该芯片研究了血脑屏障对8种抗癌药物的药效的影响,结果显示只有替莫唑胺能够穿过血脑屏障,从而诱导神经胶质瘤细胞的凋亡。该工作实现了高通量(16个)血脑屏障仿生系统的构建,可用于研究药物对脑癌的疗效和不同癌细胞向脑迁移能力。
为了实现高通量的3D类器官的培养和后续分析,Allbritton等[34]发展了一种基于微孔阵列芯片的肠隐窝类器官的高通量培养方法。实验研究了浓度梯度、不同表面性质对细胞分化、隐窝类器官形成的影响。在磁性聚苯乙烯“木筏”阵列培养形成肠隐窝后,利用“木筏”分离和磁力吸引的方法收集载有选定肠隐窝的“木筏”,对特定的肠隐窝进行后续分析,并实现了单个类器官的基因表达分析。
Kinoshita等[35]发展了一种可耐较高压力的仿生血管组织的加工方法。该方法使用氯化钡粉末掺杂的PDMS加工微通道芯片,将海藻酸钠和平滑肌细胞的混合物通入微通道,即可在通道表面形成一层平滑肌细胞和钡海藻酸钠层。最后通入内皮细胞进行共培养,内皮细胞在海藻酸钠水凝胶表面生长成为单细胞层。最终形成了外层为平滑肌细胞、内层为内皮细胞的三维血管结构。
3.4 即时检验和临床诊断
即时检验(Pointofcare testing, POCT)以便捷、快速的现场检验为主要目标,具有检测时间短、成本低、操作简便等特点,已被广泛应用于临床监护、环境监测等领域。微流控芯片技术具有低消耗、高效、微型化、集成化等优点,非常适合用于POCT装置的研制。
Priye等[36]利用无人机构建了一种便携、低成本的核酸快速分析平台。实验所需试剂与仪器设备通过无人机定点输送至样品采集区域。样品采集后借助无人机的桨叶旋转完成前处理、离心等操作。基于热对流温度循环原理,无人机搭载的小型反应器可在恒温加热条件下进行PCR反应,具有加热装置简单、能量损耗少的优点。最后,利用智能手机搭建的荧光检测装置,实现实时检测分析PCR结果。该分析平台成功用于埃博拉病毒、葡萄球菌、登革热等传染性疾病的检测。无人机技术具有操作简便、机动性强的特点,特别适用于资源匮乏地区和野外环境中的即时检验。而且随着无人机的普及与相关诊断技术的发展,预计其会较快应用于实际现场分析中。
Magro等[37]介绍了一种基于纸芯片和等温逆转录重组聚合酶扩增反应扩增(RTRPA)技术的RNA扩增和检测方法,并应用检测埃博拉病人实际样本的即时检验。该工作中,采取冷冻法预先将反应试剂固定在纸芯片,样品加入至纸芯片的反应区域与试剂混合。利用RTRPA和实时荧光定量检测样品中埃博拉病毒RNA含量。该方法已经应用于埃博拉病人样本的检测,取得了较好结果。
Duvall等[38]基于DNA介导磁珠聚集现象,建立了一种低成本、可明场成像检测的病原体诊断方法。在磁场作用下,长链DNA会触发磁珠聚集。当存在待测病原体时,其环介导等温扩增反应生成的短链DNA片段优先与磁珠结合,从而抑制磁珠聚集。结合手机成像分析磁珠聚集程度,能够快速进行病原体的现场检测。该方法已成功应用于多种病原体的诊断,包括甲型流感病毒、沙门氏菌、以及艰难梭菌。
研究白细胞的趋药性异常有助于糖尿病的诊断。Hou等[39]介绍了一个集成的微流控装置用于全血中中性粒白细胞分选和趋药性分析。指尖血经收集后进入直通道中,由于Fahraeus效应,红细胞会轴向迁移,而白细胞和血小板会迁移进侧边细通道中。在趋药性分析通道中,嗜中性粒细胞被捕获在修饰抗体CD66b的通道表面。最后通过实时成像的方法研究嗜中性粒细胞在药物梯度的迁移特性,实现对糖尿病的诊断。
4 微流控芯片领域的展望
我们相信,随着微流控芯片研究的深入及其在生物医学研究和临床诊断中的应用扩展,在不久的将来,微流控芯片技术将在以下几个方面获得突破。(1)基于液滴微流控的超高通量筛选技术将对新药研发、生物工程酶的改进、结构生物学研究起到关键的推进作用;(2)微流控技术将成为单细胞分析的核心工具,促进单细胞基因组学、蛋白组学、代谢组学的发展,从单细胞层次揭示新的分子机制、信号传导和代谢通路;(3)以数字PCR芯片和循环肿瘤细胞CTC捕获芯片为代表的新型“液体活检”诊断工具,将可能突破当前癌症早期诊断和术后疗效评估存在的技术瓶颈,成为新的癌症诊断标准;(4)器官芯片和人体芯片技术的继续发展,可能在芯片上构建用于药物研究的仿生人体,从而显著降低当前新药研究成本和研发周期;(5)微流控技术将在即时检验中扮演着越来越关键的作用,在传染病检测、环境监察、食品安全检测、农残检测、家用医疗仪器等方面具有强大的市场前景。
References
1 Park M C, Kim M, Lim G T, Kang S M, Kim T S, Kang J Y. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 123-125
2 Serra M, Ferraro D, Champ J, Gontran E, Viovy J L, Descroix S. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 197-199
3 XieZ M, Yoon D H, Sekigucihi T, Shoji S. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 129-131
4 Yoon D H, Numakunai S, Nakahara A, Sekiguchi T, Shoji S. RSC Adv., 2014, 4: 37721-37725
5 Mosadegh B, Simon K A, Minn K T, Lockett M R, Mohammady M R, Gilbert K, Boucher D M, Hall A B, Hillier S, Udagawa T, Newsome D, Li H, Eustace B K, Whitesides G M. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 38-40
6 Li X, Liu X. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 44-46
7 Park J, Shin J H,Park JK. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 278-280
8 Hansson J, Quelennec A, Yasuga H, Haraldsson T,Wijngaart W. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 284-286
9 Olanrewaju A O, Ng A, Robillard A, Juncker D. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 152-154
10 Bula W P, Aritome K, Miyake R. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 155-157
11 Chan H N, Tian Q, Shu Y W, Wu H K. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 132-134
12 Cho D W. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 150-151
13 Pati F, Jang J, Ha D H, Kim S W, Rhie J W, Shim J H, Kim D H, Cho D W. Nat. Commun., 2014, 5: 3935
14 Shan Y F, Ren L H, Cui X N, Li C Y, Xu J, Ma B. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 2-4
15 Kim J, Yang C. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 5-7
16 Swyer I, Soong R, Dryden M D M, Simpson A, Wheeler A R. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 296-298
17 Liszkaa B M, Rhob H S, Yanga Y S, Lenferinka A T M, Terstappena L W M M, Otto C. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 299-301
18 Toner M. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 1
19 Miyamoto D T, Zheng Y, Wittner B S, Lee R J, Zhu H, Broderick K T, Desai R, Fox D B, Brannigan B W, Trautwein J, Arora K S, Desai N, Dahl D M, Sequist L V, Smith M R, Kapur R, Wu C L, Shioda T, Ramaswamy S, Ting D T, Toner M, Maheswaran S, Haber D A. Science, 2015, 349: 1351-1356
20 Lim M, Kim T H, Park J, Cho Y K. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 102-104
21 Kim S H, Fujii T. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 73-75
22 Dura B, Su H W, Voldman J. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 60-62
23 Ahn J H, Choi Y H, Chun H G. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 76-78
24 Türkcan S, Nguyen J, Vilalta M, Pratx G, Abbyad P. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 194-196
25 Zhu Z, Frey O, Haandbk N, Franke F, Rudolf F, Hierlemann A. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 63-65
26 Wheeler A R, Ng AHC, M. Chamberlain D, Situ H, Lee V. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 82-84
27 Kang C C, Duncombe T A, Ward T M, Pegram M D, Herr A E. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 248-250
28 Duncombe T A, Kang C C, Maity S, Ward T M, Pegram M D, Murthy N, Herr A E. Adv. Mater., 2015, 28: 327-334
29 Mori N, Morimoto Y, Takeuchi S. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences (MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 138-140
30 Taniguchi H, Takebe T. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences (MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 332-333
31 Takebe T, Enomura M, Yoshizawa E, Kimura M, Koike H, Ueno Y, Matsuzaki T, Yamazaki T, Toyohara T, Osafune K, Nakauchi H, Yoshikawa H Y, Taniguchi H. Cell Stem Cell, 2015, 16: 556-565
32 Jusoh N, Oh S, Kim S, Ahn J, Lee K H, Kim J, Jeon N L. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 35-37
33 Xu H, Zhang M, Wang L, Qin J H. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 161-163
34 Allbritton N L, Wang Y, Gunasekara D B, Ahmad A A, Magness S T, Sims C E. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 94-96
35 Kinoshita K, Iwase M, Yamada M, Seki M. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 135-137
36 Priye A, Wong S, Ugaz Vr M. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 8-10
37 Magro L, Jacquelin B, Lafaye P, Manuguerra J C, Monti F, Sakuntabhai A, Vanhomwegen J, Tabeling P. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 281-283
38 DuVall J A, Cabaniss S T, Angotti M L, Borba J C, Moore J H, Shukla N, Kendall M M, Landers J P. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 185-187
39 Hou H W, Tay H M, Boehm B O. Proceedings of the 19th International Conference on Miniaturized Systems for Chemistry and Life Sciences(MicroTAS 2015), 25-29 October, 2015, Gyeongju, Korea 100-101
Current Research Focus and Development Trend in
Microfluidic Chip Field:
A Perspective from the International MicroTAS 2015 Conference
LIU WenWen, MA Yan, WEI Yan, PAN JianZhang, ZHU Ying*, FANG Qun*
(Institute of Microanalytical Systems, Department of Chemistry, Zhejiang University, Hangzhou 310058, China)
Abstract This paper briefly introduced the international conference on miniaturized systems of microfluidic chip for chemistry and life sciences (MicroTAS conference). Current research focus and trend in the research field of microfluidic chip revealed from the conference were discussed, including the technology of dropletbased microfluidics, paperbased chip, 3D printing, and chip detection, as well as the application of microfluidic chips in cell separation/capture, single cell analysis, organsonachip, and pointofcare testing/clinical diagnosis.
Keywords Microfluidic chip; International conference on miniaturized systems for chemistry and life sciences; Research focus; Development trend; Review
(Received 18 February 2016; accepted 9 March 2016)
This work was supported by the National Natural Science Foundation of China (Nos. 21435004, 21227007, 21475117) and the Natural Science Foundation of Zhejiang Province, China (No. LY14B050001)
