西妥昔单抗修饰异长春花碱隐形阳离子脂质体的制备及其理化性质、细胞抑制作用研究Δ
2016-11-18林祥辉王晓敏王艳红李学涛临沂经济技术开发区人民医院药剂科山东临沂7603辽宁中医药大学药学院辽宁大连116600
林祥辉,王晓敏,王艳红,李学涛#(1.临沂经济技术开发区人民医院药剂科,山东临沂 7603;.辽宁中医药大学药学院,辽宁大连 116600)
西妥昔单抗修饰异长春花碱隐形阳离子脂质体的制备及其理化性质、细胞抑制作用研究Δ
林祥辉1*,王晓敏2,王艳红2,李学涛2#(1.临沂经济技术开发区人民医院药剂科,山东临沂276023;2.辽宁中医药大学药学院,辽宁大连116600)
目的:制备西妥昔单抗(IMC-C225)修饰异长春花碱(VRB)隐形阳离子脂质体(以下简称VRB阳离子脂质体),并对其理化性质和细胞抑制作用进行研究。方法:采用硫酸铵梯度法制备VRB阳离子脂质体,同时对VRB阳离子脂质体的形态学、粒径、多分散系数(PDI)、Zeta电位、包封率、体外释放度等理化性质进行研究,采用磺酰罗丹明B(SRB)法检测VRB阳离子脂质体对肺癌Lewis细胞的抑制作用。结果:所制备的VRB阳离子脂质体外观呈圆球形、大小均匀、表面光滑,平均粒径为(89.06±3.56)nm,PDI为0.175±0.01,Zeta电位为(35.91±0.51)mV,包封率为(90.61±0.80)%,48 h的体外释放度为(26.74±3.76)%(n=3);与异长春花碱脂质体和IMC-C225修饰空白隐形阳离子脂质体比较,VRB阳离子脂质体能降低Lewis细胞的存活率。结论:所制备的VRB阳离子脂质体粒径均匀、包封率较高,对Lewis细胞有明显的抑制作用。
异长春花碱;西妥昔单抗;隐形阳离子;脂质体;理化性质;细胞抑制
异长春花碱(Vinorelbine,VRB)是从长春花Catharathus roseus(L)G.Don中提取出来的半合成的生物碱。VRB是一种作用于肿瘤细胞微管蛋白的药物,主要抑制微管蛋白的聚集,选择性地作用于细胞有丝分裂期。临床上VRB适用于治疗非小细胞肺癌、转移性乳腺癌,同时对于急性淋巴细胞白血病、霍奇金淋巴瘤及非霍奇金淋巴瘤等都有显著治疗功效[1]。然而VRB在临床应用过程中,有明显的骨髓抑制、正常组织器官细胞毒性及静脉炎等副作用。西妥昔单抗(Cetuximab,又名IMC-C225、Erbitux)是目前临床上应用的抗表皮生长因子受体(EGFR)人/鼠嵌合单克隆抗体,研究报道IMC-C225可以作为脂质体的靶向配体以增加脂质体的主动靶向效果[2]。为了降低VRB的毒副作用,增加化疗药物的主动靶向性,笔者将VRB制备成IMC-C225修饰的隐形阳离子脂质体,并考察了其理化性质和对肺癌Lewis细胞的抑制作用。
1 材料
1.1仪器
LF-1脂质体挤出仪(加拿大奥维斯丁公司);LC-1100液相色谱仪(安捷伦科技有限公司);Zetasizer 3000HS激光散射粒径测定仪(英国马尔文公司);Tecnai G220ST透射电子显微镜(美国FEI公司);SPI3800N原子力扫描探针显微镜(日本精工株式会社);XDS-1B倒置显微镜(重庆光学电学仪器公司);MR-96酶标仪(深圳迈瑞生物医疗电子股份有限公司)。
1.2药品与试剂
卵磷脂(EPC,日本NOF公司,批号:120015);胆固醇(Chol,上海普迈生物科技有限公司,批号:8280100);聚乙二醇2000-二硬脂酰磷脂酰乙醇胺(PEG 2000-DSPE,日本精化株式会社,批号:B10206);3β-[N-(N′,N′-二甲基胺乙基)胺基甲酰胺基]胆固醇(DC-Chol,上海艾韦特医药科技有限公司,批号:201923);IMC-C225-PEG 2000-DSPE(辽宁中医药大学药剂实验室合成);VRB原料药(海南国栋药业有限公司,批号:20080512,纯度:98.0%);葡聚糖凝胶G-100(上海华蓝化学科技有限公司);RPMI-1640培养液和胎牛血清(北京迈晨科技有限公司);磷酸盐缓冲液(PBS,北京鼎国生物技术有限公司);磺基罗丹明B(SRB,美国Sigma公司);三氯乙酸(TCA,北京市兴津化工厂);胰蛋白酶(美国Amresco公司);其余所用试剂均为分析纯。
1.3细胞
小鼠Lewis肺癌细胞(中国医学科学院协和医科大学药物研究所)。
2 方法与结果
2.1IMC-C225修饰VRB隐形阳离子脂质体(以下简称VRB阳离子脂质体)的制备[3]
精密称取卵磷脂60µmol、DC-Chol 40µmol、PEG 2000-DSPE 3µmol和IMC-C225-PEG 2000-DSPE 1µmol,共同溶解于10 ml氯仿中,然后在40水浴中低速旋转蒸发去除氯仿,形成薄膜。随后加入250 mmol/L(NH4)2SO4水溶液5 ml,水化,水化液超声(功率200W)10 min,超声后的混悬液采用脂质体挤出仪反复通过聚碳酸脂膜(200 nm)。将过膜后的脂质体混悬液密封于MD34透析袋(截留分子质量12 000~14 000)中,透析袋置PBS中透析24 h,每8 h更换1次透析液,即得IMCC225修饰空白隐形阳离子脂质体(以下简称空白阳离子脂质体)。将空白阳离子脂质体与适量的VRB混合(磷脂-药为30∶1,m/m),置于40水浴中振摇30 min,即得VRB阳离子脂质体。
2.2VRB的含量测定方法
2.2.1色谱条件[4]色谱柱:C18(250 mm×4.6 mm,5µm);流动相:乙腈-0.06 mol/L磷酸二氢钾(35∶65,用磷酸调pH为3.0);流速:1.0 ml/min;检测波长:215 nm;柱温:30;进样量:20µl。在该色谱条件下,理论板数以VRB峰计不得低于3000。
2.2.2线性关系考察精密制备质量浓度分别为0.03、0.06、0.12、0.18、0.24、0.30 mg/ml的VRB溶液,按“2.2.1”项下色谱条件进样测定。以VRB的质量浓度(x)为横坐标、峰面积(y)为纵坐标,绘制标准曲线,得回归方程为y=1 245.8x-13.32(r=0.999 9,n=6)。结果表明,VRB在0.03~0.30 mg/ml质量浓度范围内线性关系良好。
2.2.3精密度试验取一定浓度的VRB溶液,分别连续进样6次,计算得峰面积的RSD=1.33%(n=6),表明精密度良好。
2.2.4稳定性试验取一定浓度的VRB溶液,分别于0、2、4、8、24 h进样分析,计算得峰面积的RSD=1.46%(n=5),表明VRB溶液在24h内稳定。
2.2.5回收率试验精密吸取VRB阳离子脂质体样品溶液0.5 ml,分别加入适量的VRB对照品溶液,按“2.2.1”项下色谱条件进样测定,计算加样回收率。结果,平均加样回收率为98.64%(RSD=1.09%,n=9),表明本方法满足样品测定的要求。
2.3VRB阳离子脂质体的理化性质
2.3.1透射电子显微镜下的粒子形态观察[5]VRB阳离子脂质体外观为乳白色半透明液体,色泽均匀,略带乳光。取适量VRB阳离子脂质体,用蒸馏水稀释到适宜浓度,滴至反应瓷板的凹槽内,并将喷碳铜网放于凹槽内的试液上,1~2 min后取出喷碳铜网,用滤纸从铜网边缘吸去多余液体,然后将该铜网放在1%醋酸双氧铀水溶液中浸泡1 min后取出,静置,使粒子在铜网上沉积。用透射电子显微镜观察粒径大小、形态并拍照。结果显示,VRB阳离子脂质体外观呈圆球形、大小均匀。结构示意图见图1,透射电子显微镜图见图2。

图1 脂质体的结构示意图Fig 1 The schematic representation of liposomes

图2 脂质体的透射电子显微镜图(×10000)Fig 2 TEM images of liposomes(×10000)
2.3.2原子力扫描探针显微镜下的粒子形态观察[6]取适量VRB阳离子脂质体,用蒸馏水稀释到适当浓度,量取10 μl脂质体溶液涂于硅片上,置培养皿中室温下阴干,然后使用原子力扫描探针显微镜进行观察并拍照。结果显示,VRB阳离子脂质体表面光滑,粒径主要分布于100 nm左右。原子力扫描探针显微镜图见图3。

图3 脂质体的原子力扫描探针显微镜图Fig 3 Atomic force scanning probe microscope images of liposomes
2.3.3粒径、多分散系数(PDI)[7]与Zeta电位[8]精密吸取VRB阳离子脂质体0.5 ml,加PBS稀释至20 ml。用马尔文激光粒度仪进行测定,粒径测定结束后分别以微粒的个数作为基准绘制粒径分布图。结果可见,VRB阳离子脂质体的平均粒径为(89.06±3.56)nm,呈正态单峰分布,PDI为0.175± 0.01,Zeta电位为(35.91±0.51)mV。脂质体的粒径分布见图4,Zeta电位分布见图5。

图4 脂质体的粒径分布图Fig 4 Particle size distribution map of liposomes
2.3.4包封率称取葡聚糖凝胶G-100 2.0 g,置于PBS中浸泡24 h,然后采用湿法装柱(10 cm×1.5 cm)备用。精密吸取VRB阳离子脂质体0.5 ml,加至凝胶柱上方,采用PBS溶液进行洗脱,收集带有乳光的脂质体溶液,所收集的脂质体溶液加入9倍体积的甲醇破坏后,分别按“2.2.1”项下色谱条件进样测定,计算包封率(EE)[9-10]。EE(%)=(m后/m总)×100%,式中,m后是过葡聚糖凝胶G-100柱后被甲醇破坏的VRB阳离子脂质体中VRB的质量,m总是相同体积脂质体中的VRB的质量。结果显示,VRB阳离子脂质体中VRB的包封率为(90.61±0.80)%。

图5 脂质体的Zeta电位分布图Fig 5 Zeta potential distribution map of liposomes
2.3.5体外释放度精密吸取VRB脂质体和VRB阳离子脂质体各2 ml,分别加入2 ml的释放介质(含10%胎牛血清的PBS)中,密封于MD34透析袋中。将透析袋置于40.0 ml PBS中,37下100 r/min均匀振荡。分别于0、4、8、12、24、48 h时取出0.5 ml PBS溶液,并立即补入0.5 ml新鲜的释放介质。待测样品分别加入同体积的甲醇溶液超声处理进行破坏,然后10 000r/min(离心半径为16cm)离心10min,取上清液,按“2.2.1”项下色谱条件进样测定VRB的含量[11-12],计算累积释放度(RR)。RR(%)=(mi/m总)×100%,式中,mi为第i个时间点的释放介质中测得VRB的量,m总为透析前相同体积脂质体混悬液中VRB的量。不同脂质体的体外释放度结果见图6。
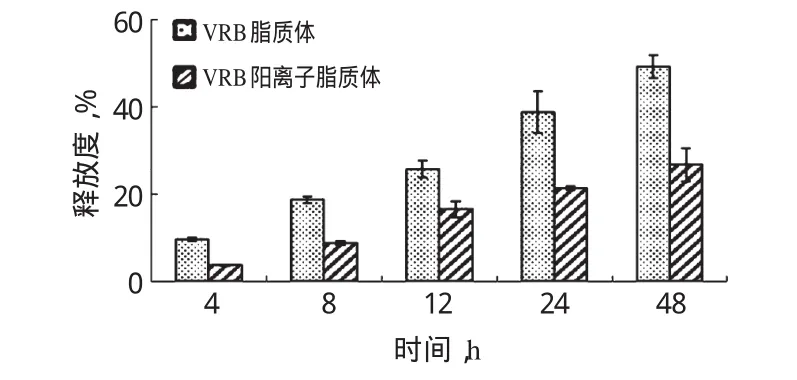
图6 不同脂质体的体外释放度结果Fig 6 The release rate of different liposomes in vitro
由图6可知,VRB阳离子脂质体经过48 h后,体外累积释放度为(26.74±3.76)%,而VRB脂质体在相同条件下的累积释放度为(49.32±2.65)%。
2.4VRB阳离子脂质体的细胞抑制作用评价
2.4.1细胞的培养[13]Lewis细胞在RPMI-1640培养液(含10%胎牛血清、100 u/ml青霉素和100 μg/ml链霉素)中生长,于培养条件为37、5%CO2的孵箱内进行培养。
2.4.2抑制作用评价取对数生长期的Lewis细胞,接种至96孔培养板,37、5%CO2下培养24 h后,将VRB脂质体、VRB阳离子脂质体及空白阳离子脂质体分别加入96孔培养板中,使VRB的最终浓度为0.005、0.01、0.02、0.04、0.05、0.08、0.1µmol/ L。给药后继续孵育48 h,孵育完毕吸弃孔中的培养液,每孔加入200µl 10%预冷的三氯乙酸,在4中放置1 h以固定细胞。弃去孔内液体后用蒸馏水洗涤5次以去除三氯乙酸,在空气中干燥,向每孔加入100µl 0.4%SRB(以1%醋酸配制)染色,室温下放置15 min。弃去孔内液体后用1%醋酸洗涤5次以去除未结合染料,空气中干燥后用pH 10.5的10 mmol/L的Tris碱200µl溶解,振荡20 min。于酶标仪上540 nm波长处测定吸光度(A)[14-15],计算细胞存活率(细胞存活率=药物处理后的A540nm/空白对照孔A540nm×100%),绘制存活率曲线。不同脂质体对Lewis细胞存活率的影响见图7。

图7 不同脂质体对Lewis细胞存活率的影响Fig 7 Effects of different liposomes on survival rate of Lewis cells
由图7可知,对Lewis细胞存活率抑制作用的大小顺序依次为VRB阳离子脂质体>VRB脂质体>空白阳离子脂质体。与VRB脂质体比较,VRB阳离子脂质体在不同VRB给药浓度下均显示出最强的抑制Lewis细胞增殖的作用。空白阳离子脂质体对Lewis细胞的细胞毒性作用很小,可以忽略不计。
3 讨论
本试验采用硫酸铵梯度法制备VRB阳离子脂质体,该方法具有操作简便、制备的脂质体的包封率高的特点。相对于传统的被动载药方法,采用硫酸铵梯度法所制备的脂质体药物不易渗漏。硫酸铵梯度法依靠脂质体内外水相的硫酸铵浓度梯度来载水溶性药物。本试验所制备VRB阳离子脂质体的平均包封率大于90%,平均粒径均小于100 nm,PDI小于0.20,Zeta电位大于30 mV;通过透射电子显微镜和原子力扫描探针显微镜观察该脂质体外观呈圆球形,表面光滑,大小均匀,所观察的粒径和激光粒度分析仪测定的结果一致。
为了解脂质体在体内的释药情况,本试验考察了脂质体的体外释放度。由于脂质体在机体内与血浆蛋白之间存在脂交换作用,所以在考察脂质体的体外释放度的过程中加入了10%的胎牛血清。结果发现,VRB脂质体和释放介质混合后在所有的测定时间点的体外释放度均显著高于VRB阳离子脂质体,该结果可能与VRB阳离子脂质体中的PEG 2000-DSPE的加入阻止了血清对脂质体的破坏有关。
空白阳离子脂质体对Lewis细胞的细胞毒性作用很小,可以忽略不计,说明VRB阳离子脂质体对Lewis细胞的细胞抑制作用可能是由于增加了细胞对药物的主动摄取而引起的。VRB阳离子脂质体的主动摄取一方面来自于IMC-C225与肿瘤细胞膜表面的抗原所发生的特异性结合,另一方面来自于脂质体表面所带的正电荷,其可以与肿瘤细胞表面的负电荷结合,进而增大其对肿瘤细胞的摄取强度。
[1]唐世彩.盖诺致静脉炎及局部反应的护理体会[J].中国中医药咨讯,2011,3(15):300.
[2]Portnoy E,Lecht S,Lazarovici P,et al.Cetuximab-labeled liposomes containing near-infrared probe for in vivo imaging[J].Nanomedicine,2011,7(4):480.
[3] 姬颖华,杨晓煜,王荦楠,等.转铁蛋白和RGD肽共修饰脂质体的制备及其肺癌组织细胞的靶向性[J].中国肿瘤生物治疗杂志,2015,22(3):295.
[4]李学涛,赵琳,程岚.异长春花碱脂质体的制备及其在小鼠体内的组织分布[J].中国药房,2012,23(9):788.
[5]周立,刘裕红,贾俊.芦丁脂质纳米混悬剂的制备及性质考察[J].中外医学研究,2009,29(11):1054.
[6]张诚翔,赵炜煜,吕万良.多功能靶向性表柔比星脂质体的制备及其对脑胶质瘤细胞的抑制效应[J].中国药学杂志,2015,50(14):1208.
[7]杨平,林珈好,王玉蓉.盐酸小檗碱前体脂质体的制备及理化性质研究[C]//世界中联中药专业委员会学术年会暨中药新药研发与中药资源可持续利用国际研讨会,北京:世界中医药学会联合会,2011:289-292.
[8] 赵梦玉,张丽男,孙勇军,等.两性霉素B磁性脂质体的制备及磁靶向性研究[J].华西药学杂志,2014,29(6):618.
[9]李文静,杨志强,王杏林.两种硫酸长春新碱脂质体包封率测定方法的比较[J].中国实验方剂学杂志,2012,18(14):71.
[10]Zhang Y,Li RJ,Lu WL.Targeting therapy with mitosomal daunorubicin plus amiodipine has the potential to circumvent intrinsic resistant breast cancer[J].Mol Pharm,2011,8(1):162.
[11] 李学涛,程岚,贾天柱.异长春花碱脂质体的制备及体外释放度考察[J].中国实验方剂学杂志,2011,17(14):15.
[12] 仵文英,李莎,徐晓娜,等.苦参碱脂质体的稳定性及体外释放度研究[J].中国药房,2013,24(37):3542.
[13] 牛庆元,张晶晶,纪珍玲,等.小鼠正常肺细胞和肺癌细胞之间的力学特性比较研究[J].中国细胞生物学学报,2014,36(3):308.
[14]龙浩.人参皂苷衍生物AD-1对肺癌A549细胞增殖和荷瘤裸小鼠肿瘤生长的抑制作用研究[J].中国药业,2015,24(1):25.
[15] 汤军,窦霄云,修芸,等.阿霉素脂质体制备工艺优化及节拍式给药细胞探讨[J].西南大学学报:自然科学版,2014,36(9):57.
(编辑:邹丽娟)
Study on Preparation,Physicochemical Properties and Cell Inhibition of IMC-C225 Modified Vinorelbine Stealth Cationic Liposomes
LIN Xianghui1,WANG Xiaomin2,WANG Yanhong2,LI Xuetao2(1.Dept.of Pharmacy,the People’s Hospital of Linyi Economic and Technological Development Zone,Shandong Linyi 276023,China;2.School of Pharmacy,Liaoning University of TCM,Liaoning Dalian 116600,China)
OBJECTIVE:To prepare IMC-C225 modified vinorelbine(VRB)stealth cationic liposomes(called VRB cationic liposomes for short),and to study the physicochemical properties and cell inhibition.METHODS:The VRB cationic liposomes were prepared by ammonium sulfate gradient method.The physicochemical properties,including morphology,particle size,polydispersity index(PDI),Zeta potential,encapsulation efficiency and in vitro release rate,were studied.The inhibitory effects of the liposomes on lung caner Lewis cell were evaluated by SRB methods.RESULTS:The prepared VRB cationic liposomes were spheroidal in shape,even in size and smooth in surface.The average particle size of liposomes was(89.06±3.56)nm,PDI value was 0.175±0.01 and Zeta potential was(35.91±0.51)mV.The encapsulation efficiency was(90.61±0.80)%,and in vitro release rate was(26.74±3.76)%within 48 h(n=3).Compared with vinorelbine liposomes and IMC-C225 modified blank stealth cationic liposomes,VRB cationic liposomes could reduce the survival rate of Lewis cells.CONCLUSIONS:Prepared VRB cationic liposomes have even particle size and high encapsulation efficiency,and show significant inhibitory effect on Lewis cells.
Vinorelbine;IMC-C225;Stealth cationic;Liposomes;Physicochemical properties;Cell inhibition
R943
A
1001-0408(2016)28-3964-04
10.6039/j.issn.1001-0408.2016.28.23
国家自然科学基金资助项目(No.81541081);辽宁省科学技术计划项目(No.2014020046);辽宁省教育厅重点实验室基础研究项目(No.LZ2015053)
*副主任药师。研究方向:药事管理、新药开发。电话:0539-8769177。E-mail:yylinxh@163.com
副教授,博士。研究方向:靶向给药系统。电话:0411-85890170。E-mail:lixuetao1979@163.com
(2016-01-06
2016-03-15)
