辛芍组方对氧糖剥夺损伤的神经PC12细胞凋亡的影响及其机制研究Δ
2016-11-18董永喜付思红刘宗炎王爱民李勇军兰燕宇贵州医科大学药学院贵阳550004贵州医科大学贵州省药物制剂重点实验室贵阳550004
董永喜,董 莉,付思红,刘宗炎,王爱民,李勇军,兰燕宇(1.贵州医科大学药学院,贵阳 550004;.贵州医科大学贵州省药物制剂重点实验室,贵阳 550004)
辛芍组方对氧糖剥夺损伤的神经PC12细胞凋亡的影响及其机制研究Δ
董永喜1,2*,董莉1,2#,付思红1,2,刘宗炎1,2,王爱民2,李勇军2,兰燕宇2(1.贵州医科大学药学院,贵阳550004;2.贵州医科大学贵州省药物制剂重点实验室,贵阳550004)
目的:考察辛芍组方对氧糖剥夺(OGD)损伤的神经PC12细胞凋亡的影响,并探讨其作用机制。方法:采用连二亚硫酸钠培养PC12细胞建立OGD损伤模型,将OGD损伤的细胞分为模型组(空白培养基)、尼莫地平组(阳性药物,0.42 mg/L)和辛芍组方低、中、高浓度组[质量浓度分别为0.313、0.625、1.25 mg(生药)/L],并取正常细胞作为正常对照组(空白培养基)。各组细胞经药物作用4 h,再复糖复氧4 h后采用MTT法检测细胞存活率,比色法测定乳酸脱氢酶(LDH)的释放量,流式细胞术检测细胞凋亡率和线粒体膜电位(MMP),并采用Western blot法检测细胞凋亡相关基因Caspase-3、Bax、Bcl-2蛋白的表达。结果:与正常对照组比较,模型组细胞的存活率、MMP、Bcl-2蛋白表达水平以及Bcl-2/Bax比值显著降低,而LDH释放量、细胞凋亡率以及Caspase-3、Bax蛋白表达水平显著升高(P<0.05或P<0.01)。与模型组比较,辛芍组方可增加细胞的存活率和MMP,降低LDH的释放量和凋亡率,显著抑制Caspase-3和Bax蛋白表达水平,升高Bcl-2蛋白表达水平和Bcl-2/Bax比值;除辛芍组方低浓度组细胞的MMP、Bcl-2和Bax外,其余各给药组细胞上述指标差异均有统计学意义(P<0.05或P<0.01)。结论:辛芍组方对OGD损伤诱导的PC12细胞凋亡具有抑制作用,其机制可能与减少LDH释放、稳定细胞MMP、调节凋亡相关基因的表达有关。
辛芍组方;氧糖剥夺;神经PC12细胞;凋亡;凋亡相关基因;线粒体膜电位
据世界卫生组织统计,全球每年有1 500万人患脑卒中,而65岁以上的人为高危人群[1]。脑卒中是心血管疾病患者致死、致残的主要原因,在临床上多以偏瘫的形式出现。脑卒中可分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中最为常见,占脑卒中的80%~85%[2]。随着对脑缺血病理生理机制研究的不断深入,细胞凋亡在缺血引发的神经元损伤和死亡过程中的作用受到越来越多的重视。神经PC12细胞源于大鼠肾上腺嗜铬细胞瘤,具有多种神经细胞特性,被广泛用于神经药理学方面的研究。
辛芍组方源于民间验方,由灯盏细辛和赤芍配伍组成,且灯盏细辛和赤芍提取物对神经细胞损伤均有不同程度的保护作用,在民间多用于治疗偏瘫,有较好的临床基础。本课题组在前期对辛芍组方进行了一系列的研究[3-9],发现该方具有软化、扩张血管及抗凝血的作用,而且还明确了辛芍组方发挥对氧糖剥夺(OGD)损伤PC12细胞保护作用的最佳配比[10]。本研究在此基础上,以连二亚硫酸钠(Na2S2O4)复制OGD损伤的PC12细胞模型,考察辛芍组方对OGD损伤的PC12细胞凋亡的影响及其作用机制,为进一步阐明该方发挥神经保护作用的机制提供参考。
1 材料
1.1仪器
680型酶标仪(美国Bio-Rad公司);TS-100F型荧光倒置显微镜(日本Nikon公司);FACS Calibur型流式细胞仪(美国BD公司);凝胶成像系统(美国Thermo公司)。
1.2药品与试剂
灯盏细辛提取物[批号:20150908,规格:21.3 g(生药)/g,采用高效液相色谱法测得其中含野黄芩苷64.28%、3,5-二咖啡酰基奎宁酸8.36%]、赤芍提取物[批号:20150916,规格:28.9 g(生药)/g,采用高效液相色谱法测得其中含芍药苷65.04%、芍药内酯苷3.35%]均由贵州省药物制剂重点实验室提供;尼莫地平注射液(拜耳医药保健有限公司,批号:BJP2013042/37,规格:10 mg∶50 ml);MTT(美国Sigma公司);乳酸脱氢酶(LDH)试剂盒(南京建成科技有限公司,批号:20130625);荧光素FITC标记的膜联蛋白Ⅴ(AnnexinⅤ-FITC)/碘化丙啶(PI)双染凋亡检测试剂盒、JC-1线粒体膜电位(MMP)检测试剂盒(上海贝博生物公司,批号:BB150061、BB150071);半胱氨酸天冬氨酸特异性蛋白酶3(Caspase-3)、B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-肌动蛋白(β-actin)单克隆抗体和辣根过氧化物酶(HRP)标记的山羊抗兔二抗(美国Santa Cruz公司);蛋白抽提试剂盒、二喹啉甲酸(BCA)蛋白定量试剂盒(康为世纪生物科技有限公司,批号:00041409、00051308)。
1.3细胞
神经PC12细胞购自中国科学研究院上海细胞所。
2 方法
2.1供试品的制备
辛芍组方由灯盏细辛与赤芍按质量比为2∶3进行组方[8,10],以灭菌超纯水为溶剂,二甲基亚砜(DMSO)助溶制备成总质量浓度为10mg/ml的母液,备用。
2.2细胞培养及传代
PC12细胞培养于含10%胎牛血清、5%马血清、96 mg/L青霉素和160 mg/L链霉素的DMEM完全培养基中,将培养基置于37℃、5%CO2培养箱中培养,当细胞融合至80%时,用0.25%胰酶溶液消化传代。
2.3细胞存活率测定
采用MTT法。取对数生长期细胞,以3×104~4×104ml-1的密度接种于96孔细胞培养板中,孵育24 h后,将细胞分为正常对照组(空白培养液)、模型组(空白培养液)、尼莫地平组(阳性药物,0.420 mg/L)和辛芍组方低、中、高浓度组[质量浓度分别为0.313、0.625、1.250 mg(生药)/L]。模型组、尼莫地平组和辛芍组方各浓度组细胞分别加入含30 mmol/L Na2S2O4的无糖DMEM培养液100 μl,正常对照组加入100 μl正常DMEM培养液。孵育4 h后,各组细胞均更换为正常DMEM培养液,复糖复氧继续培养4 h。吸弃上清液,每孔加入100 μl MTT溶液,于酶标仪490 nm波长处测定光密度(OD),计算细胞存活率,细胞存活率(%)=试验组OD值/正常对照组OD值×100%。每组设6个复孔,试验重复3次。
2.4细胞上清液中LDH含量测定
细胞接种、分组、培养以及造模的方法均同“2.3”项下。在复糖复氧4 h后,取上清液,按照试剂盒说明书测定细胞上清液中LDH含量。每组设6个复孔,试验重复3次。
2.5细胞凋亡率测定
采用比色法。细胞接种、分组、培养以及造模的方法均同“2.3”项下。在复糖复氧4 h后,消化收集细胞,磷酸盐缓冲液(PBS)洗2遍,AnnexinⅤ结合液悬浮细胞,再加入5 μl AnnexinⅤ-FITC染色液,置于细胞培养箱中避光孵育15 min后,加入5 μl PI染色液避光孵育5 min。用流式细胞仪检测细胞凋亡率。每组设3个复孔,试验重复3次。
2.6 细胞中MMP测定
采用流式细胞术。细胞接种、分组、培养以及造模的方法均同“2.3”项下。复糖复氧4 h后,消化收集细胞,PBS洗2遍,每个样本用JC-1工作液重悬细胞,置于细胞培养箱中孵育15 min,离心收集细胞。重悬细胞后用流式细胞仪检测荧光强度,激发波长为490 nm,发射波长为530 nm。每组设3个复孔,试验重复3次。
2.7细胞中Caspase-3、Bcl-2、Bax蛋白水平测定
采用Western blot法。细胞接种、分组、培养以及造模的方法均同“2.3”项下。复糖复氧培养4 h后,按照蛋白抽提试剂盒说明书提取蛋白,并用BCA蛋白定量试剂盒检测蛋白浓度。取20 μg蛋白上样,聚丙烯酰胺凝胶电泳分离蛋白,转膜及封闭后,分别加入Caspase-3(1∶400)、Bcl-2(1∶200)、Bax(1∶200)一抗,4℃孵育过夜,用含HRP标记的山羊抗兔二抗(1∶5 000)孵育1.5 h。增强化学发光法(ECL)显色,凝胶成像系统扫描图像,通过Gene Tools分析软件进行灰度值分析,以目的基因灰度值与内参β-actin灰度值比值表示目的基因的相对表达水平。每组设3个复孔,试验重复3次。
2.8统计学方法
3 结果
3.1辛芍组方对OGD损伤的PC12细胞存活率和LDH释放量的影响
与正常对照组比较,模型组细胞存活率显著降低、上清液中LDH释放量显著增加(P<0.05)。与模型组比较,各给药组细胞的存活率显著升高、LDH释放量显著减少(P<0.05或P<0.01),且呈浓度依赖性。各组细胞的存活率和上清液中LDH含量测定结果见表1。
表1 各组细胞的存活率和上清液中LDH含量测定结果(±s,n=3)Tab 1 Survival rate and LDH content in supernatants of cells in each group(±s,n=3)
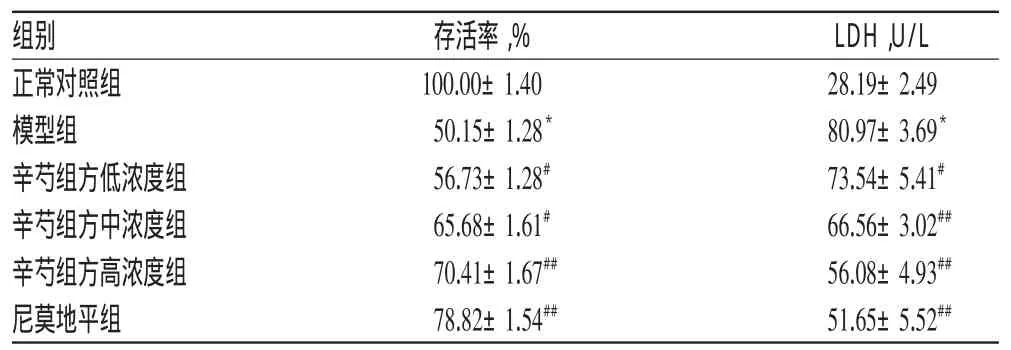
表1 各组细胞的存活率和上清液中LDH含量测定结果(±s,n=3)Tab 1 Survival rate and LDH content in supernatants of cells in each group(±s,n=3)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,*P<0.05;vs.model group,#P<0.05,##P<0.01
LDH,U/L 组别 存活率,%
3.2辛芍组方对OGD损伤的PC12细胞凋亡率和MMP的影响
与正常对照组比较,模型组细胞的凋亡率显著升高、细胞中MMP显著降低(P<0.05);与模型组比较,各给药组细胞的凋亡率均有不同程度降低、细胞中MMP均不同程度升高,且与辛芍组方呈现一定的质量浓度依赖性;除辛芍组方低浓度组细胞的MMP升高不显著外(P>0.05),其余各组细胞上述指标差异均有统计学意义(P<0.05或P<0.01)。各组细胞的凋亡率和MMP测定结果见表2、流式细胞图见图1、图2。
表2 各组细胞的凋亡率和MMP测定结果(±s,n=3)Tab 2 The apoptosis rate and MMP of cells in each group(±s,n=3)
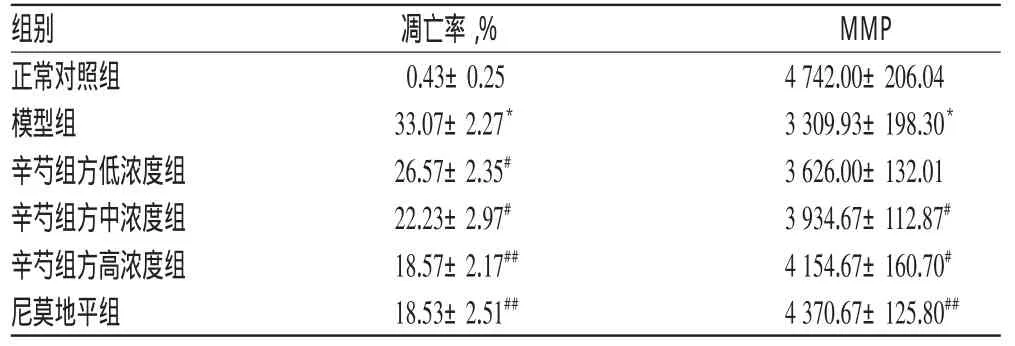
表2 各组细胞的凋亡率和MMP测定结果(±s,n=3)Tab 2 The apoptosis rate and MMP of cells in each group(±s,n=3)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,*P<0.05;vs.model group,#P<0.05,##P<0.01
MMP 组别 凋亡率,%
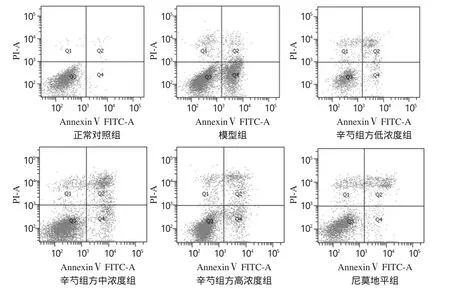
图1 细胞凋亡的流式细胞图Fig 1 Flow cytometry of apoptosis
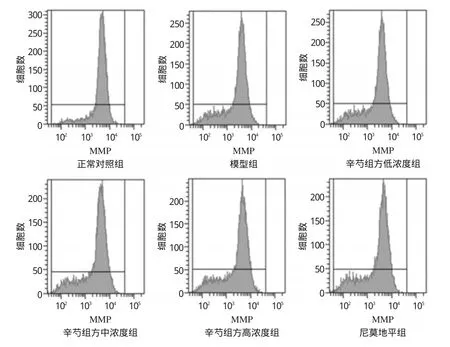
图2 细胞MMP的流式细胞图Fig 2 Flow cytometry of cells MMP
3.3辛芍组方对OGD损伤的PC12细胞中Caspase-3、Bcl-2和Bax蛋白表达的影响
与正常对照组比较,模型组细胞中Caspase-3、Bax蛋白表达水平显著升高(P<0.05),Bcl-2蛋白表达水平以及Bcl-2/Bax比值显著降低(P<0.05或P<0.01)。与模型组比较,各给药组细胞上述指标均得到不同程度改善;除辛芍组方低浓度组细胞中Bcl-2、Bax蛋白水平和Bcl-2/Bax比值,以及辛芍组方中浓度组细胞中Bcl-2蛋白水平差异无统计学意义(P>0.05)外,其余各组各指标差异均有统计学意义(P<0.05或P<0.01)。各组细胞中Caspase-3、Bcl-2和Bax蛋白表达水平以及Bcl-2/ Bax比值测定结果见表3,蛋白表达电泳图见图3。
表3 各组细胞中Caspase-3、Bcl-2和Bax蛋白表达水平以及Bcl-2/Bax比值测定结果(±s,n=3)Tab 3 The protein expression of Caspase-3,Bcl-2 and Bax and the ratio of Bcl-2/Bax of cells in each group(± s,n=3)
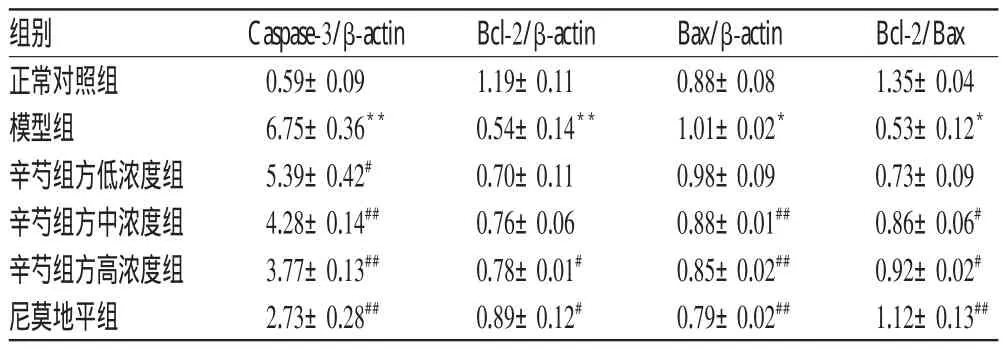
表3 各组细胞中Caspase-3、Bcl-2和Bax蛋白表达水平以及Bcl-2/Bax比值测定结果(±s,n=3)Tab 3 The protein expression of Caspase-3,Bcl-2 and Bax and the ratio of Bcl-2/Bax of cells in each group(± s,n=3)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,*P<0.05,**P<0.01;vs.model group,#P<0.05,##P<0.01
Bcl-2/Bax 1.35±0.04 0.53±0.12*0.73±0.09 0.86±0.06#0.92±0.02#1.12±0.13##组别正常对照组模型组辛芍组方低浓度组辛芍组方中浓度组辛芍组方高浓度组尼莫地平组Caspase-3/β-actin 0.59±0.09 6.75±0.36**5.39±0.42#4.28±0.14##3.77±0.13##2.73±0.28##Bcl-2/β-actin 1.19±0.11 0.54±0.14**0.70±0.11 0.76±0.06 0.78±0.01#0.89±0.12#Bax/β-actin 0.88±0.08 1.01±0.02*0.98±0.09 0.88±0.01##0.85±0.02##0.79±0.02##

图3 各组细胞中Caspase-3、Bcl-2和Bax蛋白表达的电泳图Fig 3 The electrophoregrams of protein expression of Caspase-3,Bax and Bcl-2of cells in each group
4 讨论
Na2S2O4是一种氧清除剂,能清除融入培养基质中的氧,在短时间内即可造成细胞缺氧。采用Na2S2O4结合无糖培养基的方法模拟缺氧缺糖环境,作用于PC12细胞4 h后,再更换为正常含糖的培养基,恢复氧、糖供应,从而建立PC12细胞的OGD损伤模型[4]。尼莫地平为钙拮抗药,用于缺血性脑血管病、偏头痛、轻度蛛网膜下腔出血所致脑血管痉挛等疾病的治疗,疗效明确,常在抗脑缺血药物研究中被作为阳性对照药物。课题组在前期试验中考察了不同浓度尼莫地平对OGD损伤的PC12细胞的保护作用,结果表明,当尼莫地平浓度为1 μmol/L(即0.420 mg/L)时可以显著改善OGD所致的PC12细胞损伤,与文献[11-12]报道一致。因此,在本试验中设置尼莫地平的质量浓度为0.420mg/L。
MTT法主要用于测定药物对体外培养细胞的活性。其原理是当有活细胞存在时,线粒体内琥珀酸脱氢酶可将淡黄色的MTT还原成蓝紫色的针状甲臜结晶;结晶物能被DMSO溶解,用酶标仪测定其OD值,OD值越大,表示存活的细胞越多[3]。LDH释放量的测定是在LDH的作用下,NAD+被还原生成的NADH,再与氧化型2-(4-碘苯)-3-(4-硝基苯)-5-苯四唑在硫辛酰胺脱氢酶的催化下反应生成强生色物甲臜,在490 nm波长下产生吸收峰,从而确定释放的LDH的活性,LDH释放量的增加是细胞受损的指标[3]。因此,细胞存活率和LDH释放量是作为评价细胞损伤的常用指标。本试验结果显示,辛芍组方能够呈浓度依赖性地升高OGD损伤的PC12细胞存活率、抑制细胞中LDH释放。线粒体是细胞的产能供能中心,MMP可反映细胞内线粒体功能状态。在细胞凋亡的过程中往往伴随着MMP的破坏,MMP降低是细胞凋亡过程中的早期事件之一[13]。本试验结果显示,辛芍组方可降低细胞的凋亡率、稳定细胞MMP,且呈现一定的浓度依赖性。
Bcl-2家族与细胞凋亡紧密相关,抗凋亡蛋白Bcl-2是其中最重要的蛋白之一,其与MMP的改变密切相关;而促凋亡蛋白Caspase-3、Bax能使线粒体膜通透性增加,致使MMP降低,从而引起细胞凋亡。故Bcl-2和Bax蛋白表达水平的高低与细胞凋亡的严重性相关,二者比值越低,细胞凋亡越严重[14-15]。本试验结果显示,辛芍组方能降低细胞中Caspase-3、Bax蛋白水平,升高细胞中Bcl-2蛋白水平和Bcl-2/Bax比值,且呈一定的浓度依赖性。
综上所述,辛芍组方对OGD诱导的PC12细胞具有明显的保护作用,其机制可能与减少细胞LDH释放、稳定细胞MMP、调节凋亡相关基因的表达有关。
[1]Zhang Z,Yan J,Shi H.Hyperglycemia as a risk factor of ischemic stroke[J].J Drug Metab Toxicol,2013,29(4):153.
[2]Young CC,Al-Dalahmah O,Lewis NJ,et al.Blocked angiogenesis in galectin-3 null mice does not alter cellular and behavioral recovery after middle cerebral artery occlusion stroke[J].Neurobiol Dis,2014,doi:10.1016/j.nbd. 2013.11.003.
[3]刘宗炎,董莉,董永喜,等.灯盏细辛与赤芍配伍组方对H2O2致PC12细胞损伤的保护作用[J].中国实验方剂学杂志,2014,20(5):152.
[4]Bin J,Wang Q,Zhuo YY,et al.Piperphentonamine(PPTA)attenuated cerebral ischemia-induced memory deficits via neuroprotection associated with anti-apoptotic activity[J].Metab Brain Dis,2012,27(4):495.
[5]郑林,牟景丽,黄勇,等.UPLC-MS/MS法同时测定注射用辛芍中7种指标成分的含量[J].中国新药杂志,2014,23(1):7.
[6] 郑林,牟景丽,唐丽,等.UPLC-MS法研究辛芍提取物的药动学及其绝对生物利用度[J].中国新药杂志,2014,23(4):819.
[7] 苏红,王爱民,王永林,等.注射用辛芍(冻干粉针)指纹图谱研究[J].中国中药杂志,2007,32(15):1515.
[8]刘丽娜,兰燕宇,郑林,等.灯盏细辛、赤芍配伍对血栓形成和凝血时间的交互作用[J].中国实验方剂学杂志,2012,18(21):157.
[9]黄勇,王永林,兰燕宇,等.注射用辛芍对大鼠脑缺血再灌注损伤的保护作用和对脑微循环血流量的影响[J].中国新药杂志,2008,17(2):119.
[10]董莉,董永喜,刘宗炎,等.不同配比辛芍组方对PC12细胞氧糖剥夺损伤的保护作用[J].贵阳医学院学报,2014,39(4):451.
[11] 朱君荣,李云曼,方伟蓉.灯盏乙素对PC12细胞拟缺血性损伤的保护作用研究[J].中国药房,2009,20(15):1132.
[12]段贤眷,夏伦祝,汪永忠,等.人参炔醇对氧糖剥夺神经细胞损伤的保护作用[J].中国实验方剂学杂志,2011,17(16):180.
[13]石瑞丽,胡金凤,孔零雷,等.瓜子金皂苷己对连二亚硫酸钠致氧糖剥夺/复供诱导细胞凋亡的抑制作用[J].中国药理学通报,2013,29(3):333.
[14]何筑,况时祥,张树森,等.脑通汤对缺氧/复氧大鼠海马神经元Bcl-2、Bax和Caspase-3表达的影响[J].中国老年学杂志,2015,35(24):6973.
[15] 翟文生,李前前,张建,等.益气化瘀清热方及拆方对脂多糖诱导的大鼠系膜细胞凋亡及其调控基因Bax和Bcl-2蛋白表达的影响[J].时珍国医国药,2016,27(3):580.
(编辑:林静)
Effects of Xinshao Formula on the Apoptosis of Oxygen-glucose Deprivation-induced Nerve PC12 Cells and Its Mechanism
DONG Yongxi1,2,DONG Li1,2,FU Sihong1,2,LIU Zongyan1,2,WANG Aimin2,LI Yongjun2,LAN Yanyu2(1.School of Pharmacy,Guizhou Medical University,Guiyang 550004,China;2.Guizhou Provincial Key Laboratory of Pharmaceutics,Guizhou Medical University,Guiyang 550004,China)
OBJECTIVE:To investigate the effects of Xinshao formula on the apoptosis of oxygen-glucose deprivation(OGD)-induced PC12 cells,and to investigate its mechanism.METHODS:PC12 cells were cultured by Na2S2O4to establish OGD model. OGD-induced cells were divided into model group(blank medium),nimodipine group(positive drug,0.42 mg/L)and Xinshao formula low-concentration,medium-concentration and high-concentration groups[0.313,0.625,1.25 mg(crude drug)/L];normal cells were included in normal control group(blank medium).MTT assay was used to determine the survival rate of PC12 cells after treated with drugs for 4 h and then oxygen-glucose restoration for 4 h.The release of LDH was detected by colorimetric method. The apoptosis rate and mitochondrial membrane potential(MMP)were detected by flow cytometry.The protein expression of Caspase-3,Bax and Bcl-2 were examined by Western blot.RESULTS:Compared with normal control group,the survival rate,MMP,the protein expression of Bcl-2 and the ratio of Bcl-2/Bax were decreased significantly in model group;while the release of LDH,apoptosis rate,protein expression of Caspase-3 and Bax were increased significantly(P<0.05 or P<0.01).Compared with model group,the survival rate,MMP,the protein expression of Bcl-2 and the ratio of Bcl-2/Bax were increased in Xinshao formula groups;while the release of LDH,apoptosis rate,protein expression of Caspase-3 and Bax were decreased.The above indexes had significant differences except for MMP,Bcl-2 and Bax in Xinshao formula low-concentration group(P<0.05 or P<0.01).CONCLUSIONS:Xinshao formula can inhibit the apoptosis of OGD-induced PC12 cells,which may be related to reducing the release of LDH,keeping MMP stable and regulating the expression of apoptotic-related gene.
Xinshao formula;Oxygen-glucose deprivation;Nerve PC12 cells;Apoptosis;Apoptotic-related gene;Mitochondrial membrane potential
R285
A
1001-0408(2016)28-3907-04
10.6039/j.issn.1001-0408.2016.28.06
国家自然科学基金资助项目(No.81260636,81060335);贵州省优秀青年科技人才培养对象专项资金项目(No.黔科合人字〔2015〕11号);贵州省高等学校创新能力提升计划项目(No.黔教合协同创新字〔2013〕04);贵州省教育厅基金项目(No.黔科合KY字〔2013〕122)
*讲师,硕士。研究方向:心血管药物设计与合成。电话:0851-88416153。E-mail:dongyx01@163.com
副教授,硕士。研究方向:中药药效学、药理学研究和安全性评价。电话:0851-88416153。E-mail:108405755@qq.com
(2016-04-20
2016-06-17)
