斯钙素1的表达对肺癌细胞A549细胞周期及凋亡的影响
2016-11-17李妮娅左雪梅杜玉珍
李妮娅,左雪梅,李 莉,刘 华,杜玉珍
1.上海交通大学附属第六人民医院检验科,上海200233
2.上海交通大学医学院附属同仁医院检验科,上海 200050
斯钙素1的表达对肺癌细胞A549细胞周期及凋亡的影响
李妮娅1,左雪梅2,李 莉1,刘 华1,杜玉珍1
1.上海交通大学附属第六人民医院检验科,上海200233
2.上海交通大学医学院附属同仁医院检验科,上海 200050
背景与目的:斯钙素1(stanniocalcin l,STC1)在多种癌组织中表达上调,且与癌组织的恶性程度相关,但STC1在肺癌细胞中的分子作用机制尚不明确。本研究旨在探讨STC1的表达对肺癌细胞A549细胞周期及凋亡的影响。方法:构建STC1基因RNA干扰的肺癌细胞株A549-STC1-siRNA和对照细胞株A549-Vector,用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)检测A549-Vector及A549-STC1-siRNA细胞株的细胞周期蛋白基因CyclinA、CyclinB1、CyclinD1、CyclinE、CDK2、CDK4,凋亡抑制基因Bcl-2、Bcl-xl及凋亡诱导基因Caspase-3、Bax、Bak、Bid的表达水平,用流式细胞术检测STC1基因对A549细胞周期的影响,用原位末端标记(terminal deoxynucleotidyl transferase-mediated nick-end labeling,TUNEL)检测STC1基因对A549细胞凋亡的影响。结果:与A549-Vector细胞相比,A549-STC1-siRNA的细胞周期蛋白基因CyclinA、CyclinB1、CyclinD1、CyclinE、CDK2和CDK4在转录和蛋白表达水平上均显著减少(P<0.05),G0/G1期细胞比例明显增加,S期及G2/M期细胞比例降低(P<0.05),细胞周期受阻;A549-STC1-siRNA的凋亡抑制基因Bcl-2和Bcl-xl表达下调(P<0.05),而凋亡诱导基因Caspase-3、Bax、Bak及Bid显著上调(P<0.05);TUNEL实验表明,A549-STC1-siRNA细胞的凋亡率明显增加。结论:STC1基因的低表达可阻滞肺癌细胞A549的细胞周期,抑制细胞增殖,同时促进细胞凋亡。
斯钙素1;RNA干扰;细胞周期;细胞凋亡
斯钙素(stanniocalcin,STC)是一种最先在硬骨鱼中被发现的糖蛋白激素,可调节钙磷稳定,防止血钙过高。在哺乳动物细胞中STC基因可分为STC1和STC2,人类STC1定位于染色体的8p11.2-p21上,包含4个外显子,可编码247个氨基酸残基的多肽[1-2]。STC1在哺乳动物心、肺、肝、肾、卵巢和甲状腺等多种组织内均有表达[3-4],以旁分泌或自分泌形式参与多种生理过程的调节,如妊娠和血管生成等[5-6]。多项研究显示,STC1在多种肿瘤组织中的表达量上调,并与肿瘤组织的恶性程度相关[7-11],且在非小细胞肺癌患者外周血液中,STC1的表达量明显高于其他肺部非肿瘤疾病患者与健康对照组[9],因此推测STC1的表达与肺部肿瘤的发生、发展密切相关。但既往的研究多基于组织和外周血蛋白水平,对STC1在肿瘤发生、发展中的分子作用机制报道较少,因此本文拟通过RNA干扰实验,探讨在分子和细胞水平STC1基因表达对肺癌细胞A549细胞周期进程和凋亡的影响,进一步分析STC1在肺癌发展进程中的作用。
1 材料和方法
1.1 主要材料与试剂
肺癌A549和293T细胞购自美国菌种保藏中心(American Type Culture Collection,ATCC);细胞培养基(Dulbecco's modified eagle medium,DMEM)购自美国Gibco公司;SYBR Green PCR试剂盒和反转录试剂盒购自美国Thermo公司;感受态细胞DH5α和High Pure dNTPs购自北京全式金生物技术有限公司;质粒抽提试剂盒购自美国Omega公司;琼脂糖凝胶DNA回收试剂盒购自北京索莱宝科技有限公司;Trizol和脂质体转染试剂盒购自美国Invitrogen公司;胎牛血清购自杭州四季青生物工程材料有限公司;PCR引物由上海捷瑞生物工程有限公司合成;RNA干扰载体PLKO.1、PCMV-U6和PLKO.1-EGFP购自美国Addgene公司;鼠抗人STC1抗体购自美国Sigma公司;鼠抗人CyclinA、CyclinE、Bcl-xl、Bak和Bid购自英国Abcam公司;鼠抗人Capase-3、CDK2、CDK4、CyclinD1、CyclinB和GAPDH购自美国CST公司;鼠抗人Bcl-2和Bax抗体购自美国Santa Cruz公司。HRP标记羊抗鼠IgG购自碧云天生物技术研究所;0.25%胰蛋白酶购自基尔顿生物科技(上海)有限公司;TUNEL试剂盒购自瑞士Roche公司。
1.2 方法
1.2.1 细胞培养
肺癌A549和293T细胞用含10%胎牛血清的DMEM,在37 ℃、CO2体积分数为5%的培养箱中培养,取对数生长期的细胞进行实验。
1.2.2 STC1 siRNA转染A549细胞
针对STC1 mRNA的开放读码框(位点369~392),通过Ambion网站设计siRNA(5'-AATTCAAAAAGGGTGCAGGA AGAGTGCTACAGCAACCTACGTACTTGC TGTAGCACTCTTCCTGCACC-3')和siRNANC(5'-AATTCAAAAAGGGTGCAGGAAGAGTGC TACAGCAACCTACGTACTTGCTGTAGCACTCTT CCTGCACC-3')。经生工生物工程(上海)股份有限公司合成的siRNA溶解于退火缓冲液中,95 ℃水浴10 min后取出置于室温自然冷却,形成带黏性末端的双链。利用脂质体转染试剂盒,将空载质粒转染A549细胞作为对照组(A549-Vector);STC1 siRNA与阴性siRNA分别与脂质体按1∶2的比例转染293T细胞,细胞培养48 h后收集慢病毒颗粒。慢病毒颗粒感染肺癌细胞A549,培养24~48 h后,筛选出STC1低表达的细胞株(A549-STC1-siRNA)。
1.2.3 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测细胞周期蛋白基因和细胞凋亡相关基因的mRNA表达
收集肺癌A549-Vector和A549-STC1-siRNA细胞,总RNA按照Trizol试剂说明书进行提取,按反转录试剂盒获取cDNA,配制RTFQ-PCR的反应体系,相关基因的PCR引物见表1。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火及延伸45 s,40个循环。使用7 500 System SDS Software,选择ddCt Study输出数据,每个样本都是3孔重复,使用时取各自Ct值的平均值,基因的相对表达分析采用2-ΔΔCt法计算。
1.2.4 蛋白[质]印迹法(Western blot)检测细胞周期蛋白基因及细胞凋亡相关基因的蛋白表达
收集肺癌细胞A549-Vector和A549-STC1-siRNA并抽提蛋白,用BCA法测定蛋白浓度。20 μL蛋白经10%PAGE胶电泳分离后转移至PVDF膜,5%脱脂奶粉室温封闭1 h后,单次加入一抗STC1 1∶800、CyclinA 1∶300、CyclinB1 1∶20 000、CyclinD1 1∶2 000、CyclinE 1∶1 000、CDK2 1∶1 000、CDK4 1∶2 000、Bcl-2 1∶200、Bcl-xl 1∶1 000、Caspase-3 1∶1 000、Bax 1∶150、Bak 1∶500和Bid 1∶500,室温温育2 h,TBST洗膜3次后加入HRP标记的二抗(1∶1 000稀释),与膜37 ℃温育1 h,用TBST洗涤3次后,经ECL化学发光显色、X光显影并观察结果。
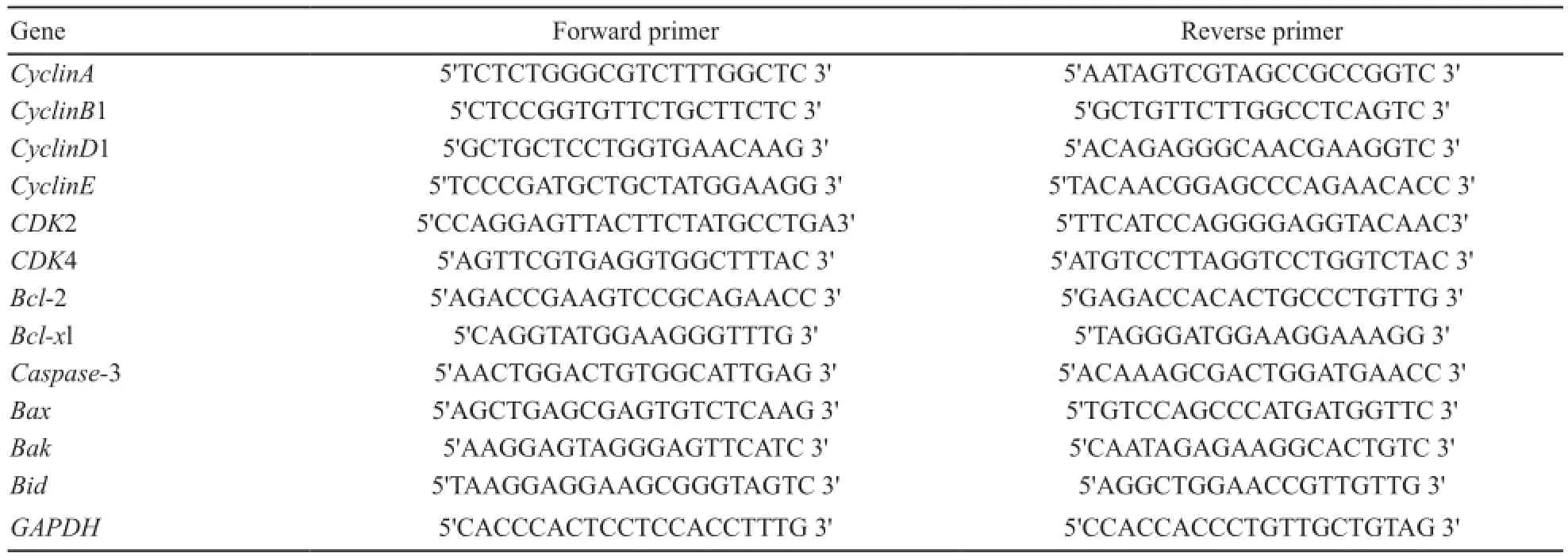
表 1 RTFQ-PCR引物序列Tab. 1 RTFQ-PCR primer sequence
1.2.5 流式细胞术检测细胞周期变化
1 000×g离心5 min,收集A549-Vector及A549-STC1-siRNA细胞,弃上清液,沉淀用含有胎牛血清的PBS溶液悬浮,后加入无水乙醇,置于-20 ℃冰箱内固定细胞24 h以上;取出固定的样品,再次3 000×g离心细胞30 s,弃上清液;用1 mL预冷的PBS将样品洗涤2次;细胞沉淀用RNase A溶液悬浮后加入400 μL浓度为50 μL/mL的碘化丙啶溶液,避光染核10 min。用流式细胞仪进行细胞DNA含量的测定,确定细胞在各细胞周期中所占比例。
1.2.6 原位末端标记(terminal deoxynucleotidyl transferase-mediated nick-end labeling,TUNEL)检测细胞凋亡变化
培养好的A549-Vector及A549-STC1-siRNA细胞,经多聚甲醛固定后,浸入胰蛋白酶内消化40 min,PBS洗涤后加TUNEL反应混合液,封口膜在37 ℃暗湿盒中反应1 h,PBS洗涤3次,每次3 min;加POD于标本上,封口膜在37 ℃暗湿盒中反应30 min,PBS洗涤3次,每次3 min;DAB染色3~10 min,自来水冲洗,苏木精复染,0.1%盐酸酒精分化,在显微镜下观察,控制染色程度。抗荧光猝灭封片液封片后使用显微镜观察。
1.3 统计学处理
2 结 果
2.1 构建STC1基因干扰的肺癌细胞A549-STC1-siRNA细胞株
通过Western blot检测A549-Vector细胞及A549-STC1-siRNA细胞中STC1的表达量,结果显示,与A549-Vector细胞相比,A549-STC1-siRNA细胞中STC1表达显著降低(P<0.05),干扰效率约为75%(图1)。
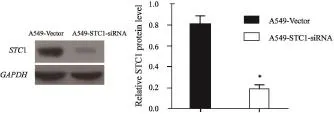
图 1 Western blot检测A549-STC1-siRNA细胞系的STC1干扰效率Fig. 1 STC1 interference efficiency of A549-STC1-siRNA cells detected by Western blot
2.2 STC1基因低表达对A549细胞周期蛋白基因及凋亡相关基因表达的影响
在转录水平上RTFQ-PCR检测的结果见图2,以GAPDH基因作为内参照,各基因表达量相对于GAPDH进行定量。与A549-Vector细胞相比,A549-STC1-siRNA细胞中CyclinA、CyclinB1、CyclinD1、CyclinE、CDK2、CDK4、Bcl-2和Bcl-xl基因表达水平降低,Caspase-3、Bax、Bak和Bid基因表达水平增高,差异有统计学意义(P<0.05)。
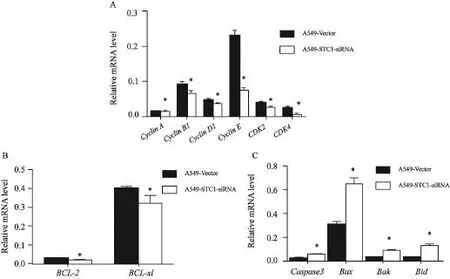
图 2 在转录本水平上STC1基因低表达对A549细胞周期蛋白和细胞凋亡相关基因表达差异的影响Fig. 2 Relative mRNA level of cell-cycle and apoptosis-related genes detected by RTFQ-PCR
Western blot检测结果见图3,以GAPDH蛋白作为内参照,各蛋白表达量相对于GAPDH进行定量。A549-STC1-siRNA细胞中CyclinA、CyclinB1、CyclinD1、CyclinE、CDK2、CDK4、Bcl-2和Bcl-xl蛋白表达量降低,Caspase-3、Bax、Bak和Bid蛋白表达量增高。与A549-Vector相应蛋白表达量相比,差异有统计学意义(P<0.05)。
2.3 STC1基因低表达对A549细胞周期的影响
流式细胞术检测A549-Vector和A549-STC1-siRNA细胞周期见图4。A549-STC1-siRNA细胞中G0/G1期细胞比例明显增加(P<0.05),S期及G2/M期细胞比例降低(P<0.05),细胞周期阻滞于G0/G1期。
2.4 STC1低表达对A549细胞凋亡的影响
TUNEL检测A549-Vector和A549-STC1-siRNA细胞的凋亡情况见图5。与A549-Vector细胞株相比,A549-STC1-siRNA细胞凋亡率明显增加(P<0.05)。
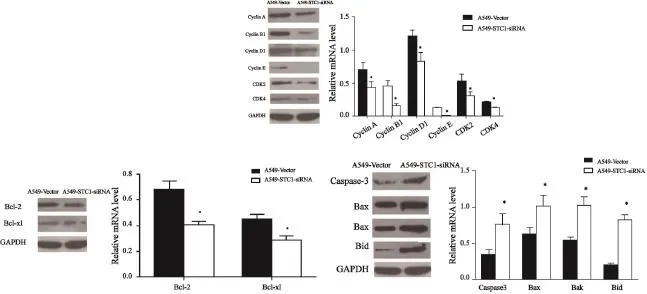
图 3 在蛋白水平上STC1基因低表达对A549细胞周期蛋白和细胞凋亡相关基因表达差异的影响Fig. 3 Relative protein level of cell-cycle- and apoptosis-related genes detected by Western blot
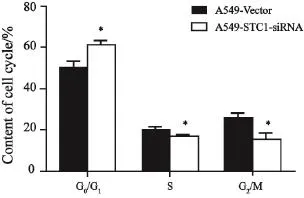
图 4 流式细胞术检测细胞周期Fig. 4 Cell cycle detected by flow cytometry
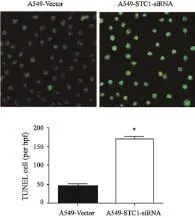
图 5 TUNEL法检测A549-Vector和A549-STC1-siRNA细胞的凋亡情况Fig. 5 Apoptosis of cells detected by TUNEL assay
3 讨 论
STC1与多种癌症如RCC、甲状腺癌、肺癌、结肠癌和卵巢癌等的发生密切相关[7-11],且在癌组织中含量越高,预示患者的预后越差[12-13]。目前,有研究认为,STC1可能参与肿瘤细胞的增殖与凋亡过程[7,14],进而对癌症的发展起调控作用。本研究显示,STC1基因的低表达可减弱A549中细胞周期蛋白基因CyclinA、CyclinB1、CyclinD1、CyclinE、CDK2和CDK4的表达,导致细胞周期阻滞于G0/G1期;同时STC1基因的低表达还可下调凋亡抑制基因Bcl-2和Bcl-xl,上调凋亡诱导基因Caspase-3、Bax、Bak和Bid,促进细胞的凋亡进程。本研究在分子水平上,揭示了STC1与A549细胞周期和细胞凋亡变化的关联性。
细胞周期失控是细胞增殖异常而导致癌变的重要原因,细胞周期的不同时相由不同的细胞周期蛋白控制,CyclinA、CyclinB1、CyclinD1和CyclinE可与CDK2和CDK4形成Cycin-CDK复合物,磷酸化不同的底物,调控细胞周期的不同阶段,促进细胞周期的完整与循环过程。已有研究显示,CyclinACDK2除参与细胞周期调控外,还可通过磷酸化Rad9来参与细胞凋亡[15];CyclinB1、CyclinD1和CyclinE表达异常可导致细胞周期异常,诱导肿瘤的发生、发展[16-18];干扰CDK4的表达能抑制子宫内膜癌细胞的增殖[7,19]。本研究显示,STC1基因表达的抑制可下调肺癌细胞A549中CyclinA、CyclinB1、CyclinD1、CyclinE、CDK2和CDK4的表达,影响细胞周期相关的信号通路,导致细胞停留G0/G1期,抑制癌细胞增殖。
细胞凋亡的发生受凋亡抑制基因和凋亡诱导基因调控。Bcl-2和Bcl-xl是凋亡抑制基因[18,20-21],Caspase-3、Bax、Bak和Bid是凋亡诱导基因[17-18,22-23]。凋亡抑制基因的表达下调,同时凋亡诱导基因的表达上调,可促进细胞的凋亡。本研究显示,STC1基因的低表达可抑制肺癌细胞A549凋亡抑制基因Bcl-2和Bcl-xl的表达,同时,刺激凋亡诱导基因Caspase-3、Bax、Bak和Bid的高表达,导致A549-STC1-siRNA细胞凋亡增加。
本研究在细胞和分子水平上揭示了抑制STC1基因表达,可阻滞肺癌细胞A549细胞周期进程和促进细胞凋亡,从而起到抑癌作用,同时也预示着STC1可能成为一个肺癌个性化治疗的新方向,但本研究仅是STC1体外实验的初探,在人体内抑制STC1的表达是否能起到抑癌作用,有待进一步研究。
[1] CHANG A C, JEFFREY K J, TOKUTAKE Y, et al. Human stanniocalcin (STC): genomic structure, chromosomal localization, and the presence of CAG trinucleotide repeats[J]. Genomics, 1998, 47(3): 393-398.
[2] VARGHESE R, WONG C K, DEOL H, et al. Comparative analysis of mammalian stanniocalcin genes[J]. Endocrinology, 1998, 139(11): 4714-4725.
[3] LIU G, YANG G, CHANG B, et al. Stanniocalcin 1 and ovarian tumorigenesis[J]. J Natl Cancer Inst, 2010,102(11): 812-827.
[4] LAW A Y, YEUNG B H, CHING L, et al. Sp1 is a transcription repressor to stanniocalcin-1 expression in TSA-treated human colon cancer cells HT29[J]. J Cell Biochem,2011, 112(8): 2089-2096.
[5] HASILO C P, MCCUDDEN C R, GILLESPIE J R, et al. Nuclear targeting of stanniocalcin to mammary gland alveolar cells during pregnancy and lactation[J]. Am J Phsiol Endocrinol Metab, 2005, 289(4): E634-E642.
[6] LAW A Y, WONG C K. Stanniocalcin-1 and -2 promote angiogenic sprouting in HUVECs via VEGF/VEGFR2 and angiopoietin signaling pathways[J]. Mol Cell Endocrinol,2013, 374(1-2): 73-81.
[7] MA X, GU L Y, LI H Z, et al. Hypoxia-induced overexpression of stanniocalcin-1 is associated with the metastasis of early stage clear cell renal cell carcinoma [J]. J Transl Med,2015, 13: 56.
[8] SUGURU H, YOSHIHITO S, TSUTOMU M, et al. Expression of stanniocalcin 1 in thyroid side population cells and thyroidcancer cells[J]. Thyroid, 2015, 25(4): 425-436.
[9] DU Y Z, GU X H, LI L I, et al. The diagnostic value of circulating stanniocalcin-1 mRNA in non-small cell lung cancer[J]. J Surg Oncol, 2011, 104(7): 836-840.
[10] SHUZO T, TAKASHI O, KAZUE Y, et al. Clinical significance of STC1 gene expression in patients with colorectal cancer[J]. Anticancer Res, 2011, 31(1): 325-330.
[11] LIU G, YANG G, CHANG B, et al. Stanniocalcin 1 and ovarian tumorigenesis[J]. J Natl Cancer Inst, 2010,102(11): 812-827.
[12] CHANG A C, DOHERTY J, HUSCHTSCHA L I, et al. STC1 expression is associated with tumor growth and metastasis in breast cancer[J]. Clin Exp Metastasis, 2015, 32(1): 15-27.2008, 75(3-4): 192-202.
[13] SHIRAKAWA M, FUJIWARA Y, SUGITA Y, et al. Assessment of stanniocalcin-1 as a prognostic marker in human esophageal squamous cell carcinoma[J]. Oncol Rep,2012, 27(4): 940-946.
[14] CRISTINA P, MARÍA V C, MAJA B L, et al. STC1 expression by cancer-associated fibroblasts drives metastasis of colorectal cancer[J]. Cancer Res, 2012, 73(4): 1287-1297.
[15] ZHAN Z, HE K, ZHU D, et al. Phosphorylation of Rad9 at serine 328 by Cyclin A-Cdk2 triggers apoptosis via interfering Bcl-xL[J]. PloS One, 2012, 7: e44923.
[16] 李伟华, 吴剑宏, 高 纯, 等. 主要细胞周期蛋白表达与胃癌临床病理特征的关系[J]. 中华志, 2013, 35(2): 114-118.
[17] SHIRALI S, AGHAEI M, SHABANI M, et al. Adenosine induces cell cycle arrest and apoptosis via cyclin D1/Cdk 4 and Bcl-2/Bax pathways in human ovarian cancer cell line OVCAR-3[J]. Tumour Biol, 2013, 34(2): 1085-1095.
[18] ZHAO L W, ZHONG X H, YANG S Y, et al. Inotodiol inhabits proliferation and induces apoptosis through modulating expression of cyclinE, p27, bcl-2, and bax in human cervical cancer HeLa cells [J]. Asian Pac J Cancer Prev, 2014,15(7): 3195-3199.
[19] 常 军, 刘玲芳, 郑殊娟, 等. 小干扰RNA阻断周期蛋白依赖激酶4对子宫内膜癌细胞生物学行为的影响[J]. 中国癌症杂志, 2014, 24(4): 292-298.
[20] ZAANAN A, OKAMOTO K, KAWAKAMI H, et al. Mutant KRAS upregulates BCL-XL via STAT3 to confer apoptosis resistance that is reversed by BIM induction and BCL-XL antagonism[J]. J Biol Chem, 2015, 290(39): 23838-23849.
[21] 张 飞, 王 瑧, 张 萍, 等. 异常高表达TCTP通过上调Bcl-xL抑制胰腺癌细胞的细胞凋亡[J].中国癌症杂志, 2013,23(5): 321-327.
[22] HUANG L, HAN J, BEN-HAIL D, et al. A new fungal diterpene induces VDAC1-dependent apoptosis in Bax/Bakdeficient cells[J]. J Biol Chem, 2015, 290(39): 23563-23578.
[23] JANG H S, PADANILAM B J. Simultaneous deletion of Bax and Bak is required to prevent apoptosis and interstitial fibrosis in obstructive nephropathy[J]. Am J Physiol Renal Physiol, 2015, 309(6): F540- F550.
Effects of stanniocalcin l on cell cycle and apoptosis of lung cancer A549 cells
LI Niya1, ZUO Xuemei2,LI Li1, LIU Hua1, DU Yuzhen1
(1.Department of Laboratory Medicine, Shanghai Jiao Tong University Affiliated Sixth People's Hospital, Shanghai 200233, China; 2.Department of Laboratory Medicine, Tongren Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200050, China)
Correspondence to: DU Yuzhen E-mail: duyuzhen2005@163.com
Background and purpose: Stanniocalcin 1 (STC1) has been reported to be up-regulated in various cancer tissues, and related to malignancy degree of cancer. However, the molecular mechanism of STC1 in lung cancer cells is still not clear. This experiment aimed to investigate the effects of STC1 on cell cycle and apoptosis of lung cancer A549 cells. Methods: A549 cells were transfected with validated siRNA for STC1 A549-STC1-siRNA and a negative control vector RNA A549-Vector. The gene and protein expression of cell cycle-related genes, including CyclinA, CyclinB1, CyclinD1, CyclinE, CDK2 and CDK4, as well as apoptosis-inhibiting genes Bcl-2, Bcl-xl and apoptosis-inducing genes Caspase-3, Bax, Bak and Bid, were detected by real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot. The cell cycle distribution was determined with flow cytometry. Terminal deoxynucleotidyl transferase-mediated nick-end labeling (TUNEL) was used to detect cell apoptosis. Results: After transfection with STC1-siRNA, the gene and protein expression of CyclinA, CyclinB1, CyclinD1, CyclinE, CDK2 and CDK4 decreased significantly in A549 cells (P<0.05). The proportion of cells in G0/G1phase significantly increased,whereas the proportion of cells in S phase and G2/M phase decreased (P<0.05). The cell cycle was blocked at G0/G1phase. Furthermore, compared with that in A549-Vector, the gene and protein expression of Bcl-2 and Bcl-xl in A549-STC1-siRNA was reduced significantly (P<0.05), while the expression of apoptosis-inducing genes Caspase-3, Bax,Bak and Bid increased obviously (P<0.05). In addition, the percentage of apoptotic cells significantly increased in A549-STC1-siRNA compared with that in A549-Vector detected by TUNEL method. Conclusion: Down-regulation of STC1 by RNAi can block the cell cycle of A549 cells, inhibit cell proliferation, and promote cell apoptosis.
Stanniocalcin l; RNA interference; Cell cycle; Apoptosis
10.19401/j.cnki.1007-3639.2016.08.001
R734.2
A
1007-3639(2016)08-0641-07
上海巿卫生计生委课题(201540118)。
杜玉珍 E-mail:duyuzhen2005@163.com
(2015-11-03
2016-03-05)
