通过CT灌注扫描及DSA分析兔肝转移瘤血供来源
2016-11-16王光大吴勇超张风宾武中林
王光大,吴勇超,张风宾,高 超,武中林*,林 妍
(1.河北医科大学第四医院CT室,河北 石家庄 050011;2.河北医科大学第四医院放射科,河北 石家庄 050011;3.河北医科大学第四医院消化内科,河北 石家庄 050011;4.河北医科大学第四医院放疗科,河北 石家庄 050011;5.河北医科大学第四医院图书馆,河北 石家庄 050011)
通过CT灌注扫描及DSA分析兔肝转移瘤血供来源
王光大1,吴勇超2,张风宾3,高超4,武中林2*,林妍5
(1.河北医科大学第四医院CT室,河北 石家庄 050011;2.河北医科大学第四医院放射科,河北 石家庄 050011;3.河北医科大学第四医院消化内科,河北 石家庄 050011;4.河北医科大学第四医院放疗科,河北 石家庄 050011;5.河北医科大学第四医院图书馆,河北 石家庄 050011)
目的通过CT灌注扫描、数字减影血管造影(digital subtraction angiography,DSA)分析兔肝转移瘤(liver metastases,LM)血供来源,为LM的血管内介入治疗提供理论依据。方法新西兰大白兔35只,将VX2瘤株种植于脾脏,通过脾脏形成LM,2周后行肝脏CT平扫,确认兔LM形成后行肝脏CT灌注扫描,分析兔LM灌注参数;第2天荷瘤兔于DSA下行直接肝动脉及间接门静脉造影,分析兔LM的血供及瘤灶染色情况。结果33只荷瘤兔CT灌注扫描发现LM病灶46个(注:5只荷瘤兔为肝内多发转移),直径1.25~2.74 cm,平均(1.8±0.5) cm,灌注扫描表现为环形强化,环形强化区的组织血流量、组织血容量、肝动脉供血分数、肝动脉灌注量、肝动脉灌注指数明显大于瘤周正常肝组织,差异有统计学意义(P<0.05);环形强化区的门静脉灌注量、门静脉灌注指数明显小于瘤周正常肝组织,差异有统计学意义(P<0.05)。荷瘤兔DSA发现LM病灶62个,直径0.7~1.3 cm,平均(1.0±0.2) cm,DSA直接肝动脉造影表现为环形染色,肿瘤中心无或轻微染色,间接门静脉造影表现为肿瘤区域为环形缺损,未见瘤内供血征象。结论DSA发现荷瘤兔较小转移瘤的敏感度较CT高,兔LM的CT灌注表现与DSA表现一致,肝动脉参与LM供血,门静脉不参与供血。
肝肿瘤,实验性;肿瘤转移;血液供给doi:10.3969/j.issn.1007-3205.2016.10.026
肝动脉灌注化疗栓塞(transcatheter arterial chemoembolization,TACE)治疗肝转移瘤(liver metastases,LM)的理论基础是LM由肝动脉供血,目前门静脉是否参与LM供血,国内外学者尚存较多争议[1-6]。有研究认为LM完全由肝动脉供血,门静脉不参与供血[1-3]。另有研究认为LM不仅接受肝动脉供血,也接受门静脉供血[4-6];这些研究结论的不一致,导致有学者采用TACE一种途径,有学者采用门静脉、肝动脉置泵或双重置泵,有学者采用门静脉、肝动脉双重途径来治疗LM,这是LM血管内介入治疗所面临的最重要的问题。因此,明确LM的血供来源,对LM患者治疗方式的选择具有重要指导意义,同时为LM的血管内介入治疗提供理论依据。现将本研究观察结果报告如下。
1 材料与方法
1.1瘤株及实验动物35只新西兰大白兔由河北医科大学第四医院动物中心提供,雌雄不限,体质量2.5~3.0 kg。VX2瘤株由中国人民解放军第四军医大学唐都医院惠赠。
1.2兔LM模型的建立新西兰大白兔全身麻醉后暴露腹腔脏器,游离脾脏成功后,将1×107细胞/mL的VX2瘤株悬液注入脾脏,还纳入腹腔脏器,逐层缝合。青霉素40万U连续3 d注射预防感染。造模14 d后行肝脏CT平扫,确认兔LM形成后,立即行肝脏CT灌注扫描。35只新西兰大白兔建模成功33只,麻醉死亡2只,建模成功率为94.29%。
1.3CT灌注参数荷瘤兔用1%戊巴比妥钠全身麻醉后,四肢固定,经兔耳缘静脉注入碘佛醇350,速度为1 mL/s,总量为4 mL,总扫描时间为12 s,间隔时间1 s,层厚2.5 mm。将图像及数据用GE公司perfusion 3软件包中的肝脏肿瘤灌注模式进行后处理,选取LM和瘤周正常肝组织的兴趣区,软件自动计算出LM及瘤周正常肝组织的组织血流量(blood flow,BF)、组织血容量(blood volume,BV)、肝动脉供血分数(hepatic arterial fraction,HAF)、肝动脉灌注量(hepatic arterial perfusion,HAP)、门静脉灌注量(portal vein perfusion,PVP)及根据公式计算出肝动脉灌注指数(hepatic arterial index,HPI)=HAP/(HAP+PVP)和门静脉灌注指数(portal venous perfusion index,PPI)=PVP/(HAP+PVP)。
1.4荷瘤兔DSA荷瘤兔用1%戊巴比妥钠全身麻醉后,四肢固定,在腹股沟区触摸股动脉搏动最强处,逐层分离暴露股动脉,股动脉暴露成功后植入穿刺鞘,透视下将Stride微导管和微导丝送至胸12~腰1椎间隙水平,行腹主动脉造影,然后超选至肝固有动脉行直接肝动脉造影,随后经腹腔干选至脾动脉行间接门静脉造影。分析DSA图像观察LM血供及瘤灶染色情况。
1.5统计学方法应用SPSS 13.0软件进行统计学分析,计量资料比较采用独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1CT灌注扫描结果33只荷瘤兔肝脏CT灌注扫描发现LM病灶46个(注:5只荷瘤兔为肝内多发转移),直径1.25~2.74 cm,平均(1.8±0.5) cm,灌注扫描表现为环形强化,环形强化区的BV、BF、HAP、HAF、HPI明显大于瘤周正常肝组织,差异有统计学意义(P<0.05);LM(环形强化区)的PVP、PPI明显小于瘤周正常肝组织,差异有统计学意义(P<0.05)。荷瘤兔CT灌注参数见表1,荷瘤兔CT灌注扫描图像见图1。
2.2DSA结果33只荷瘤兔DSA发现LM病灶62个,直径0.7~1.3 cm,平均(1.0±0.2) cm,DSA直接肝动脉造影,动脉期可见肿瘤供血血管,纤细、稀少、走形僵直、呈枯树枝状,实质期肿瘤呈环形染色,中心区域染色较为淡薄或不染色;DSA间接门静脉造影,未见门静脉分支进入肿瘤内部,实质期肿瘤无染色,肿瘤密度明显低于周围正常肝组织密度,部分可见门静脉分支围绕肿瘤呈环形缺损。见图2。
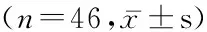
部位 BVBFHAPHAFHPIPVPPPILM(环形强化区)37.98±9.63399.07±117.46256.36±124.410.70±0.210.74±0.27108.79±62.830.26±0.17瘤周正常肝组织 18.23±6.49188.90±91.9448.65±59.360.23±0.190.23±0.26180.88±105.850.98±0.42t 11.5359.55610.22011.2899.0873.97210.699P 0.0000.0000.0000.0000.0000.0000.000
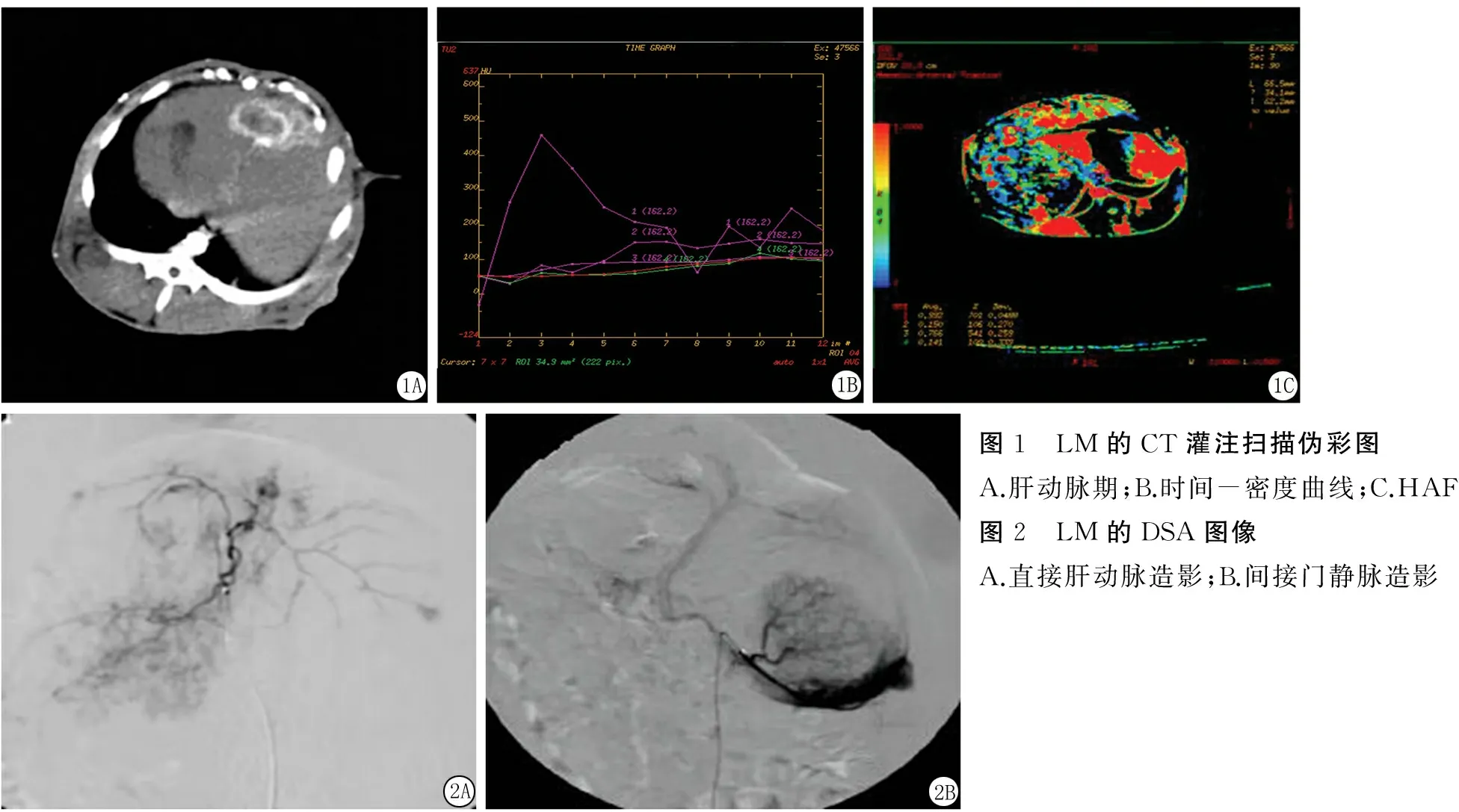
图1 LM的CT灌注扫描伪彩图A.肝动脉期;B.时间-密度曲线;C.HAF图2 LM的DSA图像A.直接肝动脉造影;B.间接门静脉造影
3 讨 论
理想的LM动物模型应与人类LM的生物学行为相同或相近[7]。目前建立兔LM模型主要有2种方法:一种为直接将VX2瘤细胞或组织块种植于兔肝脏;另一种为将VX2瘤细胞悬液种植于兔脾脏,在脾形成肿瘤后再转移至肝脏。VX2瘤株为起源于Shope病毒诱发的兔乳头状瘤,其病理类型为鳞癌[8],在肝脏接种VX2瘤细胞或组织块的方法建立的LM模型,从病理上看应该为LM,但从生长方式及产生途径上来看似乎更接近于原发性肝癌;在脾脏接种VX2瘤细胞悬液的方法建立的LM模型,从生长方式、产生途径及病理上都接近于LM。本研究采用VX2瘤细胞悬液种植于新西兰白兔脾脏,在脾形成肿瘤后再转移至肝脏,新西兰白兔具有完整的免疫系统,虽然在脾脏形成肿瘤,但保留了脾脏的免疫功能,保存了宿主固有的抗肿瘤免疫,从生长方式、产生途径及病理上都接近于人类LM,该模型能全面地表现肿瘤浸润、转移的全过程。
近年来随着CT灌注成像技术的不断成熟和发展,为判断肿瘤血管情况提供了一种新方法[9-10]。王玉理等[11]研究显示,LM病灶中心及病灶边缘的HAP、HPI较正常肝组织明显升高,尤其在病灶边缘的HAP较中心更高。说明LM病灶边缘肝动脉供血更丰富。王守安等[12]研究显示,无论是富血供型LM,还是乏血供型LM,全肝总灌注量、PVP、PPI均减低,HPI均增加,因此推测LM主要供血血管是肝动脉,而不是门静脉,只不过血供程度不一样。本研究结果显示,兔LM的CT灌注扫描表现为环形强化,环形强化区的BV、BF、HAP、HAF、HPI明显大于瘤周正常肝组织(P<0.05),说明LM的BV、BF及肝动脉供血所占比例增加,肝动脉参与了LM的供血;进一步分析发现,环形强化区的BF、BV、HAF明显大于LM中心及瘤周正常肝组织(P<0.05),说明环形强化区的肝动脉供血更加丰富;LM环形强化区的PVP、PPI明显小于瘤周正常肝组织(P<0.05),说明门静脉不参与供血。如果门静脉不参与LM的供血,理论上LM环形强化区的PVP、PPI值应该为零,但我们忽略这样一个事实,LM只要有肝动脉供血,在门静脉期扫描也会出现增强,也就是说在门静脉期扫描时,肝动脉内的造影剂仍然是存在的,本研究中PVP、PPI值均大于零可能由此造成。本研究下一步将采用肠系膜上动脉插管行单纯门静脉CT灌注成像,排除肝动脉供血的干扰,进一步明确门静脉不参与LM供血。
DSA具有极高的时间和空间分辨率,可直接选入目标血管,在使用少量造影剂的情况下,即可获得清晰的血管显示和强化效果,且不受全身血流动力学影响,成为研究判断肿瘤血供程度的理想手段[13]。武中林等[13]对326例LM在DSA下行直接肝动脉及间接门静脉造影,发现LM由肝动脉供血,门静脉不参与供血。与王煊等[14]研究结论一致。Liu等[2]研究显示,LM在最初阶段肝动脉及门静脉均无供血,早期阶段由门静脉供血,随着LM的增长由门静脉及肝动脉双重供血,随着LM的进一步的增长最后完全由肝动脉供血,而门静脉不再参与供血。本研究结果显示,兔LM的直接肝动脉造影,动脉期可见肿瘤供血血管,纤细、稀少、走形僵直、呈枯树枝状,实质期肿瘤呈环形染色,中心区域染色较为淡薄或不染色,在周围正常肝组织的衬托下形成大小不一的类圆形充盈缺损影,说明肝动脉参与了LM的供血;间接门静脉造影显示,未见门静脉分支进入肿瘤内部,实质期肿瘤无染色,肿瘤密度明显低于周围正常肝组织密度,部分可见门静脉分支围绕肿瘤呈环形缺损,说明门静脉不参与LM的供血。对于肿瘤来说无论是良性还是恶性、原发或是继发,都需要建立自己的供血系统维持生长,在早期即无血管状态下,肿瘤依靠简单被动扩散获得营养,当肿瘤体积增长>1~2 mm3时,弥散获取的营养无法满足肿瘤存活和生长的需要,此时若无新生血管的生成,肿瘤组织将保持静止状态或发生退化[15]。
研究LM血供的方法有很多[16],这些方法的应用取得了令人欣慰的结果,体现了潜在的应用价值,越来越多的研究显示,LM由肝动脉供血,门静脉不参与供血。本研究结果显示,33只荷瘤兔DSA发现LM病灶62个,明显多于CT灌注扫描发现的LM病灶46个,说明DSA发现荷瘤兔较小转移瘤的敏感度较CT高。肝脏是恶性肿瘤常见的转移器官之一,TACE因有效地控制了肿瘤生长,明显延长了患者的生存期,现成为非手术治疗LM的首选方法[17-20]。本研究通过对兔LM的影像学表现分析发现,兔LM的CT灌注表现与DSA表现一致,说明肝动脉参与兔LM供血,门静脉不参与供血,从2种影像学方法阐明了LM的血供来源,为LM血管内介入治疗提供了理论依据。
[1]武中林,吴勇超,谷铁树,等.肝转移瘤血液供应来源分析[J].河北医科大学学报,2015,36(4):428-432.
[2]Liu Y,Matsui O. Changes of intratumoral microvessels and blood perfusion during establishment of hepatic metastases in mice[J]. Radiology,2007,243(2):386-395.
[3]Joo I,Lee JM,Kim KW,et al. Liver metastases on quantitative color mapping of the arterial enhancement fraction from multiphasic CT scans evaluation of the hemodynamic features and correlation with the chemotherapy response[J]. Eur J Radiol,2011,80(3):e278-283.
[4]独建库,何伟华,邹洋,等.经肝动脉化疗栓塞术联合经皮肝穿门静脉大剂量热碘油栓塞治疗肝转移癌[J].介入放射学杂志,2014,23(2):115-117.
[5]Voboril R. Blood supply of metastatic liver tumors an experimental study[J]. Int Surg,2005,90(2):71-77.
[6]周春泽,吕维富,张行明,等.选择性门静脉栓塞术联合肝动脉化疗栓塞术治疗肝转移癌的对照研究[J].介入放射学杂志,2012,21(5):384-390.
[7]史博,李智岗,王永中,等.经脾与经肝种植VX2瘤株建立兔肝转移瘤模型的影像学比较[J].介入放射学杂志,2014,23(3):236-240.
[8]曹玮,王执民,张洪新,等.兔VX2肝癌模型的移植方式及生长特性的研究[J].实用放射学杂志,2003,19(2):97-99.
[9]姜正岳,马振波,孔兰玉,等.CT灌注成像在肝脏局限性结节状增生和肝细胞肝癌鉴别诊断中的价值[J/CD].中华消化病与影像杂志:电子版,2015,5(2):13-16.
[10]毛景松.多层螺旋CT灌注成像对肝脏占位性病变的诊断与鉴别诊断[J].中国现代医生,2015,53(9):91-93,封3.
[11]王玉理,郭顺林,郭吉刚,等.肝转移瘤64层CT灌注成像的临床应用[J].实用放射学杂志,2008,24(8):1403-1406.
[12]王守安,白人驹,孙浩然,等.肝脏转移瘤的CT灌注成像[J].实用放射学杂志,2007,23(9):1193-1197.
[13]武中林,刘玉芝,吴勇超,等.肝转移瘤血供对肝动脉灌注化疗的近期疗效影响[J].河北医科大学学报,2015,36(5):497-500.
[14]王煊,黄加胜,陈卫.肝转移瘤169例的数字减影血管造影表现[J].山西医药杂志,2012,41(3):244-245.
[15]冯子明,袁中平,董谢平,等.转移瘤CD34及微血管表达的研究[J].实用临床医学,2014,36(6):33-35.
[16]吴勇超,李智岗.肝脏转移瘤血供的影像及病理研究[J].介入放射学杂志,2012,21(6):520-523.
[17]武中林,吴勇超,杨光,等.影响肝转移瘤介入治疗效果因素分析[J].河北医科大学学报,2015,36(3):304-307,308.
[18]叶颖江,申占龙,王杉.转移性肝癌的治疗理念和策略[J/CD].中华普外科手术学杂志:电子版,2014,8(1):26-29.
[19]Hoffmann RT,Paprottka P,Jakobs TF,et al. Arterial therapies of non-colorectal cancer metastases to the liver[J]. Abdom Imaging,2011,36(6):671-676.
[20]李闯,张跃伟,刘影,等.明胶海绵微粒栓塞治疗肝转移癌[J].中国介入影像与治疗学,2014,11(5):259-262.
(本文编辑:许卓文)
·论著·
R575.2
B
1007-3205(2016)10-1215-04
2016-05-10;
2016-10-13
河北省医学科学研究重点课题(ZL20140056)
杨运亮(1983-),男,河北石家庄人,河北省石家庄市第一医院主治医师,医学硕士,从事临床麻醉学研究。
。E-mail:song84989@aliyun.com
