核苷(酸)类药物治疗慢性乙型肝炎患者不同巩固治疗期的停药复发率
2016-11-16梁嘉仪杨小安张卡徐启桓
梁嘉仪 杨小安 张卡 徐启桓
510630 广州,中山大学附属第三医院
·病毒病诊断与治疗·
核苷(酸)类药物治疗慢性乙型肝炎患者不同巩固治疗期的停药复发率
梁嘉仪 杨小安 张卡 徐启桓
510630 广州,中山大学附属第三医院
目的 探讨核苷(酸)类药物治疗慢性乙型肝炎(CHB)患者达停药标准后不同巩固治疗期的停药复发率差异。方法 回顾性分析接受核苷(酸)类药物(NAs)治疗达到停药标准后停药的102例CHB患者资料,停药后按巩固治疗期长短分组比较不同组的停药复发率。采用乘积限法(Kaplan-Meiermethod)计算累计复发率,采用时序检验(Log-rank test)进行累计复发率的比较。结果患者停药后第6、12、18、24、36、48月的累计复发率,达标组分别为52.3%、70.0%、74.3%、76.7%、82.4%、88.4%,达标后延长疗程组分别为24.0%、38.8%、40.6%、43.3%、43.3%、43.3%。结果表明达标后延长疗程组的累计复发率明显低于达标组。患者停药后第6、12、18、24、36、48月的累计复发率,达标+12月组分别为35.0%、48.2%、51.9%、57.9%、57.9%、57.9%,达标+24月组分别为18.1%、30.7%、30.7%、30.7%、30.7%,达标+36月组分别为7.1%、21.4%、21.4%、21.4%。结果表明达标+12月组累计复发率最高,达标+24月组次之,达标+36月组最低。达标组、达标+12月组、达标+24月组、达标+36月组四组患者停药后随访期间复发总例数分别为26例、21例、5例、3例。结论 接受NAs抗病毒治疗的CHB患者,达2010年指南停药标准后应适当延长巩固治疗期,以减少停药后复发。
Fund programs: National Natural Science Foundation of China(81500462);Pharmaceutical Association of Guangdong Province(2012GRS01,2013GRS06)
目前,慢性乙型肝炎(chronic hepatitis B,CHB)需抗病毒治疗已达成共识。核苷(酸)类药物(nucleos(t)ide analogues,NAs)因其口服方便,抗病毒作用强,不良反应少,安全性好,在我国已成为CHB患者抗病毒治疗的主要方法,但也存在耐药、治疗终点不确定、停药后容易复发等问题。即使严格按照指南推荐的停药标准停药,仍存在不同程度的复发[1]。本研究旨在探讨NAs治疗CHB患者达2010年指南停药标准后不同巩固治疗期的停药复发率差异,为寻求合理的抗病毒疗程及最佳治疗终点提供循证医学依据。
1 资料与方法
1.1 研究对象 中山大学附属第三医院自2009年10月至2015年10月初次接受核苷(酸)类似物抗病毒治疗达到停药标准后停药的CHB患者,诊断和停药标准均符合《慢性乙型肝炎防治指南(2010年版)》[2]:即HBeAg阳性CHB患者血清HBV DNA(hepatitis B virusdeoxyribonucleic acid)水平低于检测下限、达到HBeAg血清学转换后巩固治疗至少1年,总疗程至少2年;HBeAg阴性患者血清HBV DNA水平低于检测下限,巩固治疗至少1.5年,总疗程至少2.5年;排除其他肝炎后肝硬化、既往接受干扰素或其他核苷(酸)类似物抗病毒治疗者,及合并其他病毒感染者。该研究获中山大学附属第三医院伦理委员会批准实施,所有患者均签署知情同意书。1.2 治疗药物与停药标准 口服阿德福韦酯(adefovirdipivoxil,ADV)30例、恩替卡韦(entecavir,ETV)29例、拉米夫定(lamivudine,LAM)20例、替比夫定(telbivudine,LDT)23例。停药标准:按照2010年指南停药标准停药。
1.3 复发再治疗 对复发患者再次给予抗病毒治疗。
1.4 分组及检测指标 根据2010年指南治疗终点标准及巩固治疗期长短,分为达标组(A组)和达标后延长疗程组(B组),其中达标组30例、达标后延长疗程组72例。根据达标后延长疗程不同将B组分为3组:达标后延长12月组(B1组)、达标后延长24月组(B2组)、达标后延长36月组(B3组),分别于基线及停药后1、2、3、4、5、6、9、12月,此后每6个月检测生化学、血清学、HBV-DNA等指标。
1.5 观察终点 若HBV DNA>1.0*103拷贝/ml和/或丙氨酸氨基转移酶(alanine aminotransferase,ALT)升高,则为复发,即观察终点;未复发者随访时间≥6个月,随访直至截至日期 2015年10月24日为观察终点。
1.6 实验方法 应用荧光定量多聚酶链反应(polymerase chain acid,PCR)法检测HBV DNA,检测下限为103拷贝/ml。应用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)法检测HBsAg、HBsAb、HBeAg、HBeAb、HBcAb。应用美国Beckman全自动生化仪及其配套试剂检测ALT等。

2 结果
2.1 患者一般资料 符合入选标准停药患者130例,剔除未达停药标准停药患者17例、失访者4例、达标停药未复发者随访<6个月4例、缺失基线血清标本患者3例,满足本研究统计分析的患者102例,男性76例、女性26例,年龄17-63岁,平均35.5±9.2岁;HBeAg阳性者57例,HBeAg阴性者45例;基线ALT188(32-800)(U/L);基线ALT 160(35-600)(U/L);基线HBV DNA 6.07±1.17(log10拷贝/ml)。
2.2 达标组与达标后延长疗程组停药后的累计复发率比较 两组停药后的累计复发率详细结果见表1。达标后延长疗程组的累计复发率明显低于达标组,两组比较差异有统计学意义[时序检验

表1 两组患者停药后的累计复发率(Kaplan-Meier法,%)
注:Group A为达标组;Group B为达标后延长疗程组
Note:Group A:Meeting the cessation criteria group;Group B:Extending consolidation therapy group

表2 达标后延长不同巩固治疗期停药后的累计复发率(Kaplan-Meier法,%)
注:B1为达标+12个月组;B2为达标+24个月组;B3为达标+36个月组
Note:B1:Extended 12 months group;B2:Extended 24 months group; B3:Extended 36 months group
(Log-rank test)χ2=15.493,P=0.000)],见图1。
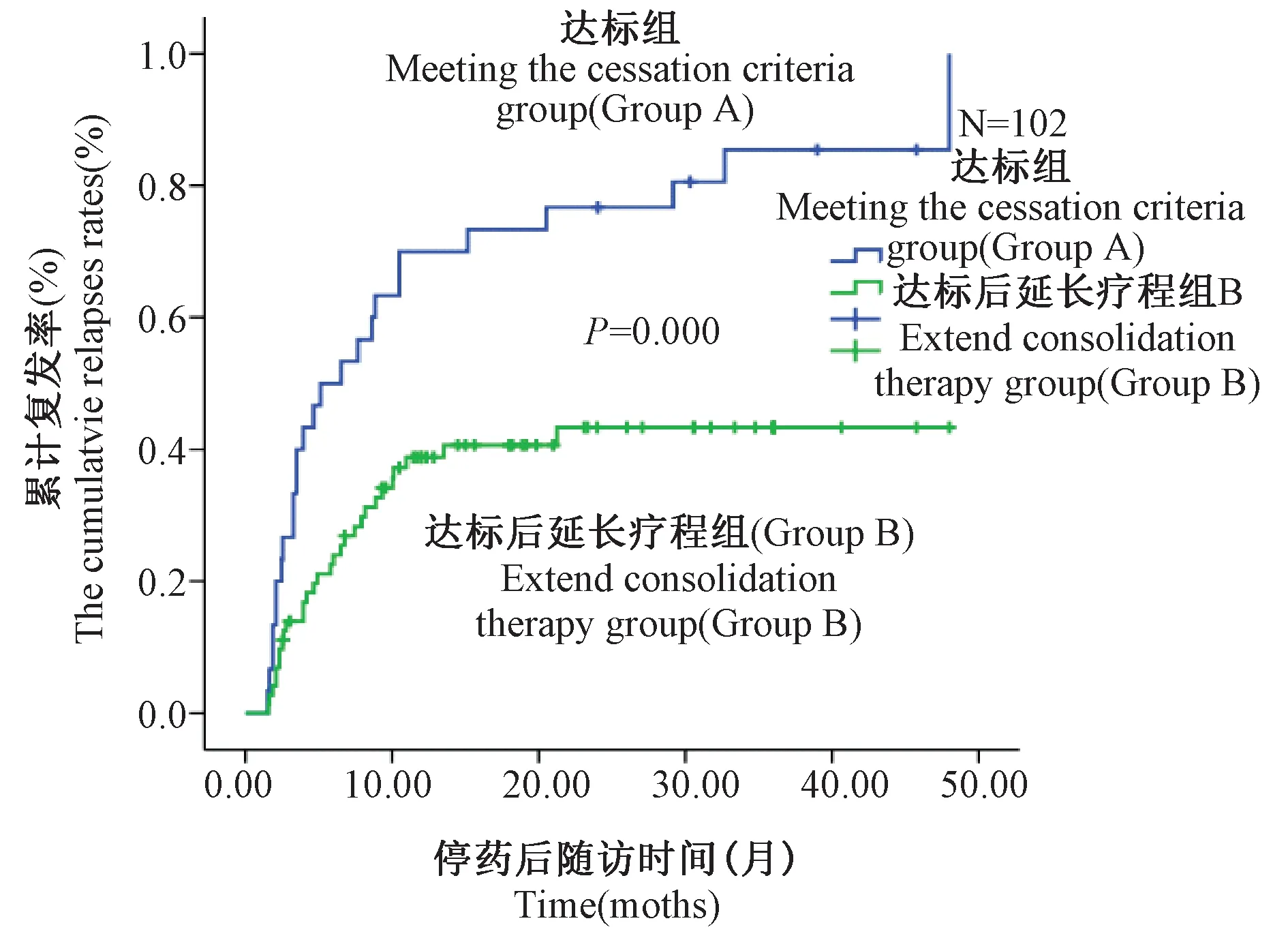
注:A为达标组; B为达标后延长疗程组图1 两组累计复发率比较Note: A:Meeting the cessation criteria group; B:Extending consolidation therapy groupFig.1 Comparison of the cumulative relapses rates in Group A and Group B
2.3 达标后不同巩固治疗期停药后的累计复发率比较 三组停药后的累计复发率见表2。达标+12月组的累计复发率高于达标+24月组,达标+36月组的最低,三组比较差异有统计学意义[时序检验(Log-rank test)χ2=6.430,P=0.040)],见图2。

注: B1为达标+12个月组; B2为达标+24个月组; B3为达标+36个月组图2 三组累计复发率比较Note:B1:Extended 12 months group;B2:Extended 24 months group;B3:Extended 36 months groupFig.2 Comparison of the cumulative relapses rates in Group B1, B2 and B3
2.4 核苷(酸)类药物停药后复发病例的复发时间 达标组、达标+12个月组、达标+24个月组、达标+36个月组四组患者停药后随访期间复发总例数分别为26例、21例、5例、3例;4组患者分别从第1.5、1.6、2.3、6.5个月开始复发;四组患者最长的复发时间分别为第48.0、21.2、10.1、11.0个月。停药后复发55例中,52例出现在停药后24个月(2年)内,停药后6、12、18、24、36、48个月的累计复发病例分别占所有复发病例的58.2%(32例)、87.2%(48例)、90.9%(50例)、94.5%(52例)、98.1%(54例)、100%(55例)。
2.5 停药后安全性分析 所有接受再治疗患者均未发现有肝功能衰竭,无1例因复发而导致病情加重。
3 讨论
本组资料中,达2010年指南推荐的停药标准停药,复发率仍非常高,停药后第6、12、18、24、36、48个月的累计复发率分别为52.3%、70.0%、74.3%、76.7%、82.4%、88.4%,与Hadziyannis等[3]报道类似。这可能与CHB患者体内肝细胞内cccDNA难以清除[4]有关,停药后对HBV DNA合成的阻断作用解除,HBV再度活跃复制,引起复发[5]。本研究达标停药复发的55例中,超过一半(58.2%)复发病例出现于停药后6个月内,94.5%出现于2年内,低于日本学者Akihiro Matsumoto等[6]的报道,可能与本组部分患者随访时间不足2年、样本例数较少等有关。因此,抗病毒治疗结束后应密切随访,停药后2年内应密切监测以便及早发现复发。
国内外目前关于达标后延长巩固治疗期的停药复发报道较少,绝大多数学者倾向于认为巩固治疗期越长,停药复发率越低。Jeng[7]等研究发现CHB患者达到APASL停药标准后再巩同治疗>16月,停药复发率可降至33.3%。Seto[8]等报道HBeAg阴性CHB患者经抗病毒治疗>2年,停药后6和12个月复发率高达74.2%和91.4%。本研究达2010年指南停药标准停药,复发率仍非常高(58.2%-88.4%);达标后延长巩固治疗期,停药复发率下降至24.0%-43.3%,提示达标后延长巩固治疗期可减少复发。横断面观察达标+36月组的停药累计复发率较达标+12月组以及达标+24月组的低,但高于Ryu等[9]的报道,考虑原因可能与患者HBV基因型不同、样本量较少等有关。本组结果表明,达标后巩固治疗期越长,停药复发率越低,考虑可能原因为肝细胞内cccDNA水平随着治疗时间延长而降低,从而停药复发率也相应下降[10]。本研究达标后再巩固治疗36个月,2年内仍存在一定的复发率(21.4%),提示延长1-3年可能还是不够的。至于需要巩固治疗多久才使复发率降至最低,有待今后扩大样本量进一步深入研究。
本组所有接受再治疗的患者均未发现有肝功能衰竭,无1例因复发而导致病情加重,考虑原因可能为:本组所有患者均为CHB患者,无一例为肝硬化;停药后密切随访;复发后及时治疗。可见停药后应密切随访,一旦发现复发应及时给予抗病毒治疗。
总之,接受NAs抗病毒治疗的CHB患者,达2010年指南停药标准后应适当延长巩固治疗期,以减少停药后复发。至于NAs抗病毒治疗的最佳疗程及最佳停药时机,仍有待扩大样本量进一步深入研究。即使达指南停药标准停药,也有88.4%患者复发,那么是否存在某些因素可以预测复发呢?关于本组资料基线年龄、性别、基线ALT、AST以及HBV DNA水平是否与停药复发有关,将有待今后继续深入研究。
[1] Ahn SH, Chan HL, Chen PJ, et al. Chronic hepatitis B: whomto treatand for howlong? Propositions, challenges, andfuturedirections[J].HepatolInt, 2010,4(1):386-395.doi: 10.1007/s12072-010-9163-9.
[2] 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版). 中华肝脏病杂志, 2011, 19(1): 13-24.doi:10.3760/cma.j.issn.1007-3418.2011.01.007.[3] Hadziyannis SJ, Vassilopoulos D. Hepatitis B e antigen-negative chronic hepatitis B[J]. Hepatology, 2001, 34(4 Pt1):617-624.doi:10.1053/jhep.2001.27834.
[4] Nassal M. HBV cccDNA: viral persistence reservoir and key obstacle for a cure of chronic hepatitis B[J]. Gut,2015,64(12): 1972-1984.doi: 10.1136/gutjnl-2015-309809.
[5] Dandri M, Petersen J. Mechanism of Hepatitis B Virus Persistence in Hepatocytes and Its Carcinogenic Potential[J]. Clin Infect Dis,2016,62 Suppl 4: S281-288. doi: 10.1093/cid/ciw023.
[6] Akihiro Matsumoto, Eiji Tanaka, Yoshiyuki Suzuki, et al. Combination of hepatitis B viral antigens and DNA for prediction of relapse afterdiscontinuation of nucleos(t)ide analogs in patients with chronic hepatitis B[J].Hepatol Res, 2012, 42(2):139-149. doi: 10.1111/j.1872-034X.2011.00910.x.
[7] Jeng WJ, Sheen IS, Chen YC, et al. Off-therapy durability ofresponseto entecavirtherapyinhepatitisB e antigen-negativech-ronic hepatitis patients[J]. Hepatology, 2013, 58(6):1888-1896. doi: 10.1002/hep.26549.
[8] Seto WK, Hui AJ, Wong VW, et al. Treatment cessation ofentecavir in Asianpatients withhepatitis Be antigen negative-chronic hepatitis B:amuhicentre prospective study[J]. Gut, 2015, 64(4):667-672.doi: 10.1136/gutjnl-2014-307237.
[9] Ryu SH, Chung YH, Choi MH, etal.Long-term additional Iamivudine therapy enhances durability of lamivudine-induced HBeAg loss: a prospective study[J]. J Hepatol, 2003, 39(4):614-619.doi:10.1016/S0168-8278(03)00394-5.
[10] Jiang NJ, Liang XY, Guo WW, et al. The value of intrahepatic HBV tDNA and cccDNA at cessation NAs as an indicator for relapse in the CHB patients[J]. Journal of Hepatology, 46th EASL, 2011, 54suppl 1:s289-s290.
The relapse rates of different duration of extended consolidation therapy after withdrawal of nucleos(t)ide analogues treatment in patients with chronic Hepatitis B
LiangJiayi,YangXiaoan,ZhangKa,XuQihuan
ThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
XUQihuan,Email:xqh032014@163.com
Objective To retrospectively investigate the relapse rates of different duration of extended consolidation after withdrawal of nucleos(t)ide analogues (NAs) treatment in patients with chronic hepatitis B (CHB) who met NAs cessation criteria. Methods 102 CHB patients discontinued treatment according to NAs cessation criteria or extended duration of consolidation therapy after meeting the cessation criteria. 30 patients meeting the cessation criteria were Group A. 72 patients extending consolidation therapy after meeting the cessation criteria were Group B. Based on different duration of extended consolidation therapy, 72 patients were divided into 3 groups. Patients with a duration of extended 12 months after meeting NAs cessation criteria were Group B1. Patients with a duration of extended 24 months were Group B2. Patients with duration of extended 36 months were Group B3. After cessation of NAs treatment, the cumulative relapse of different group was calculated by the Kaplan-Meier method. The cumulative relapses between the selected groups were analyzed with Log-rank test. Results The cumulative relapse rates after 6,12,18,24,36 and 48 months after cessation of NAs treatment were 52.3%, 70.0%, 74.3%, 76.7%, 82.4% and 88.4% in Group A; 24.0%, 38.8%, 40.6%, 43.3%, 43.3% and 43.3% in Group B; respectively. The relapse rate of Group B was much lower than that of Group A. The cumulative relapse rates after 6,12,18,24,36 and 48 months after cessation of NAs treatment were 35.0%, 48.2%, 51.9%, 57.9%, 57.9% and 57.9% in Group B1; 18.1%, 30.7%, 30.7%, 30.7%, 30.7% in Group B2; 7.1%, 21.4%, 21.4%, 21.4% in group B3; respectively. The relapse rate of Group B1 was the highest, the following was of Group B2, and of Group B3 was the lowest one. The total amount of relapse in Group A, B1, B2 and B3 was 26, 21, 5 and 3 respectively. Conclusions A longer duration of extended consolidation therapy after meeting NAs cessation criteria may contribute to the lower relapse rates.
Hepatitis B,chronic;Nucleosides;Treatment outcome; Adefovirdipivoxil;HBeAg-positive
徐启桓,Email: xqh032014@163.com
10.3760/cma.j.issn.1003-9279.2016.05.017
肝炎,乙型,慢性;核苷酸类;治疗结果;停药;复发
国家自然科学基金(81500462);广东省药学会基金(2012GRS01,2013GRS06)
2016-07-16)
